Послеоперационная боль различной интенсивности возникает после любой операции, как после минимальных амбулаторных вмешательств, так и после высокотравматичных многочасовых операций.
Боль — ощущение (эмоциональное переживание) неприятного характера, обусловленное имеющимся или возможным повреждением тканей либо описываемое пациентом словами, соответствующими подобному повреждению. Неспособность к общению не отрицает возможности того, что пациент испытывает боль и нуждается в соответствующем лечении.
Боль послеоперационная — болевые ощущения, возникающие у хирургического пациента в области выполненного оперативного вмешательства [1, 2]. Всемирная организация здравоохранения и Международная ассоциация по изучению боли (IASP — International Association of Study of Pain) признали обезболивание неотъемлемым правом человека [3]. Статья № 19 ФЗ РФ № 323 «Об основах охраны здоровья граждан Российской Федерации» говорит о том, что каждый пациент имеет право нa «облегчение боли, связанной с заболеванием и (или) медицинским вмешательством, доступными методами и лекарственными препаратами».
Боль физиологическая (ноцицептивная) — естественная реакция нервной системы на ноцицептивные стимулы, являющиеся потенциально опасными. Поведенческая реакция при этом стремится прервать связь с источником повреждения.
Боль патологическая — измененное восприятие болевых стимулов в результате формирования морфофункциональных изменений в структурах центральной и периферической нервной системы, а также нарушений связи между ноцицептивными восходящими структурами и антиноцицептивной системой.
Боль острая (ноцицептивная, физиологическая) — боль, недавно возникшая, обусловлена активацией ноцицепторов повреждающими стимулами, является симптомом какого-либо заболевания или повреждения тканей, исчезает при устранении повреждения, выздоровлении пациента.
Боль хроническая (патологическая) — приобретает статус самостоятельного заболевания, существует длительное время, зачастую на протяжении всей жизни пациента, в ряде случаев трудно установить ее этиологию. Хроническая боль оказывает дезадаптивное патогенное влияние на организм.
Ноцицепция — является реакцией сенсорной системы на повреждающие или потенциально повреждающие стимулы, включает в себя нейрональные процессы кодирования и обработки этих стимулов.
Гиперальгезия — снижение порогов активации ноцицепторов (повышение болевой чувствительности).
Анальгезия предупреждающая (preemptive analgesia) — назначение анальгетиков (опиоидов, нестероидных противовоспалительных средств (НПВС), кетамина) и/или выполнение регионарных блокад до начала операции (до разреза) для ограничения интраоперационной ноцицептивной стимуляции с целью снижения интенсивности послеоперационной боли и потребности в анальгетиках.
Анальгезия профилактическая (preventive analgesia) — предусматривает ограничение ноцицептивной стимуляции на протяжении пред-, интраи послеоперационного периода. Является более эффективным (в сравнении с предупреждающей анальгезией) методом профилактики возникновения патологических изменений в структурах ноцицептивной системы, являющихся основой формирования хронических болевых синдромов.
Анальгезия мультимодальная — одновременное применение нескольких (двух и более) обезболивающих препаратов и/или методик обезболивания с разными механизмами действия, позволяющее достичь целевой анальгезии с минимумом побочных эффектов, присущих назначению больших доз одного анальгетика в режиме монотерапии.
Послеоперационная боль — это не просто острый болевой синдром, это еще и сильный триггер хирургического стресс-ответа, который вызывает активацию вегетативной нервной системы и оказывает негативное влияние практически на все жизненно важные органы и системы (табл. 1).
| Таблица 1. Негативное влияние послеоперационной боли на жизненно важные системы организма | |
| Система | Изменения, обусловленные наличием острого болевого синдрома |
|---|---|
| Сердечно-сосудистая | Тахикардия, гипертензия, повышенное периферическое сосудистое сопротивление, увеличение потребности миокарда в кислороде, ишемия миокарда, снижение периферического кровотока (фактор риска образования тромбов в сосудах нижних конечностей) |
| Дыхательная | Снижение дыхательного объема (ДО) и функциональной остаточной емкости легких (ФОЕ), затруднения адекватного откашливания, накопление мокроты, формирование ателектазов, легочная инфекция, гипоксемия |
| Желудочно-кишечный тракт | Угнетение моторики желудочно-кишечного тракта, повышенный риск транслокации кишечной флоры |
| Мочевыделительная | Затруднения мочеиспускания |
| Нейроэндокринная | Повышение концентрации в плазме катаболических гормонов: глюкагона, соматотропного гормона (СТГ), вазопрессина, альдостерона, ренина и ангиотензина. Угнетение синтеза анаболических гормонов: инсулина и тестостерона. Катаболизм характеризуется гипергликемией, резким снижением уровня белка в плазме. Отрицательный азотистый баланс замедляет течение репаративных процессов и затрудняет послеоперационную реабилитацию пациентов |
| Система гемостаза | Гиперкоагуляция, ТЭЛА, тромбоз глубоких вен нижних конечностей |
| Скелетно-мышечная | Повышение мышечного тонуса, иммобилизация (фактор риска тромбозов глубоких вен нижних конечностей) |
| Центральная нервная система | Риск формирования хронического послеоперационного болевого синдрома вследствие сенситизации структур центральной нервной системы на фоне интенсивной острой боли |
Послеоперационный болевой синдром формируется с помощью и на основе многоуровневой ноцицептивной системы, состоящей из периферических ноцицепторов и центральных нейронов, которые расположены в различных структурах нервной системы и реагируют на повреждение.
Уровни формирования острого болевого синдрома таковы:
Развитие болевого синдрома связано с формированием зон гиперальгезии. Существует первичная и вторичная гиперальгезия.
Первичная гиперальгезия развивается быстро, непосредственно в зоне поврежденных тканей возле раны. В основе этого процесса лежит сенситизация ноцицепторов (периферическая сенситизация). Главную роль в запуске периферических ноцицептивных механизмов играет брадикинин — он может оказывать и прямое, и непрямое воздействие на болевые рецепторы. Важную роль играют простагландины Е2, повышающие чувствительность ноцицепторов к воздействию прочих медиаторов боли.
Зона вторичной гиперальгезии формируется позднее и располагается не только рядом с местом повреждения, но и на удалении от него. Вторичная гиперальгезия обусловлена включением центральной сенситизации ноцицептивных нейронов, которые находятся в задних рогах спинного мозга. У этих нейронов увеличиваются возбудимость, чувствительность к механической стимуляции и спонтанная электрическая активность. Дальнейшая болевая стимуляция вызывает гиперсекрецию нейропептидов (субстанция Р, нейрокинин А), которые возбуждают ноцицептивные нейроны и усиливают возбуждающее действие глутамата через N-метил-D-аспартатные рецепторы (NMDA-рецепторы). Нейрокинины вызывают деполяризацию клеточной мембраны, удаляя блокирующие ионы магния из ионных каналов NMDA-рецепторов. Затем глутамат воздействует на NMDA-рецепторы, вызывая обильное поступление ионов кальция в клетку и длительную деполяризацию. Увеличение зоны снижения болевого порога в области операционной раны связано с расширением рецептивных полей нейронов, находящихся в задних рогах спинного мозга. Этот процесс происходит в течение 12–18 ч и значительно часто обусловливает увеличение интенсивности послеоперационной боли на вторые сутки послеоперационного периода.
Согласно отчету Национального института здравоохранения США за 2011 г., более 80 % пациентов в клиниках Северной Америки страдают от послеоперационной боли, при этом менее 50 % считают обезболивание адекватным [4]. Эпидемиологическое исследование PATHOS выявило неудовлетворительное качество послеоперационного обезболивания в Европе и необходимость принятия неотложных мер по его улучшению [5]. Болевой синдром в стационаре у хирургических пациентов регистрировался у 55 (37,7–84) % пациентов, причем частота интенсивной боли варьирует в пределах 9–36 % [6, 7]. Боль интенсивностью 4 балла по 10-бальной визуально-аналоговой шкале (ВАШ) и более отмечалась у 70 % пациентов после операций на нижних конечностях и абдоминальных вмешательствах, у 60 % пациентов после операций на позвоночнике и верхних конечностях. Болевой синдром средней и высокой интенсивности фиксировался после кесарева сечения (87 %), открытого остеосинтеза костей нижней конечности (85 %), гистерэктомий (71 %), лапаротомий (70 %) [8]. В одном из наиболее крупных исследований (20 тыс. хирургических пациентов) послеоперационная боль средней интенсивности отмечалась в 29,7 (26,4– 33) % случаев, а боль высокой интенсивности — в 10,9 (8,4–13,4) % случаев [9]. 40 % пациентов отделений реанимации и интенсивной терапии (ОРИТ) сообщили о наличии у них умеренной или сильной боли [10].
Хроническая боль, возникающая в результате хирургического вмешательства и неадекватного лечения острой послеоперационной боли, частота формирования которой достигает 30–70 %, оказывает серьезное негативное влияние на качество жизни человека и создает существенную финансовую нагрузку на общество [11].
В целом литературные данные свидетельствуют об отсутствии положительной динамики в решении проблемы послеоперационного обезболивания [12].
Боль, не классифицированная в других рубриках (R52):
R52.0 — Острая боль.
R52.1 — Постоянная некупирующаяся боль.
R52.2 — Другая постоянная боль.
R52.9 — Боль неуточненная.
На основании совместного решения Всемирной организации здравоохранения и IASP хроническая послеоперационная боль включена в новую версию Международной классификации болезней (МКБ-11) [13].
По типу:
По интенсивности:
По продолжительности:
По характеру и локализации:
По виду:
По происхождению:
Особые виды боли:
Основные типы боли
Ноцицептивная боль (соматогенная) — возникает вследствие активации ноцицепторов. Активирующими факторами могут быть: травма, воспаление, ишемия, растяжение тканей.
Нейропатическая боль (нейрогенная) возникает в результате повреждения периферических или центральных структур нервной системы, участвующих в механизмах ноцицепции. Нейропатический компонент зачастую входит в структуру послеоперационного болевого синдрома. Его наличие (или высокая вероятность его возникновения) является основанием для включения в схему обезболивания препаратов, эффективных в отношении нейропатической боли.
Психогенная боль — возникает при отсутствии каких бы то ни было соматических, висцеральных или нейрональных повреждений. Жалобы на боль могут предъявлять пациенты, страдающие истерией, шизофренией, биполярными расстройствами. При наличии в анамнезе подобных психических расстройств и отсутствии вышеуказанных повреждений к лечению таких пациентов должен привлекаться психиатр.
Некупированный болевой синдром проявляется тахикардией, артериальной гипертензией, повышением ригидности мышц передней брюшной стенки и мышц грудной клетки, что приводит к нарушению вентиляционной функции легких и гипоксемии (см. табл. 1).
Трудности с откашливанием на фоне боли вызывают нарушение эвакуации секрета бронхов, что способствует развитию ателектазов и присоединению инфекционных осложнений. Обусловленная болевым синдромом активация симпатической нервной системы вызывает послеоперационную гиперкоагуляцию. Усиленная симпатическая стимуляция тормозит перистальтику и параллельно усиливает тонус гладкой мускулатуры кишечника, что чревато развитием послеоперационного пареза. Кроме того, послеоперационный болевой синдром препятствует ранней активизации пациентов, а также способствует их эмоциональному и физическому страданию, нарушениям сна.
Внезапное усиление боли, особенно ассоциированное с появлением тахикардии, гипотензии, гипертермии, — требует экстренной комплексной оценки состояния пациента, поскольку это может быть предвестником осложнений послеоперационного периода (кровотечение, несостоятельность анастомозов, тромбоз глубоких вен и т. д.).
Основой выбора эффективной и безопасной схемы послеоперационного обезболивания является индивидуальный подход, учитывающий особенности каждого конкретного пациента, оценку интенсивности боли в динамике, постоянный контроль адекватности обезболивания, а также своевременное выявление побочных эффектов препаратов и методов анальгезии.
Тщательное изучение болевого анамнеза в сочетании с историей основного заболевания и осмотром пациента предоставляет важную информацию о типе и характере болевого синдрома, причине его возникновения и позволяет выбрать оптимальную схему анальгезии. Основная структура изучения анамнеза боли представлена в табл. 2.
| Таблица 2. Структура изучения анамнеза боли | |
| Локализация болевых ощущений | Оценка первичной локализации боли и ее иррадиации |
| История возникновения боли | Когда и при каких обстоятельствах впервые появились болевые ощущения, что предшествовало их появлению |
| Характер боли | Острая, тупая, коликообразная, жгучая, стреляющая и т. п. |
| Интенсивность боли | Оценивается отдельно в покое и при движении. Длительность боли. Имеет постоянный характер или приступообразный. Какие факторы усиливают интенсивность боли |
| Сопутствующая симптоматика | Например, тошнота, потливость |
| Влияние боли на качество жизни | Например, ограничение физической активности, нарушения сна и т. д. |
| Какие методы лечения боли используются сейчас и какие применялись в прошлом | Дозы анальгетиков, частота их назначения, эффективность, наличие побочных эффектов |
Оценка боли является крайне важным элементом послеоперационного обезболивания [14]. Принципы адекватной оценки боли представлены в табл. 3.
| Таблица 3. Основные принципы адекватной оценки боли |
|
Для оценки боли используют специальные шкалы. Использование одной определенной шкалы в стенах конкретной клиники позволяет всем, кто занимается обезболиванием пациентов, «говорить на одном языке». Самостоятельная оценка боли пациентом — наиболее ценный инструмент. Всегда следует прислушиваться к мнению пациента и доверительно относиться к его ощущениям.
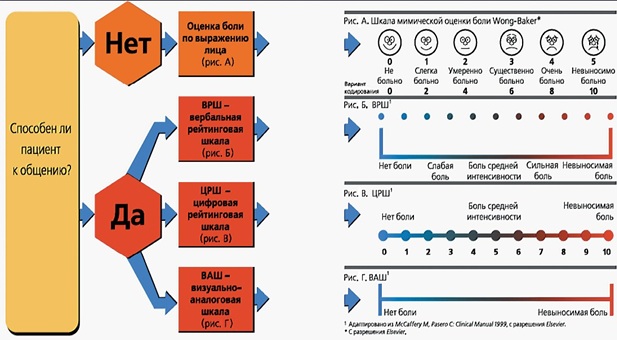
Основные шкалы оценки боли представлены на рис. 1.

Рис. 1. Шкалы оценки боли
А. Оценка боли по определенному выражению лица (шкала Wong-Baker): шкала состоит из шести лиц с той или иной мимикой, отражающей ощущения от полного счастья до максимально вообразимого страдания. Эта шкала рекомендуется к использованию у пациентов, контакт с которыми затруднен (см. выше).
Б. Вербальная рейтинговая шкала (ВРШ): в этом случае пациент должен оценить боль как 1 из 5 вариантов: «слабая», «умеренная», «средняя», «сильная», «очень сильная».
В. Цифровая рейтинговая шкала (ЦРШ): представляет собой линию с цифрами от 0 до 10 (также существует вариант от 1 до 5), где 0 — это полное отсутствие боли, а 10 — максимально возможная боль.
Г. Визуально-аналоговая шкала (ВАШ): представляет собой прямую линию длиной 10 см (100 мм), без цифр и меток, в начале линии есть обозначение «боли нет», а в конце — «невыносимая боль». Пациент отмечает на линии точку, которая является текущей оценкой интенсивность его боли (миллиметры = проценты).
Для выявления нейропатического компонента в структуре острого послеоперационного болевого синдрома используется опросник DN4 (рис. 2) [15].
Инструментальные методы оценки боли с помощью анализа фотоплетизмограммы, оценки индекса ноцицепции, кожной проводимости, пупиллометрии, а также индексов, полученных с помощью электроэнцефалограммы, в широкой клинической практике распространения не получили.

Рис. 2. Опросник DN4 для диагностики нейропатической боли
Основным принципом послеоперационного обезболивания в настоящее время является реализация концепции мультимодальной анальгезии (ММА).
ММА сегодня — это методика выбора при послеоперационном обезболивании. Ее основой является применение сочетаний неопиоидных анальгетиков (НПВС и парацетамола); у пациентов со средним и высоким уровнем боли дополнительно назначаются адъювантные препараты, опиоидные анальгетики (при необходимости) и регионарные методы анальгезии. Выбор конкретной схемы ММА зависит от травматичности хирургического вмешательства.
Парацетамол и НПВС являются базисом послеоперационной ММА. Дозы препаратов представлены в табл. 4.
| Таблица 4. Дозы парацетамола и нестероидных противовоспалительных средств, рекомендуемые для послеоперационного обезболивания (в соответствии с инструкциями по использованию препаратов) | ||||
| Препарат | Разовая доза | Интервал назначения | Максимальная суточная доза | Максимальная длительность назначения |
|---|---|---|---|---|
| Парацетамол | 0,5–1 г, в/в инфузия в течение 15 мин |
6 ч | 4 г | 5–7 сут |
| Диклофенак | 75 мг в/м | 12 ч | 150 мг | 2 сут |
| Кеторолак | 30 мг в/в, в/м | 8 ч | 60–90 мг | 5 сут |
| Кетопрофен | 100 мг в/в, в/м | 12 ч | 200 мг | в/в не более 2 сут |
| Лорноксикам | 8 мг в/в/ в/м | 12 ч | 16 мг | 1–7 сут |
| Декскетопрофен | 50 мг в/в, в/м | 8–12 ч | 150 мг | 2 сут |
Данные доказательной медицины, подтверждающие эффективность применения НПВС и парацетамола в схемах ММА
Влияние НПВС на консолидацию костной ткани [31, 32], а также их способность повышать риск несостоятельности анастомозов после колопроктологических операций [33–35] остается до конца не изученным [36]. В то же время имеются достаточно веские опасения увеличения частоты несостоятельности анастомозов при операциях на желудочно-кишечном тракте, обусловленного назначением препаратов группы НПВС, как при открытых, так и при лапароскопических вмешательствах [37, 38]. В связи с этим мы не рекомендуем включение НПВС в схемы обезболивания пациентов, перенесших операции на органах на желудочно-кишечного тракта, связанные с наложением анастомозов.
Опиоиды остаются препаратами, широко применяемыми для послеоперационного обезболивания в большинстве зарубежных и отечественных клиник. Выраженность обезболивающего эффекта агонистов µ-опиатных рецепторов должна быть сходной при их назначении в эквианальгетических дозировках. Например, эффекту 10 мг морфина должен соответствовать эффект 20 мг промедола или 100 мг трамадола. В то же время имеется индивидуальная вариабельность в плане чувствительности конкретных пациентов к определенным опиоидам. Важно то, что опиоиды обеспечивают только антиноцицептивный эффект, но не предотвращают развитие гиперальгезии.
Дозы опиоидных анальгетиков представлены в табл. 5.
| Таблица 5. Дозы опиоидных анальгетиков, рекомендуемые для послеоперационного обезболивания (в соответствии с инструкциями по использованию препаратов) | |||
| Препарат | Разовая доза | Интервал назначения | Максимальная суточная доза |
|---|---|---|---|
| Морфина гидрохлорид | 10 мг в/в, в/м | 5–6 ч | 50 мг |
| Тримеперидин (промедол) | 20–40 мг в/в, в/м | 4 ч | 120 мг |
| Трамадол* | 100 мг в/в, в/м | 6 ч | 400 мг |
* Препарат трамадол, который традиционно рассматривается среди опиоидных анальгетиков, строго говоря, к ним не относится. Правильнее называть его анальгетиком центрального действия, механизм которого частично обусловлен воздействием на опиатные рецепторы.
Ряд специалистов считает, что назначение опиоидных анальгетиков в послеоперационном периоде связано с увеличением числа осложнений и, соответственно, стоимости пребывания пациента в больнице. Помимо давно известных побочных эффектов препаратов данной группы (угнетение дыхания, избыточная седация, угнетение моторики желудочно-кишечного тракта, тошнота, рвота, кожный зуд), в последние годы активно обсуждаются такие клинически значимые осложнения, как опиоид-индуцированная гиперальгезия [39] и обусловленная опиоидной анальгезией иммуносупрессия [40].
Данные доказательной медицины, характеризующие некоторые особенности применения опиоидов в послеоперационном периоде
Кетамин начали рассматривать в качестве адъювантного препарата в схемах периоперационного обезболивания с 90-х годов прошлого века, когда были открыты его свойства неконкурентного антагониста N-метил-D-аспартатовых (NMDA) рецепторов.
Внутривенная инфузия субанестетических доз кетамина может использоваться в качестве компонента ММА у взрослых. Перед операцией кетамин вводится в/в болюсно в дозе 0,15–0,2 мг/кг, а затем в виде непрерывной инфузии со скоростью 0,2–0,4 мкг/кг/ мин. Оптимальная продолжительность послеоперационной инфузии — 12–24 ч.
Данные доказательной медицины, подтверждающие эффективность применения кетамина в схемах ММА
В обзоре литературы, посвященном роли антагонистов NMDA-рецепторов в предотвращении гиперальгезии, включившем 24 исследования применения кетамина, сделан однозначный вывод о снижении уровня боли и потребности в опиоидах на фоне его назначения [49]. Длительность эффекта значительно превышала период действия самого кетамина.
Кроме того, согласно Кокрановскому обзору [48] (37 исследований, из которых 27 были с позитивным результатом), использование кетамина в малых дозах снижало потребность в назначении морфина и частоту послеоперационной тошноты и рвоты в первые сутки послеоперационного периода. Побочные эффекты были незначительными либо отсутствовали.
В последние несколько лет были выполнены исследования, показавшие положительное влияние габапентиноидов (габапентина и прегабалина) на острую послеоперационную боль, их анксиолитическое действие, а также снижение риска формирования хронического болевого синдрома. Следует сказать, что габапентин в качестве компонента схем ММА начал применяться раньше прегабалина, соответственно, ему посвящено большее количество публикаций, шире доказательная база.
Обычно препараты назначают перорально, однократно, за 1–2 ч до операции. Предоперационная доза габапентина варьирует от 300 до 900 мг, прегабалина — от 75 до 300 мг. Ряд специалистов назначает габапентиноиды однократно, но большинство пролонгирует их использование. В послеоперационный период рекомендуемая суточная доза габапентина составляет 900– 1200 мг, прегабалина — от 150 до 300 мг. Длительность назначения обычно не превышает 8–10 сут.
Данные доказательной медицины, подтверждающие эффективность применения габапентиноидов в схемах ММА
Метаанализ E. Tiippana et al. показал целесообразность однократного назначения габапентина перед операцией для снижения уровня послеоперационной боли и дальнейшей потребности в анальгетиках [57]. Исследователями было установлено, что назначение габапентина в дозах от 300 до 1200 мг снижает потребность в морфине на 20–60 %.
Метаанализ P. Peng et al. (18 исследований) представляет собой анализ анальгетической эффективности габапентина и его опиоидсберегающего эффекта [55]. В 12 из них использовалась суточная доза 1200 мг. В подавляющем большинстве случаев был подтвержден опиоидсберегающий эффект габапентина в первые сутки после операции (в среднем на 35 %), достоверное уменьшение уровня боли в покое (в те же первые сутки) и при активизации (через 2, 4 и 12 ч) после операции.
J. Clivatti et al. осуществили анализ 26 РКИ (2002– 2007 гг.), которые оценивали влияние габапентина на послеоперационный болевой синдром [60]. В 17 из них пациентам давалась однократная доза препарата (300–1200 мг) в промежутке от 30 мин до 2 ч перед операцией. В прочих исследованиях габапентин назначался за 24 ч до операции и использовался далее в течение 10 сут, суточная доза составляла 1200–1800 мг. Значимое снижение уровня боли отмечалось у 75 % пациентов, получивших габапентин однократно, и у 55,6 % — получавших его длительно. Потребность в опиоидах была ниже у 82,4 % пациентов при однократном приеме и у 77,8 % — при длительном приеме габапентина. Из побочных эффектов чаще всего регистрировались избыточная седация и головокружение (4–5 %).
Внутривенная инфузия лидокаина может использоваться в качестве компонента ММА при ряде хирургических вмешательств, больше всего доказательств эффективности получено при операциях на органах брюшной полости, как лапароскопических, так и открытых. Раствор лидокаина вводится перед операцией внутривенно болюсно медленно в дозе 1,5 мг/кг (не более 100 мг), затем во время операции продолжается инфузия со скоростью 1,5–2 мг/кг/ч, которую желательно пролонгировать на 24–48 ч послеоперационного периода. Максимальная суточная доза лидокаина при внутривенном введении составляет 2000 мг.
При внутривенном введении лидокаин метаболизируется до моноэтил-глицин-эксилидида, который взаимодействует как с периферическими, так и с центральными потенциал-зависимыми открытыми Na-каналами, расположенными на внутренней поверхности мембран нейронов. Кроме того, лидокаин усиливает высвобождения эндогенных опиатов [61] и подавляет постсинаптическую деполяризацию, опосредованную через NMDA- и нейрокининовые рецепторы [62].
Данные доказательной медицины, подтверждающие эффективность внутривенной инфузии лидокаина в схемах ММА
Не было выявлено позитивного влияния инфузии лидокаина на интенсивность послеоперационной боли при операциях тотального эндопротезирования тазобедренного сустава [65], кардиохирургических операциях [66], тонзиллэктомии [67], эндоскопических нефрологических операциях [68], абдоминальной гистерэктомии [69].
Метаанализ 2010 г. (16 рандомизированных исследований) позволил сделать заключение, что при абдоминальных операциях (как лапароскопических, так и открытых) периоперационная инфузия лидокаина сопровождается значимым снижением интенсивности послеоперационной боли и потребности в анальгетиках [70]. В большинстве исследований нагрузочный болюс лидокаина составлял 100 мг, скорость последующей инфузии варьировала в пределах 1,5–3 мг/кг/ч. Снижение интенсивности боли (как в покое, так и при активизации) фиксировали в течение 48 ч после операции. Опиоидсберегающий эффект лидокаина достигал 85 %. Длительность пареза кишечника сокращалась в среднем на 28 ч.
Годом позже метаанализ 29 рандомизированных контролируемых исследований выявил существенные различия в качестве обезболивания при внутривенном введении лидокаина в сравнении с применением опиоидов «в чистом виде» [64]. У пациентов, получавших лидокаин, интенсивность боли по ВАШ (в покое, при кашле и при движении) была достоверно ниже.
Основной задачей ММА является прерывание потока афферентных ноцицептивных импульсов от болевых рецепторов на периферии (в органах и тканях) к сегментарным структурам центральной нервной системы (задним рогам спинного мозга). Успешное решение этой задачи может быть достигнуто использованием методик регионарной анальгезии (РА).
Инфильтрация мягких тканей местными анестетиками длительного действия до начала операции рассматривается в качестве способа снижения интенсивности послеоперационного болевого синдрома при некоторых, преимущественно эндоскопических хирургических вмешательствах, таких как лапароскопическая холецистэктомия, аппендэктомия, герниопластика, гемиколэктомия и т. п.
При лапароскопических операциях осуществляется локальная инфильтрация тканей в местах установки эндоскопических портов. Рекомендуется использовать 0,5% бупивакаин, 0,5% левобупивакаин или 0,75% ропивакаин из расчета 7 мл на 10 мм троакар и 3–4 мл на 5 мм троакар [71].
Данные доказательной медицины, подтверждающие эффективность инфильтрации мягких тканей МА до начала операции
Показания для проведения продленных блокад периферических нервов: длительные и травматические вмешательства на верхних и нижних конечностях и туловище, требующие обезболивания более 24 ч, а также обеспечение fast-track-технологий. Для обеспечения длительной (48–72 ч) послеоперационной анальгезии и проведения реабилитационных мероприятий целесообразно использовать катетеризационные методики блокады нервов. Выполнение катетеризаций нервов целесообразно проводить в условиях УЗ-навигации, в крайнем случае — с применением электронейростимулятора. Варианты блокад в зависимости от зоны хирургического вмешательства представлены в табл. 6.
| Таблица 6. Выбор блокады в зависимости от зоны хирургического вмешательства | |
| Область операции | Методика |
|---|---|
| Плечо | БПС (межлестничный доступ) |
| Локтевой сустав, предплечье, кисть | БПС (надключичный доступ) |
| Верхняя конечность (дистальнее верхней трети плеча) | БПС (нижнеключичный доступ) |
| Предплечье, кисть | БПС (подмышечный доступ) |
| Грудная клетка | Торакальная паравертебральная блокада |
| Срединная лапаротомия | Блокада влагалища прямой мышцы живота (двусторонняя); блокада поперечного пространства живота — ТАР-блок (двусторонний) |
| Открытая аппендэктомия | ТАР-блок |
| Открытая холецистэктомия | ТАР-блок |
| Гистерэктомия/кесарево сечение (доступ по Пфанненштилю) | Подвздошно-паховый и подвздошно-подчревный (двусторонний); ТАР-блок (двусторонний) |
| Паховая грыжа | Подвздошно-паховый и подвздошно-подчревный; ТАР-блок |
| Пупочная грыжа | Блокада влагалища прямой мышцы живота (двусторонняя) |
| Эндопротезирование тазобедренного и коленного суставов | Блокада поясничного сплетения, блокада бедренного нерва (протезирование коленного сустава) |
| Нижняя конечность | Блокада седалищного нерва |
| Бедро | Блокада поясничного сплетения или илеофасциальная блокада |
| Колено | Блокада поясничного сплетения, блокада бедренного нерва |
| Нижняя треть голени, голеностопного сустава, стопы | Блокада ветвей седалищного нерва на уровне подколенной ямки |
| Голеностопный сустав | Катетеризация седалищного нерва до его бифуркации в нижней трети бедра |
БПС — блокада плечевого сплетения.
При блокадах изолированных нервов (бедренный, седалищный и др.) и сплетений (плечевое, поясничное) используют инфузию 0,2% раствора местного анестетика (ропивакаин, левобупивакаин) с помощью эластомерных помп или перфузора со скоростью 4–6 мл/ч.
При межфасциальных блокадах (илеофасциальная, ТАР-блок и др.) предпочтительно интермиттирующее введение местного анестетика (ропивакаин, левобупивакаин) в дозе 2,0 мг/кг.
Данные доказательной медицины, подтверждающие эффективность применения продленных блокад периферических нервов
Эпидуральная анальгезия (ЭА) рекомендуется при обширных открытых оперативных вмешательствах на органах грудной клети, брюшной полости, малого таза, магистральных сосудах, а также при эндоскопических операциях у пациентов с повышенным риском послеоперационных респираторных осложнений [75–81].
Уровень пункции и катетеризации эпидурального пространства определяется областью оперативного вмешательства. В качестве препаратов для ЭА используют растворы местных анестетиков и опиоидный анальгетик морфин. Начало действия 2–5 мг морфина, введенного в эпидуральное пространство, развивается через 30–60 мин, длительность эффекта — от 6 до 24 ч.
Интраоперационная нейроаксиальная анальгезия уменьшает послеоперационную потребность в опиоидных анальгетиках [82].
Данные доказательной медицины, подтверждающие эффективность применения послеоперационной эпидуральной анальгезии
Не существует единой универсальной схемы обезболивания для всех хирургических вмешательств. Болевой синдром в различных областях хирургии имеет свою специфику, которая определяется: травматичностью доступа (разный подход к обезболиванию после эндоскопических и открытых операций), объемом хирургического вмешательства (симультанные онкологические операции), длительностью вмешательства, структурой болевого синдрома (преобладанием соматического или висцерального компонента и, что очень важно, наличием нейропатического компонента). В связи с этим послеоперационное обезболивание должно иметь процедур-специфический характер, ориентированный на вид хирургического вмешательства. Кроме того, рекомендации по обезболиванию для каждой типовой операции не должны ограничиваться только послеоперационным периодом, а должны включать разделы: до операции, во время операции, после операции. Назначение различных анальгетиков и адъювантов, применение тех или иных вариантов регионарной анестезии/анальгезии на протяжение всего периоперационного периода оказывают существенное влияние на интенсивность и динамику послеоперационного болевого синдрома. Применение принципов предупреждающей и профилактической анальгезии особенно важно при реализации концепций fast-track surgery и ERAS (Enhanced Recovery After Surgery — ускоренная послеоперационная реабилитация пациентов).
Значительное количество оперативных вмешательств на органах брюшной полости сегодня выполняется с использованием лапароскопической техники. Схемы периоперационного обезболивания при этом не подразумевают использования методов нейроаксиальной анестезии/анальгезии (за редким исключением). Для блокады ноцицептивного входа из поврежденных тканей рекомендуется инфильтрация мягких тканей в местах установки эндоскопических портов (см. раздел 4.1). Для ускорения разрешения пареза кишечника целесообразна периоперационная внутривенная инфузия лидокаина (см. раздел 3.5). Ряд абдоминальных вмешательств, в том числе лапароскопических, характеризуется наличием нейропатического компонента в структуре послеоперационной боли (например, холецистэктомия), что повышает риск формирования хронического послеоперационного болевого синдрома. Это является основанием для включения в схемы обезболивания препаратов, эффективных в отношении нейропатической боли — габапентиноиды, антагонисты NMDA-рецепторов (см. разделы 3.3 и 3.4).
Периоперационное обезболивание при открытых обширных операциях на органах брюшной полости должно включать продленную ЭА местными анестетиками. Данная методика не только обеспечивает адекватное обезболивание (с исключением потребности в системном введении опиоидных анальгетиков), но и позитивно влияет на течение раннего послеоперационного периода, снижая частоту жизнеугрожающих осложнений, а также вероятность летального исхода [78, 79, 81]. При переводе пациента в профильное отделение для продленной ЭА рекомендуется использовать одноразовые эластомерные помпы.
Некоторые схемы периоперационной анальгезии при операциях на органах брюшной полости представлены в табл. 7–9.
| Таблица 7. Периоперационное обезболивание при открытой гемиколонэктомии | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Установка эпидурального катетера на уровне Th10–12, болюсное введение 7–8 мл 0,5% ропивакаина (35–40 мг) или 6–7 мл 0,5% левобупивакаина (30–35 мг) |
| Интраоперационно | Общая анестезия с ИВЛ, эпидуральная анальгезия в качестве компонента (болюсно 0,5% р-р ропивакаина или левобупивакаина 0,375% по 4–5 мл, или инфузия 0,2% ропивакаина со скоростью 5–6 мл/ч) |
| В послеоперационном периоде | Продленная эпидуральная анальгезия: 0,2% ропивакаин со скоростью 6–8 мл/ч в течение ≈ 48 ч. После окончания эпидуральной анальгезии — парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг в/в, в/м |
| Таблица 8. Схема периоперационного обезболивания при лапароскопической гемиколонэктомии | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Лидокаин 100 мг в/в во время индукции общей анестезии |
| Интраоперационно | Общая анестезия с ИВЛ. Инфильтрация тканей в месте установки портов 0,5% раствором ропивакаина или левобупивакаина по 5–7 мл на каждый порт. Инфузия лидокаина 1,5–2 мг/кг/ч |
| В послеоперационном периоде | Рекомендуется продолжить в/в инфузию лидокаина со скоростью 1 мг/кг/ч в течение ≈ 24 ч. Парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут + трамадол 100–200 мг. При необходимости — промедол 20 мг |
| Таблица 9. Периоперационное обезболивание при лапароскопической холецистэктомии | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг перорально за 2 ч до операции. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза. Кетамин 12,5 мг, в/в, во время индукции |
| Интраоперационно | Общая анестезия с ИВЛ. Инфильтрация тканей в месте установки портов 0,5% раствором ропивакаина или левобупивакаина, по 5–7 мл на каждый порт. Инфузия кетамина в/в, в дозе 2–3 мкг/кг/мин |
| В послеоперационном периоде | Кеторолак 30 мг, 2–3 р./сут (лорноксикам 8 мг, кетопрофен 100 мг) в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин — 3–4 р./сут. Габапентин 300 мг per os 3 р./сут в течение 3–4 сут |
При открытых операциях на органах грудной клетки (торакотомиях) послеоперационный болевой синдром характеризуется высокой интенсивностью. В его структуре преобладают соматический компонент (пересечение ребер, хрящей) и нейропатический компонент (повреждение ребер, как во время торакотомии, так и при установке ранорасширителей). Высокая интенсивность послеоперационной боли и наличие нейропатического компонента являются факторами риска формирования хронического постторакотомического болевого синдрома (ХПТБС), частота которого достигает 65–80 % [83].
Широкое внедрение эндоскопических методик в торакальной хирургии (торакоскопические и видеоассистированные торакоскопические операции) снизило травматичность вмешательств на органах грудной клетки, снизило частоту, но не исключило риска формирования ХПТБС.
Основой схем периоперационного обезболивания в торакальной хирургии являются методики регионарной анальгезии, прежде всего ЭА и паравертебральная блокада. По данным Кокрановского обзора (метаанализ 23 контролируемых рандомизированных исследований, 2013 г.), послеоперационная ЭА снижает частоту развития ХПТБС через 6 мес. после торакотомии [84]. Кроме того, рекомендуется использование препаратов, оказывающих влияние на нейропатический компонент болевого синдрома. Примерные схемы обезболивания представлены в табл. 10–11.
| Таблица 10. Периоперационное обезболивание при торакотомии | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг, перорально за 2 ч до операции. Установка эпидурального катетера* на уровне Th6–8, болюсное введение 7–8 мл 0,5% ропивакаина (35–40 мг) или 6–7 мл 0,5% левобупивакаина (30–35 мг). Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза |
| Интраоперационно | Общая анестезия с ИВЛ, эпидуральная анальгезия в качестве компонента (0,5% ропивакаина болюсно, или левобупивакаин 0,375% в объеме 4–5 мл, или инфузия 0,2% ропивакаина со скоростью 5–6 мл/ч) |
| В послеоперационном периоде | Продленная эпидуральная анальгезия 0,2% ропивакаином 6–8 мл/ч в течение ≈ 48 ч. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./ сут ± трамадол 100–200 мг в/в, в/м. При необходимости — промедол 20 мг |
*Альтернативой эпидуральной анальгезии может являться паравертебральная блокада. Катетер в паравертебральное пространство устанавливается до начала операции с использованием УЗ-навигации.
| Таблица 11. Периоперационное обезболивание при видеоассистированной торакоскопической операции | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг, перорально за 2 ч до операции. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в за 20 мин до разреза. Кетамин 12,5 мг, в/в, во время индукции |
| Интраоперационно | Общая анестезия с ИВЛ. Инфильтрация тканей в области установки портов и мини-торакотомии — ропивакаин или левобупивакаин 0,5% по 5–6 мл на каждый порт и зону разреза. Инфузия кетамина — в/в, 2–3 мкг/кг/мин |
| В послеоперационном периоде | Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг, в/в, в/м. При необходимости — промедол 20 мг |
Данные доказательной медицины, касающиеся послеоперационного обезболивания пациентов после кардиохирургических операций
Примерные схемы послеоперационного обезболивания представлены в табл. 12.
Таблица 12. Варианты послеоперационного обезболивания у кардиохирургических больных |
|
| Этап | Рекомендации |
|---|---|
| До операции | Обычно не требуется |
| Во время операции | Сбалансированная многокомпонентная общая анестезия, ИВЛ |
| После операции | 1-я схема: Парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± опиоидный анальгетик по показаниям: промедол в дозе 20 мг в/в или в/м или морфин в дозе 10 мг в/м, или трамадол в дозе 100 мг в/в или в/м (в зависимостот степени выраженности болевого синдрома при ВАШ > 4 или ВШ > 2 баллов) или КПА промедолом, морфином или трамадолом |
| 2-я схема: Кетопрофен 100 мг (декскетопрофен 50 мг, лорноксикам 8–16 мг, кеторолак 30 мг), в/в или в/м × 2–3 р./сут ± парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± опиоидный анальгетик: промедол в дозе 20 мг в/в или в/м или морфин в дозе 10 мг в/м, или трамадол в дозе 100 мг в/в (в зависимости от степени выраженности болевого синдрома при ВАШ > 4 или ВШ > 2 баллов) или КПА промедолом, морфином или трамадолом |
|
| 3-я схема: Нефопам 20 мг, в/в, в течение 30 мин, за 30 мин до эктубации трахеи, затем постоянная инфузия в дозе до 120 мг в сут ± кетопрофен 100 мг (декскетопрофен 50 мг, лорноксикам 8–16 мг, кеторолак 30 мг) в/в или в/м × 2–3 р./сут ± опиоидный анальгетик по показаниям: промедол в дозе 20 мг в/в или в/м или морфин в дозе 10 мг в/м, или трамадол в дозе 100 мг в/в (в зависимости от степени выраженности болевого синдрома при ВАШ > 4 или ВШ > 2 баллов) или КПА промедолом, морфином или трамадолом |
|
ВАШ — визуально-аналоговая шкала; ВШ — вербальная шкала; КПА — контролируемая пациентом анальгезия.
По интенсивности боли в ранний послеоперационный период гинекологические операции (наряду с вмешательствами ортопедического и травматологического профиля) занимают ведущие места в рейтинге «самых болезненных операций», составленном по результатам масштабного исследования, выполненного в Германии и включившего 50 523 пациента 105 различных клиник [95].
Широкое внедрение методик эндоскопической хирургии в гинекологии существенно снизило вероятность возникновения интенсивного болевого синдрома и риск его хронизации, но не решило полностью проблему послеоперационной боли в этой области хирургии. Примерные схемы обезболивания представлены в табл. 13 и 14.
| Таблица 13. Схема периоперационного обезболивания при открытой гистерэктомии | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Установка эпидурального катетера на уровне Th10–12, болюс 7–8 мл 0,5% ропивакаина (35–40 мг) или 6–7 мл 0,5% левобупивакаина (30–35 мг). Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза |
| Интраоперационно | Общая анестезия с ИВЛ, эпидуральная анальгезия* в качестве компонента (болюсно 0,5% р-р ропивакаина, или 0,375% левобупивакаин по 4–5 мл, или инфузия 0,2% ропивакаина со скоростью 5–6 мл/ч) |
| В послеоперационном периоде | Продленная эпидуральная анальгезия: 0,2% ропивакаин со скоростью 5–6 мл/ч в течение ≈ 12–24 ч. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг в/в, в/м |
*Альтернативой эпидуральной анальгезии может являться ТАР-блок, выполненный под УЗ-контролем. Введение ропивакаина 0,2% — по 20 мл с каждой стороны. Катетер разместить над фасцией вдоль линии разреза, соединить с эластомерной помпой. Инфузию или болюсное введение 0,2% ропивакаина продолжить в течение 12–24 ч.
| Таблица 14. Схема периоперационного обезболивания при лапароскопической гистерэктомии | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза |
| Интраоперационно | Общая анестезия с ИВЛ. Инфильтрация тканей в месте установки портов — 0,5% ропивакаином или левобупивакаином по 5–7 мл на каждый порт |
| В послеоперационном периоде | Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг в/в, в/м |
Послеоперационная боль после операции на позвоночнике является результатом активации различных механизмов боли, включая ноцицептивный, нейропатический и воспалительный компоненты. Большинство этих пациентов страдают хронической болью и длительно используют неопиоидные и даже опиоидные анальгетики. Все эти факторы способствуют возникновению проблем с послеоперационным обезболиванием. В послеоперационном периоде оптимально использовать ММА. Потенциальные периоперационные неопиоидные анальгетики и другие анальгетики, которые могут использоваться в мультимодальном протоколе, включают: ацетаминофен, габапентин, антагонисты NMDA-рецепторов (кетамин или MgSO4) (см. разделы 3.3 и 3.4), дексаметазон, агонисты а2-рецептора, внутривенную инфузию лидокаина (см. раздел 3.5), НПВС, нейроаксиальную блокаду инфильтрационную анестезию места разреза.
Большинство пациентов в непосредственном послеоперационном периоде должны получать опиоиды внутривенно или методом пациент-контролируемой анальгезии с переходом к употреблению их per os, однако неблагоприятные побочные эффекты могут ограничивать дозу опиоидов, получаемых пациентом.
Несмотря на это, опиоиды остаются эффективными анальгетиками и используются в качестве основы лечения из-за их сильных анальгетических свойств.
После коррекции сколиоза у детей и подростков для обезболивания используется ЭА. ЭА обеспечивает отличный контроль боли и может быть выполнена также хирургом во время оперативного вмешательства. Важно отметить, что местные анестетики, используемые эпидурально, могут затруднить неврологический осмотр после операции и могут маскировать неврологическую травму 1. Местные анестетики, такие как ропивакаин и бупивакаин, используются для инфильтрации хирургической раны. Также они могут применяться в виде непрерывной инфузии в рану.
1 Как альтернатива эпидуральной анальгезии может использоваться интратекальное введение опиоидов, которое можно проводить до операции, или хирург может непосредственно пунктировать твердую мозговую оболочку. Интратекальное введение морфина обеспечивает от 12 до 36 ч анальгезии [32, 33], приводит к уменьшению потребности в опиоидах и снижает боль по сравнению с контролируемой пациентом анальгезией [32].
Примерные схемы обезболивания представлены в табл. 15–17.
| Таблица 15. Схема периоперационного обезболивания. Транспедикулярная фиксация, спондилодез | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг, перорально за 2 ч до операции. Установка эпидурального катетера, только если не используется нейрофизиологический мониторинг и нет противопоказаний (на 2–4 сегмента выше разреза), болюс 0,5% ропивакаина 7–8 мл (35–40 мг) или 0,5% левобупивакаина 6–7 мл (30–35 мг). Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза |
| Интраоперационно | Общая анестезия с ИВЛ, эпидуральная анальгезия в качестве компонента (0,5% р-р ропивакаина болюсно, или 0,375% левобупивакаин по 4–5 мл, или инфузия 0,2% ропивакаина со скоростью 5–6 мл/ч) |
| В послеоперационном периоде | Продленная эпидуральная анальгезия: 0,2% ропивакаин со скоростью 6–8 мл/ч в течение ≈ 48 ч. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг, в/в, в/м. При необходимости — промедол 20 мг или морфин 10 мг |
| Таблица 16. Схема периоперационного обезболивания. Коррекция сколиотической деформации позвоночника | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза |
| Интраоперационно | Общая анестезия с ИВЛ, эпидуральная анальгезия на первом или втором уровне в качестве компонента, только если не используется нейрофизиологический мониторинг (ропивакаин болюсно 0,5% р-р или левобупивакаин 0,375% по 4–5 мл или инфузия ропивакаина 0,2% 5–6 мл/ч). Установка одного или двух эпидуральных катетеров (Th3–6, Th10–12) хирургом в конце операции перед ушиванием раны |
| В послеоперационном периоде | Продленная эпидуральная анальгезия — ропивакаин 0,2% 5–6 мл/ч в течение ≈ 12–24 ч после неврологического осмотра. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг в/в, в/м. При отсутствии эпидуральной анальгезии — продленная в/в инфузия промедола или морфина |
| Таблица 17. Схема периоперационного обезболивания. Эндоскопическое удаление грыжи диска | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг per os за 2 ч до операции. Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг), в/в, за 20 мин до разреза |
| Интраоперационно | Общая анестезия с ИВЛ. Инфильтрация тканей в месте установки порта — ропивакаин или левобупивакаин 0,5% 5–6 мл или в зону разреза |
| В послеоперационном периоде | Кеторолак 30 мг (лорноксикам 8 мг, кетопрофен 100 мг) × 2–3 р./сут в/в или в/м + парацетамол 1 г, в/в инфузия в течение 15 мин × 4 р./сут ± трамадол 100–200 мг, в/в, в/м. При необходимости — промедол 20 мг или морфин 10 мг |
Операции тотального эндопротезирования суставов нижних конечностей, наверное, уникальны по широте предлагаемого спектра анестезиологического обеспечения. Единого мнения о выборе оптимального метода до сих пор не сформировано. Тем не менее, основываясь на данных доказательной медицины и собственном опыте, мы предлагаем следующие схемы (табл. 18–21).
| Таблица 18. Тотальное эндопротезирование тазобедренного сустава (вариант 1) | |
| Этап Рекомендации | |
|---|---|
| Перед операцией | Габапентин 1 600 мг, перорально за 2 ч до операции. Кеторолак 2 30 мг или лорноксикам 8 мг, в/в, за 15–20 мин до разреза |
| Интраоперационно | Спинальная анестезия (бупивакаин гипербарический 12,5–15 мг) |
| В послеоперационном периоде | Кеторолак 30 мг 2–3 р./сут или лорноксикам 8 мг 2 р./сут в/в или в/м 2–3 р./сут + парацетамол 1 г, в/в, капельно в течение 15 мин ± трамадол 100–200 мг в/м или в/в. Габапентин 300 мг per os 3 р./сут в течение 3–4 сут |
1 При тотальном эндопротезировании тазобедренного сустава послеоперационный болевой синдром имеет нейропатический компонент, за счет этого высок риск формирования хронического послеоперационного болевого синдрома. Это обусловливает необходимость включения в схему мультимодальной анальгезии габапентина.
2 При наличии противопоказаний к назначению НПВС препарат этой группы может быть заменен на нефопам или трамадол.
| Таблица 19. Тотальное эндопротезирование тазобедренного сустава (вариант 2) | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг, перорально за 2 ч до операции. Кеторолак 30 мг или лорноксикам 8 мг, в/в, за 15–20 мин до разреза |
| Интраоперационно | Спинально-эпидуральная анестезия. Уровень спинномозговой пункции L3–4, пункции эпидурального пространства — L2–3 |
| В послеоперационном периоде | Продленная эпидуральная анальгезия: ропивакаин 0,2% 5–6 мл/ч в течение ≈ 24 ч. Кеторолак 30 мг 2–3 р./сут или лорноксикам 8 мг 2 р./сут в/в или в/м 2–3 р./сут + парацетамол 1 г, в/в капельно в течение 15 мин, после окончания эпидуральной анальгезии. Габапентин 300 мг per os 3 р./сут в течение 3–4 сут |
| Таблица 20. Тотальное эндопротезирование коленного сустава (вариант 1) | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин1 600 мг, перорально за 2 ч до операции. Кеторолак2 30 мг или лорноксикам 8 мг, в/в, за 15–20 мин до разреза |
| Интраоперационно | Спинальная анестезия (бупивакаин гипербарический 12,5–15 мг) |
| В послеоперационном периоде | Кеторолак 30 мг 2–3 р./сут или лорноксикам 8 мг 2 р./сут в/в или в/м 2–3 р./сут + парацетамол 1 г, в/в капельно, в течение 15 мин ± трамадол 100–200 мг в/м или в/в. Габапентин 300 мг per os 3 р./сут в течение 3–4 сут |
1 При тотальном эндопротезировании коленного сустава послеоперационный болевой синдром имеет нейропатический компонент, за счет этого высок риск формирования хронического послеоперационного болевого синдрома. Это обусловливает необходимость включения в схему мультимодальной анальгезии габапентина.
2 При наличии противопоказаний к назначению НПВС препарат этой группы может быть заменен на нефопам или трамадол.
| Таблица 21. Тотальное эндопротезирование коленного сустава (вариант 2) | |
| Этап | Рекомендации |
|---|---|
| Перед операцией | Габапентин 600 мг, перорально за 2 ч до операции. Кеторолак 30 мг или лорноксикам 8 мг, в/в, за 15–20 мин до разреза |
| Интраоперационно | Спинально-эпидуральная анестезия. Уровень спинномозговой пункции L3–4, пункции эпидурального пространства — L2–3 |
| В послеоперационном периоде | Продленная эпидуральная анальгезия: ропивакаин 0,2% 5–6 мл/ч в течение ≈ 24 ч. Кеторолак 30 мг 2–3 р./сут или лорноксикам 8 мг 2 р./сут в/в или в/м 2–3 р./сут + парацетамол 1 г, в/в капельно в течение 15 мин, после окончания эпидуральной анальгезии. Габапентин 300 мг per os 3 р./сут в течение 4–5 сут |
Проводится по общим принципам послеоперационной реабилитации, в зависимости от нозологии и вида оперативного вмешательства.
| № п/п | Критерии качества | Уровни убедительности рекомендаций | Уровни достоверности доказательств |
|---|---|---|---|
| 1 | Проведена оценка болевого синдрома по шкале ВАШ | А | 1 |
| 2 | После операций среднего и высокого риска применена мультимодальная анальгезия | А | 1 |
| 3 | У пациентов с повышенным риском развития сердечно-сосудистых, легочных осложнений и кишечной непроходимости использована нейроаксиальная анальгезия при обширных торакальных и абдоминальных операциях | А | 1 |
Рекомендации разработаны в соответствии с приказом Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. А.М. Овечкин — дизайн, общее руководство, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи; И.Б. Заболотских — дизайн, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи; А.Ж. Баялиева, А.А. Ежевская, А.А. Еременко, Д.В. Заболотский, А.Е. Карелов, В.А. Корячкин, А.П. Спасова, В.Э. Хороненко, Д.Н. Уваров, Г.Э. Ульрих, Р.В. Шадрин — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.