Вторичные гипокалиемические миоплегии (ВГМ) характеризуются клиническим полиморфизмом, связанным с поражением всех видов миоцитов (гладких, поперечнополосатых мышечных волокон, кардиомиоцитов), реализующих электродинамику нервной системы. Снижение в сыворотке крови уровня калия (К), участвующего в мышечной сократимости и являющегося одним из важнейших электролитов, ниже 3,5 ммоль/л обусловливает нервно-мышечные, сердечно-сосудистые нарушения, расстройства функционирования желудочно-кишечного тракта (ЖКТ) [1]. В тех случаях, когда отмечается значительное снижение уровня К в сыворотке крови, опасными для жизни являются респираторная недостаточность и расстройства сердечной деятельности. Важно учитывать при оценке содержания К в тканях тот факт, что его внутриклеточное содержание составляет 98 % от общего количества в организме и доступным для клинической оценки является мониторинг уровня только внеклеточного К в крови [2].
Изменение соотношения внеклеточного и внутриклеточного уровней К, определяя возникновение нарушения возбудимости и проводимости сердечной мышцы, играет важную роль в манифестации фатальных аритмий при ВГМ [3]. Риск систематических ошибок при дифференциально-диагностическом поиске в случае остро возникших периферических парезов должен быть сведен к минимуму, так как запоздалая диагностика определяет риск повышения частоты летальных исходов при возникновении аритмий у больных с ВГМ [4].
Дифференциальную диагностику ВГМ необходимо проводить с острым инфекционно-аллергическим полирадикулоневритом, токсическими, метаболическими, воспалительными миопатиями (табл. 1).
| Таблица 1. Дифференциальная диагностика вторичных гипокалиемических миоплегий | |||||
| ВГМ | Метаболические миопатии | Токсические миопатии | Воспалительные миопатии | Синдром Гийена— Барре | |
|---|---|---|---|---|---|
| Начало | Острое/подострое | Медленное | Острое | Острое/подострое | Острое/подострое |
| Повышение уровня креатинфосфокиназы | −/+ | + | + | + | − |
| Снижение уровня К в крови | + | − | − | − | − |
| Развитие лактат-ацидоза | − | + | − | − | − |
| Снижение мышечной силы | + | + | + | + | + |
| Снижение сухожильных рефлексов | − | − | − | − | + |
| Другие неврологические симптомы | − | + | − | − | +/− |
| ЭНМГ (признаки поражения нервных волокон) | − | − | − | − | +/− |
| Биопсия (патологические изменения мышц) | − | + | + | + | − |
Синдром Гийена—Барре в настоящее время стал наиболее распространенной причиной острого генерализованного периферического паралича после фактического исчезновения полиомиелита в глобальном масштабе. Синдром Гийена—Барре, так же, как и ВГМ, дебютирует с поражения скелетных мышц нижних конечностей, которое в тяжелых случаях приобретает восходящий характер, сопровождаясь нарушением глотания и вентиляции легких. Это сходство в клинической картине двух разных нозологий требует особой осведомленности врачей о мультифакториальной природе острых миоплегий во избежание диагностических ошибок.
При метаболических миопатиях любое нарушение поддерживающих синтез АТФ в мышцах биохимических процессов, включающее расстройства углеводного, липидного обмена и нарушения функции митохондрий, неизбежно приводит к непереносимости физических нагрузок. Обычно при сокращении мышц имеются определенные механизмы, предотвращающие необратимое поражение саркоцитов. Одним из распространенных симптомов при метаболических миопатиях в условиях снижения трофического обеспечения мышц является непреодолимая быстрая утомляемость мышц, сопровождающаяся болевыми ощущениями, крампи, что является отражением в конечном итоге разрушения мышечного волокна. Последнее определяет возникновение миоглобинурии, потенциально опасной развитием почечного тубулярного некроза. Причинами митохондриальных заболеваний, сопровождающихся рецидивирующей мышечной слабостью с непереносимостью физической нагрузки, являются несколько разных дефектов в функционировании дыхательной цепи на уровне митохондрий. В группе заболеваний, известных как митохондриальные миопатии, неврологические нарушения менее выражены, основным симптомом является снижение толерантности к физической нагрузке. При митохондриальных нарушениях поддержание адекватного уровня АТФ в состоянии покоя может потребовать полностью активированного митохондриального окисления. В этой ситуации пациент в состоянии покоя может испытывать все симптомы, которые обычно сопровождают энергичные физические упражнения. Кроме того, поскольку окислительные механизмы недостаточны для удовлетворения повышенного запроса АТФ в условиях сокращения мышц, компенсаторно включаются анаэробные механизмы, обусловливающие высокую концентрацию лактата в крови.
При подостром течении воспалительные миопатии, основные этиопатогенетические механизмы развития которых представлены опосредованным аутоиммунным поражением мышечной ткани [5] либо прямым воздействием инфекционных агентов, могут мимикрировать под ВГМ и должны распознаваться с помощью специализированных клинических исследований (биопсии мышц, электромиографии). Выделяются среди аутоиммунных заболеваний полимиозит, дерматомиозит, некротизирующий аутоиммунный миозит и спорадический миозит с включениями [6]. Патологическое вовлечение мышц также встречается при других аутоиммунных заболеваниях (ревматоидном артрите).
При токсических миопатиях разрушение мышечных волокон может являться результатом применения лекарственных препаратов, непосредственно поражающих сарколемму, структуру ядра, митохондрии и/ или другие органеллы. Несколько часто используемых препаратов вызывают миопатию. В редких случаях пероральный прием статинов вызывает токсические миопатии, которые сопровождаются мышечной слабостью, признаками разрушения мышечных волокон вследствие поражения сарколеммы и ядерного аппарата клетки. При этой нозологии периферические парезы в сочетании с миоглобинурией могут имитировать клинические проявления гипокалиемии у больных с рабдомиолизом, что определяет значительные сложности в процессе дифференциально-диагностического поиска [7].
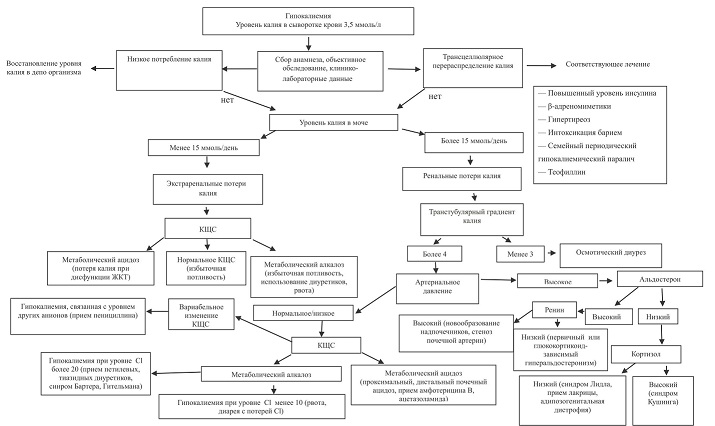
ВГМ могут обусловливаться перераспределением
К между внеклеточной и внутриклеточной жидкостью, потерей ионов К через ЖКТ, повышенной почечной экскрецией К [8] (рис. 1).
1. ВГМ, связанные с вне- и внутриклеточным перераспределением К. Вторичные гипокалиемические миоплегии, связанные с вне- и внутриклеточным перераспределением К при эндокринной патологии
Тиреотоксический периодический паралич (ТПП) доминирует по частоте у лиц азиатского происхождения [20], у коренных американских и островных этносов [9]. Дебютирует ВГМ при манифестации болезни Грейвса [20]. С учетом латентного протекания клинических проявлений тиреотоксикоза у мужчин целесообразно включать в скрининговое обследование больных с необъяснимыми пароксизмальными нервно-мышечными нарушениями тщательное изучение функции щитовидной железы [10]. В случае декомпенсации сахарного диабета вследствие повышения почечной экскрекции К отмечается дефицит этого электролита в депо организма, однако недостаток его содержания в тканях не приводит к манифестным проявлениям гипокалиемии ввиду того, что внутриклеточное содержание К на фоне недостаточной выработки инсулина поджелудочной железой не нарастает. При ускоренной коррекции диабетического кетоацидоза могут развиваться ВГМ, обусловленные быстрым снижением уровня К в сыворотке крови.
2. Вторичные гипокалиемические миоплегии, связанные с вне- и внутриклеточным перераспределением К, вызванные экзогенными факторами
Причинами ВГМ могут быть различные экзогенные агенты: карбонат бария, лекарственные вещества. Производные ксантина (теофиллин, кофеин) являются косвенной причиной ВГМ, активируя выброс адреналина/норадреналина, инициирующих активность Na-K-АТФазы Как показывает клинический опыт, из всех фармакологических агентов в подавляющем большинстве случаев причиной ятрогенной гипокалиемии являются диуретики [11, 12].
Тяжелая гипокалиемия может наблюдаться при хроническом злоупотреблении алкоголем после развития делирия вследствие избыточного выброса катехоламинов надпочечниками [13].

Рис. 1. Общие принципы диагностики гипокалиемии
КЩС — кислотно-щелочное состояние.
3. Вторичные гипокалиемические миоплегии, связанные с вне- и внутриклеточным перераспределением К, обусловленные различными причинами
Гипомагнеземия определяет снижение интрацеллюлярного К вследствие недостаточного функционирования Na-К-АТФ-азы. Также увеличивается выделение К с мочой. При замещении крови у больных с пернициозной анемией снижение содержания К в крови обусловливается вне- и внутриклеточным перераспределением этого электролита в эритроцитах.
4. Вторичные гипокалиемические миоплегии при повышенной экскреции К почками. Вторичные гипокалиемические миоплегии при повышенной экскреции К почками, вызванные экзогенными факторами
Значительное усиление почечного выведения К в сочетании с гипомагенеземией, определяющего возникновение ВГМ, многими авторами связывается с продолжительным приемом кортикостероидов, антибиотиков, цитостатиков, препаратов из корней солодки [14].
5. Вторичные гипокалиемические миоплегии при повышенной экскреции К почками у больных с эндокринной патологией
Первичный гиперальдостернонизм у больных с новообразованием надпочечников манифестирует в форме тяжелых нервно-мышечных расстройств на фоне значительной гипокалиемии [15, 16]. Вторичный альдостеронизм при нефротическом синдроме, стенозе почечных артерий, ренинпродуцирующем новообразовании надпочечников, кардиоваскулярной недостаточности может определять развитие гипокалиемии.
6. Вторичные гипокалиемические миоплегии при повышенной экскреции К почками у больных с первичной патологией почек
ВГМ возникают при почечном тубулярном ацидозе, тубулопатии у детей, водной интоксикации, геридитарной патологии (синдром Лидла, Бартера, Гительмана) [17-20].
7. Вторичные гипокалиемические миоплегии при ренальной потере К различной этиологии
Острые лейкозы могут сопровождаться ВГМ, обусловленными развитием гипокалиемии, связанной с усилением по неизвестным причинам ренальной экскреции К.
8. Вторичные гипокалиемические миоплегии при экстраренальной потере К. Вторичные гипокалиемические миоплегии при потере К через желудочно-кишечный тракт
В ряде случаев причиной снижения уровня К в крови является потеря электролитов при рвоте, диарее, кровопотере у больных с синдром мальабсорбции, инфекционных заболеваниях с желудочно-кишечными расстройствами, после хирургических операций на тонком кишечнике [21].
При абузусном употреблении лаксатива у больных, стремящихся похудеть, многократном повторении клизм может возникать гипокалиемия.
Метаболический алкалоз, развивающийся при экстраренальной потере К (избыточная потливость, рвота, диарея), всегда сочетается с гипокалиемией, снижением содержания хлоридов в крови, может сопровождаться мышечной слабостью.
9. Вторичные гипокалиемические миоплегии, возникающие вследствие недостаточного поступления К с пищей
В редких случаях при приеме К менее 1 г в сутки с пищей отмечается гипокалиемия из-за сохраняющейся экскреции К почками и истощения его запасов в организме.
10. Типичные изменения на ЭКГ при гипокалиемии
Типичными электрокардиографическими индикаторами гипокалиемии являются: снижение амплитуды Т-зубца, сегмента ST, отрицательные зубцы Т, удлинение интервала PQ, экстрасистолы (желудочковые и наджелудочковые), фибрилляция предсердий [22].
Возникающая при гипокалемии мультифокальная предсердная тахикардия, связанная с проведением электрических импульсов, продуцирующихся аномальной активностью различных предсердных очагов, определяет неритмичность учащенных сердечных сокращений, возникновение на ЭКГ различных по характеристике Р-волн, разных по длительности интервалов P–P [23]. При гипокалиемии в тяжелых случаях могут отмечаться потенциально фатальные приступы желудочковой тахикардии типа «пируэт» (torsade de pointes) с постоянным полиморфизмом комплексов QRS (различной формы, направления, амплитуды и длительности) на фоне удлинения интервала QT [24].
При синдроме Гительмана у ряда пациентов наблюдается выраженное нарушение процессов реполяризации в виде депрессии сегмента ST, имитирующих на ЭКГ признаки острой ишемии миокарда [25, 26].
При ТПП у всех больных отмечаются типичные изменения ЭКГ [27], которые связаны с гиперпродукцией тиреодных гормонов. Наряду с типичными для гипокалиемии ЭКГ-изменениями регистрируются нарушения функционирования проводящей системы сердца: AV-блокада, слабость синусового узла, трепетание и фибрилляция предсердий, различные виды аритмий [28, 29].

Рис. 2. Общие принципы лечения гипокалиемии
Необходимо помнить, что нарушение функции почек или недостаточность надпочечников может вызвать калиевую интоксикацию, которая может развиваться быстро и бессимптомно. Гипокалиемия тяжелой степени является жизнеугрожающей, требует ургентного лечения (рис. 2) [30]. При внутривенном введении растворов К важно учитывать, что уровень К в сыворотке крови не обязательно является надежным индикатором количества К в депо организма.
Выбор тактики лечения гипокалиемии зависит от этиологии ВГМ, уровня К в крови и риска истощения запасов этого электролита в вне- и/или внутриклеточных депо. В общем гипокалиемия, возникшая в результате интрацеллюлярного шифта, купируется при адекватной этиопатогенетической терапии. Например, незначительная гипокалиемия при гиперкатехоламинемии, связанной с интенсивным болевым синдромом, купируется адекватной анталгической терапией. В случае тяжелой гипокалиемии, возникшей при межклеточном перераспределении К, сопровождающейся кардиоваскулярными и нервно-мышечными нарушениями, показано внутривенное введение K [31].
При истощении К заместительная терапия зависит от предполагаемой степени снижения общего его количества в организме. Например, снижение общего содержания К в организме, сопровождаемое падением сывороточного К до 3,0–3,5 ммоль/л и 2–3 ммоль/л, связано с дефицитом К 150–200 ммоль и 200–400 ммоль соответственно [32].
Рекомендуется введение К внутривенно не более 20 ммоль в час при постоянном мониторинге сердечного ритма. Вводится калия хлорид (KCl) 10 ммоль/час внутривенно (избегать применения раствора глюкозы), рекомендовано не превышать общее количество введенного К более 50 ммоль или 2 г перорально каждые 2 ч. Избыточно быстрое внутривенное введение растворов К может спровоцировать перегрузку большого и/ или малого круга кровообращения, отек легких, а также вызвать увеличение объема циркулирующей жидкости с вторичным снижением концентрации К в сыворотке крови (водная интоксикация вследствие слишком быстрой внутривенной инфузии растворов может вызвать ятрогенную гипокалиемию).
При внутривенном введении К необходим контроль уровня в сыворотке крови К, натрия, хлорида, бикарбонатов, рН. Предпочтительно проводить непрерывный мониторинг сердечной деятельности при инфузии К более 10 мг-экв в течение 1 часа, особенно у пациентов с заболеваниями сердца, принимающих дигоксин, при наличии заболеваний почек. У больных с нарушением функции почек при введении некоторых растворов К, в ряде случаев содержащих алюминий, возникает увеличение уровня последнего к крови, обусловливая токсический эффект. Постинъекционный флебит может возникать при введении К в концентрациях, превышающих 40 мг-экв/л [2]. Снижение уровня хлоридов в крови обычно сопровождает истощение запасов К в депо, провоцируя гипохлоремический алкалоз, что требует при возникновении последнего экстренного купирования гипокалиемии, наряду с выявлением причины уменьшения запасов К в организме.
Для купирования нарушений сердечного ритма может использоваться смесь калиевой и магниевой солей аспарагиновой кислоты. Сульфат магния (MgSO4) применяют для элиминирования приступов желудочковой тахикардии.
Использование подщелачивающих кровь солей К (ацетата, цитрата, бикарбоната К) является предпочтительным для коррекции гипокалиемии у больных с метаболическим ацидозом, почечным канальцевым ацидозом, часто сопровождающихся гиперхлоремией. Ацетат калия следует использовать с осторожностью у пациентов с метаболическим или респираторным алкалозом и у больных с тяжелой печеночной недостаточностью. Фосфат калия предпочтителен для терапии гипокалиемии в случае специфического внутриклеточного дефицита К, не вызванного алкалозом. Противопоказано его использование при наличии почечной недостаточности. В остальных случаях используется KCl, как уникальное средство коррекции гипокалиемии различной этиологии.
При ВГМ целесообразно избегать внутривенного введения К, предпочтительно восполнение дефицита указанного иона пероральным путем (в виде KCl) в течение нескольких недель с одновременным приемом спиронолактона, амилорида, так как экзогенный К продолжает выделяться через почки. Рекомендуется использование в пищу продуктов, богатых калием. С осторожностью рекомендуется использовать калийсберегающие диуретики вследствие развития возможного повышения уровня К в крови, приводящего к фатальным кардиоваскулярным осложнениям, особенно у пациентов с сахарным диабетом и/или поражением почек.
1. Лечение ВГМ при тиреотоксическом периодическом параличе
Эффективным при ТПП является парентеральная инфузия неселективных β-блокаторов в дозе 3–4 мг/кг [33], затем — пероральный прием пропранолола (40 мг 4 раза в день). Ввиду того, что побочными эффектами парентерального введения β-блокаторов являются жизнеугрожающая брадикардия, полная AV-блокада, необходимо соблюдать крайнюю осторожность при их внутривенном введении. При грубых парезах предпочтение отдается парентеральному введению KCl [9]. Быстрое внутривенное введение KCl (более 10 ммоль/ч) обусловливает риск рикошетной фатальной гиперкалиемии [34, 35]. Целесообразно назначение антитиреоидных средств, при неэффективности консервативного лечения рассматривается возможность хирургического вмешательства — тиреоидэктомия/радиоктивный йод. Монотерапия антитиреодными средствами часто приводит к рецидиву болезни Грейвса и ТПП после их отмены [28, 36].
2. Лечение ВГМ при отравлении барием
При отравлении барием наряду с парентральным введением KCl используется инфузия сульфата натрия (NaSO4), при введении которого следует соблюдать осторожность вследствие высокого риска поражения почечных канальцев [13]. В случае ятрогенного отравления растворимыми солями бария необходим пероральный прием NaSO4 или MgSO4.
3. Лечение ВГМ, возникающих вследствие повышенной экскреции К при нарушении функции почек
При ВГМ ацидоз у больных с почечным ацидозом I типа [37] купируется внутривенным введением гидрокарбоната натрия с одновременным продолжительным назначением диеты, включающей продукты, содержащие большое количество К. Необходимо учитывать при коррекции сниженного уровня К в сыворотке крови в случае почечного ацидоза II типа риск усугубления гипокалемии на фоне инфузии гидрокарбоната натрия. При синдроме Гительмана эффективно [38]: назначение перорально KCl; MgSO4 или хлорида магния. Дополнительно в ряде случаев назначается спиронолактон, верошпирон; антагонист минералокортикоидных рецепторов — эплеренон [39], ингибитор ренина —алискирен [25, 40], иногда — нестероидные противовоспалительные препараты [41].
4. Лечение ВГМ при метаболическом алкалозе
При метаболическом алкалозе, снижении уровня хлоридов в крови проводится инфузия хлоридов, что в сочетании с приемом К перорально в адекватной дозировке позволяет быстро купировать метаболический алкалоз.
5. Лечение ВГМ при первичном гиперальдостеронизме
ВГМ исчезают при радикальном удалении объемного образования надпочечников [42, 43], при невозможности резекции опухоли — назначаются калийсберегающие диуретики.
В настоящее время дифференциально-диагностический алгоритм обследования больных с острыми вялыми параличами различной этиологии, обусловленных гипокалиемией, сопровождающихся развитием сердечной, дыхательной недостаточности, разработан не полностью. Это является наиболее частой причиной использования неадекватной, этиопатогенетически необоснованной тактики лечения ВГМ и в конечном итоге неэффективности консервативной терапии, что обусловливает повышение летальности и задержку рековалесценции у пациентов с ВГМ.
Таким образом, причины ВГМ гетерогенны, важную роль в их возникновении играют перераспределение содержания ионов К относительно клеточной стенки, потеря К через мочевыделительную систему, желудочно-кишечный тракт. Ввиду мультифакториальности ВГМ для выявления этиологии гипокалиемии и тщательного проведения дифференциально-диагностического поиска требуется мультидисциплинарный подход, своевременная информированность специалистов различного профиля об особенностях клинических проявлений ВГМ.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Вклад автора. Саковец Т.Г. — разработка концепции исследования, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.