Синтезированный в 1962 г. кетамин прошел путь от активного внедрения, жестокой критики, относительного забвения до возрождения живейшего интереса в последнее десятилетие. Наглядно это демонстрирует рост числа публикаций, найденных в базе данных PubMed: от 500 результатов, датированных 2008 г., до 1028 опубликованных в 2018 г. Этот факт объясняется относительно недавним обнаружением у кетамина целого ряда благоприятных эффектов [1]. Обсуждается способность кетамина профилактировать послеоперационную гиперальгезию [2], дрожь [3–6], послеоперационную тошноту и рвоту (ПОТР) [7, 8], постпункционную головную боль (ППГБ) [9], снижать выраженность воспаления [10, 11], предотвращать и лечить психические нарушения, в частности послеоперационные депрессивные расстройства [12–16].
Хорошо известны побочные действия кетамина, среди которых нервно-психические нарушения, такие как галлюцинации, психомоторное возбуждение, длительная дезориентация и психоз [17, 18]. Однако описанные эффекты чаще всего возникают в ответ на введение стандартных, анестетических, доз кетамина (1–3 мг/кг), в то время как низкие дозы их демонстрируют редко [11]. Тем не менее не решенным до сих пор остается вопрос о том, какие же дозы следует считать минимально эффективными и при этом максимально лишенными побочных эффектов.
Особый интерес представляет использование кетамина в акушерской практике. Во-первых, кетамин — один из немногих анестетиков, который разрешен к использованию у беременных женщин как в Российской Федерации, так и за рубежом. Во-вторых, именно молодые женщины фертильного возраста в наибольшей степени подвержены ряду специфических периоперационных анестезиологических осложнений, например, таких как ПОТР [19]. Наконец, в-третьих, у беременных женщин может иметь место изменение фармакокинетики лекарственных препаратов [20], в связи с чем результаты исследований низких доз кетамина, полученные на других категориях пациентов, нельзя экстраполировать на акушерскую популяцию.
Цель обзора состоит в том, чтобы оценить клинические эффекты различных доз и схем внутривенного введения кетамина в пределах субанестетического диапазона в периоперационном периоде кесарева сечения.
Двумя исследователями независимо друг от друга был выполнен поиск статей, опубликованных на всех языках с января 2008 г. по декабрь 2019 г. в базах данных библиотек PubMed, MEDLINE, EMBASE и Cochrane Central Register of Controlled Trials (CENTRAL).
Поисковый запрос включал следующие слова: «кетамин» и «акушерство», или «кесарево сечение», или «роды», или «послеродовой период», или «перипартальный период». Для включения в обзор были отобраны только рандомизированные контролируемые слепые исследования, выполненные на людях. Во всех найденных исследованиях была изучена библиография с целью выявления дополнительных, не обнаруженных ранее публикаций. Оба исследователя тщательно изучили названия и краткое содержание исследований, чтобы удалить возможные дублирующиеся результаты, которые были идентифицированы при поиске в различных базах данных.
Оценка соответствия исследований критериям включения проводилась в три этапа: сначала на основе заголовка, затем на основе аннотации и, наконец, на основе полного текста статьи.
Критериями включения в обзор были:
Критерии исключения:
Первичными контрольными точками были:
Вторичными контрольными точками были кумулятивные частоты всех побочных действий, описанных в исследованиях (например, желудочно-кишечные, неврологические, психологические и кардиореспираторные нежелательные эффекты).
Два исследователя независимо друг от друга изучили базы данных и получили потенциально релевантные исследования. Затем еще два эксперта оценивали соответствие полного текста статей критериям включения. В случае необходимости они разрешали спорные моменты путем обсуждения.
Данные публикаций, отвечающих критериям включения и исключения, были извлечены двумя рецензентами в соответствии с заранее определенными критериями. Нас интересовали данные, касающиеся дозы кетамина, степени выраженности благоприятного эффекта кетамина в сравнении с показателем контрольной группы, частота и характер нежелательных реакций.
Два рецензента и два исследователя независимо друг от друга оценивали и обсуждали риск систематической ошибки в каждом исследовании на основе рекомендаций, представленных в Кокрейновском справочнике по систематическим обзорам вмешательств, версия 5.1.0 (http://www.handbook.cochrane.org). В ходе работы рецензенты также оценивали метод рандомизации; степень ослепления пациентов, медицинского персонала и исследователей; наличие и полноту представленных авторами данных о результатах.
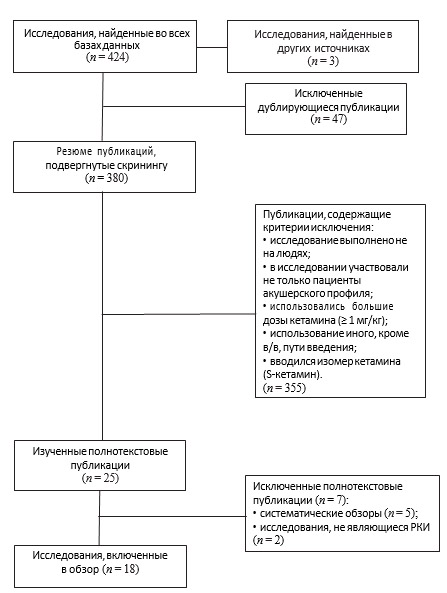
Наши поиски выявили 427 потенциально релевантных исследований. Тем не менее 409 из этих исследований были исключены после изучения резюме, так как содержали критерии исключения или не были выполнены на пациентках акушерского профиля (рис. 1).

Рис. 1. Выбор исследований PRISMA
Fig. 1. PRISMA selection of studies
Мы детально изучили 25 полнотекстовых публикаций, в результате чего были исключены 5 систематических обзоров [21–25] и 2 исследования, не являющихся РКИ [26, 27]. Остальные 18 исследований, которые соответствовали критериям включения, составляют основу данного обзора. Основные данные из 18 включенных в обзор РКИ приведены в (табл. 1).
Таблица 1. Данные исследований, включенных в обзор
Table 1. Research data included in the review
Фамилии исследователей, год публикации, страна |
Количество пациентов, вид оперативного вмешательства, анестезия |
Характеристика групп пациентов |
Дозы и схемы введения кетамина |
Оцениваемые эффекты |
Полученные результаты |
Регистрируемые побочные эффекты |
|---|---|---|---|---|---|---|
Профилактика послеоперационной боли |
||||||
Hajipour A. et al., 2002, Иран |
53 пациентки; ОА (тиопентал натрия, суксаметония хлорид; 50 % О2 + N2O + галотан, атракурия безилат морфин, мидазолам) |
1) группа кетамина (n = 27); 2) группа контроля (n = 26) — дистиллированная вода |
0,2 мг/кг до индукции анестезии |
Время до первого запроса анальгетика. Оценка боли по ВАШ. Суммарная доза потребления морфина за первые 24 ч. Оценка новорожденного по шкале Апгар |
Кетамин достоверно снижал: • время до первого запроса на анальгезию; • среднюю дозу морфина за первые 24 ч после операции; • уровень боли по ВАШ в течение 24 ч после операции (р < 0,001 для всех показателей) |
Галлюцинации. Галлюцинации не зафиксированы ни в одной из групп |
Reza F.M. et al., 2010, Иран |
60 пациенток; ОА (тиопентал натрия, суксаметония хлорид, атракурия безилат, 50 % O2 + N2О + галотан). После извлечения плода: фентанил и морфин |
1) группа кетамина (n = 30); 2) группа контроля (n = 30) — 0,9 % раствор натрия хлорида |
0,5 мг/кг в/в за 5 мин до индукции анестезии |
Оценка боли по ВАШ в течение первых 2, 6, 12, 24 ч послеоперационного периода. Суммарное потребление морфина в течение первых 2 и первых 24 ч после операции. Показатели гемодинамики (АД, ЧСС). Оценка новорожденного по шкале Апгар |
Кетамин снижал потребление морфина в течение первых 2 ч после операции (p < 0,01). Кетамин не влиял на: • потребление морфина в течение 2–24 ч после операции; • интенсивность боли в течение 2–24 ч после операции |
Галлюцинации. ПОТР |
Bilgen S. et al., 2012, Турция |
140 пациенток; ОА (пропофол; рокурония бромид 50 % О2 + N2O + севофлуран, морфин и лорноксикам) |
1) группа 1 (n = 35) — 0,25 мг/кг кетамина; 2) группа 2 (n = 35) — 0,5 мг/кг кетамина; 3) группа 3 (n = 35) — 1 мг/кг кетамина (результаты, полученные в данной группе, исключены из нашего обзора); 4) группа 4 (n = 35) — 0,9 % раствор натрия хлорида |
0,25 мг/кг в/в; 0,5 мг/кг в/в; 1 мг/кг в/в после преоксигенации |
Оценка боли по ЦРШ и суммарное потребление морфина через 2, 6, 12, 18, 24 и 48 ч после операции. Послеоперационная боль через 2 нед., 1 мес., 6 мес. и 1 год. Оценка новорожденного по шкале Апгар. Показатели гемодинамики (ЧСС, АД, SpO2) |
Кетамин не влиял на уровень боли в раннем и позднем послеоперационном периоде |
Тошнота. Рвота. Галлюцинации. Нистагм. Диплопия. Седация по шкале Ramsay. Частота побочных эффектов значимо не различалась между группами |
Haliloglu M. et al., 2015, Турция |
52 пациентки; ОА (тиопентал натрия, рокурония бромид, морфин, 50 % О2 + N2О + севофлуран) |
1) группа кетамина (n = 26); 2) группа контроля (n = 26) — 0,9 % раствор натрия хлорида |
В/в болюсно 0,5 мг/кг во время индукции ОА. После индукции кетамин продолжался в виде инфузии 0,25 мг/кг/ч вплоть до окончания операции |
Среднее 24-часовое потребление морфина. Оценка боли по ЦРШ через 2, 6, 12, 18, 24 ч после операции. Необходимость использования дополнительных обезболивающих препаратов (диклофенак). Оценка новорожденного по шкале Апгар, газы пуповинной крови |
Кетамин снижал: • среднее 24-часовое потребление морфина (p = 0,001); • уровень боли по ЦРШ через 15 мин после операции (p = 0,001). Кетамин не влиял на необходимость дополнительного обезболивания (р > 0,05) |
Зуд. ПОТР |
Вauchat J.M. et al., 2011, США |
174 пациентки; СА (гипербарический бупивакаин 12 мг, фентанил 15 мкг и морфин 150 мкг в виде одной инъекции) |
1) группа кетамина (n = 85); 2) группа контроля (n = 89) — 0,9 % раствор натрия хлорида |
10 мг кетамина, разведенного в 20 мл 0,9 % раствора натрия хлорида в/в инфузионно шприцевым насосом в течение 10 мин (2 мл/мин) через 5 мин после извлечения плода |
Оценка боли по ЦРШ в течение первых 24 ч и через 2 нед. после операции. Прорывная боль в первые 24 ч. Оценка боли по ЦРШ при первом запросе анальгезии. Время до первого запроса анальгезии. Суммарная доза таблеток, содержащих ацетаминофен и гидрокодон, «спасательная» анальгезия за первые 24, 48, 72 ч. Суммарная доза введенного ибупрофена. Удовлетворенность анестезией через 24, 72 ч и 2 нед. после родоразрешения |
Кетамин снижал: • уровень боли через 2 нед. после операции (профилактика хронической боли). Кетамин не влиял на: • частоту прорывных болей (p = 0,86); • уровень боли по ЦРШ в первые 24 ч после операции; • потребность в дополнительном обезболивании (ацетаминофен и гидрокодон) в первые 24 и 72 ч после операции |
Тошнота. Рвота. Зуд. Жалобы .на психомиметические эффекты (спутанность сознания, головокружение, диплопия). Психомиметические эффекты, оцененные по опроснику ARCI |
Мenkiti I.D., 2012, Нигерия |
60 пациенток; СА (гипербарический бупивакаин 0,5 % — 3 мл) |
1) группа кетамина (n = 28); 2) группа контроля (n = 28) — 0,9 % раствор натрия хлорида |
Кетамин в/в 0,15 мг/кг, разведенный до 2 мл раствором 0,9 % натрия хлорида после выполнения СА |
Послеоперационная боль по ВАШ каждые 30 мин в течение первых 150 мин после операции. Время до первого запроса на обезболивание в послеоперационном периоде. Общее потребление диклофенака и пентазоцина в течение первых 24 и 48 ч после операции. Число новорожденных, получивших менее 7 баллов по шкале Апгар |
Кетамин снижал: • уровень боли по ВАШ в течение 120 мин после операции (р = 0,022); • потребность в обезболивании диклофенаком и пентазоцином в первые сутки после операции (p < 0,001) для обоих показателей). Кетамин значимо увеличивал время до первого запроса на обезболивание (p < 0,001). Кетамин не влиял на потребление диклофенака (p = 0,302) и пентазоцина (p = 0,092) на второй послеоперационный день |
Гипотензия. Тошнота. Седация. Дрожь. Рвота. Головная боль. Галлюцинации. Нарушения зрения. Частота побочных эффектов не различалась между группами |
Behdad S. et al., 2013, Иран |
60 пациенток; СА (1,5 мл 5 % лидокаина) |
1) группа кетамина (n = 30) — кетамин + 1 мг мидазолама; 2) группа контроля (n = 30) — 1 мг мидазолама |
30 мг кетамина сразу после выполнения СА |
Оценка боли по ВАШ через 1, 2, 3 ч после операции. Время до первого запроса анальгетика. Общее потребление анальгетика (мг меперидина) в течение первых 24 ч после операции. Оценка новорожденного по шкале Апгар. Газы пуповинной крови. Гемодинамические показатели (АД, ЧСС) |
Кетамин снижал • уровень боли по ВАШ в первые 3 ч после кесарева сечения (p = 0,00; p = 0,95; p = 0,31 соответственно); • общую дозу меперидина в первые 24 ч (р = 0,02) |
Галлюцинации. Послеоперационная тошнота. Не было отмечено существенных побочных эффектов у пациентов обеих групп |
Milani F. et al., 2014, Иран |
60 пациенток; СА (лидокаин 5 % + адреналин 0,2 %) |
1) группа кетамина (n = 30); 2) группа контроля (n = 30) — 0,9 % р-р натрия хлорида |
0,2 мг/кг после выполнения СА |
Оценка боли по ВАШ через 0, 30, 60, 90, 120, 150, 180 мин, 6, 12, 18 и 24 ч после операции. Время до первого запроса анальгетика. Суммарная доза опиоидных (петидин) и неопиоидных (диклофенак) анальгетиков за сутки |
Кетамин снижал суммарную дозу петидина за сутки (p = 0,02). Кетамин не влиял на: • уровень боли по шкале ВАШ в первые сутки после операции (p = 0,70); • количество суппозиториев диклофенака за первые послеоперационные сутки (p = 0,76); • время до первого запроса на обезболивание (p = 0,87) |
Тошнота. Рвота. Головная боль. Зуд. Галлюцинации |
Rahmanian M. et. al., 2015, Иран |
160 пациенток; СА (2,5 мл 0,5 % раствора бупивакаина) |
1) группа кетамина (n = 80); 2) группа контроля (n = 80) — 0,9 % раствор натрия хлорида |
0,25 мг/кг кетамина в/в болюсно через 5 мин после извлечения плода |
Оценка боли по ЦРШ через 1, 2, 6, 12 ч после операции. Время до первого запроса на обезболивание. Количество суппозиториев диклофенака и инъекций петидина за первые 24 ч после операции |
Кетамин значимо снижал: • уровень боли по ЦРШ через 1, 2, 6, 12 ч после операции; • количество суппозиториев диклофенака и инъекций петидина за первые 24 ч после операции (p < 0,001 для всех перечисленных характеристик). Кетамин значимо увеличивал: • время до первого запроса на обезболивание (p < 0,001) |
Тошнота. Рвота. Головная боль. Галлюцинации. Зуд. Побочные эффекты (включая тошноту, зуд и головную боль) значимо не различались между двумя группами |
Sen S. et al., 2015, Турция |
90 пациенток; СА (15 мг изобарического бупивакаина) |
1) группа фентанила (n = 30) — интратекально в дополнение к бупивакаину вводилось 10 мкг фентанила; 2) группа кетамина (n = 30) — в/в вводилось 0,15 мг/кг кетамина; 3) группа контроля (n = 30): интратекально, в дополнение к 3 мл бупивакаина, вводилось 0,2 мл 0,9 % раствора натрия хлорида |
0,15 мг/кг кетамина, разведенного до 2 мл 0,9 % раствором натрия хлорида, в/в сразу после интратекального введения бупивакаина |
Оценка боли по ВАШ каждые 30 мин в течение первых 3 ч после операции. Время первого запроса на обезболивание. Суммарное потребление диклофенака в первые 24 и 48 ч после операции. Высота и продолжительность сенсорного блока. Продолжительность моторного блока. Оценка новорожденного по шкале Апгар |
Кетамин снижал: • уровень боли по ВАШ в течение первых 3 ч после операции по сравнению с группами фентанила и контроля; • потребность в обезболивании в первые 24 ч после операции по сравнению с группами фентанила и контроля (p = 0,02, p = 0,0001 соответственно). Кетамин увеличивал: • время до первого запроса на обезболивание в послеоперационном периоде по сравнению с группой контроля (p = 0,001). Кетамин не влиял: • на потребность в обезболивании на 2-е сутки после операции |
Тошнота. Седация. Зуд. Постпункционная головная боль |
Профилактика озноба |
||||||
Kose E.A. et al., 2013, Турция |
120 пациенток; СА (3 мл раствора Маркаин Хеви) |
1) группа K-0,25 (n = 30) — кетамин 0,25 мг/кг; 2) группа К-0,5 (n = 30) — кетамин 0,5 мг/кг; 3) группа контроля (n = 30) — 0,9 % раствор натрия хлорида |
В/в в дозе 0,25 мг/кг или 0,5 мг/кг после выполнения СА |
Выраженность дрожи по 4-балльной шкале. Температура барабанной перепонки интраоперационно с интервалом в 10 мин. Показатели гемодинамики (срАД, ЧСС, SpO2). Оценка новорожденного по шкале Апгар |
Кетамин в дозах 0,25 мг/кг и 0,5 мг/кг одинаково снижал: • выраженность дрожи (p = 0,001); • частоту тошноты (p = 0,020); • частоту гипотонии (p < 0,001); • частоту тахикардии (p = 0,020); • количество введенного эфедрина (p = 0,001) по сравнению с группой контроля |
Гипотензия. Гипертензия. Брадикардия. Тахикардия. Тошнота и рвота. Нистагм. Галлюцинации. Уровень седации по 5-балльной шкале. Амнезия |
Lema G.F., 2017, Эфиопия |
123 пациентки; СА (12,5 мг изобарического бупивакаина) |
1) группа кетамина (n = 41); 2) группа трамадола (n = 41) — трамадол 0,5 мг/кг; 3) группа контроля (n = 41) — 0,9 % раствор натрия хлорида |
Кетамин 0,2 мг/кг вводился в/в после выполнения СА |
Температура барабанной перепонки. Частота и выраженность дрожи по 4-балльной шкале. Продолжительность дрожи. Необходимость введения «спасательного» петидина. Показатели гемодинамики (ЧСС, срАД, SpO2). Оценка новорожденного по шкале Апгар |
Кетамин снижал: • частоту озноба (p = 0,028); • частоту выраженной дрожи (p = 0,011). Эффекты кетамина сопоставимы с трамадолом. Неонатальные исходы и периоперационные осложнения были сопоставимы с группой контроля |
Гипотензия. Тошнота и рвота. Седативный эффект. Галлюцинации |
Профилактика послеоперационной тошноты и рвоты |
||||||
Shabana A.M. et al., 2012, Египет |
229 пациенток; СА (0,5 % гипербарический бупивакаин 10–12 мг + 15 мкг фентанила) |
1) группа кетамина (n = 110); 2) группа контроля (n = 110) — 0,9 % раствор натрия хлорида |
0,5 мг/кг в/в инфузоматом в течение 20 мин перед выполнением СА сразу после обработки спины пациентки |
Частота гипотензивных эпизодов. Применение эфедрина (мг). Интраоперационная тошнота/рвота. Применение противорвотных средств. Показатели гемодинамики (срАД, ЧСС). Оценка новорожденного по шкале Апгар |
Кетамин снижал: • интраоперационную тошноту (p = 0,004); • частоту гипотензивных эпизодов (p = 0,018) |
Галлюцинации |
Modir H. et. al., 2019, Иран |
140 пациенток; СА (3 мл 0,5 % гипербарического бупивакаина) |
1) группа кетамина; 2) группа дексаметазона — дексаметазон в дозе 0,1 мг/кг; 3) группа дексмедетомидина — дексмедетомидин в дозе 1 мкг/кг; 4) группа контроля — в/в 20 мл физиологического раствора. Число пациенток в каждой из групп не указано |
0,5 мг/кг в/в после пережатия пуповины |
Оценка ПОТР по ВАШ. Уровень седации по шкале седации Ramsay. Гемодинамические показатели (срАД, ЧСС, SpO2). Оценка новорожденного по шкале Апгар |
Кетамин снижал: • ПОТР сразу и через 1, 2, 3, 4 ч после введения препарата (p = 0,001) по сравнению с контролем. Эффективность кетамина снижать ПОТР ниже, чем у дексмедетомидина, однако по сравнению с дексмедетомидином кетамин реже вызывает брадикардию и гипотензию (р < 0,05) |
Не указано |
Профилактика послеродовой депрессии |
||||||
Xu Y. et al., 2017, Китай |
330 пациенток; СА (0,5 % бупивакаин 15 мг + 0,1 мг морфина) |
1) группа кетамина (n = 162); 2) группа контроля (n = 163) — 0,9 % раствор натрия хлорида |
0,25 мг/кг, разбавленный до 10 мл 0,9 % раствором натрия хлорида, в/в течение 5 мин после пережатия пуповины |
Оценка боли по ЦРШ на 3-и сутки и через 6 нед. после родов. Оценка ПРД по EPDS на 3-и сутки и через 6 нед. после родоразрешения. Оценка новорожденного по шкале Апгар |
Кетамин снижал: • уровень боли по ЦРШ через 6 нед. после родов (p = 0.014); • количество пациенток, имеющих хроническую боль, — оценку более 3 баллов по ЦРШ через 6 нед. после родов (p = 0,018). Кетамин не влиял на: • риск возникновения послеродовой депрессии через 3 сут и 6 нед. после родов (p = 0,965, p = 0,900 соответственно); • уровень боли по ЦРШ на 3-й день после родов (p = 0,747) |
Рвота. Головная боль. Головокружение. Галлюцинации. Сонливость. Диплопия. Баллы по шкале Ramsay — более 3 |
Loripoor M. et al., 2018, Иран |
134 пациентки; ОА (тиопентал натрия) |
1) группа кетамина; 2) группа контроля. Число пациенток в каждой из групп не указано |
0,5 мг/кг во время индукции ОА |
Оценка по EPDS до, через 2 и 4 нед. после родоразрешения |
Кетамин снижал баллы по шкале EPDS через 2 и 4 нед. после родоразрешения |
Не указаны |
Ma J.H. et al., 2019, Китай |
654 пациентки; СА (1,5 мл 1 % ропивакаина + 0,5 мл фентанила + 0,5 мл 10 % глюкозы) |
1) группа кетамина (n = 327); 2) группа контроля (n = 327) |
0,5 мг/кг кетамина болюсно через 10 мин после извлечения плода. После операции для пациентов группы кетамина кетамин в дозе 160 мг вводили с использованием устройства для в/в обезболивания, контролируемого пациентом (PCIA) |
Оценка по EPDS. Суицидальные мысли |
Кетамин снижал: • распространенность ПРД (р = 0,020); • баллы по шкале EPDS на 4-й день после родов (р = 0,007); • распространенность бэби-блюза (р = 0,022); • уровень суицидальных мыслей (р = 0,017) |
Рвота. Головокружение. Психотических симптомов, таких как паранойя, амнезия или расстройства мышления, в группе кетамина интраоперационно не отмечалось |
Профилактика постпункционной головной боли |
||||||
Zangouei A. et al., 2019, Иран |
64 пациентки; СА (0,5 % бупивакаин 10 мг + 20 мкг фентанила) |
1) группа кетамина (n = 32); 2) группа контроля (n = 32) — 0,9 % раствор натрия хлорида |
После СА и наступления блокады до уровня Th4 в/в вводили кетамин 0,15 мг/кг |
Средняя выраженность головной боли по аналоговой шкале; тошнота, зуд сразу после и через 4, 12, 24 ч после операции; время первого запроса на обезболивание |
Кетамин значимо снижает: • выраженность ППГБ (р = 0,001); • зуда и тошноты в первые 4 ч после операции (р = 0,007). Кетамин увеличивает время до первого запроса на обезболивание (р = 0,007) |
ППГБ. Тошнота. Зуд. Артериальная гипертензия. Брадикардия |
Примечания. РКИ в таблице расположены согласно исследуемым конечным точкам.
АД — артериальное давление; ВАШ — визуальная аналоговая шкала боли; ОА — общая анестезия; ПОТР — послеоперационная тошнота и рвота; ППГБ — постпункционная головная боль; ПРД — послеродовая депрессия; СА — спинальная анестезия; срАД — среднее артериальное давление; ЦРШ — цифровая рейтинговая шкала; ЧСС — частота сердечных сокращений; EPDS — Эдинбургская шкала послеродовой депрессии; PCIA — пациент-контролируемая внутривенная анальгезия.
В целом все представленные РКИ имеют достаточно высокое качество. Выявленные риски смещения представлены в табл. 2. В РКИ M. Loripoor и соавт. отсутствуют данные о порядке сокрытия порядка распределения и ослеплении исследователя, оценивающего результаты. В РКИ J.H. Ma и соавт. не представлена информация о маскировке препарата. В РКИ M. Loripoor и соавт. и РКИ H. Modir нет данных о количественном составе групп.
Таблица 2. Оценка риска смещения
Table 2. Displacement Risk Assessment
Фамилии исследователей, год публикации |
Рандомизация |
Сокрытие порядка распределения |
Ослепление участников и персонала |
Ослепление исследователя, оценивающего исходы |
Неполные данные по исходам |
Выборочное представление результатов |
Другое смещение |
|---|---|---|---|---|---|---|---|
Hajipour A. et al., 2002 |
+ |
? |
+ |
+ |
+ |
+ |
— |
Reza F.M. et al., 2010 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Bilgen S. et al., 2012 |
+ |
? |
+ |
+ |
+ |
+ |
+ |
Haliloglu M. et al., 2015 |
+ |
? |
+ |
+ |
+ |
+ |
+ |
Вauchat J.R. et al., 2011 |
+ |
+ |
+ |
— |
+ |
+ |
+ |
Мenkiti I.D. et al., 2012 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Behdad S. et al., 2013 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Milani F. et al., 2014 |
+ |
? |
+ |
+ |
+ |
+ |
+ |
Rahmanian M. et. al., 2015 |
+ |
? |
+ |
+ |
+ |
+ |
+ |
Sen S. et al., 2015 |
+ |
? |
+ |
+ |
+ |
+ |
+ |
Kose E.A. et al.,2013 |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
Lema G.F. et al., 2017 |
+/? |
? |
+ |
— |
+ |
+ |
+ |
Shabana A.M. et al.,2012 |
+ |
? |
+ |
— |
+ |
+ |
— |
Modir H. et. al., 2019 |
+ |
? |
+ |
? |
+ |
+ |
— |
Xu Y. et al., 2017 |
+ |
+ |
+ |
+ |
— |
— |
+ |
Loripoor M. et al., 2018 |
+ |
? |
+ |
? |
+ |
+ |
— |
Ma J. H. et al., 2019 |
+ |
? |
+/— |
+ |
— |
+ |
+ |
Zangouei A. et al., 2019 |
+ |
? |
+ |
? |
+ |
+ |
+ |
«+» — низкий риск смещения; «?» — сомнительный риск смещения, данные представлены не в полном объеме; «–» — высокий риск смещения.
Все вошедшие в обзор восемнадцать исследований были выполнены на пациентках акушерского профиля I–II степени риска по классификации ASA (Американского общества анестезиологов), которым выполнялось плановое кесарево сечение. Во всех исследованиях кетамин вводили внутривенно. Дозировки варьировались от 0,15 до 0,5 мг/кг для внутривенного болюсного или инфузионного (в течение 5, 10 или 20 минут) введения. J.R. Bauchat и соавт. [28] вводили фиксированную дозу 10 мг кетамина всем пациенткам. S. Behdad и соавт. [29] вводили 30 мг кетамина всем пациенткам. В двух исследованиях кетамин вводился и болюсно, и в виде продленной инфузии [30, 31]. В двух исследованиях сравнивались клинические эффекты двух разных доз кетамина 0,25 мг/кг и 0,5 мг/кг [3, 32]. В одном исследовании пациенткам основной группы кетамин вводился перед операцией в дозе 0,15 мг/кг [9]. В РКИ S. Bilgen и соавт. [32] нами была исключена из рассмотрения группа пациенток, получавших кетамин в дозе 1 мг/кг.
В пяти из приведенных исследований [30, 32–35] операция кесарева сечения проводилась в условиях общей анестезии (ОА), в остальных [3, 4, 7–9, 28, 29, 31, 36–40] — в условиях спинальной анестезии (СА).
В двенадцати исследованиях [9, 28–30, 32–34, 36–40] в том или ином аспекте изучалось влияние низких доз кетамина на выраженность послеоперационной боли, в трех [31, 35, 40] исследованиях анализировалась связь внутривенного введения кетамина и послеродовой депрессии, две работы [3, 4] были посвящены профилактике дрожи/озноба после выполнения СА, два РКИ [7, 8] выявляли влияние низких доз кетамина на выраженность ПОТР, одно [9] — на частоту ППГБ.
Учитывая высокую гетерогенность исследований, а также недостаточное количество работ, посвященных профилактической эффективности кетамина в отношении послеродовой депрессии, ПОТР, ППГБ, дрожи и озноба, мы не смогли провести метаанализ в отношении указанных исходов.
В найденных нами восемнадцати РКИ изучалась способность кетамина снижать выраженность послеоперационной боли, предотвращать озноб и дрожь после выполнения СА, уменьшать частоту ПОТР, ППГБ, оказывать профилактическое действие в отношении послеродовой депрессии. Нами была выбрана группа пациенток акушерского профиля, так как у данной категории лиц использование кетамина представляет особый интерес.
Наибольшее количество публикаций (двенадцать) было посвящено именно анальгетическим и противогиперальгетическим возможностям кетамина. В настоящий момент накоплен большой опыт применения низких доз кетамина как одного из компонентов мультимодальной анальгезии, что отражено в Клинических рекомендациях по лечению послеоперационной боли Американского общества боли [41]. Этой теме посвящены, в том числе, и крупные систематические обзоры. K. Laskowski и соавт. в своем обзоре семидесяти исследований с участием 4701 пациента продемонстрировали, что внутривенное введение кетамина является эффективным дополнением к стандартной послеоперационной анальгезии, особенно при ортопедических операциях, а также вмешательствах на верхних отделах живота и грудной клетке [42]. В данном обзоре имелась большая гетерогенность по используемым дозам кетамина, в связи с чем получились разнородные данные о зарегистрированных побочных эффектах. M. Heesen и соавт. в 2015 г. впервые выполнили систематический обзор, посвященный изучению анальгетической эффективности кетамина после операции кесарева сечения [23]. В обзор вошли двенадцать исследований с участием 953 пациенток, авторы пришли к выводу, что кетамин способен усиливать послеоперационное обезболивание после кесарева сечения, выполненного в условиях СА. В отношении использования ОА таких данных получено не было. Авторы сообщают об отсутствии различий в частоте возникновения побочных эффектов, таких как тошнота, рвота, зуд, психомиметические эффекты между группами кетамина и контроля. Тем не менее в обзоре M. Heesen и соавт. наблюдается гетерогенность в отношении доз кетамина, в частности, в трех РКИ [32, 43, 44] фигурируют дозы кетамина 1 мг/кг, что выходит за пределы субанестетического диапазона, а в одном из РКИ используется изомер кетамина S-кетамин [45]. В свете вышеизложенного мы посчитали необходимым проведение собственного систематического обзора с более жесткими критериями включения и изучением всего спектра благоприятных эффектов кетамина.
В обзор мы включили двенадцать РКИ, в которых изучалось влияние низких доз кетамина на послеоперационное обезболивание [9, 28–30, 32–34, 36–40]. В двух исследованиях [9, 40] влияние на послеоперационное обезболивание было изучено в качестве вторичного исхода. В четырех исследованиях [30, 32–34] пациенткам выполнялось кесарево сечение в условиях ОА, в остальных — в условиях СА. Самое раннее из четырех РКИ было выполнено в 2002 г. A. Hajipour и соавт. [33]. Исследователи вводили 0,2 мг/кг кетамина до индукции ОА и выявили значимое снижение уровня боли по визуальной аналоговой шкале боли (ВАШ), суммарного потребления морфина в первые 24 часа после операции, а также увеличение времени до первого запроса анальгетика в послеоперационном периоде в группе кетамина. В 2010 г. F.M. Reza и соавт. применяли кетамин в дозе 0,5 мг/кг за 5 минут до индукции ОА и не обнаружили влияния на потребление морфина в течение 24 часов после операции [34]. В 2012 г. S. Bilgen и соавт. использовали три различные дозы кетамина 0,25 мг/кг, 0,5 мг/кг и 1,0 мг/кг [32]. Авторами не было обнаружено достоверных различий боли в баллах цифровой рейтинговой шкалы боли (ЦРШ) и суммарном потреблении морфина в течение первых 48 часов после операции, а также различий в отношении формирования хронической боли, регистрируемой на протяжении года после родоразрешения. В наиболее позднем исследовании, в 2015 г., M. Haliloglu и соавт. вводили внутривенно кетамин не только болюсно в дозе 0,5 мг/кг, но и в виде продленной инфузии со скоростью 0,25 мг/кг/час и доказали, что эта методика достоверно сокращает потребность в опиоидах в первые 24 часа после операции [30]. Таким образом, мы получили противоречивые данные в отношении влияния малых доз кетамина на обезболивание в послеоперационном периоде после операции кесарева сечения, выполненной в условиях ОА. Вероятнее всего, целесообразно использование как болюсного, так и продленного инфузионного способа введения кетамина.
В восьми РКИ анальгетическая эффективность кетамина изучалась в послеоперационном периоде кесарева сечения, выполненного в условиях СА. J.R. Bauchat и соавт. использовали одну из самых низких доз кетамина среди всех включенных в обзор исследований — 10 мг [28]. Исследователи пришли к выводу, что кетамин может быть эффективен в профилактике хронического болевого синдрома, так как показатели боли были достоверно ниже в группе кетамина по сравнению с контрольной через 2 нед. после родов, в то же время значимых различий в выраженности болевого синдрома, оцениваемого по ЦРШ, суммарной дозе анальгетиков за первые сутки после операции и времени до первого запроса анальгетика между группами кетамина и контроля не было. I.D. Menkiti и соавт. в 2012 г. использовали кетамин внутривенно в дозе 0,15 мг/кг и обнаружили значимые различия во времени до первого запроса анальгетика, уровне боли по шкале ВАШ, количестве анальгетиков в первые сутки после операции между группами кетамина и контроля [36]. Схожие результаты получили A. Zangouei и соавт., используя кетамин в дозе 0,15 мг/кг в качестве премедикации при СА [9]. В данном РКИ оценка боли была вторичным исходом. Полученные данные показали, что низкие дозы кетамина достоверно уменьшали потребность в анальгетиках (р = 0,001). S. Behdad и соавт. в 2013 г., используя кетамин в дозе 30 мг, выявили значимое снижение уровня боли по шкале ВАШ в первые 24 ч после операции и уменьшение суммарной дозы меперидина за первые послеоперационные сутки [29]. F. Milani и соавт. в РКИ 2014 г. при использовании кетамина в дозе 0,2 мг/кг обнаружили значимый опиоид-снижающий эффект при отсутствии влияния на уровень боли по шкале ВАШ, суммарную дозу ненаркотических анальгетиков, время до первого запроса на обезболивание в послеоперационном периоде [37]. M. Rahmanian и соавт. в 2015 г. вводили кетамин в дозе 0,25 мг/кг внутривенно болюсно и доказали эффективность кетамина в отношении уменьшения уровня боли в течение первых 12 ч после операции и суммарного потребления обезболивающих препаратов за первые сутки, а также увеличения времени до первого запроса анальгетика [38]. В 2015 г. S. Sen и соавт. сравнивали эффективность интратекального введения 10 мг фентанила, внутривенного введения 0,15 мг/кг кетамина с контрольной группой, в которой пациенткам интратекально и внутривенно вводились эквивалентные количества 0,9 % натрия хлорида [39]. Исследователи обнаружили, что время первого запроса на обезболивание было наиболее длительным в группе кетамина (197 мин), по сравнению с группами фентанила (165 мин) и контроля (144 мин). Также в группе кетамина были значительно ниже послеоперационная боль и потребность в анальгетиках в первые 24 ч после операции, в то же время уже на вторые сутки различий между группами не наблюдалось. Y. Xu и соавт. пришли к выводу, что интраоперационное введение 0,25 мг/кг кетамина значительно снижает выраженность боли через 6 нед. после родов, не влияя при этом на ее показатели в раннем послеоперационном периоде (на 3-и сутки после родов) [40]. В данном РКИ оценка боли была вторичным исходом.
Таким образом, данные, полученные в отношении анальгетической активности низких доз кетамина после кесарева сечения, выполненного в условиях СА, также неоднозначны. Несмотря на то что во всех исследованиях была продемонстрирована эффективность кетамина, часть данных свидетельствует о его преимущественном влиянии на боль в раннем послеоперационном периоде, другая же часть, напротив, демонстрирует возможности кетамина именно в профилактике хронизации боли.
Два РКИ [3, 4], вошедшие в наш обзор, посвящены оценке эффективности кетамина в предотвращении и уменьшении озноба и дрожи, возникающих во время оперативных вмешательств, выполняемых в условиях CA. Мышечная дрожь не является жизнеугрожающим осложнением, однако она вызывает субъективное ощущение дискомфорта и тревоги у пациенток, снижает удовлетворенность анестезией. Дрожь опасна тем, что увеличивает потребление кислорода, продукцию углекислого газа, способствует возникновению лактат-ацидоза, что может быть критично для лиц с кардиореспираторными заболеваниями. Дрожь также затрудняет проведение мониторинга жизненно важных функций в послеоперационном периоде [4, 46]. В РКИ, выполненном в 2013 г. E.A. Kose и соавт., изучалось влияние 2 доз кетамина (0,25 мг/кг и 0,5 мг/кг) на степень выраженности дрожи по 4-балльной шкале Tsai and Chu, а также температуру барабанной перепонки у пациенток, которым выполнялось кесарево сечение в условиях СА [3]. Были получены убедительные данные, подтверждающие эффективность обеих доз кетамина в отношении предотвращения дрожи. В РКИ 2017 г. G.F. Lema и соавт. сравнивали внутривенное введение низких доз кетамина (0,2 мг/кг) и трамадола (0,5 мг/кг) для профилактики дрожи, возникающей при CA [4]. Авторы пришли к выводу, что и кетамин, и трамадол эффективны для профилактики дрожи.
Еще два РКИ [7, 8] были посвящены оценке эффективности низких доз кетамина в отношении ПОТР. В РКИ 2012 г. A.M. Shabana и соавт. убедительно показано, что 20-минутная инфузия кетамина в дозе 0,5 мг/кг достоверно снижает частоту и тяжесть возникновения ПОТР [7]. В исследовании H. Modir и соавт., выполненном в 2019 г., проводился сравнительный анализ эффективности дексмедетомидина, дексаметазона и кетамина в дозе 0,5 мг/кг [8]. Кетамин продемонстрировал положительное влияние в отношении уменьшения выраженности явлений ПОТР по сравнению с плацебо, однако уступил по эффективности дексмедетомидину и дексаметазону.
Интересной представляется возможность использования кетамина для профилактики послеоперационных депрессивных реакций. Японскими исследователями в 2002 г. было показано, что низкие дозы кетамина (<1,0 мг/кг) способны снижать выраженность послеоперационной депрессии у пациентов ортопедического профиля [15].
Три РКИ, включенных в обзор, посвящены изучению эффективности малых доз кетамина в предупреждении развития послеродовой депрессии (ПРД) [31, 35, 40]. Y. Xu и соавт., изучая уровень послеродовой депрессии в течение 6 нед., не выявили влияния интраоперационного введения 0,25 мг/кг кетамина на послеродовую депрессию в течение 6 нед. после родов [40]. M. Loripoor и соавт. вводили 0,5 мг/кг кетамина во время индукции ОА при кесаревом сечении и обнаружили, что это эффективно в отношении предотвращения послеродовой депрессии [35]. В этой работе заявлено, что исследование является двойным слепым рандомизированным контролируемым, однако нет точных сведений о способе ослепления, механизме рандомизации, маскировке препаратов, а также количественном составе групп. Исследование J.H. Ma и соавт. продемонстрировало эффективность интраоперационного болюсного введения и послеоперационной продленной инфузии кетамина в дозе 0,5 мг/кг при кесаревом сечении в снижении частоты послеродовой депрессии и бэби-блюза [31]. В РКИ приняли участие 654 женщины, которым предстояло выполнение кесарева сечения в условиях СА. Распространенность послеродовой депрессии в группе кетамина составила 12,8 %, что было значительно ниже, чем в контрольной группе (р = 0,020). Оценка EPDS на 4-й день после родов была значительно ниже в группе кетамина по сравнению с группой контроля (р = 0,007). Распространенность бэби-блюза была значительно ниже в группе кетамина (11,9 %), чем в контрольной группе (18,3 %, р = 0,022). Важно отметить, что помимо болюсного интраоперационного введения в основной группе кетамин в дозе 160 мг вводился еще и в виде продленной инфузии в послеоперационном периоде с помощью устройства для пациент-контролируемой внутривенной анальгезии (PCIA). Очевидно, что необходимы дополнительные исследования, посвященные профилактической активности малых доз кетамина в отношении послеродовой депрессии.
В проанализированных нами работах были зафиксированы следующие побочные эффекты: тошнота, рвота, гипотензия, озноб/дрожь, галлюцинации, головокружение, головная боль, ППГБ, сонливость, зуд, дезориентированность, выраженная седация (более 3 баллов по шкале Ramsay). Большая часть исследователей указывают на отсутствие статистически значимых различий между исследуемыми группами по частоте зафиксированных побочных эффектов [4, 7, 29, 30, 32–34, 36–39].
E.A. Kose и соавт. отметили, что такие побочные эффекты кетамина, как нистагм и галлюцинации, чаще наблюдались при дозе 0,5 мг/кг, чем при 0,25 мг/кг (p < 0,001; р = 0,010 соответственно). Амнезия после введения кетамина в дозе 0,5 мг/кг отмечалась у 30 % пациентов и отсутствовала при меньшей дозировке (р = 0,001). J. Вauchat и соавт. отметили статистически значимое увеличение жалоб на психомиметические эффекты (дезориентированность, головокружение, диплопия) в группе кетамина (10 мг) по сравнению с группой контроля (p < 0,001). Наибольшее количество побочных эффектов было зарегистрировано в исследовании Y. Xu и соавт.: статистически значимыми были различия между группами кетамина (0,25 мг/кг) и контроля по частоте галлюцинаций, головокружения, сонливости, диплопии, уровня седации более 3 баллов по Ramsay (p < 0,001) [40]. В работах M. Loripoor и соавт. и H. Modir и соавт. данные о частоте побочных эффектов не указаны [8, 35].
Во всех РКИ, кроме работ M. Loripoor и соавт. и A. Zangouei и соавт., анализировалось влияние малых доз кетамина на неонатальные исходы, и во всех исследованиях показатели новорожденных по Апгар на 1-й и 5-й минутах были сопоставимы в группах кетамина и контроля.
Результаты настоящего систематического обзора показали, что введение низких доз кетамина (в диапазоне 0,15–0,5 мг/кг) в периоперационном периоде кесарева сечения, выполняемого в условиях СА, способно снижать интенсивность боли и потребность в анальгетиках в послеоперационном периоде. Использование низких доз кетамина при этих условиях также может быть полезным для уменьшения выраженности озноба, зуда, профилактики возникновения ПОТР, постпункционной головной боли и послеродовой депрессии. Дозы менее 0,5 мг/кг представляются более безопасными и сопоставимо эффективными в профилактике вышеописанных осложнений. Однако малое количество и высокая гетерогенность исследований не позволяют сделать однозначные выводы. Эффективность низких доз кетамина в профилактике указанных осложнений при проведении операции в условиях ОА также остается неясной. Необходимы дальнейшие исследования и проведение метаанализа данных для получения окончательных выводов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Шиндяпина Н.В., Маршалов Д.В., Шифман Е.М., Кулигин А.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
ORCID авторов
Шиндяпина Н.В. — 0000-0002-7124-3697
Маршалов Д.В. — 0000-0002-8774-0700
Шифман Е.М. — 0000-0002-6113-8498
Кулигин А.В. — 0000-0001-5705-215X