За последние три десятилетия отмечается улучшение показателей выживаемости недоношенных новорожденных с экстремально низкой массой тела (ЭНМТ) и очень низкой массой тела (ОНМТ) при рождении [1], однако выраженность неврологического дефицита у детей не дает оснований для оптимизма [2, 3]. Анализируя причины развития неблагоприятных неврологических последствий проведения интенсивной терапии у недоношенных новорожденных, большинство авторов определяют продленную искусственную вентиляцию легких (ИВЛ) как один из основных факторов развития церебральных нарушений. В ретроспективном исследовании американских неонатологов было изучено влияние длительной респираторной поддержки на частоту возникновения неврологического дефицита и летального исхода у недоношенных новорожденных. В исследование вошли случаи ИВЛ у 3651 недоношенного ребенка с гестационным возрастом менее 27 недель и весом при рождении 401–1000 г. Авторы оценивали тип респираторной поддержки (неинвазивная ИВЛ, инвазивная ИВЛ, комбинация неинвазивной и инвазивной ИВЛ), ее продолжительность, а также исход заболевания. Из 3651 новорожденного умерли или имели стойкие церебральные нарушения 1494 (40,9 %), при этом частота летального исхода в группе пациентов, получавших инвазивную респираторную поддержку более 60 суток, составила 89,1 % [4].
В неонатальной практике наиболее часто используемыми режимами ИВЛ являются режимы с контролем по давлению [5]. К ним относятся: синхронизированная перемежающаяся принудительная вентиляция (Synchronized Intermittent Mandatory Ventilation — SIMV), триггерная вспомогательная вентиляция (AssistControl) и вентиляция с поддержкой давлением (Pressure Support Ventilation — PSV). Особенностью данных режимов является постоянный уровень пикового давления, который подается ребенку вне зависимости от его потребностей. Негативные проявления этих режимов — избыточный дыхательный объем, повреждение альвеол и нередко — развитие серьезных осложнений, таких как пневмоторакс, внутрижелудочковые кровоизлияния, перивентрикулярная лейкомаляция, гипокапния, бронхолегочная дисплазия [6, 7]. Снизить риски осложнений ИВЛ позволила модификация общепринятых в настоящее время режимов, в частности, использование функции гарантированного объема, который предотвращает возникновение баротравмы, контролируя дыхательный объем.
Unal S. и соавт. доказали, что инициация функции гарантированного объема в режим PSV + volume guaranteed (VG) в более короткие сроки стабилизирует дыхание пациента, снижает частоту возникновения хронических заболеваний легких, в меньшей степени влияет на системную гемодинамику в сравнении с режимом SIMV+VG [8].
Необходимость поиска оптимального режима ИВЛ у детей с ЭНМТ при рождении способствовала внедрению в неонатальную практику нервно-регулируемой вентиляции (Neurally Adjusted Ventilatory Assist — NAVA) [9, 10], в которой используется принципиально новый способ триггирования вдоха, основанный на анализе электромиограммы диафрагмы. При обнаружении электрической активности диафрагмы (Electrical Activity of the diaphragm — Edi) с помощью датчика-электрода, встроенного в модифицированный желудочный зонд, аппаратом ИВЛ производится вдох [11]. Уровень давления поддержки (support pressure) определяется пропорционально величине электрического импульса, генерируемого дыхательным центром. Таким образом, NAVA обладает самым быстрым и чувствительным триггером, который начинает поддержку вдоха одновременно с началом сокращения дыхательных мышц пациента. При этом сигнал дыхательного центра распознается аппаратом ИВЛ даже в случае минимального сокращения дыхательной мускулатуры [12, 13].
Тяжелая анте- и интранатальная гипоксия — основное показание для проведения ИВЛ у недоношенных новорожденных [14]. Важным патогенетическим механизмом развития гипоксических состояний служит активация процессов перекисного окисления липидов (ПОЛ), которая ведет к нарушению структуры мембран и липидного обмена, токсическому действию на ткани [15–17]. В результате окисления жирных кислот образуются гидроперекиси, которые затем метаболизируются во вторичные (малоновый диальдегид) и третичные (шиффовы основания) продукты ПОЛ [18]. Субстратам ПОЛ придают огромное значение в нарушении структурной и функциональной целостности клеточных мембран и повышении сосудистой проницаемости [19].
Предупредить развитие гипоксии и обеспечить недоношенного ребенка адекватной респираторной поддержкой — важные задачи интенсивной терапии в неонатологии.
Цель исследования — сравнить в динамике показатели газового состава крови, малонового диальдегида и глутатиона у недоношенных новорожденных, которым проводилась ИВЛ в режиме SIMVи NAVA.
В период с февраля по октябрь 2019 г. было выполнено проспективное исследование эффективности применения NAVA-вентиляции у недоношенных новорожденных с ЭНМТ и ОНМТ при рождении, находившихся в отделении реанимации и интенсивной терапии Иркутского областного перинатального центра. Гестационный возраст детей составил 25–32 недели, вес при рождении 520–1100 г. В связи с клиническими проявлениями тяжелой дыхательной недостаточности (шесть и более баллов по шкале Сильвермана), а также вследствие неэффективности неинвазивной респираторной поддержки всем детям были произведены интубация трахеи и перевод на аппаратную искусственную вентиляцию легких непосредственно в родильном зале (других причин тяжелой дыхательной недостаточности не было).
Реализация респираторного дистресс-синдрома была основной причиной развития тяжелой дыхательной недостаточности у недоношенных детей. Внелегочные причины тяжелого состояния пациентов были исключены из исследования.
После стабилизации состояния пациенты переводились в отделение реанимации и интенсивной терапии, где продолжали получать респираторную поддержку, инфузионную терапию, энтеральное питание. При использовании программы генератора случайных чисел все пациенты были распределены на две группы в зависимости от режима ИВЛ. Первую группу (23 ребенка) составили недоношенные новорожденные, которым проводилась ИВЛ в режиме SIMV. Вторую группу (23 ребенка) составили новорожденные, которым проводилась NAVA-вентиляция аппаратом MAQUET Servo-n c применением Edi-катетеров 6 Fr/49 см. Респираторная поддержка применялась у детей с момента поступления в отделение реанимации из родильного зала. Для оценки показателей газового состава проводился забор венозной крови из пуповины при рождении, а также из периферической вены в течение первых трех суток. Был выполнен анализ значений рН, парциального давления углекислого газа (рСО2), парциального давления кислорода (рО2), дефицита оснований (ВЕ) и лактата в течение первых трех суток. Интенсивность процессов ПОЛ определяли по концентрации малонового диальдегида и глутатиона на 1-е и 7-е сутки.
Статистическая обработка данных проводилась с использованием программы STATISTICA 10.0. Количественные данные представлены в виде медианы и квартилей (25–75 % границы интерквартильного отрезка). Анализ статистической значимости различий количественных признаков для двух независимых групп проводился с помощью критерия Манна—Уитни, для сравнения значимости различий нескольких признаков в динамике использовался критерий Краскела—Уоллиса. За уровень статистической значимости принято значение р < 0,05.
Тактика проведения респираторной поддержки заключалась в использовании максимально щадящих параметров для поддержания адекватной оксигенации и дыхательного комфорта пациента. Стартовые параметры ИВЛ у пациентов обеих групп: давление на вдохе — 20–22 см вод. ст., положительное давление в конце выдоха — 5 см вод. ст., частота дыхания — 40–60 вдохов в минуту, процентное содержание кислорода во вдыхаемой смеси — 21–40 %. В дальнейшем для достижения целевого уровня сатурации (≥ 92 %) у детей первой группы давление на вдохе выставляли в пределах 16 (15–17) см вод. ст., при этом попытки уменьшить инспираторное давление приводили к снижению сатурации. У пациентов второй группы режим NAVA позволил нам контролировать инспираторное давление, которое изменяло свое значение при каждом вдохе пациента. Благодаря высокой чувствительности триггера даже минимальная попытка вдоха ребенка поддерживалась вентилятором пропорционально его потребностям. Таким образом, инспираторное давление в этой группе полностью зависело от пациента и составило 9 (8–10) см вод. ст. (р = 0,01). Процентное содержание кислорода во вдыхаемой смеси не превышало 40 %, без значимых различий в обеих группах.
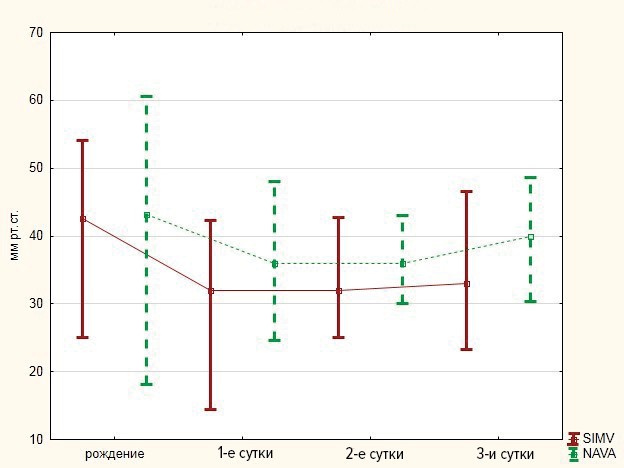
Показатели рН при рождении и в динамике у детей обеих групп соответствовали норме и статистически значимых различий не имели. Показатели рСО2 на начальном этапе исследования значимо не отличались и соответствовали нормальным значениям. В первые сутки у детей первой группы отмечалась гипокапния 32,0 (24,9–37,8) мм рт. ст., в то время как у детей второй группы показатели рСО2 были близкими к референтным и составили 36,0 (32,5–42,2) мм рт. ст. (р = 0,01). Аналогичные результаты были получены на вторые и третьи сутки. Уровень рСО2 у новорожденных первой группы на вторые сутки составил 32,0 (26,7–38,1) мм рт. ст., у детей второй группы — 35,9 (34,2–40,3) мм рт. ст. (p = 0,01). На третьи сутки значения рСО2 у детей, получавших ИВЛ в режиме SIMV, составили 33,1 (29,0–39,8) мм рт. ст., у детей, вентилируемых в режиме NAVA, — 39,9 (33,7–43,4) мм рт. ст. (p = 0,02). Динамика показателей рСО2 представлена на рис. 1.

Рис. 1. Динамика показателей рСО2
Fig.1. Changes of рСО2 values
Значения рО2 венозной крови при рождении у детей первой группы составили 22,4 (14,8–39,4) мм рт. ст., у детей второй группы — 19,7 (17,8–25,0) мм рт. ст., что соответствует норме, так как плод внутриутробно находится в состоянии физиологической гипоксии. В динамике достоверных различий показателей рО2 между группами отмечено не было.
Показатели ВЕ при рождении у детей обеих групп соответствовали норме, однако в динамике у детей первой группы дефицит оснований был более выраженным и достигал максимума на 3-и сутки. В первые сутки у детей первой группы значения ВЕ составили −5 (−7,1 … −2,8) ммоль/л, во второй группе −3,0 (−4,0 … −2,0) ммоль/л (р = 0,01). На вторые сутки уровень ВЕ у детей первой группы соответствовал −5,7 (−6,8 … −4,4) ммоль/л, у детей второй группы −4,0 (−5,2 … −2,7) ммоль/л (р = 0,01). На третьи сутки −6,4 (−7,4 … −5,2) ммоль/л у детей первой группы и −4,7 (−6,0 … −3,1) ммоль/л у детей второй группы (р = 0,02) (рис. 2).
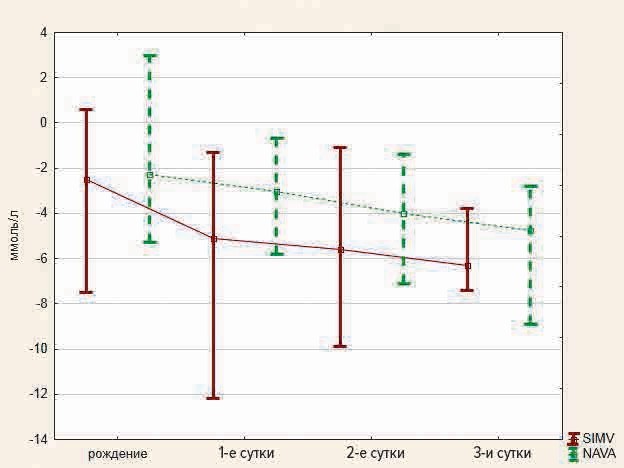
Рис. 2. Показатели ВЕ по суткам
Fig. 2. Changes of BE by days
Уровень лактата при рождении у детей обеих групп соответствовал норме и составил 2,1 (1,5–2,6) ммоль/л у детей первой группы и 2,6 (1,7–3,7) ммоль/л у детей второй группы. В динамике отмечалось повышение его концентрации у детей, получавших ИВЛ в режиме SIMV, пик концентрации лактата приходился на первые сутки и составил 2,8 (2,5–4,0) ммоль/л в сравнении с 2,5 (2,0–2,7) ммоль/л у детей с NAVA-вентиляцией (р = 0,02). На вторые сутки значения лактата у детей, получавших респираторную поддержку в режиме SIMV, соответствовали 2,5 (1,9–3,5) ммоль/л, у детей второй группы — 2,2 (2,1–2,5) ммоль/л (р = 0,26). На третьи сутки уровень лактата составил 2,6 (2,2–2,8) ммоль/л и 2,1 (1,7–2,5) ммоль/л у детей первой и второй групп соответственно (р = 0,11). Учитывая отсутствие достоверных различий в значениях лактата у детей обеих групп, можно предположить, что гиперлактатемия, возникшая при рождении и сохраняющаяся на протяжении трех суток, не связана с ИВЛ. Ее причинами могут быть: хроническая внутриутробная гипоксия плода, функционирующий артериальный проток и др.
Малоновый диальдегид был повышен у пациентов обеих групп как на первые, так и седьмые сутки, его концентрация на первые сутки у пациентов первой группы составила 13,4 (12,7–14,0) нмоль/л, у детей второй группы — 13,2 (10,7–13,6) нмоль/л (р = 0,32). В дальнейшем наблюдалось снижение уровня диальдегида, и на 7-е сутки его уровень у детей первой группы составил 12,0 (10,3–13,0) нмоль/л, у детей второй группы — 6,3 (5,4–7,4) нмоль/л (р = 0,01) (рис. 3).
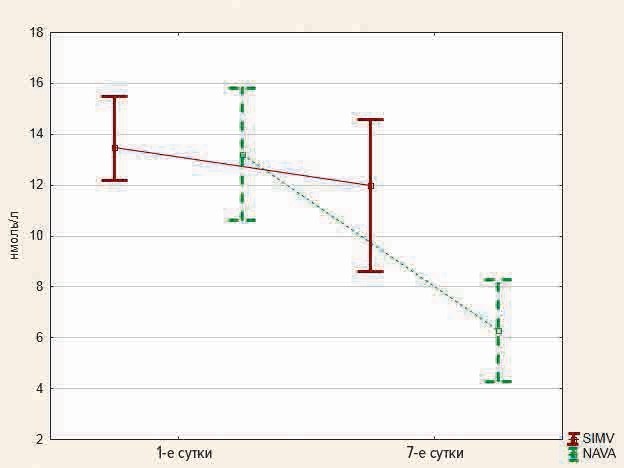
Рис. 3. Уровень малонового диальдегида на 1-е и 7-е сутки
Fig. 3. The level of malondialdehyde on days 1 and 7
Статистически значимых различий в значениях глутатиона в обеих группах не наблюдалось.
Длительность проведения респираторной поддержки у пациентов первой группы составила 6 (2–10) суток, у пациентов второй группы — 4 (3–6) суток (р = 0,5). Продолжительность лечения в отделении реанимации и интенсивной терапии у детей первой группы составила 13 (5–35) суток, у детей второй группы — 8,5 (6–15) суток (р = 0,23). После стабилизации состояния все пациенты были переведены в отделение патологии новорожденных для дальнейшего выхаживания. Летальных исходов отмечено не было.
Гипокапния, наблюдавшаяся у пациентов с респираторной поддержкой в режиме SIMV, является следствием несоответствия заданных параметров ИВЛ потребностям пациентов. Чувствительность триггера в данном режиме недостаточно совершенна для недоношенных новорожденных, в связи с чем их дыхательные попытки не регистрируются и аппарат ИВЛ подает вдохи по умолчанию. Это приводит к избыточному дыхательному объему и гипервентиляции. Динамика показателей дефицита оснований отражает компенсацию гипервентиляции, об этом говорит нормальный уровень рН у детей обеих групп. На уровень рО2 и лактата существенного влияния респираторная поддержка не оказывала. В качестве маркера оксидативного стресса был исследован малоновый диальдегид на первые и седьмые сутки. В нашем исследовании максимальная концентрации малонового диальдегида наблюдалась у пациентов первой группы в первые сутки и совпала с минимальными значениями рСО2.
Нейро-конролируемая ИВЛ у недоношенных новорожденных позволяет избежать нежелательной гипокапнии, отмеченной при ИВЛ в режиме SIMV. Кроме того, к позитивным моментам NAVA-вентиляции можно отнести положительную динамику снижения концентрации малонового диальдегида, которая тем самым предупреждает чрезмерную активацию ПОЛ, возникшую в результате гипоксии. Синхронизация аппаратного вдоха с собственными дыхательными попытками ребенка при NAVA-режиме способствует устранению как избыточной, так и недостаточной респираторной поддержки пациента, позволяет сократить сроки пребывания пациента в отделении реанимации и успешно пройти период ранней неонатальной реабилитации.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Анурьев А.М. — дизайн исследования, разработка концепции статьи, получение и анализ фактических данных, написание текста статьи, выполнение практической части исследования, проверка и утверждение текста статьи; Горбачев В.И., Анурьева Т.М., Петрова И.Л. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
ORCID авторов
Анурьев А.М. – 0000-0002-6724-5067
Горбачев В.И. — 0000-0001-6278-9332
Анурьева Т.М. — 0000-0001-5593-6007
Петрова И.Л. — 0000-0001-8616-0416