Венозные тромбоэмболические осложнения (ВТЭО) являются серьезной проблемой не только в онкологии, но и в здравоохранении в целом, существенно влияя на результаты противоопухолевого лечения, качество жизни больных и повышая летальность. За последнее время отмечен рост частоты тромбоэмболии легочной артерии при стабильном уровне распространенности тромбоза глубоких вен [1]. В России смертность от новообразований за 2018 г. составила 203,0 на 100 000 человек [2]. По данным разных авторов, распространенность тромбозов в онкологической практике достигает 20 % среди всех пациентов [3, 4]. Риск развития ВТЭО при раке возрастает в 7 раз — это вторая по значимости причина смерти онкологических больных [5, 6].
В клинической практике наиболее распространенными препаратами для проведения профилактики венозных тромбозов являются низкомолекулярные гепарины (НМГ), антагонисты витамина К, прямые ингибиторы Xа-фактора свертывания, прямые ингибиторы тромбина. Лабораторный контроль эффективности терапии нефракционированным гепарином оценивается по показателю активированного частичного тромбопластинового времени (АЧТВ), антагонистами витамина К — по уровню международного нормализованного отношения (МНО). Профилактические дозы НМГ, как правило, не оказывают влияния на стандартные показатели коагулограммы. Оценка их эффективности проводится на основании показателей анти-Ха активности [7].
Стандартные лабораторные тесты не способны дать исчерпывающую информацию о состоянии системы гемостаза, особенно в послеоперационном периоде [8]. Распространенным лабораторным показателем, отражающим повышенный риск развития ВТЭО, является D-димеры [9]. Они появляются в крови после разрушения тромба в результате фибринолиза. Этот показатель у онкологических больных зависит от возраста, локализации и стадии опухолевого процесса [10]. По результатам исследований у неонкологических больных, сообщалось об отсутствии специфичности теста для диагностики ВТЭО, а также о значительной вариативности показателей в зависимости от метода исследования [11, 12].
Анти-Xa активность — это лабораторный показатель, отражающий противосвертывающую активность НМГ. Данные исследований, проведенных у пациентов, получающих профилактические дозировки НМГ, лабораторный контроль которых осуществлялся с помощью данного метода, оказались противоречивы [13–15].
В такой ситуации особый интерес приобретают глобальные тесты гемостаза.
Тромбоэластография (ТЭГ) — метод графической регистрации процессов свертывания крови и фибринолиза. Метод известен с 1948 г. и является первым интеграционным методом исследования системы гемостаза. ТЭГ зарекомендовала себя как простой и быстрый в исполнении метод, который, что немаловажно, выполняется из образца цельной крови. Как показали исследования, параметр «максимальная амплитуда» (МА) является наиболее чувствительным для диагностики гиперкоагуляционного состояния у онкологических больных, в т. ч. и у пациентов со злокачественным новообразованием предстательной железы. Однако тест оказался непригодным для прогнозирования развития ВТЭО [8].
Схожие результаты были получены при исследовании гемостаза у больных раком легкого при применении тромбоэластометрии, позволяющей качественно и количественно оценить вязкость, прочность и эластичность сгустка цельной крови, скорость его образования и последующего лизиса — Rotation thromboelastometry (ROTEM). У этой категории пациентов было снижено время свертывания крови (coagulation time — CT), увеличена максимальная плотность сгустка (Maximum Clot Firmness — MCF) по сравнению с пациентами без онкологического заболевания. Различий между пациентами с эпизодами ВТЭО или без таковых по данным ROTEM обнаружено не было [8, 16].
В начале 2000 гг. был разработан новый интегральный метод оценки гемостаза, учитывающий пространственную организацию процесса роста фибринового сгустка — тест тромбодинамики. Клинические исследования демонстрируют, что тест тромбодинамики более чувствителен к терапии НМГ, чем АЧТВ, тест генерации тромбина и ТЭГ. При этом чувствительность метода тромбодинамики сопоставима с чувствительностью теста на анти-Ха активность [17].
Целью исследования является анализ взаимосвязи параметров теста тромбодинамики и показателей коагулограммы у пациентов, перенесших радикальную простатэктомию как способ лечения рака предстательной железы, а также выявление связей между параметрами теста тромбодинамики и развитием тромбоэмболических осложнений у данного контингента больных.
В исследование были включены 59 пациентов с диагнозом рака предстательной железы, которым предстояло оперативное лечение в объеме радикальной простатэктомии с лимфаденэктомией или без нее.
Критериями исключения служили: тромбоз вен в предоперационном периоде, прием антиагретантов (кроме аспирина, т. к. его принимали пациенты с сердечно-сосудистыми заболеваниями и высоким риском осложнений и не требовалось применения мост-терапии), прием антикоагулянтов, исходная патология системы гемостаза, почечная недостаточность (клиренс креатинина < 50 мл/мин), печеночная недостаточность (≥ 5 баллов по шкале Чайлда—Пью).
Все больные — мужчины, средний возраст которых составил 63,3 ± 5,2 г. (54–75), индекс массы тела — 27,8 ± 3,9 (20,2–37,6), физический статус по системе American Society of Anesthesiologists — II–III. У всех больных установлена стадия онкологического процесса, определен уровень простатспецифического антигена, гистология опухоли, объем предстательной железы перед проведением оперативного вмешательства.
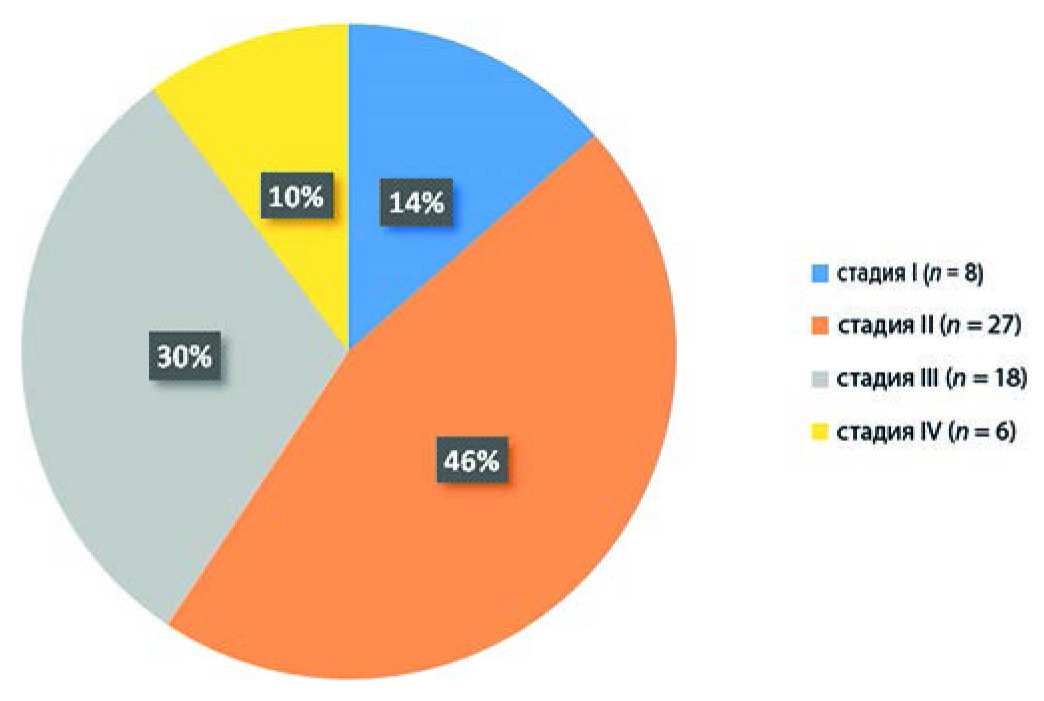
Стадия заболевания предстательной железы всех включенных в исследование пациентов представлена на рис. 1.

Рис. 1. Распределение пациентов в зависимости от стадии онкологического заболевания
Fig. 1. Distribution of patients by stage of disease
У 58 больных по данным гистологического исследования выявлена ацинарная аденокарцинома, у 1 больного — мелкоклеточный рак. Объем предстательной железы составил 47,6 ± 23 см3 (12–116). У 27 % (n = 16) пациентов перед оперативным вмешательством проведена гормональная терапия. У 3,4 % (n = 2) — в анамнезе эпизоды диагностированной венозной тромбоэмболии. У 28,8 % пациентов (n = 17) выявлена варикозная болезнь вен нижних конечностей. Тромбоэмболия легочной артерии в анамнезе была у 1 пациента. 5 % (n = 3) пациентов ранее перенесли острое нарушение мозгового кровообращения, 10 % (n = 6) — острый инфаркт миокарда, 6,8 % (n = 4) страдали пароксизмальной формой мерцательной аритмии и не получали постоянной антикоагулянтной терапии до госпитализации. Сахарный диабет 2-го типа был диагностирован у 8,5 % (n = 5). Среди всех больных 37,3 % (n = 22) принимали аспирин, 15,3 % (n = 9) — статины. Все пациенты входили в высокую группу риска по развитию ВТЭО после оценки по шкале Caprini, медиана значения составила 9 баллов.
Лабораторные данные, учитываемые в исследовании: общий анализ крови (уровень гемоглобина, гематокрита, количество эритроцитов, лейкоцитов, тромбоцитов), биохимический анализ крови (уровни креатинина, мочевины, общего белка, трансаминаз, общего билирубина, глюкозы сыворотки), коагулограмма, включающая такие параметры, как АЧТВ, протромбиновое время, протромбиновый индекс, тромбиновое время, МНО, фибриноген, активность антитромбина III, уровень D-димеров. Также всем пациентам в момент поступления в стационар проводился анализ тромбодинамики. В основе данного метода лежит имитация повреждения сосудистой стенки и роста фибринового сгустка, который регистрируется фотокамерой с помощью метода темного поля. Активация свертывания запускается от поверхности с иммобилизованным рекомбинантным тканевым фактором свертывания, которая воспроизводит место повреждения стенки кровеносного сосуда. Далее сгусток распространяется в плазме уже без контакта с активирующей поверхностью. Для проведения исследования используют нативный образец плазмы без тромбоцитов. После забора цельной крови в коагулологическую пробирку с цитратом натрия образец подвергают двукратному центрифугированию и производят забор надосадка. Первое центрифугирование проводят в течение 15 мин на 1600 g, второе — 5 мин на 10 000 g.
Основные параметры теста следующие: время задержки роста сгустка (Tlag), скорость роста сгустка (V), начальная скорость роста сгустка (Vi), стационарная скорость роста сгустка (Vst) и размер сгустка через 30 мин (CS), плотность сгустка (D — интенсивность светорассеяния), время появления спонтанных сгустков (Tsp — время до заполнения спонтанными сгустками 5 % площади кюветы вдали от фронта основного сгустка). Показатели скорости роста сгустка и стационарной скорости роста сгустка являются аналогичными.
Перед проведением оперативного вмешательства всем пациентам проводили ультразвуковое исследование проходимости вен нижних конечностей, а в течение госпитализации — профилактику ВТЭО согласно существующим российским и международным рекомендациям: компрессионный трикотаж I–II степени компрессии, назначение НМГ. В нашем исследовании использовался надропарин кальция за 12 ч перед операцией в дозе 0,3 мл подкожно.
Все исследованные больные перенесли оперативное вмешательство в условиях мультимодальной анестезии с искусственной вентиляцией легких в сочетании с эпидуральной анестезией. Индукция анестезии осуществлялась пропофолом, фентанилом, миоплегия — рокуронием. Для эпидуральной анальгезии применялся 0,375 % раствор ропивакаина в режиме болюсных введений либо непрерывной инфузии. Ингаляционный анестетик для поддержания анестезии — севофлуран. У всех больных с целью обеспечения венозного доступа был установлен центральный венозный катетер.
Среднее время оперативного вмешательства составило 179,5 ± 46,9 мин (75–280). У 80 % больных (n = 49) от общего числа наблюдений была выполнена тазовая лимфаденэктомия. Средний объем интраоперационной кровопотери составил 423,8 ± 303,1 мл (50–1200). Суммарный объем инфузионной терапии — 2986,4 ± 565,5 мл (1800–4470). У 78 % больных интраоперационно применялись коллоидные растворы не более 500 мл за время вмешательства. Двум больным проведена трансфузия свежезамороженной плазмы в объеме около 600 мл в каждом случае, 1 больному — эритроцитарной взвеси в объеме 300 мл.
В послеоперационном периоде все больные были активизированы в 1-е сутки. Введение профилактической дозы надропарина кальция было начато через 8–12 ч после окончания операции на фоне эластической компрессии нижних конечностей 1–2-го класса. Ни у одного больного в послеоперационном периоде не отмечено случаев кровотечения, трансфузионная терапия не проводилась. Надропарин кальция применялся однократно в дозировке при массе тела менее 70 кг — 0,3 мл (2850 МЕ анти-Ха), при массе тела, равной или превышающей 70 кг, — 0,6 мл (5700 МЕ анти-Ха).
Контроль эпизодов ВТЭО осуществлялся при клиническом осмотре, а также с помощью ультразвукового исследования проходимости вен нижних конечностей на 3-и — 5-е сутки после оперативного вмешательства и перед выпиской из стационара. Длительность пребывания в стационаре составила в среднем 14 ± 4 суток.
Лабораторный контроль общего анализа крови, биохимических показателей проводился до операции, на 1-е и 3-и — 5-е сутки после операции и перед выпиской из стационара.
Анализ показателей коагулограммы и тромбодинамики производился в трех контрольных точках: перед первым введением НМГ после операции, через 3 ч после введения НМГ на 3-и сутки, через 2–3 ч после введения перед выпиской из стационара. Тест тромбодинамики выполнялся на диагностической лабораторной системе «Регистратор тромбодинамики Т-2» (Россия).
Статистическая обработка данных проводилась в программах Excel, Statistica 10, SPSS. Для оценки качественных показателей использовался двусторонний критерий Фишера, для количественных — коэффициент ранговой корреляции Спирмена и U-критерий Манна—Уитни. Нормальность распределения данных проверена с помощью вероятностного калькулятора по значению Z (нормальное).
Исследование одобрено этическим комитетом МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИРЦ» Минздрава России.
Данные динамики уровня антитромбина III представлены на рис 2.

Рис. 2. Активность антитромбина III
Fig. 2. Antithrombin III activity
Среди 59 больных у 3 (5 %) был выявлен венозный тромбоз в послеоперационном периоде, подтвержденный данными ультразвукового исследования. В 2 случаях тромбоз вен нижних конечностей не сопровождался флотацией тромба, 1 случай — тромбоз яремной вены выше места установки центрального венозного катетера, без флотации. Этим больным, после выявления тромбоза, были назначены лечебные дозы НМГ.
По результатам теста тромбодинамики при поступлении у 57 больных было выявлено повышение скорости роста сгустка (V), у 2 пациентов этот показатель был на верхней границе референсных значений. Уровень D-димеров в этой же контрольной точке был повышен у 9 больных (15,3 %). Перед первым ведением надропарина кальция после операции скорость роста сгустка повышена у 50 больных, D-димеры — у 48 пациентов. В третьей контрольной точке у 10 больных (17 %) скорость роста сгустка повышена, у 21 (36 %) — в пределах нормальных параметров, у 28 пациентов — снижена. D-димеры в этом случае у 56 больных были повышены. Перед выпиской из стационара 38 больных оказались с повышенной скоростью роста, 8 — в пределах референсных значений, у 13 — скорость была снижена, уровень D-димеров повышен у 58 пациентов. Средние показатели скорости роста сгустка и D-димеров представлены в табл. 1, корреляции между данными параметрами не выявлено.
Таблица 1. Средние показатели скорости роста сгустка (V) и уровня D-димеров
Table 1. Average clot growth rate and D-dimer level
| Параметры оценки | Контрольные точки | |||
|---|---|---|---|---|
| День поступления | Перед первым введением НМГ | 3-и сутки после операции, пик эффекта НМГ | День выписки из стационара | |
| Скорость роста сгустка, мкм/мин | 34,52 ± 4,89 | 38,34 ± 10,7 | 20,8 ± 8,4 | 30,95 ± 7,8 |
| D-димеры, мг/л FEU | 0,36 ± 0,28 | 1,58 ± 1,38 | 1,83 ± 1,7 | 2,99 ± 1,7 |
FEU — фибриноген-эквивалентные единицы; НМГ — низкомолекулярные гепарины.
При сравнении динамики лейкоцитов со скоростью роста сгустка (V) была обнаружена прямая связь только в момент пика эффекта НМГ на 3-и сутки после операции (r = 0,33; p < 0,05), хотя уровень лейкоцитов и скорость роста сгустка совпадали (рис. 3; табл. 2), что может соответствовать взаимосвязи показателей тромбодинамики и тяжести воспалительного процесса, однако для установления данного факта требуются дальнейшие исследования.
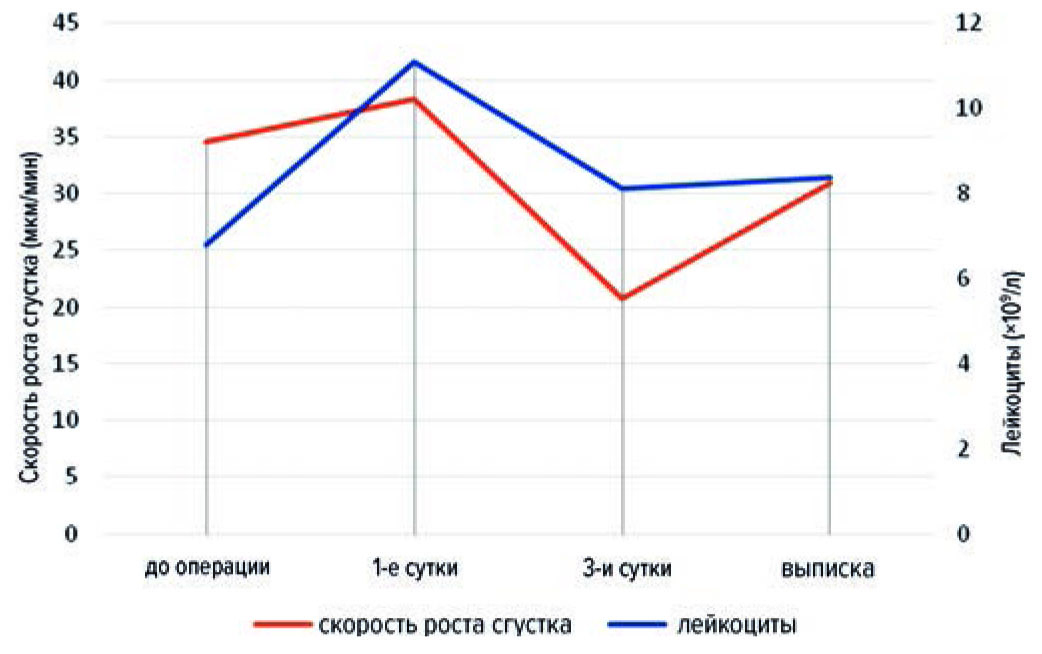
Рис. 3. Скорость роста сгустка и динамика лейкоцитов
Fig. 3. Clot growth rate and leukocyte dynamics
Таблица 2. Количество лейкоцитов и скорость роста сгустка
Table 2. White blood cell count and clot growth rate
| Параметры оценки | Контрольные точки | |||
|---|---|---|---|---|
| До операции | 1-е сутки после операции | 3-и сутки после операции | День выписки из стационара | |
| Лейкоциты, × 109/л | 6,8 ± 1,75 | 11,1 ± 2,95 | 8,1 ± 2,1 | 8,4 ± 2,4 |
| Скорость роста сгустка, мкм/мин | 34,5 ± 4,89 | 38,4 ± 10,7 | 20,8 ± 8,4 | 31 ± 7,8 |
Также была отмечена прямая корреляция в 1 и 4 точках с показателями мочевины (r = –0,30; –0,41 соответственно; p < 0,05). Однако, по нашему мнению, эта взаимосвязь опосредована гиповолемией, поскольку соотношение мочевины к креатинину превышало 20 мг/дл в отсутствие у больных признаков сердечной и почечной недостаточности (рис. 4).
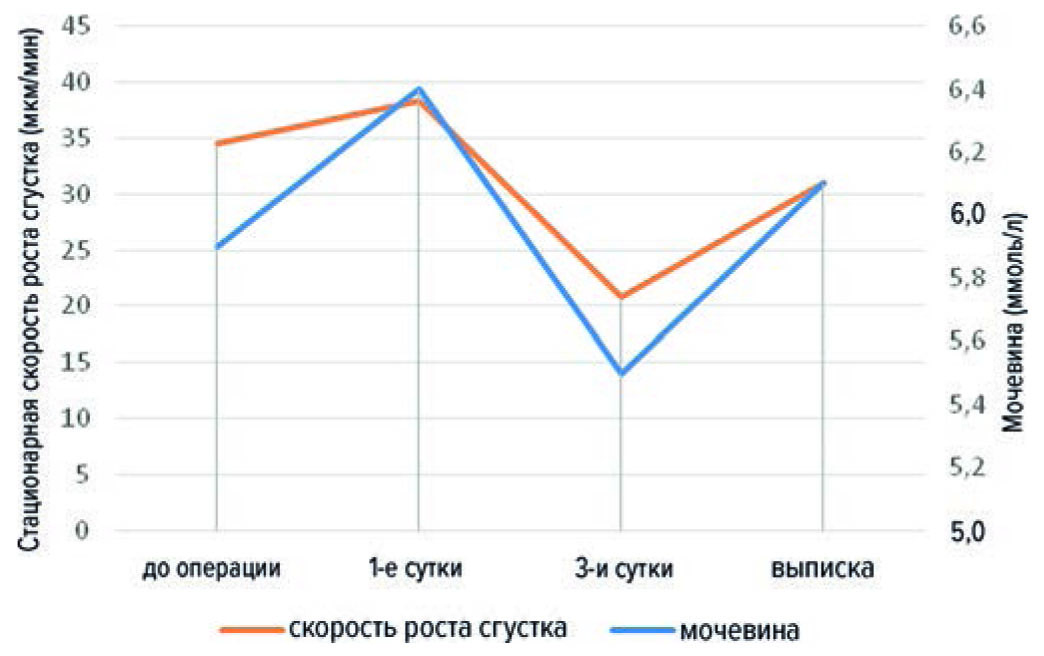
Рис. 4. Динамика скорости роста сгустка и уровня мочевины
Fig. 4. Dynamics of clot growth rate and urea level
Начальная скорость роста сгустка при поступлении в стационар была повышена у 57 пациентов, а в 2 пробах этот показатель был нормальным. После операции лишь у 1 пациента данный параметр оказался в норме, остальные значения превышали верхний предел. На пике эффекта профилактической дозы надропарина кальция повышенная скорость роста сгустка отмечена у 34 больных, нормальная — у 23, ниже нормы — у 2. При выписке этот же показатель повышен у 40 пациентов, у 19 — в пределах нормы.
Начальная скорость роста сгустка и АЧТВ имели обратную корреляцию лишь в пике действия НМГ на 3-и сутки (r = –0,30; p < 0,05), при этом показатель АЧТВ оставался в пределах референсных значений. В остальных контрольных точках взаимосвязи обнаружено не было.
Так же как и стационарная скорость, начальная обратно коррелировала с уровнем мочевины в первой и последней точках исследования (r = –0,31; –0,42 соответственно; p < 0,05), вероятно, по тем же причинам (рис. 5).

Рис. 5. Начальная скорость роста и уровень мочевины
Fig. 5. Initial growth rate and urea level
Взаимосвязь между скоростными характеристиками роста и уровнем D-димеров не обнаружена. Показатели задержки роста у всех больных были в пределах нормальных значений.
При поступлении у 54 больных параметр размера сгустка через 30 мин был повышен, 5 проб показали нормальный результат. После операции данный показатель повысился у 49 больных, в остальных случаях находился в пределах референсных значений. На пике эффекта надропарина кальция у 12 пациентов размер сгустка был увеличен, 36 проб показали нормальные значения, в остальных 11 случаях размер снижен. Была получена прямая связь с уровнем лейкоцитов (r = 0,33; p < 0,05), однако она наблюдалась лишь в момент пика действия НМГ (рис. 6).
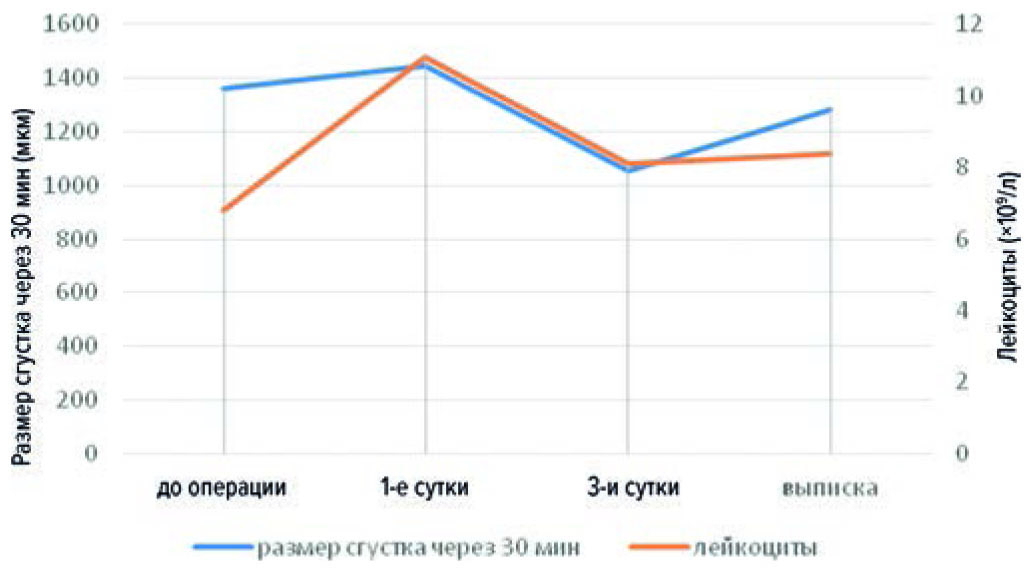
Рис. 6. Динамика лейкоцитов и плотности сгустка через 30 минут
Fig. 6. The dynamics of leukocytes and clot density after 30 minutes
В этой же точке была обратная корреляция с АЧТВ (r = –0,37; p < 0,05), однако АЧТВ, так же как и в случае с начальной скростью роста сгустка, оставалось в пределах нормальных значений. Эти данные свидетельствуют о чувствительности параметра размера сгустка к терапии НМГ у пациентов со злокачественным новообразованием предстательной железы.
Еще один показатель тромбодинамики, который учитывался в исследовании, — плотность сгустка. В первой контрольной точке 58 проб показали нормальное значение, в 1 случае — повышенное. После операции у 13 пациентов плотность оказалась повышенной, у остальных — в норме. На высоте эффекта надропарина кальция: 43 пациента — повышена, 16 — нормальное значение. Перед выпиской плотность оказалась высокой в 26 пробах; 33 случая — в пределах референсных значений.
Данный параметр показывал прямую корреляцию с уровнем фибриногена (рис. 7) во всех точках наблюдения (r = 0,73; 0,76; 0,43; 0,71 соответственно; p < 0,05), что соответствует известным результатам [17].
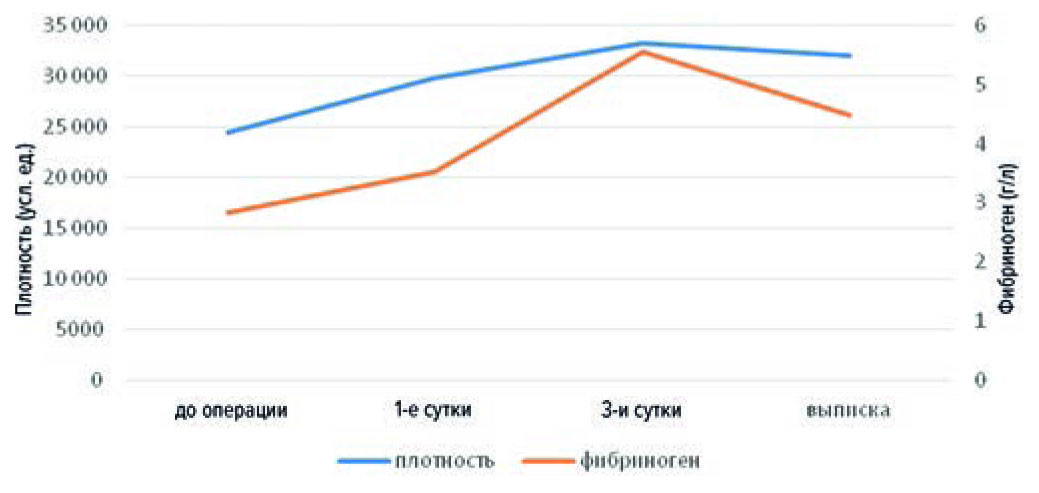
Рис. 7. Соотношение плотности сгустка и уровня фибриногена
Fig. 7. The ratio of clot density and fibrinogen level
При статистическом анализе полученных данных теста тромбодинамики мы выявили, что при значении скорости роста сгустка более 43 мкм/мин после оперативного вмешательства перед первым введением НМГ или на 3-и сутки через 3 ч после введения частота тромбоза резко возрастала. По этому показателю пациенты были разделены на две группы. Группа 1 включала 16 пациентов, среди которых было зарегистрировано 3 случая тромбоза. В группу 2 вошли 43 больных, среди которых ВТЭО не было (двусторонний критерий Фишера, p = 0,0172). Средняя скорость роста сгустка в группе 1 перед первым введением НМГ составляла 50 ± 11 мкм/мин, на 3-и сутки через 3 ч после введения — 22 ± 8 мкм/мин, в группе 2— 33 ± 5,9 и 20 ± 8 мкм/мин соответственно. В группе 1 в сравнении со 2-й отмечены более быстрая начальная скорость роста сгустка — 72,5 ± 5,43 мкм/мин vs 67 ± 4 мкм/мин, а также более высокий показатель размера сгустка через 30 мин — 1685 ± 250 мкм vs 1390 ± 152 мкм (р = 0,003) соответственно. Значимых различий в уровне D-димеров не обнаружено, однако в обеих группах их уровень был повышен с первого дня после операции.
У больных группы 1 при поступлении выявлен достоверно более высокий уровень гемоглобина и гематокрита (p = 0,038). Кроме того, на 5-е сутки уровень тромбоцитов был ниже (p = 0,025), однако в обоих случаях показатели не выходили за рамки референсных значений. В обеих группах был отмечен рост спонтанных сгустков в различное время, достоверных различий по этому параметру мы не обнаружили.
Связь гиперкоагуляционного состояния системы свертывания крови с наличием новообразования злокачественной природы известна давно, и существует множество исследований, подтверждающих этот факт. Рекомендации по тромбопрофилактике дают однозначное заключение о необходимости ее проведения всем онкологическим больным на этапах хирургического и противоопухолевого лечения. Однако вопрос лабораторного контроля рассмотрен недостаточно подробно. В клинической практике мы часто сталкиваемся с ситуациями, когда на фоне проведения стандартной антикоагулянтной профилактики тромбозов они все же развиваются. При этом показатели коагулограммы и уровней D-димеров могут оставаться в пределах нормальных значений.
В нашем исследовании показатель стационарной скорости роста сгустка, который выступал основным ориентиром, был выше референсных значений в тех контрольных точках, в которых надропарин кальция не вводился либо его введение было прекращено, в то же время на пике действия НМГ отмечено снижение скоростных характеристик тромбодинамики. В целом данный параметр отражал гиперкоагуляционное состояние, что соотносится с ранее проведенными исследованиями у неонкологических пациентов [18]. Показатель D-димеров при поступлении в стационар лишь в 15 % случаев превышал верхнюю границу нормы в отличие от показателей тромбодинамики, где он был повышен в 97 % случаев. Vst отражала степень воздействия стандартных профилактических доз НМГ на состояние системы гемостаза в послеоперационном периоде, тогда как D-димеры показывали активность фибринолиза и не позволяли оценить адекватность медикаментозной профилактики венозных тромбоэмболий. Также уровень фибриногена сильно коррелировал с показателем плотности сгустка. Аналогичный результат также был получен и в ранее проведенных исследованиях [17].
Показатель стационарной скорости роста сгустка более 43 мкм/мин перед первым ведением или через 3 ч после инъекции надропарина кальция ассоциировался с повышенным риском развития ВТЭО. При этом ни уровень D-димеров, ни иные коагуляционные тесты не имеют значимых отличий в группах, разделенных по данному признаку.
Все вышесказанное свидетельствует о возможности использования теста тромбодинамики в качестве лабораторного контроля эффективности профилактики ВТЭО с помощью НМГ у больных злокачественным новообразованием предстательной железы, которым проведена радикальная простатэктомия. Мы планируем продолжать исследование эффективности теста с учетом полученных данных с целью персонализации профилактики ВТЭО.
Тест тромбодинамики чувствителен к состоянию гиперкоагуляции у онкологических пациентов, перенесших радикальную простатэктомию. Влияние применения стандартной схемы профилактики венозной тромбоэмболии в раннем послеоперационном периоде на систему гемостаза отражается показателем стационарной скорости роста сгустка. Превышение этого параметра более чем на 43 мкм/мин в первые 3 суток после оперативного вмешательства достоверно чаще связано с развитием тромбозов. Однако для использования данного значения в практической деятельности требуются дальнейшие исследования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Суворин П.А., Хороненко В.Э., Смирнова Т.Ю., Александрова Е.А. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.