Программа ускоренного восстановления в хирургии (Enhanced Recovery After Surgery — ERAS или Fast Track) доказанно снижает частоту послеоперационных осложнений и госпитальную летальность. В хирургии пищевода протоколы ускоренной реабилитации внедряются достаточно успешно [1–4], и одним из ключевых моментов при реализации подходов ускоренной реабилитации является оптимизация нутритивного статуса больного.
У этих пациентов часто наблюдается потеря массы тела еще до операции, и их рацион питания исходно ограничен основным заболеванием [5, 6]. Оптимальные подходы к предоперационной нутритивной поддержке достаточно подробно описаны в мировой [1] и отечественной литературе [7–9].
Помимо предоперационной коррекции нутритивной недостаточности или поддержания нутритивного статуса пациентов, важным моментом является послеоперационное питание больных, перенесших эзофагэктомию (ЭЭ) с одномоментной пластикой пищевода. Недостаточное питание и послеоперационные осложнения — это два ключевых и взаимосвязанных фактора, определяющих скорость реабилитации пациента после ЭЭ [10, 11]. Необходимость проведения нутритивной поддержки после ЭЭ не подвергается сомнению [12–15], однако режим и тип послеоперационного кормления остаются предметом споров [16–18].
Традиционно в абдоминальной хирургии общепринятым способом послеоперационной нутритивной поддержки считается полное парентеральное питание (ПП) [19]. Предпочтение данному методу авторы отдают, исходя из убеждения, что голодание снижает частоту хирургических осложнений. Основным опасением при назначении раннего перорального питания (РПП) остается угроза несостоятельности дигестивного анастомоза, а также аспирационных осложнений [20, 21].
Однако на протяжении последних лет все больше исследований рекомендуют проведение энтерального питания (ЭП) в раннем послеоперационном периоде [22–24], считая этот метод более безопасным и экономически выгодным по сравнению с ПП. ЭП не только поддерживает жизнеспособность энтероцитов и улучшает моторику желудочно-кишечного тракта (ЖКТ), но и обеспечивает сохранение кишечного барьера. Это снижает частоту инфекционных осложнений [25] и среднюю продолжительность пребывания в стационаре [26].
Возможность перорального приема нутриентов после операции на органах ЖКТ изучена в хирургии поджелудочной железы, печени и желудка, в т. ч. после гастрэктомии с «высоким» эзофагоеюноанастомозом [27–30]. Результаты исследований демонстрируют, что РПП может быть безопасным после операций на ЖКТ, а также улучшает результаты лечения, ускоряет восстановление после операции и повышает комфорт больного [31].
Основываясь на опыте других видов хирургии верхних отделов ЖКТ, РПП может ускорить функциональное восстановление больного и после открытой ЭЭ. Результатов крупных рандомизированных контролируемых исследований, посвященных этому вопросу, пока нет. В настоящее время оптимальным способом кормления после ЭЭ признано ЭП. Однако недавно появились данные, что РПП после малоинвазивных ЭЭ не увеличивает количество послеоперационных осложнений [32–34].
Раннее начало перорального приема пищи после ЭЭ с одномоментной пластикой, на наш взгляд, является одним из ключевых моментов ускоренной реабилитации в хирургии пищевода. Исследование, подтверждающее безопасность и эффективность его проведения в раннем послеоперационном периоде у больных, перенесших ЭЭ, может способствовать не только ускоренному послеоперационному восстановлению больных, но и улучшению результатов хирургического лечения. Этот факт делает настоящее исследование актуальным.
Цель исследования — улучшить результаты лечения пациентов после ЭЭ с одномоментной пластикой изоперистальтической желудочной трубкой путем выбора метода нутритивной поддержки в послеоперационном периоде.
В период с января 2016 г. по декабрь 2020 г. в Национальном медицинском исследовательском центре хирургии им. А.В. Вишневского выполнено проспективное рандомизированное исследование. Проведение исследования было одобрено локальным этическим комитетом ФГБУ «Национальный медицинский центр хирургии им. А.В. Вишневского» Минздрава России, протокол № 001-2019 от 25.01.2019.
В исследование включили пациентов со злокачественными опухолями пищевода, доброкачественными стриктурами пищевода и ахалазией кардии, перенесших трансторакальную или трансхиатальную ЭЭ с одномоментной заднемедиастинальной пластикой изоперистальтической желудочной трубкой. Критериями включения были согласие оперирующего хирурга на РПП, основанное на визуальной оценке жизнеспособности кондуита и культи пищевода и отсутствии технического брака при формировании анастомоза, и низкий риск развития нутритивной недостаточности в послеоперационном периоде.
Критериями исключения из исследования являлись:
В зависимости от типа нутритивной поддержки в послеоперационном периоде больных разделили на две группы:
Рандомизацию пациентов на группы проводили с помощью генератора случайных чисел интраоперационно после формирования эзофагогастроанастомоза. Контролируемое наблюдение каждого пациента проводилось в течение госпитального периода.
На всех этапах исследования учитывали следующие параметры:
Для оценки осложнений и их значимости использовали:
В исследование включили 40 пациентов, разделенных на 2 группы: 20 — в основной группе РПП (гр. 1) и 20 — в группе контроля (гр. 2). Послеоперационное ведение больных 2 гр. проводили по классическому протоколу, принятому в стационаре. Характеристика групп представлена в табл. 1.
Таблица 1. Характеристика основной и контрольной групп
Table 1. Characteristics of the main and control groups
| Характеристики | Гр. 1, % (абс.) | Гр. 2, % (абс.) | Критерий р | |
|---|---|---|---|---|
| Количество | 20 | 20 | ||
| Пол | Муж. | 45 (9) | 65 (13) | 0,27 |
| Жен. | 55 (11) | 35 (7) | ||
| Средний возраст | 57 | 50 | 0,06 | |
| Оценка по ASA, класс | I | 10 (2) | 15 (3) | 0,54 |
| II | 45 (9) | 50 (10) | ||
| III | 40 (8) | 30 (6) | ||
| IV | 5 (1) | 5 (1) | ||
| Показание к операции | Доброкачественная стриктура пищевода | 25 (5) | 30 (6) | 0,48 |
| Ахалазия | 25 (5) | 40 (8) | ||
| Злокачественная опухоль пищевода | 50 (10) | 30 (6) | ||
| Индекс массы тела | < 18,5 | 20 (4) | 20 (4) | 0,92 |
| > 18,5 и < 25 | 45 (9) | 40 (8) | ||
| > 25 | 35 (7) | 40 (8) | ||
| NRS 2002 | 0 | 65 (13) | 50 (10) | 0,69 |
| 1 | 15 (3) | 15 (3) | ||
| 2 | 10 (2) | 35 (7) | ||
| 3 | 10 (2) | 0 | ||
Между группами не было статистически значимых различий. Половой состав групп отличался незначительно: в основной группе женщин было 55 %, в контрольной — 35 %. При оценке физиологического состояния большинство пациентов имели ASA II–III (85 и 80 % соответственно). В гр. 1 злокачественные новообразования пищевода и пищеводно-желудочного перехода послужили причиной ЭЭ в 50 % наблюдений, в гр. 2 — в 30 %. Остальные операции выполнили по поводу доброкачественных заболеваний пищевода (рубцовая стриктуры пищевода или ахалазии).
Дефицит массы тела отметили у 20 % пациентов обеих групп. Избыточную массу телу имели 35 % пациентов в основной группе и 40 % в группе контроля. У большинства пациентов в обеих группах не было нутритивной недостаточности (65 и 50 % соответственно).
При обращении в стационар больные были осмотрены хирургом. С целью уточнения стадии заболевания и выявления возможных осложнений выполняли мультиспиральную компьютерную томографию органов грудной клетки и живота с в/в контрастированием. Проведен сбор анамнеза, заполнены опросные листы.
Пациенты осмотрены мультидисциплинарной командой врачей в составе: анестезиолог-реаниматолог, хирург и кардиолог; сформированы индивидуальные планы предоперационного обследования, включающие антропометрические данные, общий анализ крови, биохимический анализ крови, коагулограмму, общий анализ мочи, электрокардиографию в 12 отведениях, эхокардиографию, дуплексное сканирование вен нижних конечностей и брахиоцефальных артерий, 6-минутный тест ходьбы, оценку нутритивного статуса.
Пациентов и их родственников информировали о характере предстоящего оперативного вмешательства и возможных осложнениях. Всем больным выдали специально разработанные для них методические рекомендации — «Руководство для пациентов, которым предстоит пластика пищевода». Накануне операции с каждым больным беседовал анестезиолог с подробным обсуждением особенностей предстоящего анестезиологического пособия и его возможных осложнений.
Согласно принятому в учреждении протоколу ведения пациентов, основанному на принципах ускоренной реабилитации в хирургии, прием пищи прекращали за 8 ч до оперативного вмешательства, премедикацию и механическую подготовку кишки не проводили. Профилактику тромбоэмболических осложнений начинали путем подкожного введения профилактических доз низкомолекулярного гепарина за 12 ч до операции, антибиотикопрофилактику — за 30 мин до оперативного вмешательства ампициллин-сульбактамом 1,5 г в/в. Повторную дозу антибиотика вводили в/в каждые 4 ч до окончания операции.
Пациентов доставляли в операционную из профильного отделения. Катетеризировали кубитальную вену. С целью проведения нейроаксиальной анестезии выполняли пункцию и катетеризацию эпидурального пространства. Эпидуральный катетер устанавливали на уровне Th8–Th9. Профилактика послеоперационной тошноты и рвоты осуществлялась введением дексаметазона 4 мг в/в во время индукции в анестезию и ондансетрона 4 мг в/в за 30 мин до окончания вмешательства.
В течение 5 мин проводили преоксигенацию 100 % О2 и затем осуществляли быструю последовательную индукцию. Для проведения инфузионной терапии катетеризировали внутреннюю яремную вену, для инвазивного мониторинга артериального давления — лучевую артерию.
После формирования шейного эзофагогастроанастомоза на основании удовлетворительной жизнеспособности культи пищевода и трансплантата, отсутствия технических погрешностей при формировании соустья оперирующий хирург принимал решение о возможности РПП пациентов. В случае положительного решения пациентов разделяли на группы с помощью онлайн-рандомизатора.
По окончании оперативного вмешательства, после восстановления сознания, мышечного тонуса и самостоятельного дыхания, проводили экстубацию трахеи. Больных доставляли в отделение реанимации на самостоятельном дыхании с инсуффляцией кислорода через лицевую маску со скоростью 5 л/мин. В отделении реанимации продолжали мониторинг витальных функций, инфузионную терапию, профилактику тромбоэмболических и инфекционных осложнений, послеоперационной тошноты и рвоты, мультимодальную анальгезию, выполняли рентгенографию органов грудной клетки. Через 2 ч после вмешательства больных активизировали в пределах палаты реанимации.
Утром 1 ПОД больных осматривали оперирующий хирург, анестезиолог, реаниматолог и принимали решение о переводе в профильное отделение. Сразу после перевода выполняли контроль лабораторных и антропометрических показателей, а также рентгенографию с пероральным приемом водорастворимого контраста.
Ведение пациентов основной группы
На 1 ПОД больному разрешали пить 500 мл воды. Инфузионную терапию назначали из расчета 30 мл/кг — 500 мл с компенсацией объема потерь по дренажам. Продолжали профилактику послеоперационной тошноты и рвоты, тромбоэмболических осложнений и мультимодальную анальгезию. Активизацию проводили в пределах профильного отделения.
На 2 ПОД пациент начинал пероральное питание в виде сипинга сбалансированных белково-энергетических коктейлей (Ресурс 2.0, Суппортан напиток, Нутридринк, Нутрикомп Дринк плюс) из расчета 10 ккал/кг, объем выпитой воды дополнительно увеличивали до 1000 мл. Инфузионную терапию проводили по формуле 30 мл/кг – 1000 мл с компенсацией объема потерь по дренажам.
На 3 ПОД выполняли повторную рентгенографию шейного соустья и трансплантата с пероральным приемом водорастворимого контраста, оценку лабораторных, антропометрических и функциональных показателей пациентов. При отсутствии данных о несостоятельности эзофагогастроанастомоза разрешали пить воду в неограниченном количестве, а также увеличивали объем перорального питания до 20 ккал/кг. Инфузионную терапию прекращали.
На 4 ПОД пациенту назначали прием протертой пищи (стол 1а по Певзнеру). Потребление специализированного питания прекращали.
На 5 ПОД выполняли рентгенографию трансплантата и анастомоза с пероральным приемом бариевой взвеси. При отсутствии аспирации, нарушения эвакуации из трансплантата, а также при подтверждении герметичности эзофагогастроанастомоза пациенты продолжали прием протертой пищи и жидкости перорально без ограничений.
На 6 ПОД проводили повторную оценку лабораторных, антропометрических и функциональных показателей. Пациента выписывали из стационара при достижении удовлетворительного состояния, отсутствии жалоб и болевого синдрома или возможности его купирования пероральными анальгетиками, а также при обеспечении полноценного перорального питания, адекватного суточного диуреза и стула.
В контрольной группе РПП не проводили. Пациентам с 1 по 4 ПОД назначали инфузионную терапию из расчета 30 мл/кг с компенсацией объема потерь по дренажам, а также ПП (Оликлиномель N7, Нутрифлекс 70/240) из расчета 30 ккал/кг.
На 5 ПОД проводили рентгенографию искусственного пищевода с пероральным приемом водорастворимого контраста, оценку лабораторных, антропометрических и функциональных показателей пациента. Разрешали пить воду в количестве 500 мл/сут. Парентеральное питание проводили в прежнем объеме, а инфузионную терапию рассчитывали по формуле 30 мл/кг – 500 мл.
На 6 ПОД увеличивали объем выпиваемой жидкости до 1–1,5 л, а инфузионную терапию проводили из расчета 30 мл/кг – 1000 (1500) мл, проводили повторную оценку лабораторных, антропометрических и функциональных показателей.
На 7 ПОД выполняли рентгенографию трансплантата и анастомоза с пероральным приемом бариевой взвеси. При отсутствии данных об аспирации, а также при подтверждении герметичности соустья пациентам разрешали пероральный̆ прием протертой пищи (стол 1а по Певзнеру). Инфузионную терапию прекращали.
На 8 ПОД разрешали пить воду без ограничений, продолжали прием пюреобразной пищи.
Выписку из стационара проводили при достижении удовлетворительного состояния пациента, отсутствии жалоб и болевого синдрома или возможности его купирования пероральными анальгетиками, а также при обеспечении полноценного перорального питания, адекватного суточного диуреза и стула.
Статистический анализ данных осуществляли с помощью программ STATISTICA (data analysis software system, version 6. StatSoft, Inc., 2001) и Microsoft Office Excel 2007. Для определения нормальности распределения использовали тест Шапиро—Уилка. При проведении статистического анализа полученные данные с ненормальным распределением представлены в виде медианы и 25–75-го процентилей. Для анализа непараметрических данных использовали тесты Манна—Уитни, Краскела—Уоллиса, χ2 Пирсона. Статистически значимыми считали показатели, при которых значение критерия соответствовало условию p < 0,05.
Непосредственные результаты лечения пациентов основной и контрольной групп представлены в табл. 2.
Таблица 2. Непосредственные результаты эзофагэктомии в обеих группах больных
Table 2. Direct results of esophagectomy in both groups
| Характеристики | Гр. 1, %, (абс.) | Гр. 2, %, (абс.) | Критерий р | |
|---|---|---|---|---|
| Количество | 20 | 20 | ||
| Отхождение газов | 2 (2–3) | 4 (3–5,5) | 0,001 | |
| Появление стула | 3 (2–3) | 4 (2–4,5) | 0,0002 | |
| Длительность госпитализации | 7 (6,5–8,5) | 8 (7–9) | 0,1 | |
| Послеоперационные осложнения | 35 (7) | 50 (10) | 0,41 | |
| Гидроторакс (пункция) | 25 (5) | 40 (8) | 0,41 | |
| Нарушение ритма (медикаментозная кардиоверсия) | 0 (0) | 10 (2) | 0,58 | |
| Несостоятельность анастомоза | 5 (1) | 0 (0) | 0,78 | |
| Транзиторная ишемическая атака | 0 (0) | 5 (1) | 0,78 | |
| Пневмоторакс | 5 (1) | 0 (0) | 0,78 | |
В группе РПП осложнения зарегистрированы у 7 (35 %) пациентов. К осложнениям I−II ст. по Clavien-Dindo отнесли: пневмоторакс у 1 (5 %) пациента и гидроторакс, потребовавший пункционного лечения, у 5 (25 %) пациентов. В этой группе мы диагностировали 1 случай несостоятельности шейного анастомоза, возникший на 6 ПОД. У пациентки на фоне гипертонического криза была многократная рвота, после которой развилась несостоятельность шейного соустья. При рентгенографии пищевода с пероральным приемом водорастворимого контраста (на 1 и 3 ПОД) и бария (на 5 ПОД) анастомоз у пациентки был состоятельный. По тяжести это осложнение отнесли ко II ст., т. к. на фоне полного ПП шейный свищ закрылся, и пациентку выписали из стационара на 27 ПОД. Осложнения более высокой степени в этой группе пациентов не наблюдались.
В группе контроля осложнения зарегистрированы у 10 (50 %) пациентов. К осложнениям I−II ст. по Clavien-Dindo отнесли: гидроторакс, потребовавший пункционного лечения, у 8 (40 %) пациентов и нарушения ритма в виде послеоперационной пароксизмальной мерцательной аритмии, потребовавшей медикаментозной кардиоверсии (амиодарон 300 мг в/в в течение 15 мин), у 2 (10 %) пациентов. Транзиторную ишемическую атаку у 1 (5 %) больного отнесли ко II ст., т. к. неврологическая симптоматика самостоятельно регрессировала в течение 20 мин.
Сравнивая результаты лечения обеих групп, мы не установили статистически значимого различия в количестве пациентов с послеоперационными осложнениями в основной и контрольной группах (35 vs 50 %, p = 0,41). У пациентов основной группы отмечалось статистически значимое более раннее отхождение газов — 2 (2–3) vs 4 (3–5,5) дней (р = 0,001) и появление стула — 3 (2–3) vs 4 (2–4,5) дней (р = 0,0002). Ранняя активизация и питание, отсутствие пареза кишечника позволили уменьшить общее время послеоперационного пребывания в стационаре — 7 (6,5–8,5) vs 8 (7–9) ПОД (р = 0,1). Это снижение статистически недостоверно, однако отмеченная тенденция реализуется при увеличении числа пациентов в группах.
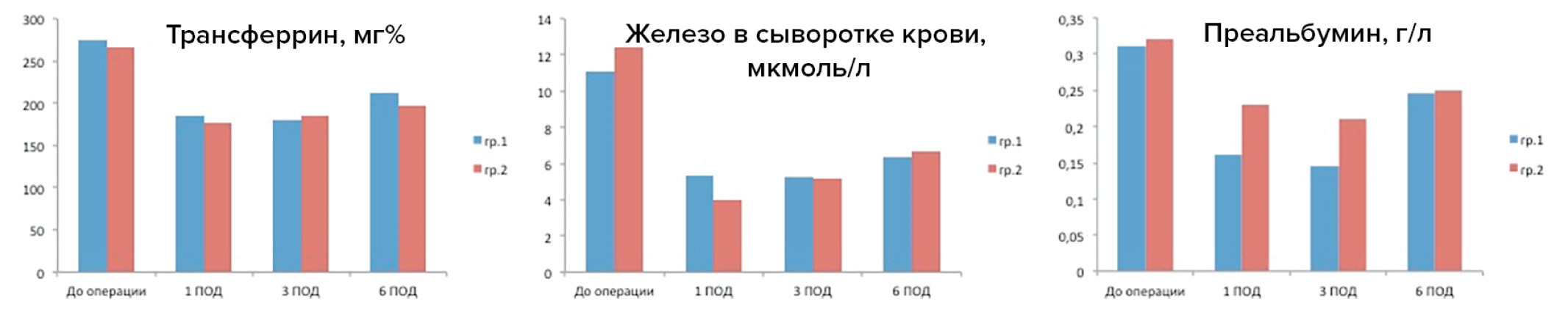
В исследовании также оценивали некоторые показатели, отражающие нутритивный статус пациентов обеих групп (рис. 1).

Рис. 1. Показатели нутритивного статуса
Fig. 1. Nutritional status parameters
Уровень сывороточного трансферрина в основной и контрольной группах не имел статистически значимого различия ни до операции — 275 (201,5–302) vs 266,5 (212–305,5) (р = 0,88); ни на 1 ПОД — 185 (157,5–218) vs 177 (150–222,5) (р = 0,32); ни на 3 ПОД — 180,5 (143–210) vs 186 (159–208) (р = 0,53); ни на 6 ПОД — 211,5 (175–233,5) vs 196,5 (170–222) (р = 0,37).
Количество свободного железа в сыворотке крови изменялось синхронно с уровнем трансферрина. До операции в гр. 1 и 2 оно составляло 11,1 (8,1–15,9) и 12,4 (8,9–19,75) соответственно (р = 0,34), на 1 ПОД снижалось до 5,3 (2,1–6,7) и 4 (1,95–6,2) (р = 0,61), на 3 ПОД составляло 5,25 (3,2–6,7) и 5,2 (4,15–7,55) (р = 0,68), а на 6 ПОД поднималось до 6,35 (4,9–8,0) и 6,7 (4,7–10,7) (р = 0,6) соответственно.
Уровень преальбумина в сыворотке крови до операции у пациентов основной и контрольной групп не отличался: 0,31 (0,245–0,415) vs 0,32 (0,26–0,575) (р = 0,46). Однако на 1 и 3 ПОД отмечалась статистически значимая разница в его количестве. В группе РПП его было значимо меньше, чем в группе классического ПП. На 1 ПОД — 0,16 (0,14–0,235) vs 0,23 (0,17–0,385) (р = 0,04) и на 3 ПОД — 0,145 (0,115–0,185) vs 0,21 (0,16–0,39) (р = 0,01). К 6 ПОД различие между группами нивелировалось — 0,245 (0,195–0,370) vs 0,25 (0,205–0,4) (р = 0,83).
Оценку эффективности ранней реабилитации и активизации пациентов после операции проводили с помощью 6-минутного теста ходьбы (рис. 2).
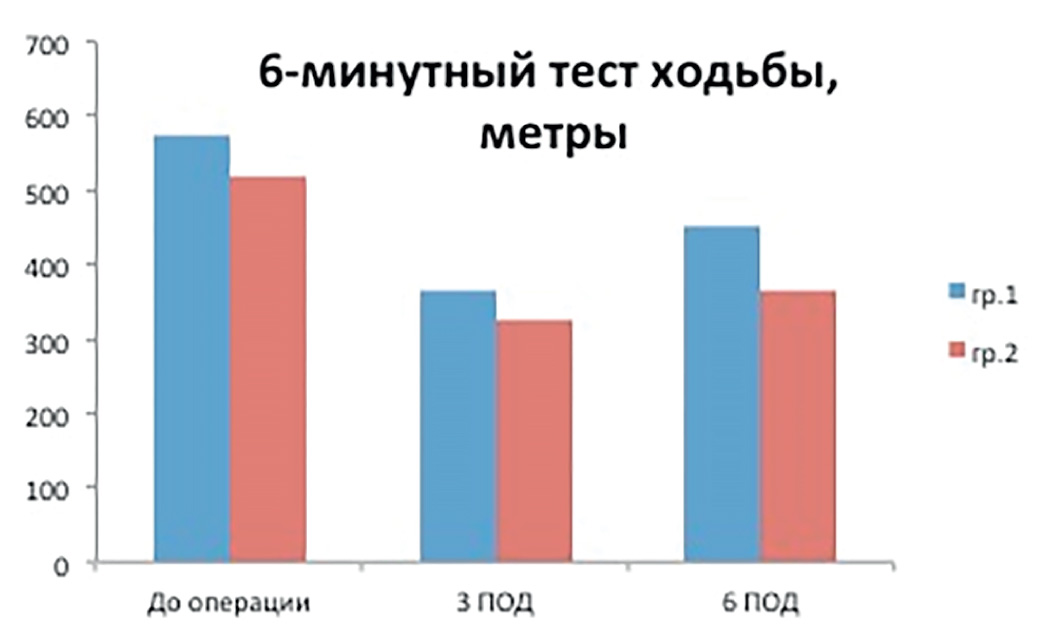
Рис. 2. Оценка переносимости физической нагрузки
Fig. 2. Assessment of exercise tolerance
Исходно результаты этого теста у больных обеих групп достоверно не отличались — 575 (512,5–625) vs 520 (457,5–570) (р = 0,053). На 3 ПОД показатели пациентов обеих групп были хуже исходных, но пациенты, получавшие РПП, достоверно лучше переносили физическую нагрузку — 367 (307,5–390) vs 325 (252,5–355) (р = 0,048). На 6 ПОД различия между группами стали еще более заметнее — 450 (425–465) vs 365 (317,5–410) (р = 0,003).
Вопрос о проведении нутритивной поддержки у пациентов с заболеваниями пищевода — один из самых важных в концепции периоперационного обеспечения, т. к. нутритивная недостаточность и частота периоперационных осложнений прямо связаны. В предоперационном периоде проведение нутритивной поддержки или терапии — достаточно сложная и многофакторная задача, однако нерешенных проблем в ней практически нет. Не подлежат обсуждению необходимость энтерального введения нутриентов и всего лишь вспомогательная роль ПП на этапе предоперационной подготовки у больных даже с полной дисфагией. В раннем же послеоперационном периоде вопросы кормления больных с нормальным течением послеоперационного периода остаются вне фокуса внимания.
Традиционно в большинстве случаев проводят либо ПП, либо не проводят ничего, ограничиваясь исключительно инфузионной терапией. В классической схеме послеоперационного лечения больным, перенесшим ЭЭ с одномоментной пластикой пищевода, запрещают пероральный прием жидкости и пищи до 6–7 ПОД [37]. В нашей практике мы на протяжении последних 5 лет сократили этот срок до 4 ПОД.
Согласно ряду исследований, после выполнения ЭЭ с одномоментной пластикой пищевода проведение ЭП является предпочтительным методом кормления в раннем послеоперационном периоде [22–24]. Однако в большинстве случаев проводить ЭП после ЭЭ рекомендуют через назоеюнальный зонд (НЕЗ) или еюностому (ЕС) [1, 38]. Методы, позволяющие избежать приема пищи через рот, используют с целью профилактики несостоятельности анастомоза [39]. Но использование НЕЗ в 13–38 % случаев также приводит к возникновению осложнений — смещению или обструкции зонда и микроаспирации кишечного содержимого [40]. В 44,4 % у пациентов после наложения ЕС наблюдаются осложнения в виде воспаления мягких тканей в месте постановки еюностомической трубки, парастомическое подтекание жидкости, транспозиция трубки, мальабсорбция [41]. Кроме того, в 7 % случаев еюностомическая трубка вызывает обструкцию кишки, что приводит к острой кишечной непроходимости [42, 43]. Фарингостомический зонд — также допустимый метод кормления при осложнениях после ЭЭ. Большинство пациентов его переносит лучше чем НЕЗ, но методика его использования технически достаточно сложна и большого распространения не получила [44]. Согласно исследованию, проведенному Elshaer в 2016 г., количество осложнений, возникающих при выборе одного из методов ЭП, сопоставимо [45].
Безусловно, ЭП является хорошей альтернативой, но у больных, не имеющих нутритивной недостаточности до операции, особенно в случае доброкачественных заболеваний пищевода, выведение еюностомы кажется нам необоснованным. Риск связанных с ней осложнений, на наш взгляд, превышает в данном случае пользу от манипуляции. Так же и НЕЗ, установленный в трансплантат с целью питания, имеет ряд неприятных последствий. В первую очередь он вызывает дискомфорт у больного. Отказ от его установки входит в список элементов ускоренной реабилитации.
Пероральный прием пищи в сочетании с такими методиками периоперационного обеспечения как рациональная инфузионная терапия, мультимодальная анальгезия, ранняя экстубация и мобилизация улучшает возможности организма и ускоряет реабилитацию после операции. В своей клинической практике мы используем концепцию периоперационного обеспечения ЭЭ, основанную на философии ускоренной реабилитации. Основным показателем эффективности применяемого подхода, безусловно, является восстановление дооперационного уровня активности пациента. Методы ускоренной реабилитации, применяемые нами в рамках концепции периоперационного обеспечения, включают в себя раннее пробуждение и экстубацию, эффективную анальгезию, мобилизацию в первые часы после операции, отказ от дренирования шейной раны и установки НЕЗ, а также раннее удаление дренажей и катетеров.
Физиология пищеварения построена таким образом, что включение нейрогуморальных механизмов на прием даже небольших доз пищи позволяет рационально утилизировать запасы организма в условиях стресса. Основной задачей нейрогуморальной системы регуляции пищевого поведения является прекращение голода и поддержание организма в состояние сытости. Именно в состоянии сытости организм способен отменить доминанту поиска и запаса пищи, начать выполнять другие задачи и тратить ресурсы, в частности, переносить физические нагрузи или, в нашем случае, адекватно восстанавливаться после оперативного вмешательства.
Пищевое насыщение бывает двух типов: сенсорное и метаболическое. Сенсорное насыщение быстрое, возникает в момент употребления пищи под воздействием ее на рецепторы, находящиеся в ротовой полости, пищеводе и желудке. Возникающая афферентная импульсация с рецепторов этих органов поступает к нейронам гипоталамуса. В результате происходит выделение анорексигенных гормонов (глюкагоноподобного пептида-1, холецистокинина, лептина и др. [46]), исчезает пищевая мотивация и пропадает желание есть. Эволюционно именно поступление пищи в ротовую полость дает организму уверенность, что запас питательных веществ будет восполнен и трата имеющихся ресурсов безопасна [47]. Метаболическая фаза насыщения включает обработку принятой пищи пищеварительными ферментами, ее всасывание и поступление полученных питательных веществ в кровь, восполнение израсходованных ресурсов.
ЖКТ имеет свою собственную интегральную нервную систему, представленную в виде межмышечных и подслизистых нервных сплетений. Ее деятельность регулируется посредством симпатической и парасимпатической нервной системы, а также локальных рефлексов, берущих начало в подслизистом слое. Однако для первичной стимуляции моторной и секреторной функции ЖКТ необходимо выделение ацетилхолина. Оно происходит за счет активации блуждающего нерва, когда пища попадает в ротовую полость и раздражает ее слизистую оболочку. В дальнейшей регуляции перистальтики участвуют растяжение гладкомышечных клеток при поступлении химуса и действие интестинальных гормонов [48].
Таким образом, вопрос о проведении РПП у больных с неосложненным течением послеоперационного периода представляется нам актуальным и крайне важным. Возможность кормления больных с 1 ПОД после ЭЭ улучшает не только психологическое состояние пациентов, но и результаты хирургического лечения. Также РПП позволит сократить общие затраты на лечение, ускорить послеоперационное восстановление и избежать серьезных осложнений, связанных с проведением ПП или ЭП через НЕЗ или ЕС.
Дискуссии, посвященные способам кормления больных после ЭЭ и сроку его начала, длятся последние несколько лет [1]. Большинство опасений связано с риском развития несостоятельности эзофагогастроанастомоза. Исследования РПП после малоинвазивных ЭЭ проводятся и показывают положительные результаты [32–34]. Длительность госпитализации сокращается с 10 до 8 ПОД [34]. Качество жизни пациентов после операции значительно улучшается, а затраты на питание снижаются [33]. Публикации о РПП после открытой ЭЭ нами не найдены. Опыт, представленный в литературе, обосновывает необходимость дальнейших исследований.
Применение концепции периоперационного обеспечения ЭЭ, основанной на принципах ускоренной реабилитации, снизило общую частоту хирургических осложнений после ЭЭ в Национальном медицинском исследовательском центре хирургии им. А.В. Вишневского, что и позволило нам провести исследование возможности РПП. Эффективность и безопасность РПП оценивали по частоте послеоперационных осложнений (см. табл. 2) и возможности ранней активизации. Субъективный комфорт пациентов, получивших РПП, также был выше. В результате именно в группе РПП пациенты достоверно быстрее вышли на дооперационный уровень физической активности.
Изменение нутритивного статуса пациентов обеих групп оценивали по динамике плазменной концентрации альбумина, трансферрина и преальбумина. Эти белки, синтезируемые в печени, имеют разный период полураспада (20, 7 и 2 дня соответственно) [49]. Также все они являются негативными белками острой фазы воспаления [50]. С целью контроля уровня воспаления оценивали количество С-реактивного белка. Преальбумин (транстиретин) имеет самый короткий период полураспада, поэтому именно его концентрация максимально отражает эффективность нутритивной поддержки [51]. Его уровень достоверно снижался на 1 и 3 ПОД в группе РПП в связи с невозможностью восполнения суточной нормы калорий в первые дни после операции. На 6 ПОД количество преальбумина выравнивалось в обеих группах. В международной и отечественной литературе оценка нутритивного статуса у пациентов с РПП после ЭЭ и одномоментной пластики пищевода не представлена.
Включение в концепцию периоперационного обеспечения ЭЭ наряду с другими принципами ускоренной реабилитации РПП не увеличивает частоту хирургических осложнений, улучшает качество послеоперационного восстановления, повышает комфорт больного и позволяет избежать специфических осложнений, связанных с такими методами, как ПП, ЭП через НЕЗ или ЕС.
Раннее пероральное питание у пациентов, перенесших ЭЭ и не имеющих нутритивной недостаточности, безопасно и эффективно. Оно ускоряет активизацию и восстановление пациентов после операции, позволяет избежать специфических осложнений, связанных с парентеральным и энтеральным зондовым питанием, и не влияет на частоту хирургических осложнений. Однако применение РПП в рутинной практике возможно только в рамках программы периоперационного обеспечения, включающей все компоненты ускоренной реабилитации. Безопасность данного метода напрямую зависит от тесного междисциплинарного взаимодействия и вовлеченности больного в процесс лечения. Высокое качество хирургической техники и персонализация тактики анестезиологического обеспечения обязательны для реализации РПП.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Все авторы в равной степени участвовали в подготовке публикации: разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.