Внебольничная пневмония (ВП) является одной из важных проблем современной медицины, что обусловлено высокой заболеваемостью и смертностью, связанными с этой нозологической единицей [1]. Согласно данным официальной статистики, заболеваемость ВП в Российской Федерации в 2019 г. составила 410 на 100 тыс. взрослого населения со снижением этого показателя по сравнению с 2018 г. на 0,5 % [2]. На фоне пандемии новой коронавирусной инфекции (НКИ) COVID-19 в 2020 г. отмечен значительный рост заболеваемости ВП — в 3,6 раза по сравнению с 2019 г. (1856,18 на 100 тыс. населения), в т. ч. по вирусной пневмонии — в 109 раз (783,08 на 100 тыс. населения). Динамика заболеваемости ВП бактериальной этиологии в 2020 г. остается неясной, поскольку лишь начиная с 2021 г. заболеваемость вирусной ВП регистрируется отдельно [3].
По данным Всемирной организации здравоохранения, пневмония и грипп занимают 3-е место среди ведущих причин смерти, унося более 3 млн жизней ежегодно [4]. В структуре смертности от болезней органов дыхания в РФ в 2019 г. на долю пневмоний приходилось 41,9 %; смертность составила 17,0 на 100 тыс. населения [5]. Зарегистрированное в России число летальных случаев от ВП в 2020 г. увеличилось почти в 12 раз по сравнению с предыдущим годом (65 232 и 5484 случая среди всего населения соответственно), составив 44,45 на 100 тыс. населения, что также обусловлено в значительной мере НКИ COVID-19 [3].
Тяжелая внебольничная пневмония (ТВП) — особая форма пневмонии, осложненная выраженной острой дыхательной недостаточностью (ОДН) и/или сепсисом [6, 7]. От 2 до 24 % госпитализированных с ВП нуждаются в интенсивной терапии вследствие органной дисфункции и сепсиса [8–10]. Среди пациентов с ТВП, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ), потребность в проведении искусственной вентиляции легких (ИВЛ) составляет от 25 до 67 %, кроме того, примерно у 12 % пациентов проводили заместительную почечную терапию, а у 47 % — вазопрессорную поддержку [11–14]. Летальность у госпитализированных в ОРИТ пациентов с ТВП, по данным многоцентровых когортных исследований, составляет 17–56 % [1, 14, 15]. Основной причиной смерти больных с ТВП являются рефрактерная гипоксемия, септический шок и полиорганная недостаточность [1]. Летальность при ТВП зависит от многих факторов, наиболее значимые из которых — возраст пациентов, септический шок, потребность в ИВЛ, время от момента поступления в стационар до перевода пациента в ОРИТ [14]. Летальность также значительно выше у пациентов с серьезными сопутствующими заболеваниями (хроническая обструктивная болезнь легких [ХОБЛ], злокачественные новообразования, алкоголизм, сахарный диабет, хроническая сердечная недостаточность и др.) [1].
В распоряжении российских врачей имеются разработанные Российским респираторным обществом и Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии клинические рекомендации по диагностике, лечению и профилактике ТВП у взрослых 2014 г. [16]. Тем не менее высокая распространенность ТВП, показатели летальности, рост резистентности возбудителей ВП к антибиотикам, отсутствие у значительной части врачей понимания особенностей патогенеза дыхательной недостаточности (ДН) и четких представлений об алгоритме респираторной поддержки при ТВП создают предпосылки для анализа и пересмотра существующих подходов в соответствии с новыми российскими и международными данными. Представленная вашему вниманию обзорная публикация призвана предоставить российским анестезиологам-реаниматологам практические аспекты диагностики, лечения и профилактики ТВП у взрослых пациентов с учетом сегодняшних реалий.
Перечень потенциальных возбудителей ВП включает более 100 микроорганизмов (бактерии, вирусы, грибы, простейшие). Однако большинство случаев заболевания ассоциируется с относительно небольшим кругом патогенов, к которым относят Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamydophila pneumoniae, Haemophilus influenzae, многочисленные респираторные вирусы, энтеробактерии, Staphylococcus aureus и Legionella pneumophila [17, 18]. Поскольку у одного пациента могут выявляться и бактериальные патогены, и респираторные вирусы, важно понимать, что в настоящее время нет достаточно точных диагностических тестов, применимых в рутинной практике, для дифференциации бактериальной и вирусной этиологии пневмонии.
S. pneumoniae— самый частый возбудитель: согласно отечественным данным, на его долю приходится более 40 % случаев ТВП установленной этиологии (табл. 1). M. pneumoniae и C. pneumoniae нетипичны для ВП тяжелого течения. H. influenzae чаще вызывает ВП у пациентов с сопутствующей ХОБЛ; энтеробактерии выявляют преимущественно у лиц с хроническими сопутствующими заболеваниями, такими как сахарный диабет, хроническая сердечная недостаточность, алкоголизм, цирроз печени [6, 19]. В последние годы доказана значительная роль респираторных вирусов в этиологии ТВП.
Таблица 1. Этиология тяжелой внебольничной пневмонии у взрослых (до появления COVID-19) [20]
Table 1. Etiology of severe community-acquired pneumonia in adults (before COVID-19 pandemia) [20]
| Возбудитель | Частота выявления, % |
|---|---|
| S. pneumoniae | 43,7 |
| Enterobacterales | 16,9 |
| S. aureus | 14,1 |
| H. influenzae | 5,6 |
| Pseudomonas aeruginosa | 5,5 |
| Legionella spp. | 4,2 |
| Респираторные вирусы | 35,2 |
| M. pneumoniae | 2 |
S. aureus чаще ассоциируется с развитием пневмонии на фоне или после перенесенного гриппа, у лиц пожилого возраста, внутривенных наркоманов; P. aeruginosa— у пациентов с муковисцидозом, бронхоэктазами, применением системных глюкокортикостероидов, предшествующей длительной антибактериальной терапией (АБТ) (табл. 2) [6, 19].
Таблица 2. Сопутствующие заболевания/факторы риска, ассоциированные с определенными возбудителями внебольничной пневмонии [6, 19]
Table 2. Comorbidities and risk factors associated with defined causative agents of community-acquired pneumonia [6, 19]
| Заболевание/фактор риска | Вероятные возбудители |
|---|---|
| ХОБЛ/курение | H. influenzae, S. pneumoniae, M. catarrhalis, Legionella spp., P. aeruginosa (тяжелая ХОБЛ) |
| Декомпенсированный сахарный диабет | S. pneumoniae, S. aureus, энтеробактерии |
| Эпидемия гриппа | Вирус гриппа, S. pneumoniae, S. aureus, H. influenzae |
| Алкоголизм | S. pneumoniae, анаэробы, энтеробактерии (чаще Klebsiella pneumoniae) |
| Подтвержденная или предполагаемая аспирация | Энтеробактерии, анаэробы |
| Бронхоэктазы, муковисцидоз | P. aeruginosa, Burkholderia cepacia, S. aureus |
| Использование внутривенных наркотиков | S. aureus, анаэробы, S. pneumoniae |
| Контакт с кондиционерами, увлажнителями воздуха, системами охлаждения воды, недавнее (≤ 2 нед.) морское путешествие / проживание в гостинице | Legionella spp. |
| Тесный контакт с птицами | Сhlamidophila psittaci |
| Тесный контакт с домашними животными (например, работа на ферме) | Сoxiella burnetii |
| Коклюшеподобный кашель > 2 нед. | Bordetella pertussis |
| Локальная бронхиальная обструкция (например, бронхогенная карцинома) | Анаэробы, S. pneumoniae, H. influenzae, S. aureus |
| Пребывание в домах престарелых | S. pneumoniae, энтеробактерии, H. influenzae, S. aureus, C. pneumoniae, анаэробы |
| Вспышка в организованном коллективе | S. pneumoniae, M. pneumoniae, C. pneumoniae, вирусы |
Частота выявления респираторных вирусов у пациентов с ВП носит выраженный сезонный или эпидемический характер. Различают первичную вирусную пневмонию (развивается в результате непосредственного вирусного повреждения легких) и вторичную бактериальную пневмонию, которая может сочетаться с первичным вирусным поражением легких или быть самостоятельным поздним осложнением респираторной вирусной инфекции (в первую очередь гриппа).
При вирусной пневмонии тяжелое течение характерно для лиц пожилого и старческого возраста, при наличии сопутствующих бронхолегочных, сердечно-сосудистых заболеваний [21–23].
У 10–30 % пациентов с ВП выявляется смешанная или коинфекция, которая может быть вызвана ассоциацией различных бактериальных возбудителей (например, S. pneumoniae с H. influenzae или M. pneumoniae), либо их сочетанием с респираторными вирусами [17, 18, 23–25].
Выделение из мокроты таких микроорганизмов, как коагулазонегативные стафилококки, стрептококки группы viridans, энтерококки, Neisseria spp., Candida spp. с высокой степенью вероятности свидетельствует о контаминации материала микрофлорой верхних отделов дыхательных путей [26].
В РФ отмечается снижение чувствительности пневмококков к β-лактамным антибиотикам. Так, частота резистентности высокого уровня при сравнении периодов 2000–2003 гг. и 2014–2017 гг. Возросла для пенициллина с 0 до 6,3 % (5,8 vs 27,9 % чувствительны при увеличенной экспозиции), для аминопенициллинов — c 0,9 до 14,3 %, для цефтриаксона — с 0,2 до 5,4 % [27]. В целом наиболее активным в отношении S. pneumoniae β-лактамом, включая штаммы, устойчивые к бензилпенициллину, аминопенициллинам и цефтриаксону, являлся цефтаролина фосамил.
Около 30 % изолятов S. pneumoniae в РФ устойчивы к макролидам; к респираторным хинолонам (РХ) большинство штаммов чувствительно; к линезолиду и ванкомицину устойчивых штаммов выявлено не было (табл. 3).
Таблица 3. Чувствительность клинических изолятов S. pneumoniae к антибактериальным препаратам в РФ (многоцентровое исследование ПеГАС, 2014–2017 гг., n = 519) [28]
Table 3. Antimicrobial resistance of clinical S. pneumoniae isolates In Russia; the results of multicenter epidemiological study “PEHASus 2014-2017”, n = 519) [28]
| Антибактериальный препарат | Распределение изолятов по категориям, % | МПК, мг/л | |||
|---|---|---|---|---|---|
| Ч | У | Р | 50 % | 90 % | |
| Азитромицин | 67,8 | 1,2 | 31,0 | 0,06 | 128 |
| Ампициллин* | 74,8 | 11,0 | 14,3 | 0,03 | 4 |
| Бензилпенициллин | 65,1 | 28,9 | 6,0 | 0,03 | 2 |
| Ванкомицин | 100,0 | 0 | 0 | 0,25 | 0,25 |
| Кларитромицин | 68,6 | 2,9 | 28,5 | 0,03 | 128 |
| Клиндамицин | 85,9 | 0 | 14,1 | 0,03 | 128 |
| Ко-тримоксазол | 59,0 | 7,3 | 33,7 | 1 | 8 |
| Левофлоксацин | 99,6 | 0 | 0,4 | 0,5 | 1,0 |
| Линезолид | 100,0 | 0 | 0 | 0,5 | 1 |
| Моксифлоксацин | 99,6 | 0 | 0,4 | 0,06 | 0,125 |
| Тетрациклин | 66,1 | 0,8 | 33,1 | 0,125 | 16 |
| Цефтриаксон | 79,0 | 15,6 | 5,4 | 0,03 | 2 |
| Цефтаролин | 98,1 | 0 | 1,9 | 0,008 | 0,125 |
| Эртапенем | 93,6 | 0 | 6,4 | 0,015 | 0,5 |
| * Результат применим для амоксициллина и амоксициллина/клавуланата.
МПК — минимальная подавляющая концентрация; Р — резистентные (согласно критериям EUCAST v. 9.0); У — чувствительные при увеличенной экспозиции; Ч — чувствительные. |
|||||
Факторами риска выявления пенициллинорезистентных пневмококков (ПРП) являются проживание или недавнее посещение регионов с высокой частотой ПРП, возраст старше 65 лет, лечение β-лактамами в предшествующие 3 мес., серьезные хронические сопутствующие заболевания, алкоголизм, иммунодефицит или иммуносупрессивная терапия, тесный контакт с детьми, посещающими дошкольные учреждения [29, 30].
Проблемой, способной оказать существенное влияние на стратегию эмпирической АБТ ТВП, является распространение внебольничных метициллинорезистентных S. aureus (MRSA) [31, 32]. За период 2010–2017 гг. устойчивыми к оксациллину были 6,9 % внебольничных изолятов S. aureus [27].
Помимо общепринятых оценки жалоб, социального статуса и семейно-бытовых условий, сбора полного медицинского, эпидемиологического и профессионального анамнеза, общего осмотра, определения показателей жизненно важных функций (число дыхательных движений, число сердечных сокращений, артериальное давление, температура тела, уровень сознания) и физикального обследования грудной клетки, клинического и биохимического анализа крови, всем пациентам с ВП рекомендуется пульсоксиметрия с измерением сатурации (SpO2) для выявления ДН и оценки выраженности гипоксемии. Пульсоксиметрия служит простым и надежным скрининговым методом, позволяющим выявлять пациентов с гипоксемией, нуждающихся в респираторной поддержке, и оценивать ее эффективность [33–35]. Необходимость пульсоксиметрии на догоспитальном этапе или на уровне приемного отделения стала особенно очевидной во время пандемии НКИ COVID-19. Определение насыщения гемоглобина кислородом по пульсоксиметру прочно вошло в повседневную клиническую практику российских терапевтов и врачей общей практики. Задержка оценки гипоксемии при поступлении в стационар пациентов с ТВП является независимым предиктором неблагоприятного исхода [36].
В случае снижения SрO2 < 90 % по данным пульсоксиметрии рекомендуется исследование газов артериальной крови, что позволяет более точно определить наличие и выраженность ДН и метаболических нарушений, оптимизировать респираторную поддержку. Повышение уровня лактата артериальной крови является маркером гипоперфузии и неблагоприятного прогноза при ТВП [37, 38]. Кроме того, лактат при пороговом значении > 2 ммоль/л, определяемый при госпитализации, повышает точность прогностической шкалы qSOFA (Quick Sepsis Organ Failure Assessment) при ТВП [39].
В настоящее время всем пациентам с ТВП настоятельно рекомендуется исследование уровня С-реактивного белка (СРБ) в сыворотке крови в рамках первичной диагностики и при динамическом наблюдении. Установлено, что уровень СРБ коррелирует с тяжестью течения, распространенностью воспалительной инфильтрации и прогнозом при ВП [29, 40–43]. Будучи высокочувствительным маркером воспалительного процесса, СРБ обладает недостаточной специфичностью для диагностики инфекционной природы воспаления. Наиболее ценным с практической точки зрения является исследование уровня СРБ у лиц с неопределенным диагнозом ТВП (отсутствие воспалительной инфильтрации у пациентов с характерным анамнезом, жалобами и локальными симптомами, свидетельствующими в пользу легочной консолидации); при концентрации > 100 мг/л его специфичность в подтверждении диагноза превышает 90 %. Напротив, при концентрации < 20 мг/л диагноз пневмонии является маловероятным. Повышение концентрации или отсутствие значимого снижения (менее чем на 50 %) уровня СРБ на фоне АБТ у госпитализированных пациентов с ВП является предиктором более высокой летальности [41].
Наряду с определением концентрации СРБ имеющиеся на сегодняшний день данные свидетельствуют об актуальности исследования уровня прокальцитонина (ПКТ) в сыворотке крови. Установлено, что ПКТ наиболее значимо повышается при пневмонии тяжелого течения и пневмококковой этиологии заболевания [44, 45]. По данным систематического обзора рандомизированных клинических исследований (РКИ), использование ПКТ в диагностическом алгоритме при респираторных инфекциях приводило к уменьшению частоты и сокращению длительности АБТ, нежелательных лекарственных реакций, связанных с применением антибиотиков, и летальности, однако в исследования включались преимущественно пациенты без ВП [46]. Определение ПКТ также значимо сокращало продолжительность применения АБП и летальность у пациентов ОРИТ с вероятной бактериальной инфекцией [47]. Сравнительные исследования СРБ и ПКТ у пациентов с ВП, в т. ч. тяжелого течения, остаются немногочисленными. ПКТ не продемонстрировал преимуществ по сравнению с СРБ как предиктор 28-дневной летальности при ВП, в т. ч. при комбинировании его с прогностическими шкалами CURB-65 (tool based on confusion, urea level, respiratory rate, blood pressure, and age > 65 years) и PSI (pneumonia severity index) [48]. У пожилых коморбидных больных в ретроспективном исследовании СРБ характеризовался более высокой чувствительностью в диагностике ВП, чем ПКТ [42]. Не до конца определенным остается пороговое значение ПКТ, которым можно руководствоваться при дифференциации вирусной и бактериальной этиологии ВП и, соответственно, назначении АБП. Наиболее часто в качестве «точки отсечения» предлагают использовать 0,5 нг/мл.
Современные рекомендации настаивают на необходимости этиологической расшифровки каждого случая ТВП. Микробиологическая диагностика при ТВП включает культуральное исследование мокроты или других респираторных образцов — трахеальный аспират и др., венозной крови, плеврального выпота (при его наличии), экспресс-тесты по выявлению пневмококковой и легионеллезной антигенурии, полимеразную цепную реакцию (ПЦР) для выявления респираторных вирусов [26, 49, 50].
Микробиологическое исследование респираторного секрета должно состоять из бактериоскопии и культурального исследования. Бактериоскопия позволяет выявить контаминацию образца микрофлорой полости рта и верхних дыхательных путей, а также предварительно определить тип микрофлоры (грамположительные кокки, грамотрицательные палочки) и оценить микробную нагрузку.
Важность микробиологического исследования крови обусловлена тем, что обнаружение возбудителя в крови, при тщательном соблюдении правил взятия, хранения и транспортировки образцов, является доказательством его этиологической роли. Бактериемия встречается при инфицировании разными возбудителями (энтеробактерии, P. aeruginosa, S. aureus), но наиболее характерна для ТВП пневмококковой этиологии [12, 17, 20]. Культуральное исследование крови при высокой специфичности отличается низкой чувствительностью — частота положительных результатов гемокультуры варьируется от 5 до 30 % [12, 20, 51].
При наличии соответствующих клинических и/или эпидемиологических данных рекомендуется исследование респираторного образца (предпочтительно мокрота или трахеальный аспират, при невозможности — комбинированный респираторный мазок) на вирусы гриппа и другие респираторные вирусы, включая возбудитель COVID-19. Основным методом идентификации респираторных вирусов в настоящее время является ПЦР и ее модификации [21, 22, 52]. Существующие тест-системы позволяют выявлять вирусы гриппа А и В, определить субтип вирусов гриппа А, например, выявить пандемический вариант A/H1N1pdm2009 и высоко патогенный вирус гриппа птиц А/H5N [26, 50]. Основным преимуществом экспресс-тестов для выявления антигенов гриппа А и Б в респираторных образцах, основанных на иммуноферментном анализе или иммунохроматографическом методе [50], является возможность выполнения «у постели больного». Вместе с тем они характеризуются вариабельной чувствительностью и специфичностью, в связи с чем могут использоваться только в качестве скрининговых тестов с необходимостью дальнейшего подтверждения результатов исследования более точными методами, в частности ПЦР [53].
Инструментальная диагностика при ВП включает лучевые методы исследования — рентгенографию, компьютерную томографию (КТ) органов грудной клетки (ОГК), пульсоксиметрию, ультразвуковые исследования (УЗИ), электрокардиографическое исследование, по показаниям — фибробронхоскопию.
Всем пациентам с подозрением на ВП в качестве скринингового исследования рекомендуется обзорная рентгенография ОГК в передней прямой и боковой проекциях (при неизвестной локализации воспалительного процесса целесообразно выполнять снимок в правой боковой проекции). В качестве метода выбора среди визуализирующих методов исследования при тяжелой форме заболевания показана КТ ОГК высокого разрешения, которая отличается более высокими чувствительностью и специфичностью в диагностике ВП по сравнению с рентгенографией ОГК. В одном из проспективных исследований раннее выполнение КТ ОГК у госпитализированных больных оказывало значимое влияние на диагностику и лечение ВП [54]. КТ ОГК целесообразно выполнять у больных с высокой вероятностью ВП и отсутствием инфильтрации при рентгенографии ОГК, а также получении изображений, которые нельзя однозначно трактовать как инфильтрацию, обусловленную пневмонией [55].
В последние годы накапливаются данные о высокой информативности УЗИ легких для диагностики пневмонии, которое, при выполнении опытным специалистом, по диагностической точности не уступает лучевым методам исследования. Исследование выполняют по специальному протоколу [56–59]. Неинвазивность, быстрота выполнения, доступность, отсутствие необходимости в транспортировке больных позволяют рассматривать УЗИ легких как «прикроватный» метод диагностики пневмонии, который особенно актуален у больных ОРИТ при невозможности выполнения/недоступности КТ ОГК в случае высокой клинической вероятности пневмонии, но отсутствия инфильтрации на рентгенограммах ОГК [60]. Метод также может эффективно использоваться для оценки прогрессирования ТВП и оценки ответа на проводимую терапию.
Несвоевременная госпитализация или перевод в ОРИТ существенно ухудшают результаты лечения пациентов с ВП [61]. Одним из наиболее эффективных инструментов для определения показаний к направлению в ОРИТ являются критерии IDSA/ATS (Американского общества по инфекционным болезням и Американского торакального общества) [62], а также шкала SMART-COP (tool based on systolic blood pressure, multilobar chest radiography involvement, albumin level, respiratory rate, tachycardia, confusion, oxygenation, and arterial pH) [63], максимально учитывающие проявления сепсис-индуцированной органной дисфункции и дыхательные расстройства.
Ведущую роль в программе лечения ТВП играет своевременная и адекватная АМТ. Всем пациентам с определенным диагнозом ТВП рекомендуется внутривенное назначение системных АБП в как можно более ранние сроки (не позднее 4 ч с момента установления диагноза, 1 ч — при ТВП, осложненной септическим шоком).
Установлено, что системная АБТ при своевременном назначении и адекватном выборе препаратов улучшает прогноз. При ВП у госпитализированных больных отсрочка c назначением АБП на 4–8 ч приводит к росту летальности [64–67]. В случае развития септического шока время начала АБТ в клинических руководствах рекомендуется сократить до 1 ч, т. к. это осложнение наиболее значимо ухудшает прогноз [16, 68, 69].
Комбинированная АБТ остается более предпочтительной стратегией с точки зрения прогноза как при пневмококковой ВП, так и при ТВП непневмококковой этиологии, при этом наибольшее количество исследований демонстрировали преимущества при включении в состав комбинированной терапии макролидов [70–73]. Отдельных клинических исследований, а также наличия у РХ активности в отношении большинства возбудителей ТВП [74, 75], по мнению экспертов, недостаточно для того, чтобы рекомендовать эмпирическую монотерапию ТВП РХ, т. к. ее эффективность не изучалась у наиболее тяжелых больных (ИВЛ, потребность в вазопрессорах).
Стартовую АБТ ТВП рекомендуется назначать эмпирически с учетом факторов, определяющих спектр потенциальных возбудителей и их чувствительность к АБП; при стратификации больных необходимо учитывать риск инфицирования ПРП, редкими возбудителями (P. aeruginosa, MRSA, продуцирующие β-лактамазы расширенного спектра [БЛРС] энтеробактерии) и предполагаемую/документированную аспирацию (см. табл. 2).
Эмпирическая АБТ предусматривает назначение препаратов, активных в отношении наиболее вероятных «типичных» бактериальных возбудителей ТВП и L. pneumophila [33, 34, 49, 76]. Рекомендованные режимы АБТ в целом характеризуются сопоставимой эффективностью, выбор в конкретной клинической ситуации определяется дополнительными факторами — переносимостью, сопутствующими заболеваниями, риском лекарственных взаимодействий, затратной эффективностью и др.
Пациентам с ТВП без дополнительных факторов риска рекомендуется комбинация антипневмококкового β-лактамного антибиотика, такого как ингибиторозащищенный аминопенициллин (ИЗП), цефалоспорин без антисинегнойной активности (цефотаксим, цефтриаксон, цефтаролина фосамил) в комбинации с макролидом (антибиотикотерапия выбора) или респираторным фторхинолоном (альтернатива). Необходимо отметить невысокую активность цефотаксима и цефтриаксона в отношении S. aureus. Их назначение лицам с факторами риска инфицирования данным возбудителем (грипп, использование в/в наркотиков, декомпенсированный сахарный диабет, инфекции кожи и мягких тканей) при ТВП должно быть ограничено. При назначении макролидов и РХ необходим регулярный мониторинг электрокардиограммы в связи с потенциальным риском удлинения QT-сегмента и развитием жизнеугрожающих нарушений ритма.
Пациентам с ТВП и факторами риска инфицирования ПРП при назначении β-лактамных АБП рекомендуется отдавать предпочтение цефтаролина фосамилу; цефотаксим и цефтриаксон должны использоваться в максимальных суточных дозах.
Цефтаролина фосамил превосходит in vitro другие β-лактамные АБП по активности против S. pneumoniae, в т. ч. ПРП, а в РКИ в субпопуляции больных пневмококковой ВП характеризовался более высокой клинической эффективностью в сравнении с цефтриаксоном [28, 77–79]. К факторам риска инфицирования ПРП относят проживание или недавнее посещение регионов с высокой частотой ПРП, возраст старше 65 лет, лечение β-лактамными АБП в предшествующие 3 мес., серьезные хронические сопутствующие заболевания, алкоголизм, иммунодефицит или иммуносупрессивная терапия, тесный контакт с детьми, посещающими дошкольные учреждения.
Пациентам с ТВП и факторами риска инфицирования P. aeruginosa рекомендуется комбинация антисинегнойного β-лактама, обладающего также антипневмококковой активностью (пиперациллин/тазобактам, цефепим, имипенем, меропенем), с ципрофлоксацином или левофлоксацином (антибиотикотерапия выбора) или макролидом (альтернатива) с возможным добавлением амикацина.
P. aeruginosa не является частым возбудителям ТВП, однако выявление данного микроорганизма ассоциируется с возрастанием летальности, поэтому назначение АБП с антисинегнойной активностью лицам из группы риска может улучшать исходы лечения [80]. К факторам риска инфицирования P. aeruginosa относятся длительная терапия системными глюкокортикостероидами в фармакодинамических дозах (> 10 мг/сут при расчете на преднизолон), муковисцидоз, бронхоэктазы, недавний прием системных АБП, особенно нескольких курсов [16, 34].
Пациентам с ТВП и факторами риска инфицирования MRSA в случае назначения ИЗП, цефотаксима или цефтриаксона дополнительно к стандартной АБТ рекомендуется назначение линезолида или ванкомицина либо использование комбинации цефтаролина фосамила с макролидом или РХ. Цефтаролина фосамил — единственный β-лактамный антибиотик, высокоактивный в отношении большинства изолятов MRSA, поэтому при его назначении добавление линезолида или ванкомицина не требуется.
Факторами риска инфицирования MRSA являются колонизация или инфекция, вызванная данным возбудителем в анамнезе, недавно перенесенные оперативные вмешательства, госпитализации или пребывание в доме престарелых, наличие постоянного в/в катетера, диализ, предшествующая АБТ [81].
Пациентам с ТВП и факторами риска инфицирования энтеробактериями, продуцирующими БЛРС, рекомендуется комбинация карбапенема (имипенем, меропенем, эртапенем) с макролидом (антибиотикотерапия выбора) или респираторным фторхинолоном (альтернатива).
Распространенность БЛРС-продуцирующих энтеробактерий у пациентов с ВП варьируется в разных странах [82–84]. Частота выявления данной группы возбудителей при ТВП в РФ неизвестна. Однако, учитывая рост в популяции доли лиц старческого возраста со множественными сопутствующими заболеваниями, частыми госпитализациями и применением АБП, актуальность данной проблемы может значимо возрасти в ближайшие годы. Карбапенемы обладают высокой активностью в отношении БЛРС-продуцирующих энтеробактерий и являются препаратами выбора при наличии факторов риска инфицирования данными возбудителями. Последние для лиц с ВП окончательно не установлены, при инфекциях другой локализации к ним, в частности, относят недавнюю госпитализацию и применение системных АБП (в предшествующие 3 мес.), старческий возраст, наличие сахарного диабета, инфекцию в анамнезе, вызванную БЛРС-продуцирующими энтеробактериями [85, 86].
В последние годы появилась концепция объединения «проблемных» возбудителей ТВП в единую группу (P. aeruginosa, БЛРС-продуцирующие энтеробактерии и MRSA, англоязычная аббревиатура PES). Это обусловлено наличием многих общих факторов риска инфицирования данными патогенами (например, недавняя госпитализация и системная АБТ, пребывание в домах престарелых/учреждениях длительного ухода) [87, 88]. Оценка риска выявления любого из микроорганизмов этой группы свидетельствует о необходимости назначения отличных от стандартных режимов АБТ. Так, при выявлении у пациента с ТВП одновременно факторов риска инфицирования P. aeruginosa, БЛРС-продуцирующих энтеробактерий и MRSA оптимальной стратегией будет являться комбинация карбапенема с антисинегнойной активностью (меропенем, имипенем) с макролидом и линезолидом.
При наличии аллергических реакций немедленного типа на любой β-лактам их назначение противопоказано, предпочтение нужно отдавать АБП с другой химической структурой. Например, может быть назначен РХ (мокси- или левофлоксацин) в комбинации с линезолидом или ванкомицином. Однако оптимальные режимы АБТ для таких пациентов не определены. При другом типе аллергических реакций на пенициллины с осторожностью могут назначаться цефалоспорины и карбапенемы.
Всем пациентам с ТВП при подтвержденном гриппе или наличии клинических/эпидемиологических данных, предполагающих вероятное инфицирование вирусами гриппа, в дополнение к АБТ рекомендуется назначение ингибиторов нейраминидазы (осельтамивир, занамивир).
Вирусы гриппа имеют существенное клиническое значение при ТВП, особенно в период подъема заболеваемости/эпидемии в конкретном регионе. Ряд наблюдательных исследований свидетельствует об улучшении прогноза у госпитализированных пациентов с подтвержденным гриппом при назначении осельтамивира [89, 90]. Раннее начало терапии (в течение 2 дней с момента появления симптомов или госпитализации) может быть более эффективным, однако преимущества сохраняются и при более позднем начале лечения (4–5 дней после появления симптомов) [89, 91, 92]. Ингибиторы нейраминидазы могут назначаться эмпирически пациентам с ТВП в критическом состоянии, в период сезонного подъема заболеваемости гриппом в регионе [16, 19]. При эмпирическом назначении противовирусную терапию целесообразно отменить в случае отрицательного результата исследования респираторных образцов на вирусы гриппа методом ПЦР. У пациентов, нуждающихся в ИВЛ, при наличии бронхообструктивных заболеваний предпочтение следует отдавать осельтамивиру.
Инфицирование вирусом гриппа оказывает влияние на структуру бактериальных возбудителей ТВП в случае коинфекции или суперинфекции. Наиболее частыми возбудителями ВП при гриппе помимо самого вируса являются S. pneumoniae, S. aureus (в т. ч. MRSA), H. influenzae [6, 19, 93, 94]. Предпочтение в данном случае следует отдавать цефтаролина фосамилу или ИЗП. Цефтаролина фосамил активен in vitro в отношении как метициллин-чувствительных золотистых стафилококков (MSSA), так и большинства изолятов MRSA [78]; по данным метаанализа РКИ при пневмонии, вызванной MSSA, по клинической эффективности препарат превосходил цефтриаксон [95].
Антимикробная терапия ТВП, вызванной другими респираторными вирусами, в настоящее время не разработана. Лечение пневмонии, ассоциированной с COVID-19, не рассматривается в данном обзоре и регламентируется отдельными клиническими рекомендациями [52].
Всем пациентам с ТВП через 48 ч после начала лечения рекомендуется оценка эффективности и безопасности, а также пересмотр стартового режима АБТ c возможной его деэскалацией.
Основными критериями эффективности АБТ в ранние сроки являются снижение температуры и основных клинических симптомов и признаков ВП, ОДН, других проявлений полиорганной дисфункции. Если у пациента сохраняется системная воспалительная реакция, прогрессируют симптомы и признаки ВП или развиваются осложнения, АБТ следует расценивать как неэффективную [33, 34, 96]. В этом случае, а также при появлении нежелательных лекарственных реакций, требующих отмены АБП, необходимо пересмотреть тактику лечения.
При неэффективности АБТ на втором этапе необходимо провести обследование пациента для уточнения диагноза, выявления возможных осложнений ВП и проанализировать результаты доступных к этому моменту микробиологических исследований. При наличии результатов данных исследований целесообразно рассмотреть деэскалацию АБТ с назначением препаратов, обладающих наиболее высокой активностью в отношении выделенного возбудителя и документированной эффективностью в клинических исследованиях [16, 97].
В исследованиях пациентов ОРИТ с тяжелыми инфекциями деэскалация являлась эффективной и безопасной стратегией, использование которой сопровождалось сокращением длительности госпитализации, продолжительности АБТ и частоты АБ-ассоциированных осложнений [98, 99].
Всем пациентам с ТВП рекомендуется перевод с в/в на пероральный прием АБП при достижении критериев клинической стабильности (должны присутствовать все нижеперечисленные):
Цель ступенчатой антибиотикотерапии заключается в уменьшении длительности парентеральной АБТ ВП, что обеспечивает сокращение сроков пребывания пациента в стационаре и риска осложнений, уменьшение стоимости лечения при сохранении высокой клинической эффективности. Оптимальным вариантом ступенчатой АБТ является последовательное использование двух лекарственных форм (для в/в введения и приема внутрь) одного и того же АБП; возможно последовательное применение препаратов, близких по своим антимикробным свойствам [96].
Продолжительность АБТ ТВП определяется индивидуально; при решении вопроса об отмене АБП при ТВП рекомендуется руководствоваться критериями достаточности АБТ (должны присутствовать все):
Продолжительность АБТ ТВП зависит от множества факторов, включая этиологию, сопутствующие заболевания, возраст, наличие осложнений, сроки ответа на стартовый режим АБТ и др. [49, 97].
Метаанализы, оценивавшие исходы лечения ВП относительно коротким (< 6 дней) и более длительным (> 7 дней) курсом АБТ, не выявили различий между группами с точки зрения клинической эффективности, в т. ч. среди субпопуляции больных с ТВП [100, 101]. При этом у пациентов с ВП, не достигавших критериев клинической стабильности к 5-му дню АБТ, наблюдалась более высокая летальность [102, 103].
По мнению экспертов, для большинства больных ТВП достаточным является 7-дневный курс АБТ. Более длительные курсы (до 10–14 дней и более) можно использовать при развитии осложнений заболевания (эмпиема, абсцесс), наличии внелегочных очагов инфекции, стафилококковой бактериемии, инфицировании P. aeruginosa [16, 49, 97]. Длительность применения противовирусных препаратов (осельтамивир, занамивир) при ТВП обычно составляет 5–10 дней [16, 19].
Несмотря на эмпирический выбор АБП для стартовой терапии, при ТВП должны быть предприняты максимальные усилия, направленные на установление этиологии заболевания с последующей деэскалацией АБТ с включением в режимы препаратов, наиболее активных в отношении выявленного возбудителя. Рекомендации по выбору АБП в случае выявления конкретного возбудителя ТВП представлены в табл. 4.
Таблица 4. Российские и международные рекомендации по этиотропной терапии ТВП [33, 34, 49, 76]
Table 4. Russian and international recommendations on pathogen-specific antimicrobial therapy in patients with severe community-acquired pneumonia [33, 34, 49, 76]
| Возбудитель | Препараты выбора | Альтернативные препараты |
|---|---|---|
| S. pneumoniae
пенициллин-чувствительные штаммы1 |
Пенициллины: Ампициллин, Амоксициллин/клавуланат (при недоступности ампициллина) | Цефалоспорины: Цефотаксим, Цефтриаксон, Цефтаролин
Хинолоны: Левофлоксацин, Моксифлоксацин Линезолид |
| S. pneumoniae
пенициллинорезистентные штаммы2 |
Цефалоспорины: Цефтаролин
Хинолоны: Моксифлоксацин Линезолид |
Цефалоспорины: Цефотаксим3, Цефтриаксон3
Карбапенемы: Имипенем, Меропенем, Эртапенем Хинолоны: Левофлоксацин |
| C. pneumoniae,
C. psittaci |
Доксициклин | Хинолоны: Левофлоксацин, Моксифлоксацин
Макролиды: Азитромицин, Кларитромицин |
| H. influenzae | Пенициллины: Ампициллин/сульбактам, Амоксициллин/клавуланат
Цефалоспорины: Цефепим, Цефотаксим, Цефтаролин, Цефтриаксон Хинолоны: Левофлоксацин, Моксифлоксацин, Ципрофлоксацин |
Карбапенемы: Эртапенем |
| S. aureus
метициллин-чувствительные штаммы |
Пенициллины: Оксациллин
Цефалоспорины: Цефазолин, Цефтаролин |
Линезолид
Пенициллины: Ампициллин/сульбактам, Амоксициллин/клавуланат Хинолоны: Левофлоксацин, Моксифлоксацин |
| S. aureus метициллинорезистентные штаммы | Линезолид | Ванкомицин4
Цефтаролин |
| Legionella spp. | Левофлоксацин ±
Рифампицин Азитромицин ± Рифампицин |
Доксициклин ±
Рифампицин |
| Enterobacterales (БЛРС–) | Цефалоспорины: Цефепим, Цефотаксим, Цефтаролин, Цефтриаксон | Карбапенемы: Имипенем, Меропенем, Эртапенем
Хинолоны5: Левофлоксацин, Моксифлоксацин, Ципрофлоксацин |
| Enterobacterales (БЛРС+) | Карбапенемы: Имипенем, Меропенем, Эртапенем | Цефтазидим/авибактам6 |
| P. aeruginosa7 | Цефалоспорины: Цефепим, Цефтазидим
Карбапенемы: Имипенем, Меропенем Пиперациллин/тазобактам Ципрофлоксацин Цефтолозан/тазобактам6 ± Амикацин |
|
| C. burnetii | Доксициклин | Респираторные хинолоны: Левофлоксацин, Моксифлоксацин |
| 1 Рекомендовано проводить скрининг чувствительности S. pneumoniae к бензилпенициллину (диск 1 мкг оксациллина или определение МПК бензилпенициллина); в случае чувствительности к бензилпенициллину изолят рассматривается как чувствительный ко всем антипневмококковым β-лактамам; в случае резистентности необходимо определение МПК каждого АБП.
2 Выбор оптимальной терапии целесообразно проводить с учетом определения МПК каждого конкретного β-лактама. 3 Цефотаксим должен назначаться в дозе не менее 6 г/сут, цефтриаксон — 4 г/сут. 4 Эффективность ванкомицина документирована в случае MRSA с МПК ≤ 1 мкг/мл; при МПК 1,5 или 2 мкг/мл обосновано увеличение суточной дозы или назначение других АБП. 5 Только при подтвержденной чувствительности возбудителя. 6 По данному показанию не зарегистрирован, назначается только при отсутствии терапевтических альтернатив. 7 Надежных режимов АБТ P. aeruginosa не существует, необходимо ориентироваться на результаты определения чувствительности возбудителя в конкретной клинической ситуации. |
||
Среди пациентов с ТВП, госпитализированных в ОРИТ, потребность в проведении ИВЛ составляет от 25 до 67 %, неинвазивной вентиляции легких (НИВЛ) — от 56 до 63 % [12–14, 104, 105]. Для прогноза потребности в респираторной поддержке у пациентов с ВП рекомендовано использовать шкалу SMART-COP. По данным когортного исследования, оценка по шкале SMART-COP 5 баллов и более прогнозирует необходимость респираторной и/или катехоламиновой поддержки у 92 % пациентов с ВП [63].
Целевым значением SрO2 при проведении респираторной поддержки является 92–96 % и PaO2 65–80 мм рт. cт. (для пациентов с ХОБЛ и другими хроническими респираторными заболеваниями — SрO2 88–92 % и PaO2 55–80 мм рт. ст.).
В многоцентровом РКИ, сравнивающем целевое значение PaO2 55–70 мм рт. ст. (SpO2 88–92 %) с PaO2 90–105 мм рт. ст. (SpO2 > или = 96 %) у пациентов с острым респираторным дистресс-синдромом (ОРДС) (преимущественно, первичным), использование более низкой цели по оксигенации было ассоциировано с повышенной летальностью [106].
Пациентам с ВП и SрО2 < 90 % или PaО2 < 60 мм рт. ст. рекомендовано проведение стандартной кислородотерапии в качестве терапии первой линии [107]. Абсолютно необходимым условием для проведения кислородотерапии является сохранение проходимости дыхательных путей. Оксигенотерапия не должна использоваться вместо респираторной поддержки, если имеются показания к применению последней.
При изолированной гипоксемии интубация трахеи и проведение ИВЛ не рекомендуются. Известно, что изолированная гипоксемия не является синонимом гипоксии и обычно поддается компенсации при помощи оксигенотерапии [108, 109].
К показаниям для перевода на ИВЛ относят повышенную работу дыхания, признаками которой являются не столько тахипноэ, сколько вовлечение вспомогательных дыхательных мышц (прежде всего, мышц шеи — грудино-ключично-сосцевидной и лестничных), а также усталость пациента. Более сложным (и более точным) параметром является оценка градиента пищеводного или плеврального давления.
У пациентов с ТВП и гипоксемией и/или видимой работой дыхания на фоне стандартной кислородотерапии рекомендовано применение высокопоточной назальной оксигенации (ВПО) или НИВЛ. В основе клинической эффективности ВПО лежит возможность создания высокой скорости потока газа (до 60 л/мин) [110]. Важно, что положительные респираторные эффекты высокой скорости потока газа не сопровождаются ухудшением кардиогемодинамики.
Рандомизированное контролируемое исследование FLORALI, в которое были включены пациенты с ВП (> 60 %), госпитальной пневмонией и пневмонией при иммуносупрессии и исходным индексом PaO2/FiO2 (отношение парциального давления кислорода в артериальной крови к содержанию кислорода во вдыхаемой смеси) около 150 мм рт. cт., продемонстрировало уменьшение частоты интубации трахеи и увеличение выживаемости в группе ВПО по сравнению со стандартной оксигенотерапией и оксигенотерапией с сеансами НИВЛ [111].
НИВЛ по сравнению с ВПО может в большей степени улучшать оксигенацию и снижать инспираторное усилие, особенно у пациентов с более тяжелой гипоксемией и с более высокой работой дыхания [112]. НИВЛ также приводит к снижению нагрузки на дыхательную мускулатуру, основным компонентом для снижения работы дыхания при НИВЛ является положительное давление на вдохе [113]. В РКИ у больных с ТВП применение НВЛ в режиме «Continuous Positive Airway Pressure» значимо улучшало оксигенацию артериальной крови по сравнению со стандартной кислородотерапией [114] и приводило к снижению потребности в интубации трахеи и ИВЛ [115].
В метаанализе, включавшем 25 исследований с участием 3804 пациентов с гипоксемической ОДН (преимущественно ВП), использование НИВЛ с помощью шлемов (отношение риска [ОР] 0,26) и лицевых масок (ОР 0,76) было ассоциировано с более низким риском интубации трахеи и госпитальной летальности по сравнению со стандартной кислородотерапией [116].
При применении НИВЛ у пациентов с ТВП рекомендован мониторинг выдыхаемого дыхательного объема (ДО) и инспираторного усилия; цель — ДО < 10 мл/кг идеальной массы тела (ИМТ) и снижение амплитуды видимых экскурсий грудной клетки. В анализе РКИ и обсервационном исследовании продемонстрировано, что ДО > 10 мл/кг ИМТ являлся независимым предиктором неблагоприятного исхода [117, 118].
При проведении НИВЛ у пациентов с тяжелыми формами ВП нередко используется слишком высокое давление на вдохе, что приводит к повышению транспульмонального давления — разницы между конечно-инспираторным давлением и плевральным давлением на вдохе, что может привести к чрезмерному перерастяжению альвеол в негравитационно-зависимых зонах легких и увеличению альвеолярного мертвого пространства [119].
Пациентам с ТВП, гипоксемией и индексом PaO2/FiO2 < 150 мм рт. ст. при проведении ИВЛ показана вентиляция в положении лежа на животе в течение не менее 16 ч в сутки. Применение ИВЛ в прон-позиции в многоцентровом РКИ у интубированных пациентов с ОРДС преимущественно вследствие ВП и индексом PaO2/FiO2 < 150 мм рт. ст. привело к снижению 90-дневной летальности с 41 до 23,6 % [120]. Метаанализ исследований подтвердил полученные результаты [121]. ИВЛ в положении на здоровом боку у пациентов с односторонней пневмонией может приводить к улучшению оксигенации [122].
Данные об эффективности применения прон-позиции у неинтубированных пациентов ограничены. В ретроспективном исследовании применение самостоятельной прон-позиции у неинтубированных пациентов с ВП на фоне оксигенотерапии или НИВЛ приводило к улучшению оксигенации и позволило избежать интубации трахеи у 13 из 15 больных с исходным индексом PaO2/FiO2 около 100 мм рт. ст. [123].
У пациентов с ТВП показаниями для интубации трахеи являются: гипоксемия (SpO2 < 92 %), несмотря на высокопоточную оксигенотерапию или НИВЛ в положении лежа на животе с FiO2 100 %, нарастание видимой экскурсии грудной клетки и/или участие вспомогательных дыхательных мышц, несмотря на ВПО или НИВЛ в положении лежа на животе с FiO2 100 %, возбуждение или угнетение сознания, остановка дыхания, нестабильная гемодинамика. Показаниями для интубации трахеи и проведения ИВЛ при гипоксемической ОДН является не только и не столько гипоксемия, а целый комплекс нарушений, ассоциированных с полиорганной недостаточностью, сепсисом и полинейромиопатией критических состояний [108, 124]: нарушения сознания, нестабильная гемодинамика, шок, усталость дыхательной мускулатуры [125–127], диафрагмальная дисфункция [128], нарушение работы голосовых связок и/или нарушение откашливания мокроты [129], выраженные нарушения биомеханики дыхания — диффузное снижение податливости легочной ткани (большой объем поражения легочной ткани) и/или грудной стенки и/или увеличение сопротивления дыхательных путей [130, 131].
При прогрессировании пневмонии с развитием ОРДС пациентам показана инвазивная вентиляция легких вследствие выраженных нарушений биомеханики дыхания с использованием малых ДО (около 6 мл/кг ИМТ) [132–134] и минимально достаточным уровнем положительного давления в конце выдоха (РЕЕР), который приводит к улучшению оксигенации и не вызывает перерастяжения уже открытых альвеол [135]. Пациентам с ТВП при проведении ИВЛ рекомендовано применение «умеренного» уровня РЕЕР с его пошаговым увеличением в пределах 5–8–10 см вод. ст. Легкие при ВП (как и при первичном повреждении легких) малорекрутабельны, что обусловливает небольшой положительный эффект на оксигенацию от применения высоких давлений (в том числе РЕЕР) и высокий риск вентилятор-ассоциированного повреждения легких и острого легочного сердца [131, 136]. Многоцентровое РКИ ART продемонстрировало более высокую летальность в группе применения маневров рекрутирования альвеол и высокого РЕЕР (около 16 см вод. ст.) у пациентов с малорекрутабельными легкими вследствие ОРДС первичного генеза (пневмония, аспирация, ушиб легких) [137].
Пациентам с ТВП и сочетанием ОРДС тяжелой степени, малорекрутабельных легких и острого легочного сердца (или высокого риска острого легочного сердца) в первые 7 суток от начала развития ОРДС следует рассмотреть вопрос об инициации экстракорпоральной мембранной оксигенации (ЭКМО).
В многоцентровом РКИ EOLIA раннее (в первые 7 суток ИВЛ) применение ЭКМО у пациентов с ВП (бактериальной и вирусной) привело к снижению 60-дневной летальности (46 vs 35 %) и высокой частоте перехода на ЭКМО (28 %) в группе контроля [138]. ЭКМО в исследование EOLIA применяли по следующим показаниям:
На фоне проведения ЭКМО следует снизить ДО до сверхмалого (3–6 мл/кг ИМТ), частоту дыханий до 10–14 в мин, но оставить «умеренный» уровень РЕЕР для предотвращения коллапса альвеол и недопущения их перерастяжения [139].
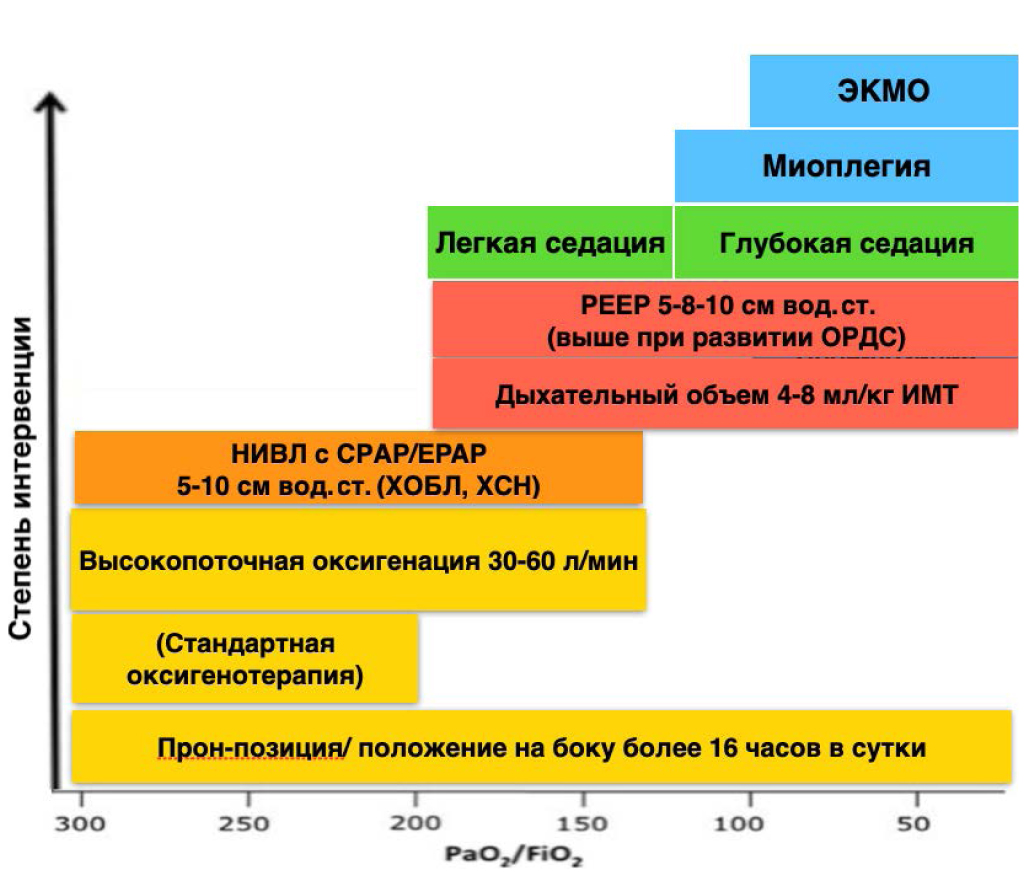
На основании патофизиологии ОДН и данных доказательных исследований можно представить следующую схему лечения гипоксемической ОДН при ВП (рис. 1).
Рис. 1. Респираторная терапия гипоксемической ОДН при тяжелой внебольничной пневмонии
Fig. 1. Respiratory therapy in hypoxemic acute respiratory failure in severe community-acquired pneumonia
X-axis — paO2/FiO2; Y-axis — degree of intervention.

В качестве адъювантной терапии при ТВП в тех случаях, когда адекватная гидратация и применение вазопрессоров не позволяют достичь гемодинамической стабильности, рекомендованы гидрокортизон в дозе 200–300 мг/сут [140, 141], а также парентеральные антикоагулянты [142] для профилактики тромбоэмболических осложнений.
Наиболее эффективными средствами профилактики ВП в настоящее время являются пневмококковые и гриппозные вакцины. С целью специфической профилактики пневмококковых инфекций, в т. ч. пневмококковой ВП у взрослых, используют вакцины двух типов: 23-валентная пневмококковая полисахаридная вакцина и 13-валентная пневмококковая конъюгированная вакцина [143–145]. В будущем станут доступны 15-валентная [146] и 20-валентная пневмококковые конъюгированные вакцины [147].
Принимая во внимание высокую медицинскую и социально-экономическую значимость проблемы, Федерация анестезиологов и реаниматологов России выступила с инициативой о разработке новых клинических рекомендаций по ТВП. В предложенном вашему вниманию обзоре приведены современные данные об эпидемиологии, этиологии, способах диагностики, лечения и профилактики ТВП, которые предполагается включить в обновляемый документ.
Целевой аудиторией новых рекомендаций должны стать прежде всего анестезиологи-реаниматологи, также они будут полезны для терапевтов, пульмонологов, клинических фармакологов и бактериологов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Все авторы в равной степени участвовали в получении и анализе фактических данных, написании и редактировании текста статьи, обосновании научной значимости, проверки и утверждении текста статьи.