
В конце 2019 г. мировая система здравоохранения столкнулась с недостаточно изученным, быстро распространяющимся заболеванием, проявляющимся мультисистемными изменениями и имеющим относительно высокую долю тяжелобольных пациентов. Всего лишь несколько месяцев спустя лавинообразное распространение инфекции, вызванной вирусом SARS-CoV-2, привело к объявлению Всемирной организацией здравоохранения пандемии коронавирусной инфекции (COVID-19). Первыми типичными клиническими проявлениями заболевания становятся лихорадка, миалгия, утомляемость, непродуктивный кашель; реже манифестируют гастроинтестинальные симптомы. В случае тяжелого течения прогрессирование инфекционного процесса ведет к нарастанию дыхательной недостаточности, сопровождается рентгенологической картиной, аналогичной таковой при вирусной пневмонии, развивается острый респираторный дистресс-синдром (ОРДС), прогрессирует полиорганная недостаточность [1]. Ссылаясь на анализ данных обширной когорты больных COVID-19, Berlin et al. указывают на тяжелое течение заболевания у 14 % пациентов, в то время как на долю критически больных приходится около 5 %. В указанной группе риск развития тяжелой полиорганной недостаточности наиболее высок, летальность же достигает 50 % [2].
На ранних этапах развития пандемии выработана стратегия лечения, основанная на опыте эпидемий ближневосточного респираторного синдрома, вызываемого вирусом MERS-CoV (2012 г.), атипичной пневмонии, возбудителем которой является коронавирус SARS-CoV (2002 г.). Таким образом, исходная доказательная база во многом основывалась на опыте лечения вышеупомянутых заболеваний [1], происходила экстраполяция клинических, биохимических и патофизиологических закономерностей течения первичного или вторичного ОРДС вследствие состояний, не связанных с COVID-19. Дальнейшее изучение новой коронавирусной инфекции выявило механизмы, ответственные за системный характер прогрессирования заболевания, и вывело понимание его патогенеза за рамки «типичного» ОРДС. Немаловажную роль в изучении играет обобщение данных, полученных отдельными центрами, специализирующимися на помощи пациентам с COVID-19.
Инфекционный госпиталь в Коммунарке принял первых пациентов 2 марта 2020 г. Готовность к массовому поступлению пациентов с тяжелой дыхательной недостаточностью в случае развития в Москве пандемии по сценарию, аналогичному итальянскому, потенциальная возможность мобилизации врачей и медицинских сестер смежных специализаций для работы в отделениях интенсивной терапии потребовали разработки единого респираторного протокола, установки контрольных точек для принятия решений о начале или эскалации респираторной поддержки (РП) в условиях отделения реанимации и интенсивной терапии (ОРИТ). Внедренная на этапе первого контакта с пациентом система сортировки («triage») сделала возможной быструю маршрутизацию наиболее тяжелых пациентов, что позволило минимизировать время их пребывания вне отделений реанимации. Опыт раннего пронирования пациентов с явлениями гипоксемической или гиперкапнической дыхательной недостаточности, связанной с COVID-19, в т. ч. на этапе транспортировки за пределами отделений интенсивной терапии, позволил в условиях массового поступления на пике заболеваемости добиваться оптимизации респираторной функции пациентов, а следовательно — предоставил возможность рационального распределения человеческих и материальных ресурсов ОРИТ.
Стартовый респираторный протокол госпиталя в Коммунарке (основные шаги представлены в табл. 1) включал в себя быструю эскалацию РП от оксигенотерапии в прон-позиции к двухчасовому тесту с неинвазивной вентиляцией легких (НИВЛ), а в случае безуспешности такового — к интубации трахеи и началу эндотрахеальной искусственной вентиляции легких (ИВЛ). Клиническими критериями эскалации служили высокая работа дыхания, признаки общего дистресса, лабораторными — соотношение парциального давления кислорода в артериальной крови и фракции вдыхаемого кислорода (PaO2/FiO2) < 200 мм рт. ст. спустя 2 ч после начала НИВЛ, гиперкапния с pH < 7,2, повышенный уровень лактата артериальной крови. В протоколе не отдавалось предпочтения какой-либо модальности контролируемой вентиляции легких, ключевыми показателями служили критерии протективности — давление плато (Pplat.) < 25 см вод. ст., давление «driving pressure» (DP) < 15. Выбор оптимального положительного давления в конце выдоха (ПДКВ) производился в соответствии с таблицей «Высокое ПДКВ / низкая FiO2», предложенной командой исследователей ARDSNetwork [3]. Вне зависимости от модальности контролируемого вдоха, дыхательные объемы (ДО) устанавливались из расчета 6–8 мл/кг предсказанной массы тела с последующей коррекцией. Стандартной частью протокола также являлась вентиляция в прон-позиции не менее 16 ч в сутки в условиях медикаментозной седации и миоплегии в случае PaO2/FiO2 < 200 мм рт. ст.
Необходимость оценки эффективности и безопасности выбранной респираторной стратегии, а также изучение ее взаимосвязи с исходами лечения у пациентов с тяжелым течением COVID-19 определили необходимость организации представляемого коллективом авторов ретроспективного когортного одноцентрового исследования.
Таблица 1. Основные этапы стартового респираторного протокола (апрель 2020 г.)
Table 1. General stages of initial respiratory support protocol (April 2020)
| Шаг | Действие / эскалация | Мониторинг | Критическое значение |
|---|---|---|---|
| 1 | Наблюдение | SpO2/ЧД | < 92 % / > 30 в мин |
| 2 | Оксигенотерапия / прон-позиция при спонтанном дыхании | SpO2/ЧД | < 92% / > 30 в мин |
| 3 | Неинвазивная вентиляция с ПДКВ ≥ 10 см вод. ст. — 120 мин | PaO2/FiO2 /ЧД | < 200 мм рт. ст. / > 30 в мин |
| 4 | Инвазивная вентиляция легких, целевые значения (все этапы ИВЛ): ДО 6–8 мл/кг ИМТARDSNetwork / Pplat < 30 см вод. ст. | PaO2/FiO2/Pplat.
PaCO2/pH |
< 200 мм рт. ст. / > 30 см вод. ст.
Гиперкапния с pH < 7,2 |
| 5 | Седация / миорелаксация 48 ч | PaO2/FiO2/Pplat.
PaCO2/pH |
< 200 мм рт. ст. / > 30 см вод. ст.
Гиперкапния с pH < 7,2 |
| 6 | Прон-позиция ≥ 16 ч/сут | PaO2/FiO2/Pplat.
PaCO2/pH |
< 80 мм рт. ст. / > 30 см вод. ст.
Гиперкапния с pH < 7,2 |
| 7 | Оценка показаний и противопоказаний к ЭКМО | PaO2/FiO2/Pplat.
PaCO2/pH |
– |
| ДО — дыхательный объем; ИМТARDSNetwork — идеальная масса тела (формула для мужчин: ИМТ(ARDS) (М) = 50 + 0,91 (рост, см, – 152,4); для женщин — ИМТ(ARDS) (Ж) = 45,5 + 0,91 (рост, см, – 152,4); ПДКВ — положительное давление в конце выдоха; ЧД — частота дыхания; ЭКМО — экстракорпоральная мембранная оксигенация; FiO2 — фракция кислорода во вдыхаемой дыхательной смеси; PaO2 — парциальное давление кислорода в артериальной крови; PaO2/FiO2 — отношение парциального давления кислорода в артериальной крови к фракции кислорода во вдыхаемом газе (син. — индекс оксигенации, индекс гипоксемии, индекс Горовица); PaСO2 — парциальное давление углекислого газа в артериальной крови; pH — показатель уровня кислотности артериальной крови; Pplat — давление плато (величина, измеряемая во время проведения ИВЛ на высоте вдоха в момент прекращении потоков как вдоха и выдоха); SpO2 — насыщение крови. | |||
Цель исследования — изучение основных характеристик и исходов лечения пациентов с тяжелым течением коронавирусной инфекции, вызванной вирусом SARS-CoV-2, находившихся на лечении и получавших РП в ОРИТ инфекционного госпиталя в Коммунарке.
Дизайн исследования соответствует одноцентровой когортной ретроспективной модели. Исследование разделено на этапы, включающие в себя определение базовых характеристик пациентов, которым проводили РП (демографические показатели, данные о коморбидности, клинико-инструментальные показатели тяжести течения заболевания, структура терапевтических вмешательств), анализ 30-дневной выживаемости в исследуемой когорте как в целом, так и в зависимости от выбранной модальности РП, выявление статистически значимых различий по основным характеристикам между группами НИВЛ и эндотрахеальной ИВЛ, между выжившими и умершими пациентами, а также изменение регистрируемых показателей в течение периода исследования.
К анализируемым ретроспективно клиническим случаям РП отнесены все эпизоды эндотрахеальной ИВЛ и НИВЛ. Пациент определялся в группу ИВЛ или НИВЛ в зависимости от максимальной степени эскалации респираторной терапии в течение госпитализации. Из анализа исключены случаи РП (ИВЛ) продолжительностью < 120 мин от момента поступления в отделение; также исключались пациенты, получавшие стандартную оксигенотерапию и не потребовавшие дальнейшей эскалации РП.
Регистрация случаев РП производилась непосредственно в структурных подразделениях (ОРИТ) врачами — анестезиологами-реаниматологами в первичной документации, которой явилась медицинская карта стационарного больного (МКСБ), представленная в электронном виде в Единой медицинской информационно-аналитической системе (ЕМИАС). С целью обеспечения оперативности доступа к данным о РП разработан и внедрен в клиническую практику стандартизированный ежедневный чек-лист безопасности пациента в ОРИТ. Данные о случае РП включали:
Статистический анализ данных включал методы описательной статистики — расчет средних с 95%-ми доверительными интервалами (95% ДИ) для числовых переменных. Показатели представлены в таблице в зависимости от характера распределения — в случае нормального распределения средним значением со стандартным квадратическим отклонением (СКО), или размахом, в случае отклонения от нормального распределения — медианой с интерквартильным размахом (ИР); расчет абсолютных/относительных (%) частот для категориальных и счетных показателей; однофакторный дисперсионный анализ ANOVA для исследования статистической значимости динамики средних значений ряда показателей помесячно. Проверку статистической значимости различия средних между двумя группами проводили с помощью t-критерия Стьюдента либо непараметрического критерия Манна—Уитни в случае отклонения выборочного распределения от нормального закона.
Анализ 30-дневной выживаемости, а также построение кривых дожития выполняли с помощью метода Каплана—Майера. Сравнительное исследование кривых дожития в группах с различными модальностями ИВЛ, а также проверку на статистическую значимость различия выживаемости в этих группах проводили с помощью логрангового критерия и критерия Гехана в зависимости от профиля кривых. Уровень статистической значимости был принят равным 0,05.
Систематизацию, подготовку и базовый анализ зарегистрированных случаев РП выполняли с применением облачных информационных технологий, обеспечивающих оперативный сбор данных в рамках структурного подразделения (ОРИТ) его руководителем, а также предоставляющих возможность автоматизированного формирования единого стандартизированного массива данных.
Последующая статистическая обработка полученной базы данных поводилась средствами программы для статистического анализа StatPlus:mac, версия 7 (AnalystSoft Inc.).
В исследование ретроспективно включен 451 случай РП у пациентов с COVID-19, находившихся на лечении в ОРИТ инфекционного госпиталя в Коммунарке в период с марта по июль 2020 г., что хронологически соответствует «первой волне» пандемии. Базовые характеристики включенных в исследование пациентов представлены в табл. 2. РП, учитываемую исследованием, получала практически половина пациентов, находившихся в отделениях интенсивной терапии, причем отмечался значимый перевес в пользу инвазивной ИВЛ.
Таблица 2. Исходные характеристики пациентов, включенных в исследование
Table 2. Baseline patient characteristics
| Показатель | Все пациенты (n = 451) |
|---|---|
| Доля пациентов, получавших респираторную поддержку, % | |
| От пролеченных в госпитале в течение периода наблюдения | 9,8 |
| От пролеченных в ОРИТ в течение периода наблюдения | 48,8 |
| Демографические показатели | |
| Возраст, среднее (СКО), лет | 66,3 (14,89) |
| Мужской пол, n (%) | 247 (54,6) |
| ИМТ, медиана (ИР), кг/м2 | 27,7 (24,8–31,02) |
| Госпитализация (интервалы времени), сут | |
| Начало заболевания — госпитализации | 7,13 (0–30) |
| Госпитализация — поступление в ОРИТ | 2,63 (0–44) |
| Начало заболевания — поступление в ОРИТ | 9,54 (0–55) |
| Показатели коморбидности | |
| Индекс Чарлсона, cреднее (СКО), баллов | 4,46 (2,6) |
| Ожирение > II ст., n (%) | 103 (22,8) |
| Сахарный диабет с осложнениями, n (%) | 121 (26,8) |
| Ишемическая болезнь сердца, n (%) | 141 (31,3) |
| ЦВБ с клинически значимым неврологическим дефицитом или снижением когнитивных функций, n (%) | 99 (21,9) |
| Фибрилляция/трепетание предсердий, n (%) | 77 (17,0) |
| ЗНК (стадия IIА и более по Стражеско—Василенко), n (%) | 34 (7,5) |
| АГ, требующая постоянной медикаментозной терапии, n (%) | 332 (73,6) |
| ХБП, III ст. и более, n (%) | 42 (9,3) |
| ХОБЛ, бронхиальная астма, n (%) | 24 (5,3) |
| Злокачественные новообразования с метастазированием, n (%) | 29 (6,3) |
| Болезни системы кроветворения, n (%) | 18 (3,9) |
| Иммунодефицитные состояния, n (%) | 2 (0,04) |
| Характеристика пациентов на момент госпитализации в ОРИТ | |
| Оценка по шкале APACHE II, медиана (ИР), баллов | 14 (10–19,8) |
| Оценка по шкале SOFA, медиана (ИР), баллов | 4 (3–6) |
| Соотношение PaO2/FiO2 (начало респираторной поддержки), медиана (ИР), мм рт. ст. | 169,3 (134–203) |
| Начальный Cstat., медиана (ИР), мл/см вод. ст. | 43 (35–51) |
| Терапевтические вмешательства | |
| Неинвазивная ИВЛ, n (%) | 104 (23,1) |
| Эндотрахеальная ИВЛ, n (%) | 347 (76,9) |
| Применение методик ПЗПТ, n (%) | 97 (21,5) |
| ВВ-ЭКМО, n (%) | 5 (1,4) |
| Терапия ГИБП (тоцилизумаб) | |
| Всего пациентов, n (%) | 149 (33) |
| Интервалы времени, сут | |
| Заболевание — начало терапии ГИБП | 9,65 (1–20) |
| Госпитализация — начало терапии ГИБП | 3,33 (0–18) |
| Госпитализация в ОРИТ — начало терапии ГИБП | 0,7 (–5...+10) |
| Начало терапии ГИБП — начало респираторной поддержки | 1,4 (–6...+15) |
| АГ — артериальная гипертензия; ВВ-ЭКМО — вено-венозная экстракорпоральная мембранная оксигенация; ГИБП — генно-инженерный биологический препарат; ЗНК — застойная недостаточность кровообращения; ИМТ — индекс массы тела; ИР — интерквартильный размах; ПЗПТ — продленная заместительная почечная терапия; СКО — среднеквадратическое отклонение; ХБП — хроническая болезнь почки; ХОБЛ — хроническая обстругивая болезнь легких; ЦВБ — цереброваскулярная болезнь; Cstat. — статический респираторный комплаенс. | |
На рис. 1 представлена структура случаев РП за анализируемый период. Обращает на себя внимание стабильная доля пациентов на НИВЛ, находящихся в отделениях. Вместе с тем необходимо отметить устойчивую тенденцию к снижению количества случаев безуспешных попыток НИВЛ (рис. 2).
Рис. 1. Изменение структуры респираторной поддержки на протяжении периода наблюдения
Fig. 1. Respiratory support structure changes during the observation period

Рис. 2. Изменение количества и доли пациентов, которым проводилась НИВЛ, а также доли безуспешных попыток НИВЛ в структуре случаев респираторной поддержки
Fig. 2. Temporal alteration of portion of noninvasively ventilated patients and failed attempts of noninvasive ventilation

Различные виды РП, представленные в табл. 2, получала практически половина пациентов, находившихся в отделениях интенсивной терапии. Сравнительная характеристика всех случаев РП, разделенных на группы инвазивной и неинвазивной ИВЛ, представлена в табл. 3.
Таблица 3. Сравнительная характеристика групп ИВЛ и НИВЛ
Table 3. Comparative characteristics of invasive and non-invasive mechanical ventilation groups
| Показатель | ИВЛ (n = 347) | НИВЛ (n = 104) | p |
|---|---|---|---|
| Возраст, среднее (размах), лет | 68,56 (23–97) | 58,43 (27–86) | < 0,0001 |
| Мужской пол, n (%) | 189 (54,5) | 57 (54,8) | 0,15 |
| ИМТ, медиана (ИР), кг/м2 | 28,6 (24,76-30,86) | 29,8 (25,24–29,56) | – |
| Индекс Чарлсона, среднее (СКО), баллов | 5,01 (2,49) | 2,24 (1,75) | < 0,0001 |
| APACHE II (при поступлении), медиана (ИР), баллов | 15 (11–19) | 10 (7–12) | < 0,0001 |
| SOFA (при поступлении), медиана (ИР), баллов | 4 (3–6) | 3 (2–4) | < 0,0001 |
| SOFA (максимальная), медиана (ИР), баллов | 10 (2–17) | 4 (3–5) | < 0,0001 |
| Максимальный уровень ПДКВ, см вод. ст. | 12,13 (3–25) | 9,71 (5–20) | < 0,0001 |
| Максимальный ДО, мл/кг ИдМТ* | 6,73 (4–10) | 8,3 (5–10) | < 0,0001 |
| Длительность респираторной поддержки, сут | 6,47 (5–46) | 4,14 (1–3) | 0,0019 |
| Начальный индекс PaO2/FiO2 (НИВЛ), медиана (ИР), мм рт. ст. | 193 (153–220) | 215 (157–241) | 0,13 |
| Наименьший PaO2/FiO2 (НИВЛ), медиана (ИР), мм рт. ст. | 155 (125,3–203,8) | 188 (180–226) | 0,046 |
| Терапия тоцилизумабом, n (%) | 85 (24,5) | 64 (61,5) | < 0,0001 |
| Временные интервалы, сут | |||
| Госпитализация — респираторная поддержка | 5,42 (–20...+37) | 4,31 (–2...+31) | 0,009 |
| Госпитализация — тоцилизумаб | 2,94 (–3...+14) | 2,92 (–2...+8) | 0,97 |
| Тоцилизумаб — респираторная поддержка | 2,17 (–2...+15) | 0,49 (–5...+6) | 0,02 |
| Безуспешная НИВЛ, n (%) | 101 (27,9) | – | – |
| Вентиляция «по объему», n (%) | 199 (57,3) | – | – |
| Трахеостомия, n (%) | 121 (34,9) | – | – |
| Сутки трахеостомии | 4,24 (0–23) | – | – |
| * ИдМТ — идеальная масса тела (формула ARDSNetwork для мужчин: ИдМТ(ARDS) (М) = 50 + 0,91 (рост, см, – 152,4); для женщин — ИдМТ(ARDS) (Ж) = 45,5 + 0,91 (рост, см, – 152,4).
ДО — дыхательный объем; ИР — интерквартильный размах; ПДКВ — положительное давление в конце выдоха; СКО — среднеквадратическое отклонение. |
|||
Неинвазивную вентиляцию легких получали, как правило, более молодые пациенты, оценка по APACHE II при поступлении и SOFA в динамике в группе НИВЛ была статистически значимо ниже на всем протяжении периода лечения (p < 0,0001). Продолжительность РП была также статистически значимо меньшей в группе НИВЛ (p = 0,0019). Доля безуспешных попыток НИВЛ в группе ИВЛ сопоставима с количеством случаев достижения целевых показателей вентиляции в неинвазивной группе. Интубация трахеи с последующей ИВЛ начиналась в среднем на сутки позже неинвазивной РП (p = 0,009).
Для анализа 30-дневной выживаемости пациентов, которым выполняли РП во всех модальностях, использовался метод Каплана—Майера. Анализ проводился на всей выборке пациентов (рис. 3, A, B) и в группах, полученных стратификацией пациентов по ряду клинически значимых факторов. К окончанию периода наблюдения, в живых оставался 141 пациент.
Рис. 3. А. 30-дневная выживаемость пациентов, получавших респираторную поддержку в ОРИТ. B. Кумулятивный риск летального исхода пациентов, получавших респираторную поддержку в ОРИТ. C. 30-дневная выживаемость пациентов на ИВЛ в зависимости от предшествующей попытки НИВЛ. D. Кумулятивный риск летального исхода пациентов на ИВЛ в зависимости от предшествующей попытки НИВЛ
Fig. 3. A. 30-day survival of patients, received respiratory support in the intensive care units of hospital. B. Cumulative risk of death in patients, received respiratory support in the intensive care units of hospital. C. 30-day survival of invasive mechanically ventilated patients, depending of previous noninvasive ventilation effort. D. Cumulative risk of mortality of invasive mechanically ventilated patients, depending of previous noninvasive ventilation attempt
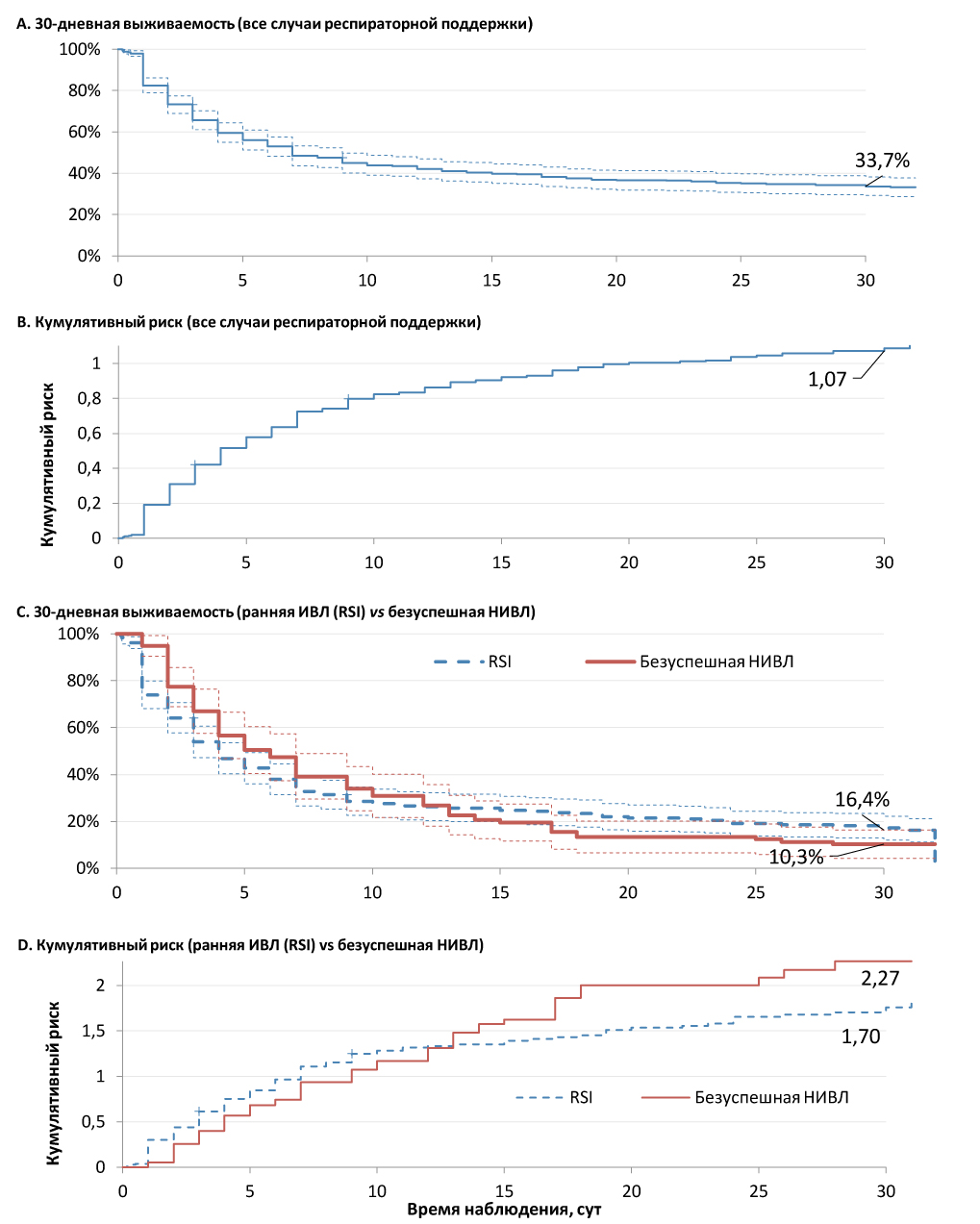
Анализ выживаемости и кумулятивный риск летального исхода в зависимости от результата попытки НИВЛ, предшествующих быстрой последовательной индукции и интубации (RSI) и раннему началу ИВЛ (рис. 3, C, D), представился затруднительным в связи с пересечением кривых выживаемости на 13-е сутки наблюдения, что значимо уменьшает силу логрангового критерия. Применение критерия Гехана, обладающего большей чувствительностью к раннему периоду наблюдения, выявило статистически значимые межгрупповые различия выживаемости с p = 0,048 в пользу группы быстрой последовательной индукции и интубации и ранней ИВЛ. В то же время отношение рисков (ОР) (hazard ratio) в сравнении «безуспешная НИВЛ/RSI» составило 1,03 при 95% ДИ 0,8–1,33, что указывает на отсутствие пропорциональности рисков на протяжении периода наблюдения.
Отмечены статистически значимые различия в выживаемости в течение 30 дней (рис. 4) для пациентов, находящихся на ИВЛ, в зависимости от выбранного режима аппаратного вдоха — с управлением объемом или управлением давлением (рис. 4, A, B) в пользу группы управления давлением (p = 0,00014). Так, ОР, рассчитанное для летального исхода «управляемый объем / управляемое давление», составило 1,53 (95% ДИ 1,21–1,94). Полученные данные послужили поводом для более детального анализа межгрупповых различий (табл. 4) с применением дисперсионного анализа ANOVA с выделением подгрупп выживших и умерших пациентов.
Таблица 4. Сравнительная характеристика подгрупп пациентов группы ИВЛ в зависимости от управления объемом или управления давлением
Table 4. Comparative characteristics patient subgroups depending on volume or pressure controlled mechanical ventilation
| Показатель | VCV
(n = 199) |
PCV
(n = 148) |
p |
|---|---|---|---|
| Возраст, лет | 68,73 (33,0–97,0) | 68.70 (23,0–94,0) | – |
| Мужской пол, n (%) | 112 (56,3) | 77 (52,0) | – |
| ИМТ, медиана (ИР), кг/м2 | 27,3 (24,54–30,86) | 27,5 (25,22–30,94) | – |
| Индекс Чарлсона, среднее (СКО), баллов | 5,17 (1,91) | 4,77 (2,17) | – |
| APACHE II (при поступлении), медиана (ИР), баллов | 15 (11–19) | 15 (8) | – |
| SOFA (при поступлении), медиана (ИР), баллов | 5 (3–6) | 4 (3–7) | < 0,001 |
| SOFA (максимальная), медиана (ИР), баллов | 11 (8–13) | 10 (8–13) | – |
| Максимальный уровень ПДКВ, см вод. ст. | 12,11 (3–20) | 12,17 (5–25) | – |
| Максимальный ДО, мл/кг ИдМТ* | 6,81 (4–10) | 6,62 (4–10) | – |
| Начальный индекс PaO2/FiO2, медиана (ИР), мм рт. ст. | 144 (55) | 129 (41,8) | – |
| Наименьший PaO2/FiO2, медиана (ИР), мм рт. ст. | 113 (50) | 108,5 (47,3) | – |
| Начальный Cstat., медиана (ИР), мл/см вод. ст. | 43 (35–50) | 43 (35–51) | – |
| Наименьший Cstat., медиана (ИР), мл/см вод. ст. | 32 (31–39) | 32 (26–42) | – |
| Длительность респираторной поддержки, медиана (ИР), сут. | 3 (6) | 4 (10,5) | 0,004 |
| Терапия тоцилизумабом, n (%) | 45 (22,6) | 40 (27,0) | – |
| Временные интервалы | |||
| госпитализация — тоцилизумаб, сут | 3,04 (–2...+14) | 2,7 (–3...+9) | – |
| тоцилизумаб — респираторная поддержка, сут | 1,33 (–2...+12) | 1,42 (–2...+15) | – |
| Безуспешная НИВЛ, n (%) | 57 (28,6) | 44 (29,7) | – |
| Трахеостомия, n (%) | 62 (31,2) | 59 (39,9) | – |
| Сутки трахеостомии (от начала ИВЛ) | 4,43 (0–15) | 4,12 (0–23) | – |
| Заместительная почечная терапия, n (%) | 46 (23,1) | 37 (25,0) | – |
| * ИдМТ — идеальная масса тела (формула ARDSNetwork для мужчин: ИдМТ(ARDS) (М) = 50 + 0,91 (рост, см, – 152,4); для женщин: ИдМТ(ARDS) (Ж) = 45,5 + 0,91 (рост, см, – 152,4).
ДО — дыхательный объем; ИР — интерквартильный размах; ПДКВ — положительное давление в конце выдоха; СКО — среднеквадратическое отклонение; Cstat. — статический респираторный комплаенс; PCV — вентиляция с управлением давлением; VCV — вентиляция с управлением объемом. |
|||
Рис. 4. А. 30-дневная выживаемость пациентов в зависимости от модальности ИВЛ (управление давлением вдоха (Pinsp.), управление дыхательным объемом Vt). B. Кумулятивный риск летального исхода пациентов зависимости от модальности ИВЛ (управление давлением вдоха (Pinsp.), управление дыхательным объемом Vt). С. 30-дневная выживаемость пациентов на ИВЛ в зависимости от применения методик продленной заместительной почечной терапии (ПЗПТ). D. Кумулятивный риск летального исхода пациентов на ИВЛ в зависимости от применения методик продленной заместительной почечной терапии (ПЗПТ)
Fig. 4. A. 30-day survival of patients in dependence of invasive mechanical ventilation modality (pressure control versus volume control). B. Cumulative risk of death of patients in dependence of invasive mechanical ventilation modes (pressure control versus volume control). C. 30-day survival of patients in dependence of renal replacement therapy utilization. D. Cumulative risk of death of patients in dependence of renal replacement therapy utilization
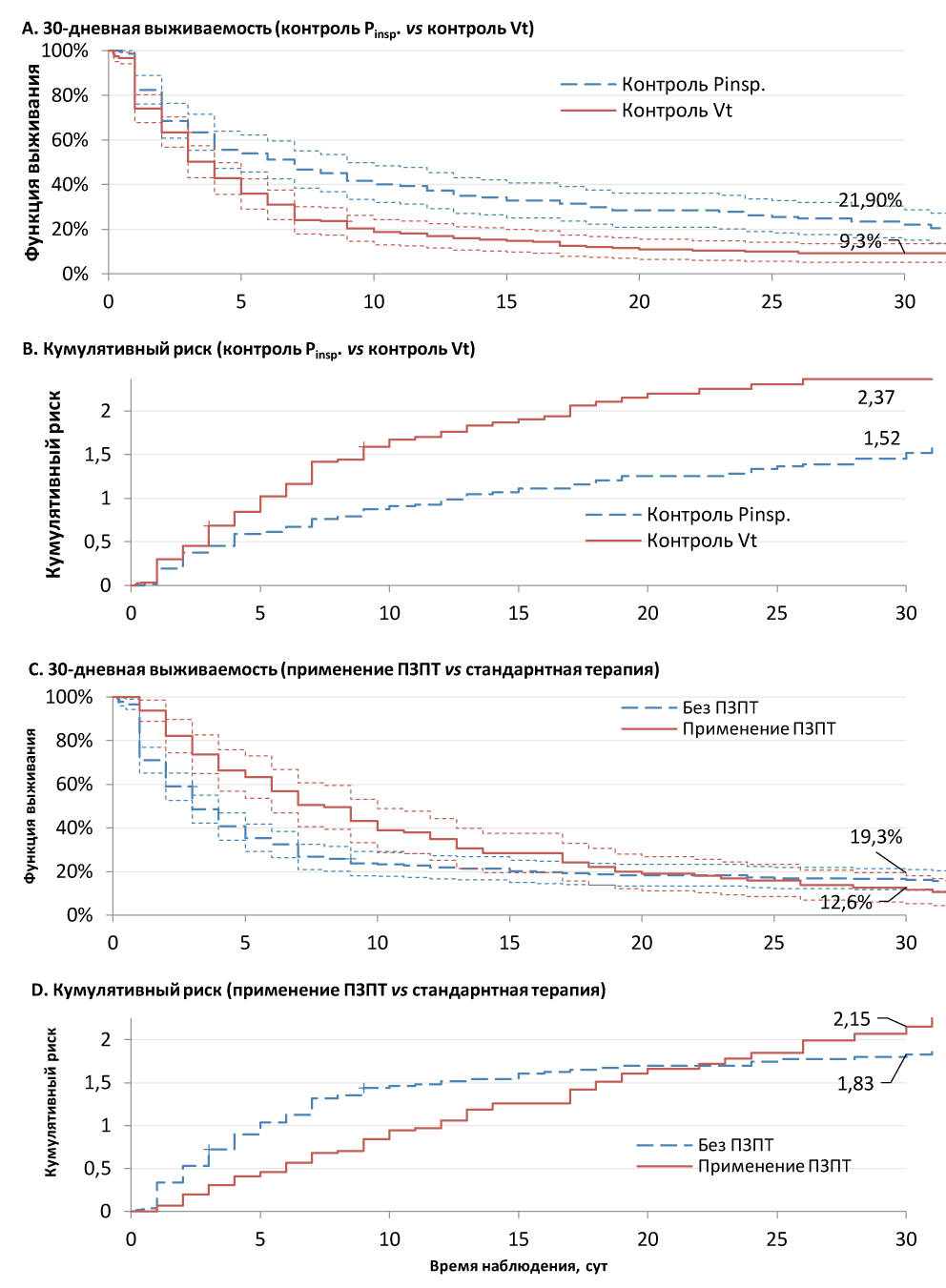
Статистически значимые межгрупповые различия получены для продолжительности РП. В среднем более длительная РП отмечена в группе вентиляции с управляемым давлением. В то же время средние значения оценок по шкале SOFA при поступлении были статистически значимо ниже в группе вентиляции с управляемым объемом.
Необходимо отметить тенденцию к использованию больших ДО в группе объемной вентиляции, что может быть обусловлено необходимостью достижения целевых показателей РП. Статистически значимых различий по уровню ПДКВ, показателям времени, связанным с началом ИВЛ, терапии тоцилизумабом, а также частоты безуспешных попыток НИВЛ или применения методик продленной заместительной почечной терапии между указанными группами не получено.
Статистически значимые изменения некоторых показателей с течением времени (помесячно) в отдельных группах пациентов представлены на рис. 5.
Рис. 5. Статистически значимая динамика некоторых характеристик пациентов подгрупп ИВЛ и НИВЛ на протяжении периода наблюдения
Fig. 5. Statistically significant alteration of some patient characteristics in invasive and noninvasive mechanical ventilation subgroups during the observation period

Развитие острого повреждения почек у пациентов с COVID-19 на ИВЛ сопряжено с высоким риском неблагоприятного исхода. Методы заместительной почечной терапии в сочетании с сорбционными методиками применялись у 97 пациентов, находящихся на продленной ИВЛ (см. табл. 3). В этой подгруппе пациентов отмечается наихудший показатель выживаемости. Критериями начала заместительной почечной терапии служили как классические почечные показания, так и септический шок с последующим развитием анурии. Среднее количество процедур на одного пациента на ИВЛ составило 2,9.
Анализ 30-дневной выживаемости с применением критерия Гехана (см. рис. 4 C, D) для выявления межгрупповых различий (имеет ограниченную мощность в связи с пересечением кривых на 22-е сутки наблюдения) выявил статистически значимо более высокую выживаемость в группе стандартной терапии (p = 0,00003). ОР «Без ПЗПТ» / «Применение ПЗПТ» составило 1,27 (95% ДИ 0,997–1,63), что свидетельствует об отсутствии пропорциональности рисков на протяжении периода наблюдения.
Значительной части пациентов, которым проводилась РП и которые соответствовали критериям развития «цитокиновой бури», в дополнение к стандартной терапии, была проведена терапия блокатором рецептора к ИЛ-6 (тоцилизумаб). Соотношение времени начала РП и начала терапии тоцилизумабом значительно варьировало. У подавляющего большинства пациентов терапия проводилась в 1-е сутки нахождения в ОРИТ.
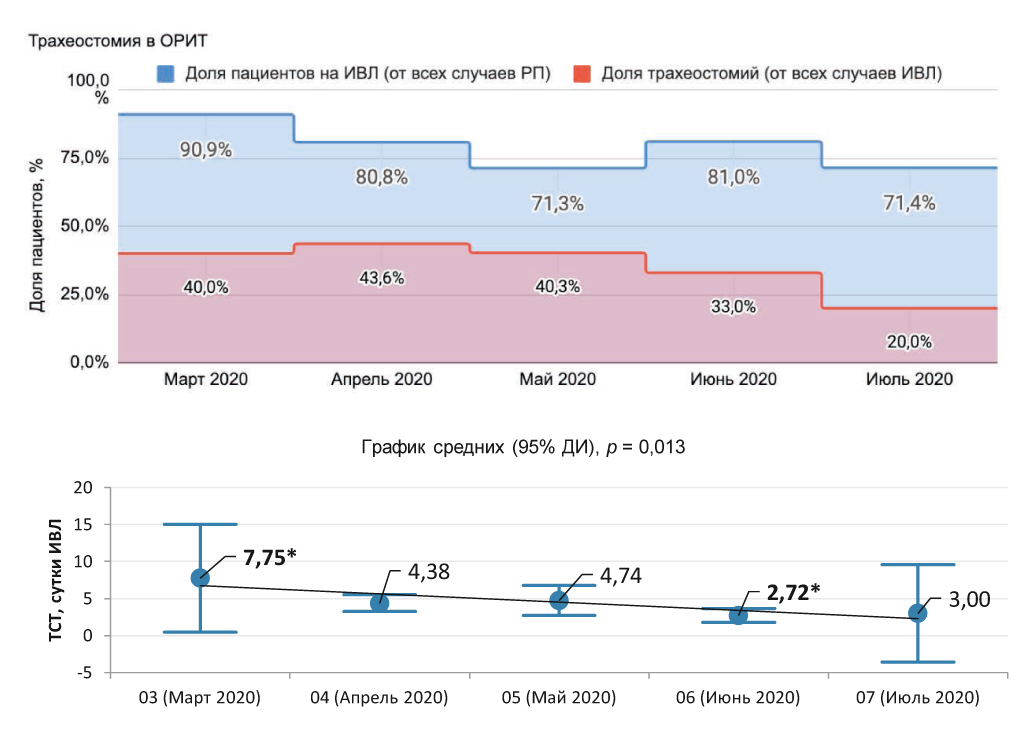
По мере накопления опыта лечения критически тяжелых пациентов с COVID-19 претерпели изменения подходы к выполнению трахеостомии в ОРИТ (рис. 6). Доля пациентов, которым она выполнялась, значимо снизилась, в то же время сроки выполнения манипуляции статистически значимо сместились в сторону 3–4 суток после интубации.
Рис. 6. Изменение доли пациентов, которым выполнялась пункционная трахеостомия, а также времени выполнения трахеостомии на протяжении периода наблюдения
ТСТ — трахеостомия.
Fig. 6. Temporal trends in portion of patients, underwent percutaneous tracheostomy and day of mechanical ventilation, when tracheostomy performed during the observation period
ТСТ — tracheostomy.
Популяция пациентов, включенных в исследование, может быть расценена как сбалансированная по демографическим показателям как в целом, так и в группах инвазивной и неинвазивной ИВЛ. При анализе базовых характеристик пациентов, получавших РП в отделениях интенсивной терапии госпиталя и включенных в исследования, обращает на себя внимание высокий индекс коморбидности Чарлсона: показатель обладает хорошей прогностической точностью и является независимым фактором риска летальности. Kim [14], Kuswardhani et al. [15] на основании ретроспективных когортных исследований оценивают его как надежный предиктор выживаемости у пациентов, госпитализированных с COVID-19. Так, превышение 5 баллов связано со значимым повышением риска наступления кумулятивного исхода (смерть, госпитализация в ОРИТ, механическая вентиляция легких или ЭКМО). У пациентов, находившихся на лечении в ОРИТ госпиталя, отмечался статистически значимо более высокий индекс Чарльстона в группе ИВЛ, что сочеталось с более высокими оценками по шкалам APACHE II и SOFA при поступлении, а также максимальной оценкой SOFA в сравнении с группой НИВЛ. Это свидетельствует о более тяжелой коморбидной патологии в группе ИВЛ, что сопряжено с высокими показателями летальности. При анализе структуры коморбидности также доминирующая роль отводится артериальной гипертензии, требующей постоянной медикаментозной терапии, не вносящей вклада в описанный индекс.
В структуре госпитализации в ОРИТ значимую часть занимают переводы из отделений общего профиля, что в целом соответствует литературным данным о континууме COVID-19, а также об относительно невысокой частоте начала РП у пациентов в приемных отделениях и отделениях неотложной помощи [2]; сроки поступления в ОРИТ соответствуют 9–10-м суткам заболевания, что нередко является критическим периодом течения заболевания вне зависимости от тяжести инфекционного процесса.
Эволюция представлений о тяжелом течении инфекции, вызванной SARS-CoV-2, привела к значимому расширению показаний к проведению НИВЛ. Так, в локальной респираторной стратегии госпиталя в первые месяцы пандемии отмечено расширение показаний к проведению НИВЛ, а также уточнены критерии конверсии на инвазивную вентиляцию легких. Соотношение PaO2/FiO2 покинуло лидирующие позиции в оценке эффективности НИВЛ, фокус внимания сместился на клинические критерии — высокая работа дыхания с избыточной инспираторной попыткой, признаки общего дистресса. Впоследствии доля пациентов, которым проводилась НИВЛ, оставалась стабильной. Статистически значимо более высокие ДО в группе НИВЛ тем не менее позволяют оставаться в приближении к протективному целевому ДО 6–8 мл/кг идеальной массы тела (ИдМТ). Так, ряд авторов указывает на связь высоких ДО, превышающих 9,5 мл/кг ИдМТ, с безуспешностью НИВЛ [12, 13]; в то же время ДО, не превышающий 8,5 мл/кг ИдМТ, не был связан с безуспешными попытками. Публикация L. Gattinnoni указывает на высокую вероятность пациент-индуцированного повреждения легких (P-SILI) у пациентов, которым проводится НИВЛ вследствие избыточной инспираторной попытки, это характерно для пациентов, получающих НИВЛ на более поздних сроках заболевания, когда респираторный комплаенс снижается, что приводит к генерации избыточного отрицательного внутригрудного давления [16, 17]. Высокий ДО в сочетании с высоким респираторным драйвом на ранних этапах НИВЛ может служить полезным диагностическим тестом, определяющим принятие решения об инвазивной ИВЛ. Так, уменьшение доли безуспешных попыток неинвазивной РП в течение периода наблюдения, вероятно, связано с накоплением опыта клинической оценки состояния, ранним выявлением пациентов наивысшего риска. В пользу подобного подхода свидетельствует статистически значимо более раннее начало РП в группе НИВЛ.
Кроме того, необходимо отметить, что безуспешная НИВЛ в сравнении с быстрой последовательной индукцией и интубацией и ранним началом ИВЛ связана с меньшей 30-дневной выживаемостью пациентов с COVID-19, однако анализ ОР не выявил статистически значимого увеличения риска неблагоприятного исхода в какой-либо из групп. Это может свидетельствовать о диспропорциональности рисков на протяжении периода наблюдения, а следовательно, о возможном отсутствии преимуществ вследствие выбора начальной респираторной стратегии в пользу как раннего начала инвазивной, так и неинвазивной искусственной вентиляции. Необходимо более детальное изучение подходов к РП у пациентов с COVID-19, позволяющее выделить субпопуляции пациентов, в которых выбор модальности РП определит меньшее ОР наступления неблагоприятного исхода.
Анализ показателей респираторной механики и газообмена выявил популяцию пациентов с относительно сохранным статическим респираторным комплаенсом в сочетании с глубокими нарушениями вентиляции и оксигенации на момент начала ИВЛ, что свидетельствует о чрезмерном шунтировании легочного кровотока. Изменения не имели статистически значимых различий в подгруппах с принудительной вентиляцией легких с управляемым объемом или давлением вдоха; в то же время в обеих подгруппах зафиксированы сопоставимые наименьшие зарегистрированные значения этого показателя.
Эволюция стратегии РП в клинике основывалась на наблюдениях, указывающих на гетерогенность механики легких у пациентов с коронавирусной инфекцией. Актуальной остается проблема подбора оптимального уровня ПДКВ в отсутствие рутинно доступного мониторинга пищеводного давления как суррогатного показателя транспульмонарного градиента давления. Одним из доступных в клинике показателей, направленных на оптимизацию ПДКВ, служило соотношение парциального давления углекислого газа в артериальной крови и содержания углекислого газа в выдыхаемой газовой смеси в конце выдоха (PaCO2/EtCO2) в сочетании с определением статического респираторного комплаенса. У подобных пациентов следование стратегии высокого ПДКВ и низкой FiO2 влекло за собой гемодинамическую нестабильность в сочетании с прогрессированием нарушений соотношения вентиляции и перфузии легких. На основании полученных данных в рутинную клиническую практику внедрен принцип нисходящего титрования ПДКВ [6], что привело к естественному смещению соотношений ПДКВ/FiO2 в сторону протокола «низкое ПДКВ / высокая FiO2» команды исследователей ARDSNetwork. Полученные данные согласуются с публикацией Tsolaki et al., указывающей на неоптимальность применения стратегии «высокое ПДКВ / низкая FiO2» у большинства пациентов с тяжелым течением COVID-19 [18].
Инвазивная ИВЛ у пациентов с ОРДС, обусловленным инфекцией, вызываемой SARS-CoV-2, сопровождается высокой летальностью как за счет особенностей течения заболевания (развитие микротромботических нарушений вследствие прямого повреждения эндотелия сосудов, альвеол, развития синдрома патологической проницаемости сосудистой стенки, вазоплегии и повреждения эндотелия, обусловленных развитием «цитокиновой бури»), нарушения ауторегуляции легочного кровотока [2], так и за счет высокого риска вентилятор-ассоциированного повреждения легких, повреждающего воздействия избыточного инспираторного усилия, способствующего развитию высокого транспульмонального градиента давления.
Обращает на себя внимание увеличение среднего возраста пациентов, которым проводили как ИВЛ, так и НИВЛ, а также увеличение среднего балла APACHE II в группе ИВЛ. Персонализация параметров РП наряду с возрастающей тяжестью пациентов, в т. ч. за счет возраста и коморбидности на анализируемом временном отрезке, сочетается со смещением средних значений ПДКВ ниже 10 мбар. Остальные анализируемые показатели в группах оставались относительно постоянными на протяжении всего периода наблюдения либо их изменения не имели статистической значимости.
Терапия тоцилизумабом проводилась пациентам с COVID-19, находящимся в ОРИТ инфекционного госпиталя в Коммунарке, при условии соответствия критериям «цитокиновой бури», а также в случае отсутствия противопоказаний к терапии в соответствии с текущими актуальными методическими рекомендациями Министерства здравоохранения Российской Федерации [8]. Пациенты, получавшие терапию тоцилизумабом, были статистически значимо моложе и имели меньшие оценки по SOFA и APACHE II; доля пациентов, получавших тоцилизумаб в группе НИВЛ, также статистически значимо выше. В отсутствие статистически значимых различий между группами во времени, прошедшем от госпитализации до введения тоцилизумаба, меньшая частота введения блокатора рецепторов к ИЛ-6 может быть объяснена большей исходной тяжестью пациентов в группе ИВЛ, не связанной с проявлениями «цитокиновой бури», в т. ч. развитием сепсиса.
Тактика ранней трахеостомии во время проведения ИВЛ у пациентов с ОРДС, вызванным SARS-CoV-2, способствует ранней активизации после прекращения миорелаксации путем минимизации потребности в медикаментозной седации, возможности раннего начала мероприятий по реабилитации.
К безусловным ограничениям исследования можно отнести отсутствие данных о применении устройств для высокопоточной оксигенотерапии, зарекомендовавших себя на сегодняшний день в качестве важного инструмента РП как в отделениях интенсивной терапии, так и за их пределами. Данные были исключены из анализа в связи с незначительным количеством наблюдений во время «первой волны» пандемии. Это обусловлено недостаточной представленностью в клинике устройств для ее проведения в анализируемый период. Кроме того, на ранних этапах изучения COVID-19 методика получила оценку экспертов как имеющая субоптимальное соотношение ожидаемой эффективности для пациента и возможной угрозы безопасности для медицинского персонала. По соображениям безопасности продуктивность подобных систем была лимитирована 40 л/мин с целью минимизации образования аэрозолей в палате интенсивной терапии.
Также ограничения интерпретации результатов исследования связаны с его ретроспективным когортным дизайном, а следовательно, с отсутствием возможности влияния на включаемую популяцию, а также полноту и характер регистрируемых данных.
Пациенты, находящиеся на лечении в ОРИТ и получающие РП в форме неинвазивной или эндотрахеальной ИВЛ, имеют высокий исходный уровень коморбидности, популяция сбалансирована по основным демографическим показателям.
Показания к НИВЛ могут быть расширены в группе пациентов с исходно более низкими индексом Чарлсона, оценками по шкалам APACHE II и SOFA. 30-дневная выживаемость статистически значимо хуже у пациентов с безуспешной НИВЛ в сравнении с ранним началом ИВЛ, что диктует необходимость раннего выявления критериев высокого риска неэффективности неинвазивных методов РП. Также требует идентификации и дальнейшего исследования популяция пациентов с COVID-19, в которой раннее начало ИВЛ не приводит к улучшению выживаемости.
Применение модальностей ИВЛ с управлением ДО у пациентов с COVID-19 связано со статистически значимым снижением 30-дневной выживаемости и повышенным ОР летального исхода и не связано с показателями интегральной оценки тяжести состояния пациента.
Необходим дальнейший анализ применения экстракорпоральных методов лечения с целью выявления группы пациентов, у которых применение ПЗПТ взаимосвязано с более высокой 30-дневной выживаемостью.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Проценко Д.Н., Тюрин И.Н., Авдейкин С.Н. — методическое руководство, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи; Матюшков Н.С. — разработка концепции статьи, методическое руководство, разработка системы регистрации и базового анализа данных с применением облачных систем, сбор, систематизация и базовый анализ данных на уровне структурного подразделения, получение и анализ фактических данных, написание и редактирование текста статьи, статистический анализ данных, проверка и утверждение текста статьи; Костин Д.М. Казаков Д.Н., Средняков А.В., Боярков А.В. — сбор, систематизация и базовый анализ данных на уровне структурного подразделения, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.