Декомпрессивная краниэктомия (ДК) является достаточно часто выполняемой нейрохирургической операцией, направленной главным образом на устранение выраженной и резистентной к терапевтическим мероприятиям внутричерепной гипертензии в остром периоде у пострадавших с тяжелой черепно-мозговой травмой и церебральными сосудистыми катастрофами (злокачественный ишемический инсульт, тяжелое аневризматическое субарахноидальное кровоизлияние, синус-тромбоз) [1–9]. Последствием ДК, в случае если пациент переживает острый период катастрофы, является наличие обширных костных дефектов свода черепа, иногда двухсторонних, что представляет определенную опасность для этих больных и создает косметические проблемы. Для закрытия костных дефектов после ДК обычно производится пластическая операция закрытия этих дефектов с помощью аутокости (если ее удалось сохранить), различных синтетических пластических материалов или металлических пластин [10–12]. Эта операция обычно производится отсроченно, когда состояние пациента уже стабильно, как правило, она не представляет каких-либо технических сложностей и не сопровождается какими-либо осложнениями. Однако в нашей практике мы столкнулись с редкой ситуацией — внезапным развитием массивного отека мозга в ближайшем послеоперационном периоде после неосложненной двухсторонней краниопластики. Ниже приведено описание этого наблюдения.
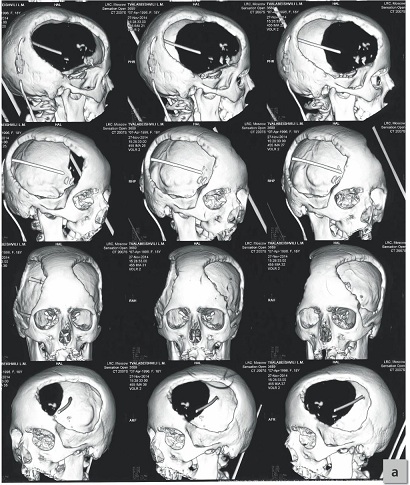
Пациентка Т., 18 лет, поступила в нашу клинику с диагнозом: последствия перенесенной тяжелой сочетанной черепно-мозговой травмы, формирующееся вегетативное состояние, двухсторонние костные дефекты свода черепа. Из анамнеза известно, что за 8 мес. до настоящей госпитализации, в результате ДТП (автоавария) пациентка получила тяжелую черепно-мозговую травму: ушиб головного мозга тяжелой степени с открытым переломом костей лица, ротационным вывихом в правом межпозвонковом суставе С1–С2 и подвывихом атланто-зубовидного сустава. Была доставлена в крайне тяжелом состоянии в ближайшую больницу, где ей была произведена в тот же день двухсторонняя ДК в лобно-височно-теменных областях. В последующем пациентка получила весь комплекс мер интенсивной терапии, используемый у пострадавших с тяжелой черепно-мозговой травмой, включая трахео- и гастростомию, установку вентрикуло-перитонеального шунта в связи с развитием посттравматической гидроцефалии. Результатом проведенного лечения стало формирование вегетативного состояния. Через 3 мес. с момента получения травмы, на фоне стабильного состояния пациентки, она была переведена по настоянию родственников в реабилитационную клинику в Израиль. Проведенное там лечение особых результатов не дало, но, со слов родственников, в начале лечения по непонятной причине у пациентки развился кратковременный эпизод асистолии, который был купирован реанимационными мероприятиями. На момент поступления в нашу клинику состояние пациентки тяжелое, вегетативное состояние, контакта с ней нет, лежит с периодически открытыми глазами. Массивные двухсторонние костные дефекты как следствие произведенной ранее ДК (рис. 1). Дыхание самостоятельное, через трахеостому. Питание через гастростому, мочеиспускание по постоянному мочевому катетеру. Цель госпитализации в наш центр — закрытие костных дефектов черепа.



Рис. 1. Дооперационные КТ пациентки Т.
Видны большие двухсторонние дефекты костей свода черепа и шунт.
Fig. 1. Preoperative CT scan of patient T.
После стандартной предоперационной подготовки пациентка была взята в операционную для проведения краниопластики. Анестезиологическое обеспечение: пропофол в/в, в виде постоянной инфузии + небольшие дозы мидазолама в начале операции + фентанил болюсно по ходу операции. Миорелаксация — рокурония бромид. Искусственная вентиляция легких (ИВЛ) через трахеостому кислородно-воздушной смесью (FiO2 = 0,3) в режиме нормовентиляции. Течение анестезии гладкое, кровопотеря за всю операцию — не более 100 мл, инфузионная терапия — кристаллоиды.
Объем хирургического вмешательства, как и планировалось, свелся к пластическому закрытию обширных двухсторонних костных дефектов свода черепа с использованием стереолитографической модели черепа и пресс-форм имплантов. Операция была окончена ушиванием мягких тканей в области операционных ран с установкой под кожу субгалеальных активных дренажей с двух сторон. По окончании операции пациентка на ИВЛ мешком Амбу была переведена в палату пробуждения, где были продолжены ИВЛ в режиме SIMV и мониторинг основных физиологических параметров.
Все было спокойно, но через полтора часа после окончания операции у пациентки была отмечена тенденция к артериальной гипотензии и тахикардии, но самое неприятное — в этот же момент было отмечено появление двухстороннего мидриаза, свидетельствующего о какой-то остро развившейся интракраниальной катастрофе. Снижение артериального давления было устранено в/в инфузией вазопрессоров, и пациентка была переведена в отделение реанимации. Там ей была незамедлительно произведена контрольная компьютерная томография головного мозга, которая показала выраженный диффузный отек всех структур головного мозга, включая заднюю черепную ямку. Причина такого остро развившегося массивного отека мозга после неосложненной краниопластики оставалась не вполне понятной, но, учитывая высокую вероятность выраженной внутричерепной гипертензии на фоне такого отека мозга, было решено незамедлительно удалить установленные костные импланты и субгалеальные дренажи, что и было сделано в условиях операционной.
Далее пациентке проводилась интенсивная терапия в условиях отделения реанимации. На вторые сутки после операции пациентке была произведена магнитно-резонансная томография головного мозга, которая подтвердила наличие выраженного диффузного отека мозгового вещества во всех отделах мозга (рис. 2). Кроме того, были обнаружены множественные мелкие кровоизлияния практически во всех отделах мозга. Признаков тромбоза магистральных артериальных и венозных сосудов мозга отмечено не было.
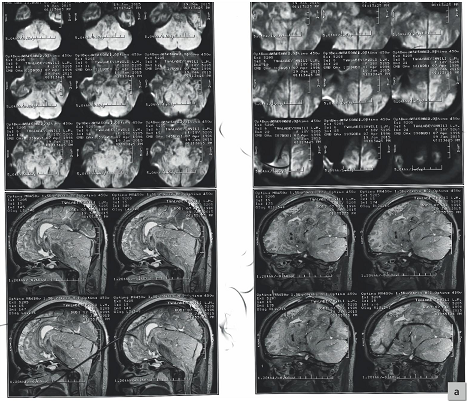
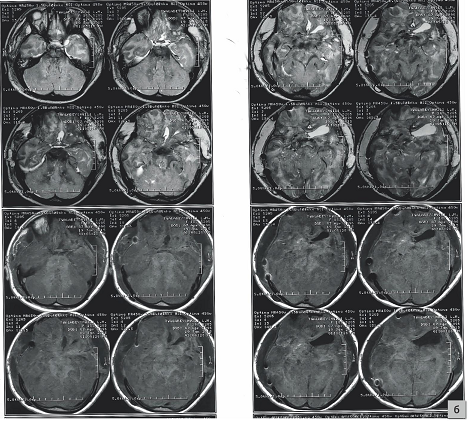
Рис. 2. Магнитно-резонансная томография больной Т., выполненная на 2-е сутки после операции
Видны выраженный диффузный отек мозгового вещества во всех отделах мозга и мелкоточечные кровоизлияния.
Fig. 2. MRI patient T., performed on the 2nd day after surgery
На фоне проводимой интенсивной терапии состояние пациентки постепенно стабилизировалось. Показатели системной гемодинамики стабильны, необходимость в вазопрессорной поддержке отсутствует. ИВЛ через трахеостому во вспомогательном режиме. Инфузионная терапия через центральный венозный катетер, питание через гастростому, диурез по постоянному мочевому катетеру. Электроэнцефалография, записанная на 4-й день после операции, выявила низкий уровень биоэлектрической активности: альфа-ритм не регистрируется, частые колебания бета-диапазона регистрируются в центрально-лобных областях, больше справа. Медленные волны дельта-диапазона низкой амплитуды, полиморфного характера, отмечаются в правом полушарии, больше в центрально-лобно-передне-височной области. Реакции на афферентные раздражения (ритмический свет, звук, болевое раздражение) не получено. Неврологически — вегетативное состояние, без какой-либо динамики. Такое состояние пациентки сохранялось в течение четырех с половиной лет: она оставалась пациенткой отделения интенсивной терапии в нашей клинике, главным образом по настоянию родственников. По прошествии этого периода времени пациентка погибла от тяжелых респираторных нарушений.
Краниопластика является достаточно часто выполняемым нейрохирургическим вмешательством. Чаще всего она производится для устранения последствий ДК у пострадавших с тяжелой черепно-мозговой травмой или больных с церебральными сосудистыми катастрофами [1–9]. Выполнение краниопластики не предусматривает каких-либо воздействий на мозговое вещество, и даже твердая мозговая оболочка при этой операции не вскрывается. Состояние больных, идущих на эту операцию, как правило, стабильно, так как она производится в отсроченном периоде травмы или сосудистой катастрофы. Поэтому краниопластика редко осложняется какими-либо серьезными проблемами. Тем невероятнее кажется ситуация, с которой мы столкнулись в нашей клинической практике. Что же случилось с нашей пациенткой через полтора часа после окончания неосложненной и, по сути, внемозговой операции? Мы неоднократно обсуждали эту клиническую ситуацию, и при этом высказывались самые разные предположения.
Первый фактор — краниопластика. Несмотря на свою кажущуюся простоту и относительную неинвазивность, краниопластика, оказывается, обладает выраженным эффектом на церебральную гемодинамику, причем даже односторонняя. Как было показано в серии многочисленных клинических исследований, герметизация полости черепа вызывает существенное увеличение значений линейного и объемного мозгового кровотока (последний эффект может быть результатом устранения эффекта атмосферного давления) [21–28]. Механизм этого эффекта остается до конца непонятным, но, возможно, именно он является причиной прогрессивного клинического улучшения в неврологическом статусе у этих больных после герметизации полости черепа и ликвидации эффекта атмосферного давления [21–23, 29–33].
Второй фактор — активные субгалеальные дренажи. Скопление крови в области операционной раны под кожным лоскутом является несерьезным, но неприятным осложнением любой нейрохирургической операции. Для предупреждения такого скопления и были разработаны эти простые, дешевые и эффективные устройства. Однако анализ данных литературы дал достаточно настораживающую информацию: оказывается, что в некоторых наблюдениях применение активного субгалеального дренирования приводило к таким серьезным осложнениям, как образование интракраниальной гематомы, псевдогипоксический отек мозга, разрыв не полностью клипированной аневризмы и аксиальная дислокация в краниальном направлении, сопровождающаяся рефлекторной асистолией [34–41]. Считается, что отрицательное давление, создаваемое активным субгалеальным дренажем, может определенным образом передаваться в полость черепа, создавая там условия для интракраниальной гипотензии со всеми вытекающими последствиями [34, 37–39]. В нашем наблюдении таких дренажей было использовано два, и к моменту обнаружения мидриаза оба были практически полными, а емкость каждой «груши» составляет не менее 100–150 мл.
Можно предположить, что эффекты двухсторонней краниопластики и активного субгалеального дренирования могли суммироваться и создать реальные условия для острого увеличения объемного мозгового кровотока у нашей пациентки, а дальнейшее развитие тотального отека мозгового вещества и множественных геморрагий было следствием этой церебральной гиперемии.
Анализ данных литературы показал, что наше наблюдение не является уникальным и в мире описан ряд аналогичных клинических ситуаций [40, 42–46]. В них приведено описание единичных клинических наблюдений развития тяжелого отека мозга после неосложненной краниопластики. Авторы этих работ, так же как и мы, не имеют абсолютной доказательной базы, объясняющей развитие данного осложнения, но ход их рассуждений в попытке найти объяснение этому феномену близок к нашему.
Ситуацию с нашим клиническим наблюдением и другими аналогичными существенно изменил и дополнил метаанализ, проведенный мексиканскими авторами и опубликованный в World Neurosurgery в марте 2018 г. [47]. Эта относительно свежая публикация многое, хотя и не все, объясняет, и поэтому, на наш взгляд, она достойна более детального рассмотрения.
Авторы анализа сконцентрировали свое внимание на проблеме MBSC (Massive Brain Swelling after Cranioplasty). К сожалению, здесь даже терминологически не все так просто, и авторы справедливо указывают, что для этого состояния в литературе есть и используются и другие определения: «смерть после краниопластики»; «отек мозга после краниопластики» и др. Тем не менее авторы проделали большую работу. По нескольким медицинским базам данных, начиная с 1960 и по 2017 г., они отобрали подходящие по смыслу (правда, только на английском языке) публикации, в соответствии с рекомендациями PRISMA (Preffered Reporting Items for Systematic Reviews and Meta-Analysis). Сначала отобранных работ было 534 (главным образом это были описания единичных клинических наблюдений или их небольших серий), затем их количество существенно сократилось (до 19), и это позволило обобщить уже достаточно репрезентативный материал из 26 пациентов.
Возраст пациентов составлял от 14 до 77 лет. Причинами декомпрессивной трепанации были черепно-мозговая травма (52 %), острое нарушение мозгового кровообращения (44 %), но у возрастных пациентов острое нарушение мозгового кровообращения было все же ведущей причиной. Тип краниотомии был таким: у 21 пациента (81 %) это была гемикраниэктомия, у остальных — двухсторонняя краниэктомия. Шунт к моменту проведения краниопластики был имплантирован 11 пациентам (44 %). По типу краниопластического материала — в 50 % случаев это была аутокость, в остальных — различные пластические материалы.
Интерес представляют временны́е показатели. Время проведения краниопластики с момента развития церебральной катастрофы варьировало от 1 до 17 мес. (в среднем 3 мес.). Время с момента окончания операции краниопластики и до развития отека мозга варьировало от 15 мин и до 16 ч (в среднем 3,3 ч).
Клинические проявления. Самыми частыми были мидриаз и кома. Судороги развились у 30 % пациентов. Радиологическая картина была одинаковой у всех больных: диффузный отек мозга со сдавлением резервных ликворных пространств. В некоторых наблюдениях были отмечены признаки интрапаренхимальной геморрагии.
Ну и наконец, лечение и исходы. Самым частым вариантом хирургического вмешательства (65 % пациентов) было немедленное удаление костных имплантов. Однако одним пациентам противоотечная терапия проводилась, а другие (n = 4) никакого лечения не получили. При этом летальность составила 88 %, а трое выживших пациентов остались глубокими инвалидами. Таковы данные анализа этой серии наблюдений из 26 пациентов. Что же позволяет предположить данная информация?
Достаточно широко используемая в клинической практике технически не сложная и относительно малоинвазивная операция краниопластики, оказывается, может быть связана с серьезной перестройкой мозгового кровообращения и реальной угрозой развития тяжелого специфического осложнения — острого массивного отека мозга. Хирургам, производящим такие операции, и всей хирургической бригаде следует помнить о таком варианте развития событий и быть к этому готовыми. Что же касается активных субгалеальных дренажей, то эти устройства, по-видимому, должны быть изъяты из практики и более не использоваться, так как риск связанных с ними осложнений и значимость этих осложнений для дальнейшей судьбы больного несопоставимы с их потенциальной пользой.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Лубнин А.Ю. — сбор и анализ литературы, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи; Савин И.А., Ошоров А.А., Попугаев К.А., Потапов А.А. — лечение пациентки, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
ORCID авторов
Лубнин А.Ю. — 0000-0003-2595-5877
Савин И.А. — 0000-0003-2594-5441
Ошоров А.А. — 0000-0002-3674-252X
Попугаев К.А. — 0000-0003-1945-323X
Потапов А.А. — 0000-0002-3873-6246