В декабре 2019 г. в г. Ухане, провинция Хубэй (Китай), произошла вспышка пневмонии неизвестной этиологии, которая затронула более 60 человек к 20-му числу того же месяца. 31 декабря Уханьский муниципальный комитет здравоохранения проинформировал Всемирную организацию здравоохранения о том, что у 27 человек была диагностирована пневмония неизвестной причины, причем 7 из них находятся в критическом состоянии. Вирус Severe acute respiratory syndrome-related coronavirus 2 (SARS-CoV-2) вызывает патологический процесс, который может протекать бессимптомно или представлять собой легкое поражение верхних дыхательных путей, в то время как в наиболее тяжелых случаях развиваются респираторный дистресс-синдром, полиорганная дисфункция и септический шок [1, 2].
Критическое состояние любой этиологии, как правило, ассоциируется с гиперметаболизмом и выраженным катаболизмом. Одним из наиболее распространенных методов оценки выраженности катаболического синдрома является определение азотистого баланса [3]. Концепция т. н. азотистого баланса заключается в том, что разница между потреблением и потерей азота отражает прирост или потерю общего белка в организме человека. Азотистый баланс в пределах от –4 или –5 г/сут до +4 или +5 г/сут обычно считается «азотным равновесием». С практической точки зрения определение баланса азота имеет свои ограничения. Наиболее популярный метод оценки азотистого баланса, используемый в клинической практике, предполагает, что общая потеря азота равна экскреции азота мочевины с мочой и дополнительной постоянной потере еще 4 г/сут [4, 5]. Постоянный коэффициент 4 г/сут позволяет предположить, что 2 г азота приходятся на немочевинный азот мочи, а оставшиеся 2 г из 4 г — на кожу и желудочно-кишечный тракт. Однако все эти допущения недооценивают немочевинный азот мочи (например, аммиак, креатинин, мочевая кислота, аминокислоты) для катаболических критических больных, а также выделение азота через желудочно-кишечный тракт при диарее [6].
Не так давно были опубликованы данные, показывающие, что при увеличении азотистого баланса на каждый 1 г в сутки возрастает вероятность благоприятного исхода заболевания (отношение шансов 1,21; р = 0,03) [7]. Хорошо известно, что особенно пожилые пациенты — преобладающая при новой коронавирусной инфекции (НКИ) категория реанимационных больных — имеют меньшую мышечную и большую жировую массу, чем более молодые пациенты с аналогичной массой тела, и это, безусловно, усугубляет последствия прогрессирования синдрома гиперкатаболизма [8, 9]. Очевидно, что необходимы дальнейшие исследования роли азотистого баланса в отношении клинических исходов у пациентов в критических состояниях.
Цель исследования — оценка прогностической значимости некоторых показателей тяжести катаболического синдрома у пациентов отделений реанимации и интенсивной терапии (ОРИТ) с НКИ.
Исследование проводилось у пациентов ОРИТ Федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России. По дизайну исследование было одноцентровым проспективным, открытым, когортным, клиническим. Категория больных — пациенты ОРИТ с тяжелым течением НКИ COVID-19.
Критерии включения в исследование (необходимо наличие всех указанных критериев):
Критерии исключения (достаточно наличия одного критерия):
Продолжительность наблюдения — от момента включения в исследование до перевода из ОРИТ. Кратность исследований: исходно в течение первых 72 ч, на 4–7-е и 8–14-е сутки пребывания в ОРИТ.
Интенсивная терапия пациентов осуществлялась согласно актуальной версии Временных методических рекомендаций «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» Министерства здравоохранения Российской Федерации, версия 8.1 (01.10.2020). Трансфузию растворов человеческого альбумина 20 % проводили только при снижении уровня альбумина сыворотки крови до 25 г/л и менее.
В качестве критериев тяжести течения катаболического синдрома нами были выбраны показатель суточной экскреции азота с мочой и альбумин сыворотки крови. Для определения суточной потери азота производился сбор мочи, определялся уровень мочевины в моче в ммоль/л. Этот показатель умножали на количество мочи в сутки в литрах. Расчет потери азота производился по формуле: экскреция азота (г/сутки) = мочевина мочи (ммоль/сутки) × 0,033 (г), где 0,033 — коэффициент пересчета мочевины в азот.
Нутритивную поддержку проводили в соответствии с клиническими рекомендациями Федерации анестезиологов и реаниматологов РФ «Метаболический контроль и нутритивная поддержка у пациентов на длительной искусственной вентиляции легких» [28]. Пациенты на неинвазивной искусственной вентиляции легких (ИВЛ) получали энтеральное питание в режиме сиппинга пероральными энтеральными диетами в сочетании с больничным столом. У пациентов на инвазивной ИВЛ зондовое энтеральное питание через назогастральный доступ проводили диетами типа «Стандарт» и «Диабет».
Полученные данные из стандартизированных форм заносились в электронную таблицу формата Microsoft Excel. Параметрические количественные данные представлены в виде среднего значения (М) и в скобках стандартного отклонения (± σ), непараметрические данные — в виде медианы (Me) и в скобках границ межквартильного интервала (границы межквартильного диапазона — 25-й и 75-й центили). Значение вариации показателя в проведенном исследовании выражено с помощью доверительного интервала (ДИ). Размер анализируемой популяции представлен как n; достигнутый уровень значимости — p. Сравнительный анализ непараметрических количественных признаков проводился с помощью критерия Манна—Уитни. Для определения прогностического значения диагностического теста строились кривые операционных характеристик (ROC-кривые) с последующим определением чувствительности и специфичности в точке разделения. Для всех статистических критериев ошибка первого рода устанавливалась равной 0,05. Нулевая гипотеза (отсутствие различий) отвергалась, если вероятность (p) не превышала ошибку первого рода.
Всего в исследование было включено 55 пациентов с тяжелым течением НКИ COVID-19. Средний возраст составил 64,4 (21–79) года, cредняя масса тела — 87,7 (59,7–112,13) кг. Мужчины составили 56,36 % (n = 31), женщины — 43,64 % (n = 24). Впоследствии были сформированы две подгруппы пациентов — с благоприятным (n = 29) и неблагоприятным (n = 26) клиническим исходом.
С целью оценки возможности прогнозировать развитие неблагоприятного исхода заболевания у пациентов с тяжелым течением НКИ COVID-19 нами был проведен ROC-анализ двух наиболее важных показателей, характеризующих выраженность синдрома гиперкатаболизма, — альбумина сыворотки крови и суточной экскреции азота с мочой в течение первых 14 суток лечения в ОРИТ.
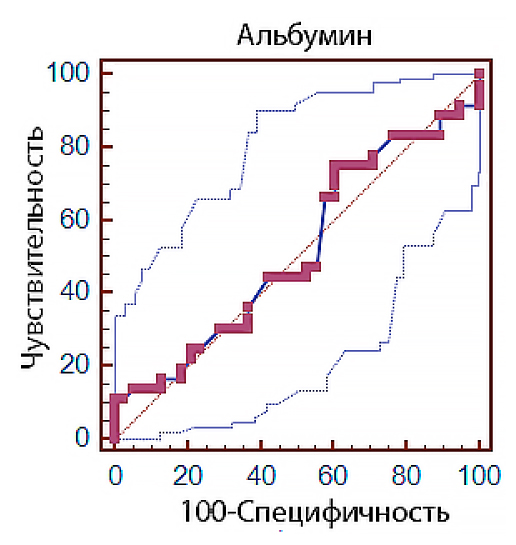
Площадь под ROC-кривой (рис. 1) для альбумина сыворотки крови составила 0,516 (0,397–0,634) (ДИ 0,397–0,634; p = 0,81) с чувствительностью 75 % и специфичностью 39,47 % (табл. 1), что указывает на низкую способность теста прогнозировать развитие неблагоприятного клинического исхода. Точка разделения была определена как 29,7 г/л.
Рис. 1. ROC-кривая влияния уровня альбумина сыворотки крови на клинический исход заболевания у пациентов ОРИТ с НКИ COVID-19
Fig. 1. ROC curve of serum albumin level effect on the clinical outcome in ICU patients with COVID-19

Анализ динамики альбумина сыворотки крови у выживших и умерших пациентов не выявил каких-либо достоверных различий на всех этапах исследования. Также обращает на себя внимание, что в обеих сравниваемых подгруппах альбумин сыворотки крови снижался умеренно и колебался в диапазоне 29–32 г/л.
Как видно на рис. 2, площадь под ROC-кривой для показателя суточной экскреции азота составила 0,624 (ДИ 0,49–0,76; p = 0,09) с чувствительностью 75,9 % и специфичностью 58,1 % (табл. 1), что указывает на умеренную способность теста прогнозировать развитие неблагоприятного исхода. Точка разделения была определена как 20 г азота в сутки, что говорит в повышении риска развития неблагоприятного исхода при суммарной суточной потере белка более 130–135 г с учетом внепочечных потерь азота.
Рис. 2. ROC-кривая влияния уровня экскреции азота с мочой на клинический исход заболевания у пациентов ОРИТ с НКИ
Fig. 2. ROC curve of daily urea nitrogen excretion effect on the clinical outcome in ICU patients with COVID-19
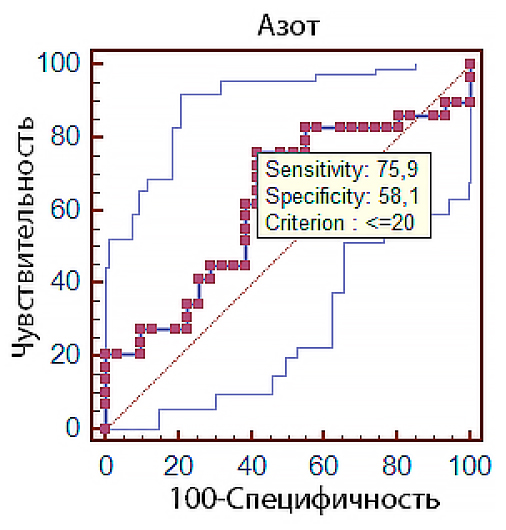
Таблица 1. Результаты ROC-анализа показателей суточной экскреции азота с мочой и альбумина сыворотки крови у пациентов с тяжелым течением НКИ COVID-19 в течение 14 суток пребывания в ОРИТ
Table 1. Results of ROC analysis of daily urinary nitrogen excretion and serum albumin in patients with severe COVID-19 during 14 days of ICU stay
| Фактор | Площадь под ROC-кривой | Точка разделения | Чувствительность (ДИ), % | Специфичность (ДИ), % | Уровень р |
|---|---|---|---|---|---|
| Суточная экскреция азота с мочой | 0,624 (0,49–0,76) | ≤ 20 | 75,9 (56,5–89,7) | 58,1 (39,1–75,5) | 0,09 |
| Альбумин сыворотки крови | 0,516 (0,397–0,634) | ≥ 29,7 | 75 (57,8–87,9) | 39,47 (24–56,6) | 0,81 |
| ДИ — доверительный интервал. | |||||
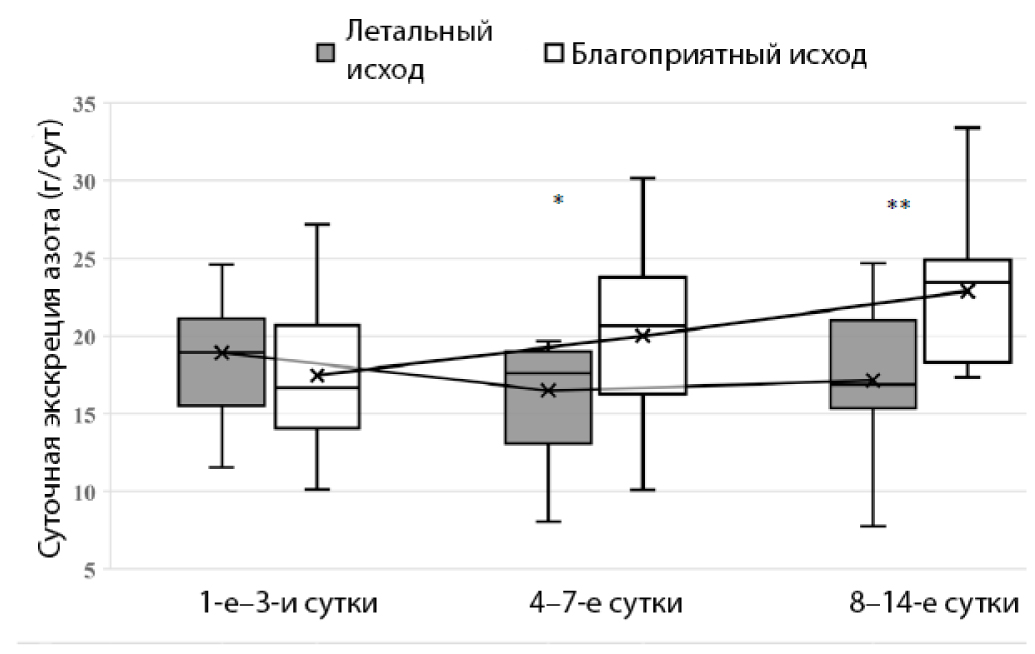
Следует отметить, что при сравнении динамики суточной экскреции азота с мочой было выявлено, что у выживших пациентов наблюдалось достоверное увеличение суточной экскреции азота мочи на 4–7-е (p = 0,022) и 8–14-е сутки (p = 0,011) интенсивной терапии по сравнению с группой пациентов с неблагоприятным исходом заболевания (рис. 3).
Рис. 3. Динамика показателя суточной экскреции азота в группах с благоприятным и неблагоприятным клиническим исходом в течение 14 суток пребывания в ОРИТ
* p < 0,05; ** p < 0,01
Fig. 3. Dynamics of daily nitrogen excretion in groups with positive and negative clinical outcome during 14 days of stay in ICU
* p < 0,05; **p < 0,01
Генерализованная инфекция, политравма, обширное хирургическое вмешательство сопровождаются той или иной степенью гиперкатаболизма. Тяжелое течение НКИ COVID-19, безусловно, представляет собой специфический вариант системной воспалительной реакции, при которой манифестация органной дисфункции, как правило, начинается с повреждения легких. Острое повреждение легких — самое раннее и наиболее частое осложнение со стороны органов и систем при длительных катаболических состояниях [10]. Повреждение тканей, вызванное вирусом SARS-CoV-2 и запущенной аутоиммунной реакцией на альвеолярном уровне, характеризуется патологическими изменениями виде инфильтрации, гиперплазии и раннего фиброза. Данные об особенностях катаболического синдрома при НКИ СOVID-19 пока достаточно скудны, противоречивы и не систематизированы [11].
В условиях интенсивной терапии сывороточный альбумин долгое время считался предиктором неблагоприятного клинического исхода, что было подтверждено рядом публикаций. У 83 пациентов в критическом состоянии снижение концентрации альбумина в плазме сопровождалось увеличением проницаемости легочных сосудов независимо от основного заболевания и жидкостного статуса. Уровни альбумина крови продемонстрировали высокую чувствительность и отрицательную прогностическую ценность для прогнозирования повышенной проницаемости легочных сосудов и риска развития респираторного дистресс-синдрома [12].
В метаанализе 90 когортных исследований с участием более 290 тыс. пациентов, оценивающих гипоальбуминемию в качестве предиктора негативного клинического исхода с помощью многофакторного анализа, и в 9 проспективных контролируемых исследованиях по коррекции гипоальбуминемии, в которых участвовали 535 пациентов, связь между гипоальбуминемией и неблагоприятным исходом оказалась очевидной, независимо от статуса питания и выраженности воспалительного процесса [13]. Более поздние исследования с участием почти 6000 взрослых пациентов также показали, что гипоальбуминемия при поступлении является независимым маркером 30-суточной летальности от всех причин [14]. По результатам проведенного нами исследования мы делаем вывод о низкой прогностической ценности альбумина сыворотки крови при тяжелом течение НКИ COVID-19. Однако еще в марте 2020 г. китайскими исследователями были опубликованы данные, демонстрирующие достоверно более низкие уровни альбумина крови у умерших пациентов с НКИ COVID-19. Cледует отметить, что средние уровни альбумина крови в нашем исследовании и в работе китайских коллег были очень схожи (29,1–35,8 г/л) [15]. Также немаловажно, что опубликованные в 2019 г. результаты клинического исследования, оценивающего прогностические уровни гипоальбуминемии, продемонстрировали, что сывороточный альбумин 24,5 г/л был определен как пороговое значение, оптимальное для прогнозирования краткосрочной и долгосрочной смертности у пациентов ОРИТ с септическим шоком [29].
Показатель суточной экскреции азота с мочой, напротив, имел умеренную прогностическую ценность, что было продемонстрировано в ходе ROC-анализа. Может быть, более важной находкой следует считать выявленный тренд достоверного роста, а не снижения, как следовало бы предполагать, потерь азота с мочой в группе выживших пациентов. Такого рода результат может быть обоснован исследованиями, подробно объясняющими целесообразность развития процессов мышечного катаболизма для восстановления тканей после перенесенной политравмы [16, 17]. Также в недавно опубликованном российском исследовании, посвященном анализу расстройств белкового обмена при торакоабдоминальной травме, авторами был описан восходящий тренд суточных потерь азота с максимальными значениями экскреции азота с мочой на 7–10-е сутки интенсивной терапии [18]. Объяснение подобного феномена может быть построено на нескольких гипотезах. Во-первых, высокие темпы катаболизма характерны для прогрессирования воспалительной реакции и могут быть вызваны активацией пролиферативных (аутоиммунных) процессов, развивающихся при закономерном тяжелом течении НКИ COVID-19 [19]. Во-вторых, рост катаболизма в группе выживших может быть объяснен известной концепцией активации «аутофагии» как классического механизма саногенеза при критических состояниях. Активация аутофагии при критических состояниях ранее интерпретировалась как негативная реакция, которая способствует гиперкатаболизму и истощению. Однако гипотеза о том, что аутофагия может быть защитной для скелетных мышц и других органов во время критического состояния изначально была озвучена и заслуживает рассмотрения в свете данных, полученных в работах, выполненных на экспериментальных животных (мыши с аутофагией, селективной к различным тканям) [20, 21]. Фактически ранее не изучалось, достаточно ли активирована аутофагия, чтобы справиться с серьезным клеточным повреждением, вызванным критическим состоянием. Тем не менее клиническое исследование, в котором учитывались последствия недостаточной аутофагии, подтвердило подобные неблагоприятные изменения в скелетных мышцах и печени у пациентов в критическом состоянии. Они заключались в накоплении агрегатов убиквитина и других субстратов аутофагии, таких как деформированные митохондрии и аберрантные концентрические мембранные структуры [22, 23]. Голодание является самым сильным физиологическим активатором аутофагии, тогда как питание и инсулин тормозят этот механизм [24]. Мышечная биопсия, выполненная у пациентов ОРИТ, показала подавление активации аутофагии с ранним, по сравнению с поздним, началом парентерального питания, но в отсутствие какого-либо влияния на маркеры развития атрофии мышц [25]. Адекватная активация аутофагии, по-видимому, имела решающее значение для обеспечения защиты от митохондриальной дисфункции, повреждения печени и почечной недостаточности в моделях критических состояний у экспериментальных животных [26, 27].
Необходимо отметить и важные ограничения нашего исследования. Безусловно, на реанимационного пациента оказывает влияние целый ряд факторов, которые могут снижать или повышать скорость метаболизма, а именно: седация и анальгезия, миоплегия, применение глюкокортикоидов, режим ИВЛ, инфекционные осложнения, объем и качество нутритивной поддержки. Поскольку зачастую выделить влияние какого-либо фактора в практических условиях бывает крайне сложно, мы исходили из посыла о равносильном воздействии этих факторов на пациентов в группе выживших и умерших. Мы, действительно, выявили феномен роста потерь азота с мочой в группе выживших пациентов с 4-х по 14-е сутки. Однако в группе умерших не было выявлено снижение потерь азота; потери азота исходно были умеренно повышены по сравнению с нормальными показателями и не менялись в течение всего периода наблюдения. Длительность наблюдения всего 14 суток от момента поступления в ОРИТ не позволяет нам сделать вывод, о том, что чем ниже потери азота у пациентов с НКИ COVID-19, тем выше летальность. Возможно, если бы исследование было продлено до выписки пациентов из стационара, данная формулировка была бы более корректной.
Альбумин сыворотки крови в условиях системной воспалительной реакции не может рассматриваться в качестве предиктора клинического исхода при тяжелом течении НКИ COVID-19. Напротив, показатель суточной экскреции азота с мочой является более точным прогностическим маркером неблагоприятного клинического исхода заболевания. Основной особенностью течения катаболического синдрома у пациентов с благоприятным исходом НКИ COVID-19 является прогрессирующее увеличение показателя экскреции азота с мочой с 4-х по 14-е сутки интенсивной терапии. Тем не менее полученные результаты не должны быть восприняты прямолинейно непосредственно для определения стратегии и тактики нутритивной поддержки, в частности, агрессивной энтеральной или парентеральной нагрузки источниками азота. Выявленные закономерности позволяют предположить, что динамический метаболический мониторинг, основанный на таких методах, как непрямая калориметрия, оценка азотистого баланса, ключевых маркеров соматического и висцерального пула белка, является важным подходом при практической реализации персонализированного подхода к выбору стратегии и тактики нутритивно-метаболической терапии. Особенности катаболического синдрома при НКИ COVID-19, безусловно, требуют дальнейшего всестороннего описания и анализа.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Лейдерман И.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи, обоснование научной значимости; Лестева Н.А. — получение и анализ фактических данных, проверка и утверждение текста статьи; Кашерининов И.Ю. — получение и анализ фактических данных, проверка и утверждение текста статьи; Кузьмин А.С. — получение и анализ фактических данных, проверка и утверждение текста статьи; Ахимов П.С. — получение и анализ фактических данных; Каншаов Н.З. — получение и анализ фактических данных; Баринова С.А — получение и анализ фактических данных; Мазурок В.А. — редактирование текста статьи, проверка и утверждение текста статьи, обоснование научной значимости.