
Повышенное давление в малом круге кровообращения (МКК) считается фактором, ассоциированным с неблагоприятными исходами кардиохирургических вмешательств у взрослых [1, 2] и детей [3].
Повышение среднего давления в легочной артерии (ДЛАср.) ≥ 25 мм рт. ст., в соответствии с клиническими рекомендациями Европейского общества кардиологов, трактуется как легочная гипертензия (ЛГ) [4]. Современные международные рекомендации указывают на наличие пяти клинических групп ЛГ:
I — легочной артериальной гипертензии (ЛАГ);
II — ЛГ, обусловленной заболеваниями левых отделов сердца;
III — ЛГ, ассоциированной с заболеваниями легких и/или гипоксемией;
IV — хронической тромбоэмболической ЛГ;
V — ЛГ с неясными и/или смешанными механизмами [4].
При кардиохирургических вмешательствах у взрослых пациентов повышение давления в МКК вызвано наличием ЛГ I, II и IV групп. В детской кардиохирургии в большинстве случаев ЛГ представлена состояниями I группы. Этот вариант ЛГ является прекапиллярным, поскольку повышение ДЛА вызвано гипердинамией и/или увеличением сопротивления на артериальном участке русла МКК [4–6]. В соответствии с современной международной классификацией, такие дети относятся к группе 1.4.4 ЛАГ. Указанная группа включает пациентов с операбельным и неоперабельным врожденными пороками сердца (ВПС) [4, 5]. Преходящая ЛГ после коррекции ВПС встречается в 21,9 случая на миллион населения и является одной из самых распространенных форм ЛАГ у детей [5].
Прекапиллярная ЛГ после кардиохирургических операций у детей опасна вследствие риска декомпенсации с развитием острой правожелудочковой недостаточности [7]. В интенсивной терапии прекапиллярной ЛГ ключевое значение отводится вазодилататорам МКК. Применение этих препаратов у взрослых и детей в послеоперационном периоде кардиохирургических вмешательств сопровождается значимым улучшением гемодинамики и высокой клинической эффективностью, что было доказано во многих исследованиях [7–11]. Вазодилататоры МКК, используемые для интенсивной терапии острой декомпенсации прекапиллярной ЛГ и правожелудочковой недостаточности, должны соответствовать специфическим требованиям: минимально воздействовать на большой круг кровообращения, не иметь отрицательного инотропного эффекта, быть хорошо управляемыми [12]. Данным требованиям в большей степени соответствует ингаляционный оксид азота (NO), что делает этот газ препаратом выбора для интенсивной терапии декомпенсации прекапиллярной ЛГ, в т. ч. в послеоперационном периоде кардиохирургических вмешательств у детей [7, 11, 13–15].
Из альвеолярного пространства молекулы NO попадают в прекапиллярный и капиллярный участки русла МКК. В гладких мышечных клетках сосудов NO повышает активность гуанилатциклазы, за счет чего увеличивается содержание циклический гуанозинмонофосфат (цГМФ). Результатом указанного воздействия становится падение чувствительности сократительных белков к Сa+2, а также снижение поступления Сa+2 в клетку и уменьшение выхода этого иона из саркоплазматической сети [16, 17]. Селективная легочная вазодилатация обусловлена тем, что NO обладает высокой степенью сродства к гемоглобину с образованием метгемоглобина. Вдыхаемый NO не попадает в большой круг кровообращения, поэтому его выраженный вазодилатирующий эффект ограничен легкими [18, 19].
Сегодня в отделениях реанимации и интенсивной терапии (ОРИТ) используется NO, доставляемый в лечебные учреждения в баллонах в концентрации 0,1 % (1000 частей на миллион [parts per million, ppm]) под давлением 150 атм. Кроме самого газа, современная технология подачи NO требует наличия дозирующего устройства, организации закупки, хранения и оборота баллонов. Указанные особенности значительно ограничивают широкое использование ингаляционной терапии NO.
В Российском федеральном ядерном центре — Всероссийском научно-исследовательском институте экспериментальной физики (ФГУП «РФЯЦ — ВНИИЭФ») впервые в мире был создан аппарат, способный синтезировать NO методом электрического разряда [20]. На основании разрешения Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор) клинические испытания медицинского изделия «Аппарат для терапии оксидом азота АИТ-NO-01» у взрослых пациентов и детей были проведены в ФГБУ «НМИЦ им. В.А. Алмазова».
Цель исследования — изучить клиническую эффективность и безопасность применения метода синтеза NO из атмосферного воздуха в послеоперационном периоде кардиохирургических операций у детей. Гипотеза исследования: ингаляционная терапия NO в послеоперационном периоде кардиохирургических вмешательств у детей с применением аппарата АИТ-NO-01 не менее эффективна и не менее безопасна, чем при использовании метода доставки NO из баллонов.
В период с 01.07.2019 по 12.05.2020 в ФГБУ «НМИЦ им. В.А. Алмазова» было выполнено одноцентровое когортное исследование с ретроспективным контролем. Протокол настоящего исследования был одобрен в соответствии с разрешением на проведение клинических испытаний № 755/2018 от 27.09.2018 (Заключение № 655-1112/1-18 от 17.09.2018 о возможности проведения клинических испытаний) Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор). Кроме того, было получено Заключение Совета по этике Министерства здравоохранения Российской Федерации об этической обоснованности клинических испытаний медицинского изделия с участием человека № 17 от 14.01.2019. Проведение исследовательской работы было одобрено локальным этическим комитетом НМИЦ им. В.А. Алмазова на заседании 13.05.2019 (выписка № 050519 из протокола заседания 06-19). Результаты применения метода синтеза NO из атмосферного воздуха с помощью аппарата АИТ-NO-01 (рис. 1) (группа клинического исследования) сравнивали с результатами, полученными в группе ретроспективного контроля при использовании устройства для дозирования NO из баллонов. Пациентам группы ретроспективного контроля оперативные вмешательства на сердце были выполнены в период с января 2018 г. по декабрь 2019 г.
Рис. 1. Аппарат для терапии оксидом азота АИТ-NO-01
Fig. 1. Apparatus for therapy with nitric oxide AIT-NO-01

Были определены следующие критерии включения в исследование: подписанное информированное согласие законного представителя пациента, перенесенная операция на сердце, искусственная вентиляция легких / вспомогательная вентиляция легких (ИВЛ/ВВЛ) через эндотрахеальную / трахеостомическую трубку, систолическое давление в легочной артерии (ДЛАсис.) ≥ 35 мм рт. ст. по данным эхокардиографии (ЭхоКГ). Критерии невключения: метгемоглобинемия, тяжелая левожелудочковая недостаточность (III и IV функционального класса по NYHA), внутричерепное кровоизлияние, геморрагический диатез.
Всего в исследование включили 90 пациентов (28 новорожденных и 62 ребенка старше 28 дней), из них 40 мальчиков и 50 девочек, медиана возраста составила 0,25 (0,28–1,17) года. 45 пациентов вошли в основную группу (применение аппарата АИТ-NO-01), 45 — в группу ретроспективного контроля (использование метода подачи газа из баллона). Всем пациентам были выполнены хирургические вмешательства на сердце. Пластика дефекта межжелудочковой перегородки была проведена в 31 случае, устранение транспозиции магистральных сосудов выполнили у 21 ребенка, пластику дефекта межпредсердной перегородки — в 13 наблюдениях, коррекцию тетрады Фалло осуществили у 4 детей, устранение полного атриовентрикулярного канала провели 5 раз, прочие операции — в 16 случаях. Течение послеоперационного периода у всех новорожденных и детей осложнилось развитием прекапиллярной ЛГ.
Стандартная подготовка пациента к плановой операции включала в себя отказ от приема пищи минимум за 3 ч перед началом оперативного вмешательства. Всем больным во время оперативного вмешательства проводили общую комбинированную анестезию по единому протоколу, принятому в клинике ФГБУ «НМИЦ им. В.А. Алмазова». Индукция в анестезию осуществлялась ингаляцией одной минимальной альвеолярной концентрации (МАК) севофлурана, фентанилом, вводимым внутривенно в дозе 5 мкг/кг. Поддержание анестезии обеспечивали ингаляцией севофлурана (0,75–1 МАК) и внутривенной инфузией фентанила со скоростью инфузии 10 мкг/кг/ч (не менее 50 мкг/кг до момента подключения искусственного кровообращения и не менее 100 мкг/кг за всю операцию).
Стандартный интраоперационный мониторинг включал следующие позиции. Проводили инвазивное измерение артериального давления (АД), постановку центрального венозного катетера с контролем центрального венозного давления (ЦВД), определяли содержание углекислого газа в конечно-выдыхаемой смеси (ЕtCO2) и насыщение гемоглобина артериальной крови кислородом (SaO2), выполняли электрокардиографию, термометрию в прямой кишке и носоглотке, учитывали диурез.
Интраоперационная ИВЛ проводилась со следующими параметрами: фракция кислорода во вдыхаемой смеси (FiO2) — необходимая для поддержания оптимальной SaO2 по ВПС, контроль по объему, дыхательный объем (ДО) — 6–8 мл/кг, частота дыхания (ЧД) — достаточная для поддержания нормокапнии.
Во время оперативного вмешательства экстракорпоральное кровообращение проводили аппаратом Maquet jostra HL30 (Германия) с использованием одноразовых мембранных оксигенаторов Medtronic Affinity Pixie. Подключение осуществляли по стандартной схеме путем канюлирования восходящей аорты, верхней полой вены и нижней полой вены. Во время перфузии поддерживали следующие параметры: среднее перфузионное давление — 30–50 мм рт. ст., объемная скорость перфузии — 3 л/мин/м2. При этом pO2 в артериальной крови удерживали выше 250 мм рт. ст., а pCO2 — с коррекцией по температуре 30–35 мм рт. ст. Температурный режим: умеренная гипотермия. Контроль системной гепаринизации (расчетная доза гепарина 300 Ед/кг) выполняли путем измерения активированного времени свертывания, которое поддерживали выше 400 с. После удаления шунтирующих канюль остаточное действие гепарина нейтрализовали раствором протамина сульфата из расчета 1 мг на 100 ЕД гепарина, под контролем активированного времени свертывания. Противоишемическая защита миокарда осуществлялась кардиоплегией препаратом Кустодиол (Dr. F. Kohler Chemie, GmbH, Германия) однократно.
После выполненного кардиохирургического вмешательства пациентов доставляли в ОРИТ, где продолжались мониторинг и необходимое фармакологическое сопровождение. ИВЛ в послеоперационном периоде проводили аппаратами Babylog VN 500 (Drager, Германия) в режиме нормовентиляции: EtCO2 поддерживали в диапазоне 30–35 мм рт. ст., ДО 6–8 мл/кг, SpO2 в оптимальном диапазоне для ВПС, использовали положительное давление конца выдоха от 5 до 7 см вод. ст. Первоначально применяли режим SIMV (synchronized intermittent mandatory ventilation) с последующим переходом на такие режимы ВВЛ, как BiPAP (biphasic positive airway pressure), а также BiPAP в комбинации с PS (pressure support). После восстановления сознания и мышечного тонуса перед экстубацией использовали режим CPAP (continuous positive airway pressure). После экстубации проводили инсуффляцию увлажненной кислородно-воздушной смесью через носовые катетеры с потоком 3–7 л/мин.
У всех пациентов, включенных в исследование, в послеоперационном периоде имелась прекапиллярная ЛГ (расчетное ДЛАсис. ≥ 35 мм рт. ст. по данным ЭхоКГ), что служило показанием к назначению ингаляции NO. Подача NO в дыхательный контур аппарата ИВЛ с целевой концентрацией во вдыхаемой смеси 20 ppm продолжалась до момента перевода пациентов на самостоятельное дыхание. Линия подачи смеси, содержащей NO, подключалась к магистрали вдоха на расстоянии не менее 30 см от эндотрахеальной трубки. У пациентов основной группы NO был синтезирован из атмосферного воздуха аппаратом АИТ-NO-01, в группе ретроспективного контроля газ поступал к пациентам из баллонов с использованием установки NOXBOX Mobile (Bedfont, Великобритания). Продолжительность ингаляции NO с применением аппарата АИТ-NO-01 варьировала от 1 до 171,3 ч. В группе ретроспективного контроля продолжительность применения устройства NOXBOX Mobile варьировала от 1 до 162 ч.
C целью контроля эффективности ингаляционной терапии NO оценивали комплекс гемодинамических параметров большого и малого кругов кровообращения, а также показатели клинического течения послеоперационного периода. Оценивали динамику ДЛАсис. по ЭхоКГ и насыщения кислородом гемоглобина крови из правого предсердия (SvO2). Среди показателей клинического течения была выбрана продолжительность респираторной поддержки и пребывания в ОРИТ.
С целью оценки безопасности методов подачи NO учитывали случаи развития побочного эффекта терапии NO — повышения концентрации диоксида азота (NO2) в магистрали вдоха более 2 ppm за весь период ингаляции NO. Кроме того, оценивали содержание метгемоглобина в артериальной крови.
Статистический анализ проведен с помощью пакета Statistica 7.0 (Statsoft Inc., США). Нормальный характер распределения полученных данных проверяли с помощью теста Шапиро—Уилка. Учитывая характер распределения, отличный от нормального, межгрупповые сравнения количественных показателей проводили с помощью метода Манна—Уитни для несвязанных выборок и с использованием критерия Уилкоксона для связанных выборок. Сравнение качественных признаков проводили с помощью точного критерия Фишера. Данные представлены в виде: среднее арифметическое ± стандартное квадратичное отклонение (М ± SD) при нормальном распределении, а также в виде медианы и 25–75-го процентилей (Me [Q1–Q3]) при распределении, отличном от нормального. За критический уровень значимости различий принимали p = 0,05.
Антропометрические показатели и данные о давлении в МКК до назначения терапии NO у пациентов групп исследования и ретроспективного контроля представлены в табл. 1. Мы не обнаружили значимых различий в антропометрических характеристиках новорожденных и детей, а также в проявлениях прекапиллярной ЛГ до начала терапии NO, что делало возможным продолжение сравнения групп исследования и ретроспективного контроля.
Таблица 1. Данные о новорожденных и детях, включенных в группы сравнения (Me [Q1–Q3])
Table 1. Data on newborns and children included in the comparison groups (Me [Q1–Q3])
| Показатель | Группа исследования
(n = 45) |
Группа ретроспективного контроля
(n = 45) |
|
|---|---|---|---|
| Возраст, лет | 0,42 (0,08–1,4) | 0,25 (0,08–0,42) | |
| Пол | Мужской, n (%) | 15 (33,3) | 25 (55,6) |
| Женский, n (%) | 30 (66,7) | 20 (44,4) | |
| Новорожденные, n (%) | 13 (28,9) | 15 (33,3) | |
| Вес, кг | 5,7 (3,5–9,95) | 4,9 (3,7–6,2) | |
| Рост, см | 63 (54–79) | 60 (54–68) | |
| ППТ, м2 | 0,31 (0,22–0,47) | 0,29 (0,24–0,34) | |
| Исходное ДЛАсис., мм рт. ст. | 45 (42–45) | 45 (42–50) | |
| Ни по одному из указанных в таблице показателей не обнаружено межгрупповых статистически значимых различий.
ДЛАсис. — систолическое давление в легочной артерии, рассчитанное при трансторакальной эхокардиографии; ППТ — площадь поверхности тела. |
|||
Данные об изменениях показателей гемодинамики в ответ на начало терапии NO при использовании аппарата АИТ-NO-01 и в группе ретроспективного контроля представлены в табл. 2.
Таблица 2. Показатели гемодинамики в группах сравнения на исходном этапе и через 1 час терапии оксидом азота (Me [Q1–Q3])
Table 2. Changes in hemodynamic parameters after one hour of nitric oxide therapy in the comparison groups (Me [Q1–Q3])
| Показатель | Группа исследования
(n = 45) |
Группа ретроспективного контроля
(n = 45) |
|---|---|---|
| Исходное ДЛАсис., мм рт. ст. | 45 (42–45) | 45 (42–50) |
| ДЛАсис. через 1 ч, мм рт. ст. | 30 (24–35) | 33 (25–36) |
| Число пациентов со снижением ДЛАсис. на 10 % и более, n (%) | 40 (88,9 %) | 38 (84,4 %) |
| Исходное АДср., мм рт. ст. | 67 (57–74) | 66 (58–77) |
| АДср. через 1 ч, мм рт. | 63 (53–68) | 65 (56–70) |
| Исходное ЦВД, мм рт. ст. | 8 (7–10) | 9 (7–11) |
| ЦВД через 1 ч, мм рт. | 9 (7–10) | 9 (6–10) |
| Исходная ЧСС, уд./мин | 144 (132–158) | 148 (135–155) |
| ЧСС через 1 ч, уд./мин | 150 (136–155) | 149 (137–159) |
| Исходная SсvO2, % | 77 (69–86) | 77 (70–85) |
| SсvO2 через 1 ч, % | 76 (70–83) | 78 (69–87) |
| АДср. — среднее артериальное давление; ДЛАсис. — систолическое давление в легочной артерии; ЦВД — центральное венозное давление; ЧСС — частота сердечных сокращений; SсvO2 — насыщение кислородом гемоглобина крови из правого предсердия. | ||
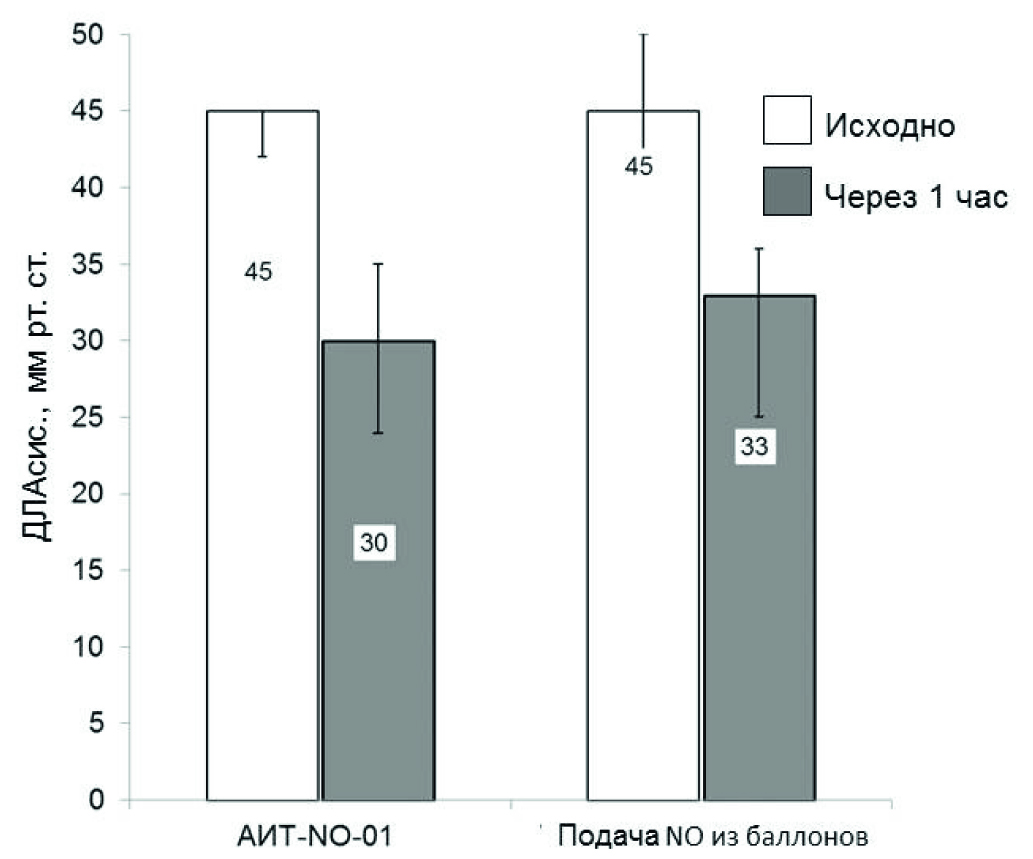
Как следует из данных, приведенных в табл. 2, через 1 ч ингаляции NO с применением аппарата АИТ-NO-01 (группа исследования) отмечено значимое снижение ДЛАсис. на 33,3 % (p < 0,001). В группе ретроспективного контроля через 1 ч ингаляции NO также отмечено статистически значимое снижение ДЛАсис. на 26,7 % (p < 0,001). ДЛАсис. снизилось на 10 % и более у 88,9 % пациентов группы исследования (аппарат АИТ-NO-01), и у 84,4 % пациентов группы ретроспективного контроля (устройство NOXBOX Mobile), различие между группами незначимое (p = 0,4). Таким образом, ингаляционная терапия NO при применении метода синтеза этого газа из атмосферного воздуха была не менее эффективна в отношении снижения давления в МКК, чем при методе подачи газа из баллонов (рис. 2).
Рис. 2. При использовании аппарата АИТ-NO-01 и при традиционном методе подачи оксида азота из баллонов у новорожденных и детей значимо снижалось систолическое давление в легочной артерии (Me [Q1–Q3])
Fig. 2. When using both methods of delivery of nitric oxide, systolic pressure in the pulmonary artery was significantly reduced (Me [Q1–Q3])
Мы полагаем, что у пациентов с прекапиллярной ЛГ обнаруженное снижение давления в МКК на фоне использовании обоих методов подачи NO положительно влияло на состояние правого желудочка.
Выполненное исследование не выявило каких-либо значимых признаков влияния терапии NO на АД и частоту сердечных сокращений. Изменений в указанных показателях не было обнаружено как при использовании АИТ-NO-01, так и при применении метода подачи NO из баллонов (см. табл. 2). Равным образом не было обнаружено значимых изменений показателя SсvO2 через 1 ч после начала ингаляционной терапии NO. Применение АИТ-NO-01 и использование баллонного метода сопровождались сохранением адекватной доставки кислорода к тканям и органам.
При использовании в послеоперационном периоде ингаляции NO с применением аппарата АИТ-NO-01 медиана продолжительности ИВЛ/ВВЛ составила 12 (2–28) ч. В группе ретроспективного контроля при применении баллонного метода медиана этого показателя была равна 14 (12,2–70,5) ч, различие между группами статистически значимо (p = 0,01).
Меньшая продолжительность ИВЛ/ВВЛ при использовании метода синтеза NO из атмосферного воздуха, по нашему мнению, была связана с тем, что при применении метода доставки газа из баллонов 4 раза ингаляции прекращались вследствие превышения содержания NO2 уровня 2 ppm. Еще в 9 случаях временное прекращение ингаляций в группе ретроспективного контроля было связано со сменой баллонов. Указанные обстоятельства привели к увеличению времени проведения ИВЛ/ВВЛ при использовании метода подачи NO из баллонов.
Длительность пребывания пациентов в ОРИТ не различалась между группами и составила 96 (21,7–168) ч при использовании аппарата АИТ-NO-01 и 112 (22,4–196) ч при применении баллонного метода подачи NO.
В группе детей, получавших ингаляционную терапию с применением аппарата АИТ-NO-01, было отмечено 14 (31,1 %) случаев развития осложнений послеоперационного периода. Наиболее частым осложнением, отмеченным у 8 детей, было формирование синдрома малого сердечного выброса, требовавшего назначения инотропной терапии. В 2 наблюдениях были зафиксированы парезы правого купола диафрагмы, вызванные интраоперационным повреждением диафрагмального нерва. У 1 новорожденного отмечена полная атриовентрикулярная блокада с необходимостью проведения временной электрокардиостимуляции. Однократно было зафиксировано развитие пароксизмальной наджелудочковой тахикардии, требовавшей фармакологической коррекции. У 1 ребенка в послеоперационном периоде отмечено развитие пареза кишечника и холестаза. Причиной дисфункции желудочно-кишечного тракта был перенесенный за месяц до операции на сердце некроз тонкой кишки, потребовавший лапаротомии и резекции участка кишки. В этой группе был отмечен 1 летальный исход. Причиной смерти ребенка была полиорганная недостаточность на фоне тяжелого сепсиса, вызванного пневмонией. Указанные осложнения не были связаны с применением аппарата АИТ-NO-01, летальный исход развился через 7 суток после прекращения терапии NO.
В группе ретроспективного контроля отмечено 15 (33,3 %) случаев осложнений послеоперационного периода. У 7 детей развился синдром малого сердечного выброса. В 3 наблюдениях были выявлены нарушения атриовентрикулярного проведения с необходимостью применения ВЭКС. Отмечено 2 случая кровотечений, потребовавших реоперации. В 2 наблюдениях развились ателектазы с необходимостью повторной интубации трахеи и перевода на ИВЛ. У 1 пациента отмечен короткий однократный эпизод судорог. В группе ретроспективного контроля (баллонный метод подачи NO) скончался 1 ребенок. Причиной смерти было профузное легочное кровотечение. Кровотечение произошло через 10 суток после прекращения ингаляции NO, летальный исход наступил на 15-е сутки от момента отключения устройства NOXBOX Mobile.
Различие между исследуемыми группами в частоте развития осложнений послеоперационного периода не было значимым (p = 0,5).
Данные о содержании метгемоглобина в крови пациентов при проведении ингаляционной терапии NO с применением аппарата АИТ-NO-01 и при использовании баллонного метода представлены в табл. 3.
Таблица 3. Данные о содержании метгемоглобина (%) в крови пациентов при проведении ингаляционной терапии оксидом азота (Me [Q1–Q3])
Table 3. Data on methemoglobin (%) in the blood of patients during inhalation of nitric oxide (Me [Q1–Q3])
| Группа | До ингаляции | 1 ч ингаляции | 6 ч ингаляции | 12 ч ингаляции |
|---|---|---|---|---|
| Группа исследования, n = 45 | 1,6 (1,4–1,8) | 1,9 (1,6–2,5)* | 2,6 (1,9–2,8)* | 2 (1,4–2,7)* |
| Группа ретроспективного контроля, n = 45 | 1,1 (1–1,5) | 2,2 (1,9–2,6)** | 2,4 (2,1–2,8)* | 2,5 (1,8–2,9)* |
| * p < 0,05 при сравнении с исходными значениями; ** p < 0,01 при сравнении с исходными значениями. | ||||
Мы обнаружили закономерный статистически значимый рост содержания метгемоглобина при ингаляции NO в сравнении с исходными значениями. Увеличение содержания метгемоглобина было характерно как для случаев использования установки АИТ-NO-01, так и для применения баллонного метода подачи NO. Ни на одном из этапов исследования не было найдено межгрупповых различий в содержании метгемоглобина. Как при использовании аппарата АИТ-NO-01, так и при применении баллонного метода не было отмечено случаев превышения метгемоглобином порогового уровня 5 %. Полученные данные свидетельствуют об одинаковой безопасности метода синтеза NO из атмосферного воздуха и метода подачи этого газа из баллонов в отношении образования метгемоглобина.
При использовании аппарата АИТ-NO-01 не было отмечено ни одного случая превышения NO2 концентрации 2 ppm, что, возможно, связано с наличием в аппарате блока адсорбции NO2. При применении баллонного метода доставки NO (группа ретроспективного контроля) было зарегистрировано 4 случая превышения NO2 концентрации 2 ppm в дыхательном контуре, различие между группами незначимое (p = 0,058). Аппарат АИТ-NO-01 снабжен электронной системой автоматического моментального прекращения подачи газовой смеси при превышении критической концентрации NO2 в контуре (в нашем исследовании был выбран уровень 2 ppm). При использовании баллонного метода подачи NO случаи повышения концентрации NO2 требовали ручного отключения ингаляции, что неизбежно продлевает воздействие на пациента токсических концентраций NO2.
Необходимо отметить, что в представленном исследовании мы использовали относительно невысокую концентрацию NO (20 ppm), для которой нехарактерно образование значительного количества NO2. Можно предположить, что использование NO в дозе более 40 ppm, особенно в условиях высокой FiO2 (> 50 %), будет сопровождаться большим риском достижения токсических концентраций NO2. В подобных ситуациях наличие в аппарате АИТ-NO-01 блока адсорбции NO2 позволит более эффективно контролировать содержание NO2 в сравнении с баллонным методом подачи NO.
В целом можно утверждать о большей безопасности применения метода синтеза NO, реализованного в аппарате АИТ-NO-01, по сравнению с методом подачи NO из баллонов. Это положение подтверждается отсутствием в непосредственной близости с пациентом и персоналом баллонов с NO в концентрации 1000 ppm, под давлением 150 атм. Мгновенное прекращение синтеза NO при превышении содержания в дыхательном контуре NO2 уровня 2 ppm и содержания NO уровня 100 ppm исключает возможность токсических эффектов этих газов. Наличие адсорбера в аппарате позволяет значимо снижать образование NO2 даже при использовании высоких концентраций NO и кислорода.
Представленные выше данные были получены в ходе клинических испытаний аппарата АИТ-NO-01, ставших основанием для выдачи Федеральной службой по надзору в сфере здравоохранения регистрационного удостоверения на это медицинское изделие.
Информация об исследовании. Протокол настоящего исследования был одобрен в соответствии с разрешением на проведение клинических испытаний № 755/2018 от 27.09.2018 (Заключение № 655-1112/1-18 от 17.09.2018 о возможности проведения клинических испытаний) Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор). Кроме того, было получено Заключение Совета по этике Министерства здравоохранения Российской Федерации об этической обоснованности клинических испытаний медицинского изделия с участием человека № 17 от 14.01.2019. Проведение исследовательской работы было одобрено локальным этическим комитетом НМИЦ им. В.А. Алмазова на заседании 13.05.2019 (выписка № 050519 из протокола заседания 06-19).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Все авторы согласно критериям ICMJE участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи; индивидуальный дополнительный вклад: Баутин А.Е. — обоснование научной значимости, проектное руководство; Селемир В.Д. — обеспечение инструментария, получение финансирования проекта, проектное руководство; Нургалиева А.И. — визуализация данных, проектное руководство; Буранов С.Н., Карелин В.И., Ширшин А.С., Валуева Ю.В. — обеспечение инструментария, проектное руководство.