Для всех пациентов характерно наличие болевого синдрома в раннем послеоперационном периоде, особенно актуальна интенсивность боли у пациентов с онкологическими заболеваниями [1, 2]. Патогенез боли является достаточно сложным, существенное значение при этом имеют ее вегетативные и психоэмоциональные компоненты [3, 4].
Ксенон относится к инертным газам, которые в организме человека не вступают в биохимические реакции и не образуют соединений. В то же время описано взаимодействие ксенона с молекулами воды с образованием т. н. клатратных соединений, которые могут оказывать существенное влияние на функциональное состояние организма [5]. Установлено, что ксенон оказывает тормозящее действие на ионотропные рецепторы глутамата, селективно связывающие N-метил-D-аспартат (NMDA), и слабо воздействует на рецепторы, связывающие γ-аминомасляную кислоту (ГАМК). Ксенон ингибирует NMDA-рецепторы, конкурентно взаимодействуя с центром, связывающим коагонист NMDA-рецепторов, глицин. Ингибирование NMDA-рецепторов путем связывания с ними ксенона обусловливает анальгетические, наркотические и нейропротективные свойства этого газа [6, 7]. Согласно представленным в литературе данным, ксенон, не вступая в химические реакции, временно и обратимо изменяет функции нейронов по передаче ноцицептивных и неноцицептивных стимулов. Клинические исследования показали, что уже в малой концентрации ксенон влияет на синаптическую передачу предположительно в области желатинозной субстанции и 2-й пластины Рекседа задних рогов спинного мозга [5]. При более продолжительном воздействии отмечается влияние ксенона на таламические и гипоталамические структуры.
Ксенон используется в качестве ингаляционного анестетика при проведении различных хирургических вмешательств, в т. ч. высокого риска [8]. Масочные ксенон-кислородные ингаляции используются для анальгезии при болевом синдроме, обусловленном различными факторами [9], в т. ч. при кратковременных хирургических манипуляциях (венесекция, грыжесечение, перевязки ожоговых пациентов и др.). Ингаляции проводятся при сохранении спонтанного дыхания с концентрацией ксенона от 20 до 50 %.
В то же время в литературе присутствуют лишь единичные исследования, посвященные оценке уровня боли при применении ксенона для обезболивания в послеоперационном периоде [10].
Проблема послеоперационного обезболивания в абдоминальной онкохирургии является актуальной в связи с высокой распространенностью обширных и травматичных хирургических вмешательств. Адекватное обезболивание необходимо для защиты от тяжелых последствий катехоламинового стресса, а также быстрого восстановления перистальтики желудочно-кишечного тракта, двигательной активности пациента и его комфорта. Эту задачу может обеспечить мультимодальная послеоперационная анальгезия, включающая системную опиоидную, неопиоидную и эпидуральную анальгезию [2, 11].
Мы предположили, что включение в эту схему ксенон-кислородных ингаляций улучшит эффективность послеоперационного обезболивания.
Цель исследования — оценка влияния масочных ингаляций ксенон-кислородной смеси на интенсивность болевого синдрома в послеоперационном периоде у онкологических пациентов после хирургических вмешательств абдоминальной локализации.
Дизайн исследования. Выполнено сравнительное рандомизированное слепое плацебо-контролируемое исследование.
Критерии включения: добровольное письменное согласие; наличие онкологического заболевания; проведение открытого хирургического вмешательства с лапаротомным доступом продолжительностью более 2 ч; возраст 45–75 лет.
Критерии невключения: сопутствующие соматические заболевания в стадии декомпенсации; тяжелая дыхательная недостаточность; заболевания с высоким риском пневмоторакса; острая фаза инфаркта миокарда (до 14 дней) и нестабильная стенокардия; тяжелые степени недостаточности кровообращения (НК 2 и выше); состояния, сопровождающиеся выраженным угнетением центральной нервной системы; инфекционные заболевания, сопровождающиеся высокой температурой; психические заболевания; несоответствие возрастной категории; нежелание участвовать в исследовании.
Критерии исключения: ошибочное включение; индивидуальная повышенная чувствительность к ксенону; появление у пациента критериев невключения во время проведения исследования; серьезное отклонение от протокола исследования; желание пациента выйти из исследования; серьезные нежелательные явления или значительные отклонения в лабораторных анализах, требующие отмены исследуемой терапии.
Первоначально было включено 73 пациента, из которых 13 выбыли из исследования (4 — в связи с развитием серьезных осложнений в раннем послеоперационном периоде: дыхательная недостаточность, сердечная недостаточность; 4 — отказались от проведения ингаляций после операции; у 5 пациентов отмечался выраженный дискомфорт при дыхании по закрытому контуру). Окончательно в исследование было включено 60 онкологических пациентов со злокачественными новообразованиями абдоминальной локализации в возрасте от 45 до 75 лет (табл. 1).
Таблица 1. Клиническая характеристика пациентов
Table 1. Clinical characteristics of patients
| Показатель | Основная группа | Группа плацебо |
|---|---|---|
| Мужчины, абс. количество | 18 | 13 |
| Женщины, абс. количество | 13 | 16 |
| Возраст, годы (Me, 1–3-й квартили) | 61,5 (55,2–67) | 61 (57,5–66) |
| Рост, см (Me, 1–3-й квартили) | 170 (162–176,2) | 167,9 (160–176,2) |
| Вес, кг (Me, 1–3-й квартили) | 75 (62–85,5) | 76,5 (60,5–90,5) |
| Индекс массы тела, кг/м2 (Me, 1–3-й квартили) | 25,9 (23,2–28,8) | 27,1 (22,4–30,7) |
| Сопутствующие заболевания | ||
| Заболевание | Основная группа, абс. количество пациентов | Группа плацебо, абс. количество пациентов |
| Артериальная гипертензия в анамнезе | 11 | 13 |
| Ишемическая болезнь сердца | 1 | 1 |
| Сахарный диабет | 3 | 3 |
| Аритмии | 3 | 1 |
| Хроническая обструктивная болезнь легких | 0 | 1 |
| Гипотиреоз | 1 | 0 |
Все включенные в исследование пациенты были рандомизированы на 2 группы: 31 пациент основной группы, которым проводились ингаляции ксенон-кислородной смеси, и 29 пациентов группы плацебо, которым проводились ингаляции кислородно-воздушной смеси. Рандомизация осуществлялась методом последовательных номеров с использованием таблицы случайных чисел. При этом каждому нечетному порядковому номеру в ранжированном ряду соответствовала цифра «1», а четному порядковому номеру — цифра «2». Цифра «1» означала основную группу, с включением ксенон-кислородных ингаляций, цифра «2» — группу плацебо. Все пациенты подписали информированное добровольное согласие на проведение исследования, где указывалось, что может проводиться как лечение ксеноном, так и ингаляции кислородно-воздушной смеси. Исследование было заслеплено для пациентов и лечащих врачей, для исследователей — оставалось открытым вследствие необходимости регулировать состав газовых смесей в процессе ингаляций.
Выполнение протокола исследования было одобрено локальным этическим комитетом МНИОИ им. П.А. Герцена № 444 от 01.11.2019.
Ксенон-кислородные ингаляции проводились по закрытому дыхательному контуру на аппарате КТК-01 (ксеноновый терапевтический контур), в состав которого входил газоанализатор для проведения контроля процентного соотношения ксенона и кислорода в дыхательной смеси и адсорбер с натронной известью для поглощения углекислого газа. Содержание ксенона во вдыхаемой смеси при этом составляло 25 ± 5 %, кислорода — 40–50 %, концентрация газов в смеси контролировалась с помощью газоанализатора ГКМ-03 (газоанализатор кислорода и ксенона медицинский).
По достижении требуемых концентраций ксенона его подача снижалась до значений 0 л/мин. Общий расход ксенона за процедуру не превышал 3 л. Кислород подавался в дыхательный контур в количестве, необходимом для обеспечения достаточного дыхательного объема пациента. Использовали ксенон медицинский — лекарственное средство «КсеМед» (общество с ограниченной ответственностью «АКЕЛА-Н», Россия, регистрационное удостоверение ЛС-000121) и кислород газообразный медицинский (ГОСТ 5583). Продолжительность ингаляции составляла 10 минут. В группе сравнения (плацебо) пациенты получали ингаляции смеси 50 % кислорода и 50 % воздуха. Лечение начиналось на 2–3-й день после операции — после перевода из отделения анестезиологии, реанимации и интенсивной терапии (ОАРИТ) в профильное хирургическое отделение.
Согласно концепции мультимодальной анальгезии [11], все пациенты в послеоперационном периоде получали комбинированную схему обезболивания: эпидуральная анальгезия 0,2 % раствором ропивакаина со скоростью введения 4–6 мл/ч, лорноксикам по 8 мг 2 раза в сутки внутримышечно (в/м), а также дополнительно опиоидные препараты по требованию (трамадол 100 мг в/м, тримеперидин 20 мг в/м или морфин 1 мг в/м). Оценку болевого синдрома проводили после перевода из ОАРИТ. В этот же день выполняли сеанс ингаляций ксенон-кислородной или кислородно-воздушной смеси.
Уровень боли оценивали по визуально-аналоговой шкале (ВАШ). Пациенты отмечали точку на отрезке длиной 100 мм, измерялось расстояние от начала отрезка до данной точки, затем полученный результат переводили в проценты [12]. Результаты оценивали следующим образом: 0 — боли нет, 10–30 % — боль незначительная, 40–60 % — боль умеренная, 70–90 % — боль выраженная, 90–100 % — боль невыносимая. Снижение интенсивности боли на 10–20 % расценивали как минимальный эффект обезболивания, на 30 % — умеренный эффект.
Определение болевого порога проводили при помощи чрескожной электронейростимуляции. Для этого использовали чрескожный электронейростимулятор (ЧЭНС-2М), постепенно увеличивая интенсивность воздействия, которая измерялась в условных единицах от 0 до 10 согласно градуировке шкалы прибора. Регистрировалось минимальное значение, при котором испытуемый начинал ощущать воздействие электронейростимулятора.
Измерения уровня и порога боли проводили за сутки до операции, перед сеансом ингаляций ксенон-кислородной или кислородно-воздушной смеси, сразу после сеанса и через 30 минут после сеанса. Время от предшествующего введения опиоидного анальгетика до начала ксенон-кислородных и кислородно-воздушных ингаляций составляло 2–3 ч. Продолжительность эффекта обезболивания определялась на основании опроса пациентов и фиксирования времени следующего введения опиоидного анальгетика. Динамика состояния пациента оценивалась по шкале общего клинического впечатления после процедуры, через 30 минут и на следующий день (табл. 2).
Таблица 2. Шкала общего клинического впечатления
Table 2. Overall Clinical Impression Scale
| Баллы | Оценка состояния |
|---|---|
| 0 | Не оценивалось |
| 1 | Очень большое улучшение |
| 2 | Большое улучшение |
| 3 | Небольшое улучшение |
| 4 | Изменений нет |
| 5 | Небольшое ухудшение |
| 6 | Большое ухудшение |
| 7 | Очень большое ухудшение |
Полученная выборка была проверена на нормальность распределения данных по критериям Лиллиефорса, Шапиро—Уилка и χ2 Пирсона; α = 0,05 (табл. 3).
Таблица 3. Проверка распределения данных на нормальность (на примере ВАШ и баллов ЧЭНС)
Table 3. Checking the distribution of data for normality (using the example of VAS and CHENS scores)
| Основная группа | Группа плацебо | ||||||
|---|---|---|---|---|---|---|---|
| Критерий Лиллиефорса | Критерий Шапиро—Уилка, р | χ2 Пирсона, p | Критерий Лиллиефорса | Критерий Шапиро—Уилка, р | χ2 Пирсона, p | ||
| Визуально-аналоговая шкала боли (ВАШ) | Исходно | p < 0,01 | 0,0000001 | 0,00002 | p < 0,05 | 0,188191 | 0,00001 |
| До сеанса | p < 0,05 | 0,043704 | 0,017 | p < 0,01 | 0,014843 | 0,300000 | |
| После сеанса | p < 0,01 | 0,031113 | 0,09 | p < 0,01 | 0,018063 | 0,480000 | |
| Через 30 мин после сеанса | p < 0,05 | 0,054010 | 0,002 | p < 0,10 | 0,228382 | 0,00001 | |
| До сеанса — после сеанса | p < 0,01 | 0,057452 | 0,03 | p < 0,01 | 0,052955 | 0,030000 | |
| До сеанса — через 30 мин | p < 0,01 | 0,386168 | 0,00001 | p < 0,01 | 0,000004 | 0,00001 | |
| После сеанса — 30 мин | p < 0,01 | 0,000001 | 0,008 | p < 0,01 | 0,075757 | 0,027000 | |
| Исходно —после сеанса | p < 0,15 | 0,034003 | 0,00001 | p < 0,15 | 0,203667 | 0,300000 | |
| Исходно —через 30 мин | p < 0,20 | 0,252014 | 0,00001 | p < 0,01 | 0,031962 | 0,130000 | |
| Чрескожная электронейростимуляция (ЧЭНС) | Исходно | p < 0,01 | 0,001910 | 0,14 | p < 0,01 | 0,000943 | 0,030000 |
| До ингаляции | p < 0,01 | 0,000333 | 0,00003 | p < 0,01 | 0,006079 | 0,004000 | |
| После ингаляции | p < 0,01 | 0,000412 | 0,0003 | p < 0,01 | 0,005566 | 0,012000 | |
| Через 30 мин | p < 0,20 | 0,144460 | 0,017 | p < 0,01 | 0,000194 | 0,080000 | |
Полученные результаты позволили сделать вывод о том, что распределение не являлось нормальным, следовательно, обоснованным было применение непараметрических методов статистики.
Статистическая обработка проводилась при помощи непараметрического критерия Вилкоксона для связанных совокупностей и критерия Манна—Уитни для не связанных между собой совокупностей; различия считались достоверными при p < 0,05. Также применялись критерии χ2 и точный тест Фишера (в случае, если хотя бы одно из ожидаемых значений, полученных при расчете статистики χ2, было не более 5).
Для осуществления анализа данных использовались программы Statistica 12.1 и RStudio.
Пациенты основной группы и группы сравнения были распределены по типам хирургических вмешательств следующим образом (табл. 4).
Таблица 4. Распределение пациентов по типам хирургических вмешательств
Table 4. Distribution of patients by type of surgical intervention
| Название операции | Основная группа (n = 31) | Группа плацебо (n = 29) |
|---|---|---|
| Гемиколэктомия | 6 | 4 |
| Атипичная резекция печени | 0 | 1 |
| Гемигепатэктомия | 3 | 9 |
| Резекция прямой кишки | 8 | 4 |
| Панкреатодуоденальная резекция | 1 | 3 |
| Резекция толстой кишки | 2 | 6 |
| Брюшно-промежностная экстирпация прямой кишки | 3 | 0 |
| Дистальная резекция поджелудочной железы | 3 | 1 |
| Комбинированные вмешательства | 4 | 0 |
| Удаление неорганной забрюшинной опухоли | 0 | 1 |
| Удаление малигнизированной пресакральной кисты, брюшно-анальная резекция прямой кишки, плоскостная резекция крестца | 1 | 0 |
До хирургического вмешательства у большинства пациентов отсутствовал болевой синдром. На 2–3-й день после операции, после перевода пациентов из ОАРИТ, проводилась оценка уровня боли. В обеих группах уровень боли был умеренным (42,5 [40–67,5] и 40 [30–60] % соответственно) и достоверно между группами не отличался. После проведения сеансов ингаляции ксенон-кислородной смеси отмечалось достоверное уменьшение уровня боли до незначительного уровня по данным ВАШ (табл. 5).
Таблица 5. Изменения уровня интенсивности боли по ВАШ
Table 5. Changes in the level of pain intensity according to VAS
| Точка измерения | Основная группа (n = 31) | Группа плацебо (n = 29) | ||||
|---|---|---|---|---|---|---|
| ВАШ, % | p по сравнению с исходными данными | p по сравнению с данными до ингаляции | ВАШ, % | p по сравнению с данными до операции | p по сравнению с данными до ингаляции | |
| До операции | 0 (0–10) | – | 0,0001 | 0 (0–10) | – | 0,000008 |
| До ингаляции | 42,5 (40–67,5) | 0,0001 | – | 40 (30–60) | 0,000008 | – |
| После ингаляции | 20 (10–30) | 0,0000016 | 0,000004 | 30 (20–42,5) | 0,00005 | 0,002 |
| Через 30 мин | 27,5 (10–30) | 0,0010 | 0,000006 | 30 (20–46,25) | 0,00027 | 0,005 |
Примечание. Сравнение проводилось в каждой группе с исходными показателями до операции и с показателями до начала ингаляции ксенон-кислородной или кислородно-воздушной смеси. Данные представлены в виде медиан с 1–3-м квартилями — Ме (Q1–Q3). Для оценки достоверности был использован критерий Вилкоксона.
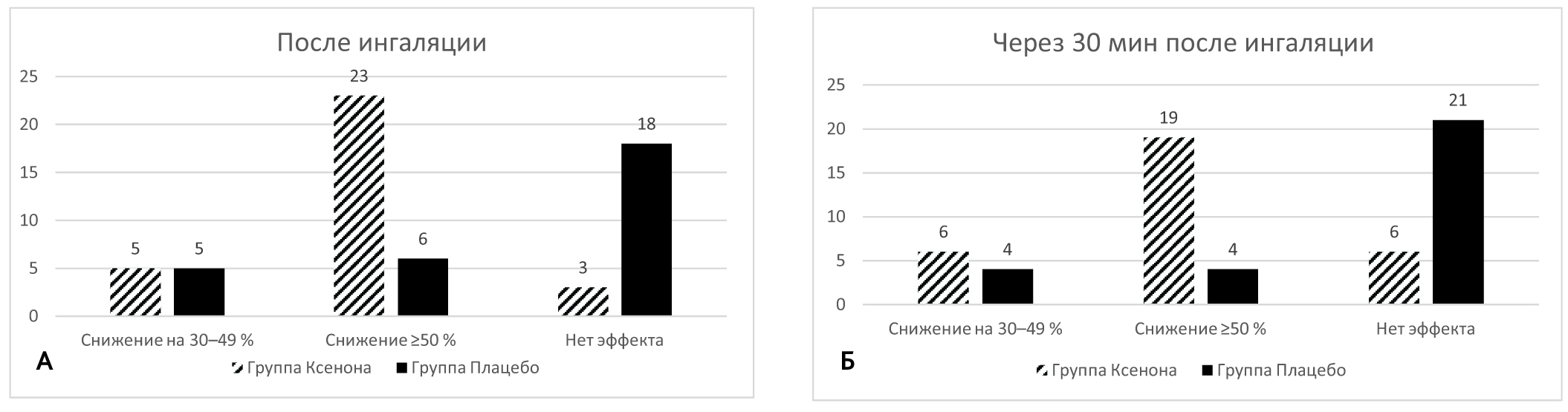
В то же время необходимо отметить, что достоверное снижение уровня боли было выявлено и в группе плацебо. Известно, что плацебо-воздействие может обусловливать до 30 % эффектов терапии, влияя на психоэмоциональный компонент боли. Для того, чтобы провести сравнительную оценку эффективности воздействий в 1-й и 2-й группах, мы разделили пациентов по степени снижения болевого синдрома (рис. 1).
Рис. 1. Степень снижения интенсивности болевого синдрома по данным визуально-аналоговой шкалы: А — сразу после окончания ингаляций ксенон-кислородной и кислородно-воздушной смеси; Б — через 30 минут после окончания ингаляций ксенон-кислородной и кислородно-воздушной смеси
Fig. 1. The degree of decrease in the intensity of pain syndrome according to the visual analogue scale; А — immediately after the end of inhalation of xenon-oxygen and oxygen-air mixture; Б — 30 minutes after the end of inhalation of xenon-oxygen and oxygen-air mixture

Умеренный и значительный эффект обезболивания после ингаляции ксеноном наблюдался у 28 (90,3 %) пациентов основной группы и всего у 11 (37,9 %) — группы плацебо. При этом у 23 (74,1 %) пациентов, получавших ксенон-кислородные ингаляции, имело место снижение уровня боли на 50 % и более. В группе плацебо значительное уменьшение болевого синдрома отмечалось только в 6 (20,6 %) случаев. В обеих группах через 30 минут происходило некоторое ослабление эффекта обезболивания, вызванного процедурой, однако в группе ксеноновой терапии умеренное и значительное снижение уровня боли наблюдалось у 25 (80,6 %), а в группе плацебо — всего у 8 (27,4 %) пациентов.
Для оценки достоверности различий между сравниваемыми группами были использованы критерий χ2 Пирсона и точный тест Фишера. Достоверность различий между группами по наличию и отсутствию эффекта определялась при помощи критерия χ2 Пирсона, p = 6,86 × 10–5. Различия между группой ксенона и группой плацебо по выраженности эффекта оценивались по точному тесту Фишера (при расчете статистики χ2 были получены ожидаемые значения менее 5, что снижает точность критерия). Для точки измерения сразу после сеанса ингаляций ксенона p = 1,24 × 10–5, а для точки измерения через 30 минут после сеанса — p = 5 × 10–5.
Таким образом, нулевая гипотеза об отсутствии различий между группами была отвергнута, и, согласно полученным результатам, анальгетический эффект ксенона значимо отличался от эффекта плацебо.
При анализе результатов электронейростимуляции в группе c ксеноном не было выявлено достоверных различий исходных данных до операции и показателей после хирургического вмешательства. В то же время отмечалось достоверное повышение порога болевой чувствительности сразу после ксенон-кислородной ингаляции, которое еще больше увеличивалось через 30 минут после сеанса (табл. 6).
Таблица 6. Изменения порога болевой чувствительности по результатам чрескожной электронейростимуляции
Table 6. Changes in the pain sensitivity threshold based on the results of transcutaneous electroneurostimulation
| Точка измерения | Основная группа (n = 31) | Группа плацебо (n = 29) | ||||
|---|---|---|---|---|---|---|
| ЧЭНС, у. е. | p по сравнению с исходными данными | p по сравнению с данными до ингаляции | ЧЭНС, у. е. | p по сравнению с данными до операции | p по сравнению с данными до ингаляции | |
| До операции | 4 (4–4,5) | – | 0,067 | 4 (4–4,5) | – | 0,456 |
| До ингаляции | 4,25 (4–4,5) | 0,067 | – | 4 (4–5) | 0,456 | – |
| После ингаляции | 4,5 (4–4,5) | 0,000007 | 0,00091 | 4 (4–5) | 0,754 | 0,726 |
| Через 30 мин | 5 (4–6) | 0,000469 | 0,0051 | 4 (4–5) | 0,878 | 0,382 |
Примечание. Сравнение проводилось в каждой группе с исходными показателями до операции и с показателями до начала ингаляции ксенон-кислородной или кислородно-воздушной смеси. Данные представлены в виде медиан с 1–3-м квартилями — Ме (Q1–Q3). Для оценки достоверности был использован критерий Вилкоксона.
В группе плацебо не было достоверных изменений порога болевой чувствительности ни по сравнению с исходными значениями, ни с показателями перед началом ингаляций кислородно-воздушной смеси, т. е. эффект плацебо не наблюдался. Отсутствие достоверных изменений может быть объяснено небольшими размерами выборки.
Продолжительность анальгетического эффекта составила для группы ксенон-кислородных ингаляций 5 (4–8,75) vs 1 (0–3) ч в группе сравнения, p = 0,0003 (достоверность различия оценивалась по критерию Манна—Уитни).
Достоверные отличия были также получены по данным шкалы общего клинического впечатления (табл. 7).
Таблица 7. Динамика показателей шкалы общего клинического впечатления после ингаляций ксенон-кислородной и кислородно-воздушной смесей
Table 7. Dynamics of indicators of the scale of general clinical impression after inhalation of xenon-oxygen and oxygen-air mixtures
| Показатели | Основная группа | Группа плацебо | p между группами | p после процедуры / через 30 мин | p через 30 мин / на следующий день | p после процедуры / на следующий день |
|---|---|---|---|---|---|---|
| После процедуры | 2 (2–3) | 3 (3–3) | 0,000089 | Основная группа | ||
| Через 30 мин после процедуры | 3 (2–3) | 3 (3–4) | 0,00039 | 0,161 | 0,301 | 0,064 |
| На следующий день | 3 (2–3) | 4 (3–4) | 0,000006 | Группа плацебо | ||
| 0,236 | 0,041 | 0,015 | ||||
Примечание. Достоверность различия между группами определяли по критерию Манна—Уитни, в одной группе между разными точками измерения внутри групп — по критерию Вилкоксона. Данные представлены в виде медиан с 1–3-м квартилями — Ме (Q1–Q3).
Чем ниже балл по шкале общего клинического впечатления, тем больше выражено улучшение состояния. В основной группе отмечалось достоверно более выраженное улучшение состояния пациентов, согласно их субъективной оценке, по сравнению с группой плацебо. В группе ксенона изменения недостоверны в процессе наблюдения, т. е. улучшение состояния сохраняется через 30 минут и на следующие сутки. В группе плацебо через 30 минут сохраняются положительные изменения состояния, однако на следующий день они становятся существенно меньше или исчезают.
При сравнении доз обезболивающих препаратов были получены следующие результаты (табл. 8).
Таблица 8. Различия между группами по частоте применения препаратов для послеоперационного обезболивания
Table 8. Differences between groups in the frequency of use of drugs for postoperative pain relief
| Препарат | Основная группа, количество пациентов | Доза, мг, Ме (Q1–Q3) | Группа плацебо, количество пациентов | Доза, мг, Ме (Q1–Q3) | p | ||
|---|---|---|---|---|---|---|---|
| абс. число | % | абс. число | % | ||||
| Ропивакаин (доза указана в мг/ч) | 31 | 100 | 8 (8–8) | 29 | 100 | 8 (8–8) | 0,364187 |
| Лорноксикам | 31 | 100 | 16 (16–16) | 29 | 100 | 16 (16–16) | 0,471758 |
| Морфин | 0 | 0 | 0 (0–0) | 2 | 6,8 | 0 (0–0) | 0,151668 |
| Трамадол | 7 | 22,5 | 0 (0–100) | 11 | 37,9 | 100 (0–100) | 0,310439 |
| Тримеперидин | 1 | 3,2 | 0 (0–0) | 6 | 20,6 | 0 (0–20) | 0,038718 |
Примечание. Достоверность межгрупповых различий оценивалась по критерию Манна—Уитни, дозы препаратов представлены в виде медианы и 1-го и 3-го квартилей — Ме (Q1–Q3).
Достоверных межгрупповых отличий по частоте введения и дозам морфина и трамадола получено не было, отмечалось достоверное снижение частоты и дозы введения тримеперидина.
В основной группе 6 пациентам в день проведения ингаляции ксенон-кислородной смеси был однократно дополнительно введен трамадол и 1 пациенту — двукратно vs 11 пациентов с однократным и 1 — с двукратным введением трамадола в группе плацебо. Пациентам группы ксенона не вводили дополнительно морфин, и только 1 пациент получил обезболивание по требованию тримеперидином vs 2 и 6 в группе плацебо, при этом 2 пациента в группе плацебо получили тримеперидин дважды в день.
По среднему количеству проведенных в стационаре койко-дней различие было недостоверным: в группе ксенона — 14,5 (11–15), в группе плацебо — 16,1 (10–18,5), p = 0,84.
Снижение уровня боли и болевого порога при недостоверных отличиях по количеству пациентов, получавших опиоидные анальгетики, в обеих группах говорит о том, что не всегда введение по требованию является адекватным отражением интенсивности болевого синдрома. Это достаточно субъективный момент, т. к. один пациент может долго не обращаться к медицинскому персоналу, а другой может из-за страха боли требовать дополнительного введения препаратов. Поэтому полученные нами результаты могли бы быть объяснены с точки зрения особенностей психоэмоционального и вегетативного статуса пациентов. Уменьшение кратности введений тримеперидина и увеличение времени до следующего введения опиоидного анальгетика в группе ксенона позволяют сделать предположение о наличии анальгетических свойств препарата и об улучшении обезболивания у обследованных пациентов.
Для достижения эффективного обезболивания у пациентов, перенесших хирургические вмешательства по поводу онкологических заболеваний, необходим комплексный подход, включающий обязательное применение эпидуральной анальгезии, наркотических анальгетиков и нестероидных противовоспалительных средств (НПВС) [11]. Эпидуральная анальгезия, безусловно, обладает рядом преимуществ, обеспечивает успешное обезболивание при травматичных операциях, к которым относятся хирургические вмешательства в абдоминальной онкохирургии, способствует профилактике послеоперационных пневмоний, аритмий и пареза кишечника. В то же время есть данные, что даже на фоне регионарных методов обезболивания в ряде случаев необходимо дополнительное введение анальгетиков [15]. В частности, в колоректальной хирургии более чем у 50 % пациентов требуется дополнительное использование наркотических анальгетиков в послеоперационном периоде [16]. При этом длительное назначение морфина и его аналогов угнетает перистальтику кишечника, вызывает сонливость и удлиняет период реабилитации больных, которым выполнялись резекционные хирургические вмешательства на органах брюшной полости. НПВС также обладают большим количеством побочных эффектов, в т. ч. могут увеличивать вероятность развития стрессовых поражений слизистой желудочно-кишечного тракта в раннем послеоперационном периоде, и, кроме того, их назначение нежелательно у пациентов с сопутствующей ишемической болезнью сердца. Согласно полученным данным, ксенон-кислородные ингаляции снижают уровень боли и повышают болевой порог в рассматриваемой группе пациентов. Эти данные согласуются с результатами исследования Н.Е. Бурова и соавт., которые показали, что ингаляции ксенон-кислородной смеси обладают анальгезирующим эффектом при использовании субнаркотических концентраций (30–50 % ксенона в газовой смеси). Ксенон может успешно применяться для лечения болевых синдромов различной этиологии (инфаркт миокарда, мочекаменная болезнь, травма, выполнение кратковременных болезненных манипуляций в хирургической практике — перевязок, обработки ожоговой поверхности, пункций, биопсий и т. д.) [9]. Кроме того, ксенон не оказывает отрицательного воздействия на углеводный, жировой и белковый метаболизм, напротив, его применение сопровождается уменьшением минутной потребности в кислороде и усилением анаболических процессов [5]. Таким образом, ксенон не обладает побочными эффектами, способными негативно влиять на реабилитацию пациентов и, согласно некоторым исследованиям, способствует восстановлению после хирургических вмешательств [15, 16].
Оценка динамики клинического состояния выявила улучшение у пациентов, получивших ингаляции ксенон-кислородной смеси, при этом значимость различий по сравнению с группой плацебо сохранялась в течение следующих суток после ингаляции. Пролонгированное анальгетическое действие ксенона было отмечено также в работе Holsträter T.F. et al., которые наблюдали эффект потенцированного обезболивания в послеоперационном периоде после интраназального введения ксенона во время анестезии [14]. Эти результаты, очевидно, обусловлены тем, что ксенон обладает не только анальгетическими, но и протекторными свойствами, благоприятно влияет на процессы метаболизма и состояние вегетативной нервной системы. Полученные данные можно также сопоставить с результатами исследования эффектов ксеноновой анестезии у пациенток, оперированных по поводу рака молочной железы, в котором авторами было отмечено сокращение в 5 раз времени посленаркозной реабилитации [16].
К ограничениям исследования можно отнести: 1) неполное ослепление исследования (отсутствовало заслепление для исследователя, непосредственно проводящего процедуры ингаляции газовых смесей, а также при анализе полученных данных); 2) отсутствие мониторинга интенсивности боли в 1-е сутки после операции; 3) однократное применение ингаляций ксенона, что не позволило достичь эффекта долговременной адаптации; 4) не фиксировалось точное время от предшествующего введения анальгетика до начала ксенон-кислородных и кислородно-воздушных ингаляций.
Выполненное исследование продемонстрировало наличие анальгетического эффекта ингаляций газовой смеси с низким содержанием ксенона (25 ± 5 %.). Было обнаружено клинически значимое снижение уровня боли сразу после ингаляции ксенон-кислородной смеси и через 30 минут у 90,3 % (p < 0,01) и 80,6 % (p < 0,05) пациентов соответственно. В группе плацебо, пациентам которой проводились кислородно-воздушные ингаляции, умеренное и значительное снижение интенсивности болевого синдрома наблюдалось только у 37,9 % пациентов сразу после процедуры и у 27,4 % через 30 минут после ингаляции кислорода. По данным чрескожной электронейростимуляции отмечалось значимое повышение болевого порога, сразу после ингаляции ксенон-кислородной смеси и через 30 минут; p < 0,01, p < 0,05 соответственно. В группе плацебо достоверных изменений порога болевой чувствительности выявлено не было. Продолжительность и выраженность анальгетического эффекта были значимо выше в группе ксенон-кислородных ингаляций. Отмечалось значимое снижение частоты дополнительного введения тримеперидина, однако не было значимых различий по частоте и дозам дополнительного введения морфина и трамадола. Кроме того, не было выявлено различий по продолжительности госпитализации между группой ксенона и группой плацебо.
Таким образом, ингаляции ксенон-кислородной смеси способствуют снижению интенсивности уровня послеоперационной боли и повышают болевой порог у онкологических пациентов с опухолями абдоминальной локализации. В связи с этим можно предположить, что использование ксенона в комплексной терапии послеоперационного болевого синдрома позволит улучшить результаты лечения и снизить потребность в использовании медикаментозных методов обезболивания. Для определения места ксеноновой терапии в мультимодальном обезболивании онкологических пациентов на хирургическом этапе лечения необходимо проведение дополнительных исследований.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Потиевская В.И., Шветский Ф.М., Сидоров Д.В., Ложкин М.В., Потиевский М.Б., Абузарова Г.Р., Сарманаева Р.Р., Кузнецов С.В., Алексеева Г.С. — разработка концепции исследования, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.