Периоперационный период — это время с момента принятия решения об операции до восстановления трудоспособности или ее стойкой утраты. Он включает в себя следующие периоды: предоперационный, интраоперационный, послеоперационный.
Белково-энергетическая (нутритивная) недостаточность — состояние организма, характеризующееся дефицитом или дисбалансом макро и/или микронутриентов, вызывающим функциональные, морфологические расстройства, нарушения гомеостаза и ухудшение результатов лечения.
Саркопения — клинический синдром, характеризующийся прогрессирующим генерализованным снижением массы мышц, снижением их силы и ухудшением функции.
Нутритивный статус — совокупность клинических, антропометрических и лабораторных показателей, отражающих состояние организма, связанное с питанием пациента, и характеризующих количественное соотношение в первую очередь мышечной и жировой массы тела пациента.
Нутритивная поддержка — процесс субстратного обеспечения больных с использованием специальных методов, отличающихся от обычного питания, и искусственно созданных питательных смесей различной направленности.
Дополнительное пероральное питание — это метод нутритивной поддержки, предполагающий самостоятельное потребление пациентом специализированных смесей с целью оптимизации пищевой ценности суточного рациона.
Энтеральное питание — это метод нутритивной поддержки, предполагающий введение питательных смесей в желудочно-кишечный тракт через зонд или стому, минуя ротовую полость.
Парентеральное питание — это метод нутритивной поддержки, предполагающий введение нутриентов (аминокислот, углеводов, липидов, электролитов, витаминов и микроэлементов) внутривенно.
Рекомендация 1. Скрининг нутритивного статуса рекомендуется проводить всем пациентам перед хирургическими вмешательствами средней и высокой травматичности (УДД — 2, УУР — B).
Рекомендация 2. Для скрининга рекомендуются шкалы NRS-2002 (приложение А4), MST (ESMO, 2008) [3, 9] (УДД — 2, УУР — B).
Комментарий. Исследование 26 лечебных учреждений по всему Европейскому Союзу с использованием шкалы NRS-2002 показало, что 32,6 % пациентов имели «высокий риск» белково-энергетической недостаточности (БЭН), и у этих пациентов развивалось больше осложнений (30,6 % vs 11,3 %; p < 0,001), отмечался повышенный уровень смертности (12 % vs 1 %; p < 0,001) и более длительное время пребывания в стационаре по сравнению с пациентами, не относящимися к группе риска [3, 11].
Наличие ≥ 3 баллов по шкале NRS-2002 требует проведения углубленного изучения параметров БЭН:
Данная тактика позволяет определить риск и степень БЭН в послеоперационном периоде. У пациентов хирургического профиля под высоким риском развития БЭН понимают наличие хотя бы одного из критериев:
Рекомендация 3. Нутритивный статус хирургического пациента рекомендуется оценивать в предоперационный период при оценке по шкале NRS-2002 ≥ 3 баллов [9, 11] (УДД — 2, УУР — В).
Комментарий. Метаанализ, изучавший эффективность шкалы NRS-2002 в качестве предиктора послеоперационных исходов в абдоминальной хирургии, включал в общей сложности 11 исследований. Послеоперационные осложнения значительно чаще встречались у тех, кто относился к группе риска, чем у тех, кто не входил в группу риска (отношение шансов [ОШ] 3,13; p < 0,00001). Смертность была также выше у пациентов группы риска (ОШ 3,61; p < 0,009), и у этих пациентов было значительно более длительным время пребывания (койко-дни) в стационаре (средняя разница — 3,99 дня; p < 0,01) [11].
У пациентов с нормальным уровнем питания одной из ключевых задач послеоперационного ведения является восстановление нормального функционирования желудочно-кишечного тракта, что решает проблему адекватного приема пищи и быстрого восстановления. Очевидно, что пациенты с адекватным уровнем питания не имеют ранее возникшего нутритивного дефицита, следовательно, при восстановлении функции ЖКТ вскоре после хирургической операции не возникнет риска развития осложнений и летальности, связанной с недостаточностью питания. И наоборот, пациенты с исходной БЭН находятся в состоянии повышенного риска развития послеоперационных осложнений [3, 10].
Первым этапом является скрининг недостаточности питания, который должен проводиться на протяжении всего времени лечения онкологического пациента. Своевременное выявление пациентов из группы нутритивного риска позволяет защитить их от прогрессирующей потери массы тела и развития рефрактерной кахексии. Для первичного скрининга наиболее удобно использовать хорошо зарекомендовавшие себя шкалы, такие как NRS-2002, MST и ESMO (2008) [6, 7]. Шкала ESMO (2008) предусматривает оценку следующих показателей в баллах:
А. Отметили ли Вы (самопроизвольное, спонтанное) снижение массы тела за последнее время?
Б. Если ДА, то на сколько?
В. Снижен ли у Вас аппетит и, как следствие, объем питания?
Г. Оценка:
В том случае, если по скрининговой шкале пациент набирает количество баллов, подтверждающее наличие риска развития нутритивной недостаточности, у него определяют степень ее выраженности на основе соматометрических (ИМТ, окружность плеча, толщина кожно-жировой складки над трицепсом, окружность мышц плеча) и лабораторных маркеров — общий белок, альбумин, трансферрин сыворотки крови, абсолютное количество лимфоцитов в периферической крови.
Рекомендация 4. У онкологических пациентов рекомендуется ранняя диагностика саркопении, т. к. ее наличие негативно влияет на общую и канцерспецифическую выживаемость [12, 13] (УДД — 2, УУР — В).
Комментарий. Хирургическое лечение является одним из основных видов радикального лечения при солидных опухолях. До 70 % пациентов со злокачественными новообразованиями головы, шеи и верхних отделов ЖКТ имеют признаки саркопении. Развитие данного синдрома затрудняет диагностику БЭН, особенно у пациентов с исходно избыточной массой тела (саркопеническое ожирение). Метаанализ Shachar et al. (2016) с высокой степенью статистической значимости показал, что наличие саркопении связано с ухудшением общей и канцерспецифической выживаемости [12]. При раке желудка наличие саркопении связано с риском возникновения клинически значимых послеоперационных осложнений, ухудшением переносимости неоадъювантной химиотерапии, а по своему прогностическому значению она сопоставима с индексом опухоли «Т» и позитивным краем резекции [13].
Для диагностики саркопении предложен ряд методов, для каждого из которых установлены пороговые значения, имеющие прогностическую значимость (указаны в скобках у мужчин и женщин соответственно) [7]. Двухэнергетическая рентгеновская абсорбциометрия позволяет оценить индекс мышечной массы конечностей (< 7,26 кг/м2; < 5,45 кг/м2). При помощи компьютерной томографии (КТ-саркометрия) рассчитывается отношение площади мышц к общей площади поперечного среза на уровне 3-го поясничного позвонка (< 55 см2/м2; < 39 см2/м2). Биоимпедансный анализ может дать представление о безжировой массе тела без участия костной ткани (< 14,6 кг/м2; < 11,4 кг/м2). Измерение окружности середины плеча и толщины кожной жировой складки над трицепсом по специальной формуле позволяет рассчитать площадь мышц верхней конечности на данном уровне (< 32 см2; < 18 см2). Всех пациентов с пониженными показателями ОМП следует рассматривать как больных с пресаркопенией, а в случаях снижения у них показателей кистевой динамометрии — как пациентов с саркопенией.
Рекомендация 5. C позиций концепции раннего восстановления после хирургических операций традиционное (8–12 ч) предоперационное голодание более не рекомендуется.
Рекомендация 6. При отсутствии у пациента риска аспирационного синдрома рекомендуется употребление чистой жидкости за 2 ч до начала анестезии, твердой пищи — за 6 ч до начала анестезии [14, 15] (УДД — 1, УУР — А).
Комментарий. Уменьшить негативные эффекты голодания перед проведением плановой операции можно путем употребления углеводов в количестве, достаточном для того, чтобы вызвать секрецию инсулина, аналогичную той, которая наблюдается после приема обычной пищи. Чувствительность к инсулину будет более высокой, если это делается до хирургического вмешательства. Такая предоперационная модификация метаболизма оказывает определенное позитивное влияние на реакцию организма в ответ на проведение операции [14, 15].
Использование углеводной нагрузки в качестве метаболического прекондиционирования подтверждается некоторыми фундаментальными научными и клиническими исследованиями. Недавнее крупное проспективное рандомизированное клиническое исследование показало значительные преимущества в отношении снижения послеоперационной инсулинорезистентности и гипергликемии без влияния на частоту осложнений [16]. У тех пациентов, которые в соответствии с современными рекомендациями могут свободно принимать жидкость, можно, не опасаясь осложнений, применять напитки, содержащие углеводы и прошедшие адекватное тестирование безопасности применения (мальтодекстрин и др.). Как было показано, это способствует снижению выраженности послеоперационной инсулинорезистентности и гипергликемии, потерь белка, потери тощей массы тела и ослабления функции мускулатуры, снижению выраженности тревоги и послеоперационной тошноты и рвоты. Противопоказаниями к употреблению чистых жидкостей за 2 ч до оперативного вмешательства являются любые клинические ситуации, сопровождающиеся замедленной эвакуацией содержимого желудка.
У тех пациентов, которые в предоперационный период по каким-либо причинам не могут есть или пить, внутривенное введение глюкозы со скоростью 5 мг/кг/мин оказывает аналогичное действие, проявляющееся не только в отношении инсулинорезистентности, но также метаболизма белка и защитного воздействия на миокард. Для обеспечения углеводной нагрузки внутривенным путем используют растворы глюкозы повышенной концентрации — 10–20 % [17, 18].
Рекомендация 7. Пациентам с исходной нутритивной недостаточностью рекомендуется предоперационная нутритивная поддержка [32, 25] (УДД — 2, УУР — В).
Комментарий. Нутритивная поддержка (НП) показана всем пациентам, не способным по какой-либо причине обеспечить более 50 % своих потребностей в энергии с помощью естественного питания в течение 6–7 сут [4, 10]. Цели предоперационной подготовки — уменьшить дефицит энергии, улучшить функциональные характеристики организма пациента, избежать потери массы тела. Варианты предоперационной подготовки должны включать диетические рекомендации, дополнительное пероральное питание (ДПП), энтеральное питание (ЭП) и парентеральное питание (ПП), а также их сочетания при необходимости. Существуют убедительные доказательства эффективности применения ДПП в периоперационном периоде: метаанализ 9 исследований [19] показал, что применение данной методики НП было ассоциировано с 35 % снижением общего числа осложнений (p < 0,001), что привело к существенной экономии средств на лечение. Для пациентов с высоким нутритивным риском, подвергающихся объемным хирургическим вмешательствам, особенно в онкохирургии, ДПП следует считать обязательным вариантом подготовки к хирургическому вмешательству [10, 20].
ЭП может быть использовано в большинстве клинических ситуаций за исключением кишечной непроходимости, ишемии кишечника, множественных кишечных свищей, продолжающегося желудочно- кишечного кровотечения. В целом ряде исследований было показано, что у пациентов с тяжелыми нарушениями метаболизма и невозможностью принимать пищу естественным путем предоперационный курс ЭП в течение 7–10 дней способствовал улучшению исходов лечения [21, 22].
При наличии любого из нижеперечисленных критериев плановую операцию следует отложить и назначить курс предоперационной НП длительностью 7–14 дней:
Рекомендация 8. Иммуномодулирующие энтеральные смеси (содержащие аргинин, омега-3, глутамин, антиоксиданты) рекомендуются в течение 5–7 дней предоперационного периода, особенно при операциях по поводу рака верхних отделов ЖКТ [23–25] (УДД — 2, УУР — В).
Комментарий. Результаты 15 метаанализов, проведенных у больных общехирургического профиля, и 1 мета-анализ, проведенный у пациентов с новообразованиями области голова–шея, посвященных периоперационному применению энтеральных иммуномодулирующих диет, продемонстрировали достоверное снижение частоты послеоперационных осложнений и сокращение длительности пребывания пациентов в стационаре [23–25]. Однако данное утверждение является доказанным только для пациентов, ведение которых осуществляется с использованием консервативных подходов, предусматривающих длительное периоперационное голодание. Подавляющее большинство рандомизированных клинических исследований (РКИ) на эту тему было выполнено до внедрения стратегии ускоренного восстановления в хирургии [7, 10].
Рекомендация 9. Предоперационное ПП рекомендуется только в случае выраженной БЭН и неэффективности или невозможности проведения адекватной НП пероральным и энтеральным доступом [27, 28] (УДД — 3, УУР — С).
Комментарий. Преимущества предоперационного ПП в течение 7–14 сут были доказаны только у пациентов с тяжелой нутритивной недостаточностью (потеря массы тела более 15 %) при подготовке к вмешательствам на органах ЖКТ. Также у данной категории больных было отмечено снижение частоты послеоперационных осложнений на 30 % и выявлена тенденция к снижению смертности [38, 39]. ПП следует проводить в течение 7–14 дней перед операцией, чтобы получить максимальную пользу, на основании доказательств того, что этот срок необходим для уменьшения осложнений, связанных с инфекцией области хирургического вмешательства [28].
Рекомендация 10. Длительность предоперационной НП рекомендуется не менее 5–7 сут и не более 14 сут [20, 40] (УДД — 3, УУР — С).
Комментарий. В настоящее время считается общепризнанным, что предоперационный курс НП способствует снижению числа осложнений. Оптимальная продолжительность его проведения предметно не исследовалась, но минимальным сроком является 5–7 дней. Увеличение данного времени > 14 дней не способствует улучшению клинических исходов, и отсрочка хирургического лечения позднее данного срока с этой точки зрения не является обоснованной [1, 7, 10]. Последнее утверждение особенно актуально в онкохирургии, где время начала специфического лечения существенно влияет на онкологические результаты.
Рекомендация 11. Возможность проведения раннего ДПП или ЭП рекомендуется оценивать на следующее утро после проведения хирургического вмешательства. Пероральный прием пищи после операции рекомендуется начать как можно раньше [31, 32] (УДД — 2, УУР — В).
Комментарий. Обзор пяти вариантов НП после панкреатодуоденэктомии показал, что пероральное введение питания было связано с наименьшей частотой осложнений [29]. Более поздний метаанализ с включением толь-ко РКИ продемонстрировал, что ЭП после панкреатодуоденэктомии имеет преимущества перед ПП [30]. Было показано, что раннее питание при абдоминальной и тазовой хирургии стимулирует перистальтику и функцию желудочно-кишечного тракта, снижает риск послеоперационной кишечной непроходимости и сокращает общую продолжительность госпитализации. В неотложной хирургии назначение раннего ЭП позволило снизить внутригоспитальную летальность (с 19,4 до 4,5 %; р = 0,008), частоту легочных осложнений (с 19,4 до 4,5 %; р = 0,008) и сроки госпитализации [31]. Кокрановский обзор, посвященный целесообразности раннего ЭП в ближайшем послеоперационном периоде, продемонстрировал сокращение продолжительности пребывания в стационаре [32]. В тех случаях, когда потребности в энергии и питательных веществах не могут быть удовлетворены только путем ДПП и ЭП, рекомендуется добавление ПП [10].
Рекомендация 12. После колоректальных операций с сохранением функции ЖКТ прием твердой пищи без побочных эффектов рекомендуется начинать в первый послеоперационный день [32, 33] (УДД — 3, УУР — С).
Комментарий. Для того чтобы вернуться к нормальному приему пищи, следует избегать рутинного использования назогастрального зонда. Отсутствие назогастральной декомпрессии после абдоминальной хирургической операции значительно сокращает вероятность возникновения эпизодов лихорадки, ателектаза и пневмонии. Пациентам не следует длительно голодать даже для проведения исследования и хирургического вмешательства. Пациенты, испытывающие недостаточность питания во время или сразу после обширной абдоминальной или сосудистой операции, быстрее восстанавливают нутритивный статус, физические функции и качество жизни, если получают советы по питанию либо им прописывают обычные диетические рекомендации или ДПП сразу после операции. В большинстве случаев методом выбора варианта ранней НП является ДПП и ЭП [10, 15, 33, 34].
Противопоказания к проведению НП (общие):
Противопоказания к проведению ПП:
Противопоказания к проведению ЭП:
Рекомендация 13. В большинстве случаев потребности пациента в энергии и белке рекомендуется определять эмпирически: потребность в энергии — 25–30 ккал/кг, потребность в белке — 1,2–1,5 г/кг/сут (УДД — 3, УУР — С).
Рекомендация 14. При необходимости более точного определения энергетических потребностей рекомендуется применение непрямой калориметрии [36, 37] (УДД — 3, УУР — С).
Комментарий. Системная воспалительная реакция способствует увеличению энергетических потребностей организма в покое. Однако общие энергетическое потребности могут уменьшаться из-за снижения физической активности, связанного с заболеванием. Предлагаемые расчетные показатели суточной потребности в энергии и белке являются оптимальными для большинства хирургических пациентов, в том числе в онкохирургии [14, 22]. Для расчета рекомендуется использовать идеальную массу тела. В отсутствие нарушения азот-выделительной функции почек суточное потребление белка до 2 г/кг является безопасным, но большинство экспертов не рекомендуют превышать эту величину более 1,5 г/кг из-за отсутствия убедительных данных об эффективности [7, 35]. Непрямая калориметрия может быть рекомендована у пациентов с ожирением, иммобилизированных, находящихся на ИВЛ.
Рекомендация 15. При невозможности обеспечить достаточный объем нутриентов пероральным доступом рекомендуется начать ЭП через назогастральный или назоеюнальный зонд [33, 38] (УДД — 2, УУР — В).
Комментарий. Базовой для начала ЭП является стандартная полисубстратная изокалорическая энтеральная диета (тип «Стандарт»). Так называемые «зондовые столы» не должны применяться для ЭП в периоперационом периоде в связи с высоким риском инфекционных осложнений, невозможностью медленного капельного введения, неясной белковой, энергетической емкостью, неизвестной осмолярностью, количеством витаминов и микроэлементов в единице объема.
Показания к назначению полуэлементных (олигомерных) диет (тип «Пептид»):
Показания к назначению смесей, обогащенных пищевыми волокнами (тип «Файбер»):
Показания к назначению смесей для пациентов сахарным диабетом (тип «Диабет»):
Показания к назначению смесей, обогащенных разветвленными аминокислотами (тип «Гепа»):
Показания к назначению смесей, обогащенных фармаконутриентами — глутамином, аргинином, омега-3 жирными кислотами (омега-3-ЖК), антиоксидантами (тип «Иммун»):
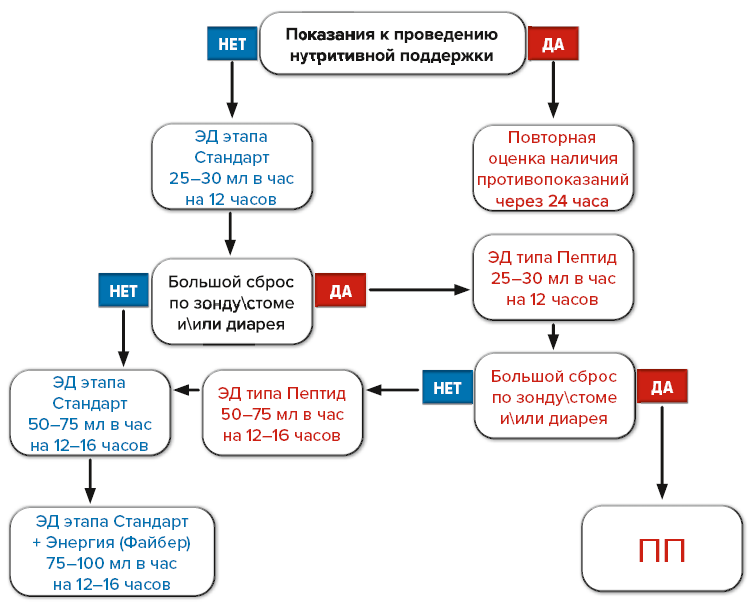
Алгоритм проведения раннего энтерального зондового питания представлен на рис. 1.
Рис. 1. Алгоритм проведения раннего энтерального зондового питания в послеоперационном периоде
Fig. 1. Algorithm for early enteral tube feeding in the postoperative period

Рекомендация 16. При длительности ЭП более 3 нед. и отсутствии перспективы удаления зонда в течение ближайших 7–10 сут рекомендуется выполнить гастро- или энтеростомию.
Рекомендация 17. Гастро- или энтеростомию рекомендуется выполнить чрескожно с помощью эндоскопических методик [38–40] (УДД — 3, УУР — С).
Комментарий. Многочисленные исследования показали преимущества и удобство кормления через зонд, установленный дистальнее анастомоза. Открытая или даже лапароскопическая установка назоеюнального зонда в специализированном центре связана с низким риском и частотой осложнений — около 1,5–6 % [38, 39]. Для пациентов, подвергшихся резекции пищевода, обсервационное исследование продемонстрировало преимущества безопасного долгосрочного назоеюнального доступа с минимальным количеством случаев несостоятельности анастомоза. Чрескожную эндоскопическую гастростомию следует рассматривать при наличии показаний к длительному энтеральному зондовому питанию. Для пациентов со стенозом верхних отделов ЖКТ, вызванным оперативным вмешательством после неоадъювантного радиохимиотерапевтического воздействия, чрескожную гастростому следует размещать только по усмотрению хирурга [39–41].
Показания для наложения энтеростомы:
Рекомендация 18. В послеоперационный период ПП рекомендуется в случае невозможности в течение 3 сут обеспечить более 60 % потребностей пациента с помощью ЭП. При исходно тяжелой БЭН и у пациентов пожилого и старческого возраста назначение ПП рекомендуется в ближайший послеоперационный период [10, 45] (УДД — 3, УУР — С).
Комментарий. Традиционно считается, что назначение ПП у пациентов без исходно выраженной БЭН необходимо, только начиная с 7-х суток при невозможности обеспечить белково-энергетические потребности в объеме > 50 % от необходимых пероральным/энтеральным доступом [10]. В РКИ Heidegger et al. (2013) установлено, что у пациентов ОРИТ назначение дополнительного ПП с 4-х суток при низкой толерантности энтерального питания в течение первых 72 ч позволяет снизить частоту нозокомиальных инфекций, расход антибактериальных препаратов и сроки ИВЛ [45]. Учитывая, что после объемных хирургических вмешательств, особенно в онкохирургии, тяжесть состояния пациентов может потребовать пребывания в ОРИТ, мы рекомендуем начиная с 4-х суток послеоперационного периода назначать ДПП с целью покрыть дефицит белково-энергетических потребностей, не обеспеченных с помощью ДПП и/или ЭП. У пациентов с исходно тяжелой БЭН следует рассмотреть назначение ПП в более ранние сроки — на следующие сутки после выполнения оперативного вмешательства.
Рекомендация 19. При проведении ПП рекомендуется использовать системы «все в одном», т. к. это является экономически выгодным и реже сопровождается инфекциями кровотока по сравнению с традиционной флаконной методикой [47, 48] (УДД — 3, УУР — В).
Комментарий. В 2 РКИ было показано, что использование 3-компонентных пакетов (аминокислоты, углеводы, ЖЭ) позволяет на 20–50 % уменьшить экономические затраты на проведение ПП по сравнению с традиционной флаконной методикой [45, 46]. В ретроспективном исследовании с участием 68 984 пациентов выявлено статистически значимое снижение инфекций кровотока с 24,6 до 18,9 % при использовании готовых систем «все в одном» [47].
Рекомендация 20. Выбирать тип ЖЭ для ПП рекомендуется индивидуально с учетом тяжести нарушений функции сердечно-сосудистой системы, выраженности легочного повреждения, полиорганной дисфункции, а также риска развития гипертриглицеридемии и холестаза [49–51] (УДД — 3, УУР — В).
Комментарий. В качестве аргумента более высокой эффективности и безопасности ЖЭ II и III поколений в российской и зарубежной литературе приводятся результаты контролируемых проспективных исследований у различных групп пациентов. Ряд авторов полагает, что преимущества ЖЭ II поколения перед ЖЭ I поколения обусловлены не только гораздо более низкой квотой линоленовой кислоты, но и метаболическими особенностями МСТ триглицеридов, таких как способность подвергаться процессам гидролиза и транспорта без участия альбумина, аполипопротеина CII и проникать в митохондрии без участия карнитина [6, 50]. В обзоре M. Adolph, посвященном проблеме различных поколений ЖЭ, суммируются преимущества II поколения ЖЭ перед жирами I поколения, а именно: отмечается более высокая скорость утилизации из кровеносного русла и окисления у больных с тяжелым сепсисом; доказано наличие большего протеин-сберегающего эффекта; высокая скорость утилизации позволяет предотвращать развитие жировой перегрузки; оказывает благоприятное влияние на газообмен и легочную гемодинамику в условиях ОРДС [49]. Исследование с участием хирургических пациентов с тяжелой формой истощения, получающих периоперационное ПП, продемонстрировало значительно более низкую частоту внутрибрюшных абсцессов при использовании ЖЭ II генерации по сравнению с ЖЭ I поколения. Не было зарегистрировано различий в показателях других инфекций или смертности [51]. ЖЭ II и III генерации оказывают принципиально иные эффекты на системы транспорта кислорода и газообмена. Особого внимания заслуживает исследование Faucher et al., опубликованное в 2003 г. в журнале Chest. В рамках проспективного, рандомизированного, двойного слепого исследования было показано, что у пациентов с ОРДС (с исходным коэффициентом оксигенации около 160) инфузия ЖЭ II поколения со скоростью менее 100 мл/ч, в отличие от внутривенной инфузии чистой соевой эмульсии, достоверно повышала коэффициент оксигенации (paO2/FiO2), что сопровождалось увеличением значений сердечного индекса и доставки кислорода [52]. У пациентов со стабильной центральной и легочной гемодинамикой, отсутствием явлений полиорганной дисфункции могут применяться ЖЭ I поколения.
Рекомендация 21. У пациентов с тяжелой кишечной недостаточностью и/или невозможностью питаться энтерально при проведении полного ПП рекомендуется внутривенное введение растворов глутамина [53, 58] (УДД — 2, УУР — В).
Комментарий. Метаанализ 13 РКИ, проведенных в 1997–2005 гг., показал, что включение дипептида аланин- глутамин в программу ПП хирургических пациентов способствует снижению частоты инфекционных осложнений с относительным риском 0,42 (0,24–0,72; р = 0,02) и сокращением длительности госпитализации на 3,25 сут (4,87–1,62; р = 0,00009) [53]. Последующие метаанализы подтвердили ранее полученные данные в отношении влияния внутривенного глутамина на развитие инфекционных осложнений [54–56]. Однако РКИ, в которых исследовалось не полное, а добавочное ПП, не выявили преимуществ применения внутривенного глутамина у пациентов, получавших адекватное количество белка и энергии [57–59]. Самое крупное РКИ, посвященное применению парентерального глутамина у пациентов в критических состояниях (REDOX, n =1223), продемонстрировало, что комбинированное введение парентерального глутамина 0,35 г/кг и энтерального глутамина 30 г/сут (т. е. выше рекомендованных доз) приводит к увеличению летальности у пациентов с полиорганной недостаточностью [60]. В РКИ у 60 пациентов, подвергшихся резекции толстой кишки, инфузия глутамина (0,5 г /кг / сут) за 24 ч до и через 1 ч после начала операции оказалась достоверно полезной для интраоперационного и послеоперационного гомеостаза глюкозы и инсулина и восстановления функции кишечника с сокращением времени до первого эпизода самостоятельного стула после резекции толстой кишки [61]. Другое многоцентровое двойное слепое РКИ включало 150 хирургических пациентов ОРИТ (с патологией ЖКТ, сосудов, кардиохирургическими операциями) без почечной или печеночной недостаточности или шока. Все пациенты получали изонитрогенное изокалорическое ПП. В группе вмешательства глутамин вводили в стандартной дозировке 0,5 г /кг/сут. Никаких существенных различий не наблюдалось по первичным конечным точкам — госпитальной смертности и частоте инфекционных осложнений [54]. Опубликованные в 2010 и 2013 гг. два метаанализа (включая 14 РКИ с 587 хирургическими пациентами, 40 РКИ с более чем 2000 пациентами) подчеркнули значительные преимущества добавок глутамина в отношении инфекционной заболеваемости и продолжительности пребывания в больнице [63]. Метаанализ включал 19 РКИ с 1243 пациентами, которым было назначено плановое обширное хирургическое вмешательство на брюшной полости. Добавки глутамина не повлияли на общую смертность (RR = 0,84; p = 0,473) и инфекционную смертность (RR = 0,64; p = 0,087). При этом у пациентов, получавших глутамин, достоверно сократилась продолжительность пребывания в стационаре [56, 62, 64].
Рекомендация 22. У пациентов ОРИТ с высоким риском развития нозокомиальных инфекций рекомендуется в программу ПП включать омега-3-ЖК [65, 66] (УДД — 2, УУР — В).
Комментарий. Влияние ЖЭ, обогащенных омега-3-ЖК, на систему предшественников медиаторов системной воспалительной реакции, по-видимому, может оказывать также влияние на ее течение. В большинстве исследований авторы оценивали эффективность внутривенного введения 5–6 г/сут омега-3-ЖК в составе многокомпонентной ЖЭ. В феврале 2007 г. были опубликованы результаты многоцентрового исследования с участием 256 хирургических пациентов после абдоминальных вмешательств, сравнивающего применение стандартной и обогащенной омега-3-ЖК ЖЭ. В группе пациентов, получавших ЖЭ III поколения, обогащенную омега-3-ЖК, выявлено статистически значимое снижение длительности пребывания в стационаре (с 22 до 17 сут; p = 0,007), а также увеличение концентрации антивоспалительных эйкозаноидов [65]. В проспективном многоцентровом двойном слепом РКИ Grau-Carmona et al. (2015) добавление в схемы парентерального питания ЖЭ, содержащей 10 % рыбьего жира, у пациентов ОРИТ позволило снизить частоту нозокомиальной инфекции с 37,2 до 21,0 % (р = 0,035) [66]. Более поздний метаанализ подтвердил ранее полученные данные в отношении положительного влияния ЖЭ, обогащенных омега-3-ЖК, на развитие инфекционных осложнений [67].
Противопоказаниями для введения омега-3-ЖК являются следующие:
Рекомендация 23. При проведении полного ПП длительностью более 5 сут рекомендуется внутривенное введение комплексов витаминов и микроэлементов [4, 68] (УДД — 3, УУР — С).
Комментарий. У здорового человека в большинстве случаев имеется достаточный запас микронутриентов, и это дает возможность какое-то время компенсировать недостаток поступления и повышенные потребности при патологии. Необходимость инфузии растворов микронутриентов диктуется их недостаточностью. Проведено немало исследований, которые показывали, что дефицит микронутриентов и низкое их потребление ассоциировались с увеличением заболеваемости. Напротив, восстановление адекватного потребления приводило к нормализации нутритивного статуса и уменьшению инцидентов заболеваний. Исследования на здоровых пожилых пациентах, которые получали индивидуальный набор витаминов и микроэлементов, показало снижение частоты инфекционных заболеваний на период более года. Подобный эффект авторы связывали с улучшением защитных функций лимфоцитов. Большое количество исследований посвящено антиоксидантной защите организма. Четко установлен факт дефицита витамина С у больных в критических состояниях. Нормализация содержания витаминов С и Е способствует уменьшению окислительного повреждения, что связано с восстановлением ферментных и неферментных антиоксидантных систем, а также улучшению функций липидов в мембранах [1, 4, 8, 68].
Рекомендация 24. Всех пациентов, подлежащих радикальному и паллиативному хирургическому лечению в онкологии, рекомендуется вести с использованием протоколов ускоренного восстановления [69, 70] (УДД — 1, УУР — А).
Комментарий. НП является неотъемлемой частью стратегии ускоренного восстановления в хирургии. Систематический обзор и метаанализ РКИ показал, что применение данной стратегии сопровождается уменьшением сроков госпитализации, общего числа осложнений и экономических затрат. После операций на верхнем отделе ЖКТ возможно увеличение частоты повторного поступления в стационар в течение 30 дней после операции, хотя в целом общая летальность не увеличивается [69]. Последнее утверждение базируется на РКИ Bu et al. (2015), отдельно оценивавшем применение протокола ускоренного восстановления после гастрэктомии у пациентов старше 74 лет [70]. После исключения данного исследования из метаанализа увеличение частоты повторных госпитализаций становится незначимым. Одним из факторов нутритивного риска является прогнозируемая неспособность пациента самостоятельно обеспечить более 60 % питательных потребностей в течение более 5–7 дней. Подобная ситуация возникает после обширных операций по поводу рака верхних отделов ЖКТ (пищевод, желудок, поджелудочная железа). Поэтому при данном типе операций показания для назначения НП возникают даже в отсутствие исходно выраженной БЭН.
Рекомендация 25. В онкохирургии в отсутствие противопоказаний рекомендуется проведение НП пероральным доступом [82, 83] (УДД — 2, УУР — В).
Комментарий. Раннее пероральное питание является важным компонентом программы ускоренного восстановления в хирургии. Подобный подход позволяет уменьшить стрессовую метаболическую реакцию организма на хирургическую травму и сократить сроки восстановления моторной функции желудка и кишечника. Метаанализ Willcutts et al. (2016) показал, что даже после операций на органах верхнего отдела ЖКТ применение раннего перорального питания не приводит к увеличению частоты клинически значимых послеоперационных осложнений и сопровождается сокращением сроков госпитализации [71]. После резекции желудка возможно увеличение частоты нарушений эвакуации содержимого из верхних отделов ЖКТ без статистически значимого роста числа несостоятельности анастомозов [72]. В настоящее время нет РКИ, позволяющих сделать однозначный вывод о безопасности раннего перорального питания после эзофагэктомии, поэтому оптимальный доступ для раннего начала НП после данного типа операций не определен и наиболее изученным является раннее ЭП через назоеюнальный зонд или еюностому [73]. При назначении ДПП онкологическим пациентам следует учитывать наличие у них хемосенсорных нарушений (расстройств вкуса и обоняния) и иметь широкий спектр смесей различного вкуса — нейтрального, сладкого и несладкого [74].
Таким образом, в настоящее время в онкохирургии нет показаний для рутинной установки зондов для ЭП в конце операции и в большинстве случаев НП может быть начата в 1-е сутки после операции пероральным доступом. Исключение составляют лишь некоторые типы операций (эзофагэктомия, панкреатодуоденальная резекция) или наличие у пациента признаков тяжелой БЭН, когда следует рассмотреть раннее начало ЭЗП и дополнительного ПП.
Рекомендация 26. НП на всех этапах рекомендуется сочетать с поддержанием физической активности с учетом состояния пациента и возможных противопоказаний [75] (УДД — 3, УУР — В).
Комментарий. Снижение физической активности усиливает атрофию мышц, что способствует усугублению саркопении. Поддержание физической активности у онкологических пациентов способствует усилению метаболизма мышечной ткани, поддержанию массы и функции мышц [7]. Хотя оптимальный режим физических упражнений в настоящее время не установлен, критерием верхнего предела нагрузки может быть достижение максимальной частоты сердечных сокращений, составляющей 75 % от базового максимума для возраста пациента. В раннем послеоперационном периоде это может быть лечебная физкультура в положении лежа, пробная вертикализация, различные варианты механо- и респираторной терапии. В настоящее время в онкохирургии обсуждается целесообразность применения преабилитационных программ, направленных на максимальную оптимизацию физического и функционального статуса пациента перед операцией путем, в том числе НП и физической активности [75]. Их продолжительность составляет от 3 нед. и более, поэтому неясно, как они будут сочетаться с началом специфического лечения и, соответственно, влиять на онкологические результаты. «Временным окном» для преабилитации может быть неоадъювантное лечение (химио- или лучевая терапия), которое проводится перед операцией и, например, при раке желудка, может длиться от 4 нед. и более.
В целях оценки качества медицинской помощи применяются следующие критерии (табл. 1).
Таблица 1. Критерии оценки качества медицинской помощи
Table 1. Criteria for assessing the quality of medical care
| № | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
|---|---|---|---|
| 1 | Выполнен скрининг нутритивного статуса в предоперационном периоде c помощью шкалы NRS-2002 или шкалы MST (ESMO, 2008) | 2 | B |
| 2 | Проведена оценка показателей нутритивного статуса в предоперационном периоде у пациентов с БЭН или высоким риском ее развития: общий белок, альбумин, лимфоциты крови, ИМТ, дефицит массы тела | 2 | B |
| 3 | Проведена предоперационная НП у пациентов с тяжелой БЭН | 2 | B |
| 4 | Начато раннее ЭП при отсутствии противопоказаний | 2 | B |
| 5 | Начато парентеральное питание при наличии противопоказаний к ЭП или низкой эффективности ЭП | 2 | B |
| 6 | Выполнена динамическая оценка основных показателей нутритивного статуса в течение 7–10-х суток послеоперационного периода: общий белок, альбумин, лимфоциты крови, ИМТ, дефицит массы тела | 3 | C |
Примечание. Критерии применимы на всех трех уровнях оказания медицинской помощи.
Рекомендации разработаны в соответствии с Приказом Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588), а также с Приказом Минздрава России от 23.06.2020 № 617н «О внесении изменений в приложения N 1, 2 и 3 к приказу Министерства здравоохранения Российской Федерации от 28 февраля 2019 г. № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Лейдерман И.Н., Грицан А.И., Заболотских И.Б., Мазурок В.А., Поляков И.В., Потапов А.Л., Сытов А.В., Ярошецкий А.И. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
Author contribution. Leyderman I.N., Gritsan A.I., Zabolotskikh I.B., Mazurok V.A., Polyakov I.V., Potapov A.L., Sytov A.V., Yaroshetskiy A.I. — all authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.