
Согласно недавно опубликованным данным Международной федерации диабета (IDF), количество пациентов с сахарным диабетом (СД) во всем мире увеличилось с 151 млн в 2000 г. до 463 млн (9,3 % населения мира) в 2019 г. [1]. Между тем показатель смертности в мире от СД и его осложнений в 2019 г. составил 4,2 млн больных [1]. В свою очередь, 465 900 смертей (8,5 % от смертности по разным причинам) среди взрослого населения в возрасте от 20 до 79 лет в Европе были связаны с СД и его осложнениями [1]. Наибольшее количество смертей от диабета (59,0 %) в Европе в 2019 г. было зарегистрировано в странах со средним уровнем дохода, включая Российскую Федерацию, Турцию и Украину [1]. Многочисленные клинические исследования доказывают прямую связь между наличием интра- / послеоперационной гипергликемии и развитием осложнений у пациентов с СД после хирургических вмешательств [2–7]. У больных с СД после кардиохирургических вмешательств наблюдается увеличение летальности по таким причинам, как снижение функции миокарда (сердечная недостаточность), стремительное развитие раневой инфекции, послеоперационная почечная недостаточность и отсроченные нарушения мозгового кровотока [5, 6]. В недавно опубликованном ретроспективном анализе 44 408 пациентов, перенесших операцию по уменьшению объема желудка с целью снижения веса, повышенная 30-дневная послеоперационная смертность была выявлена у пациентов с СД [7]. При этом пациенты, применявшие пероральные гипогликемические средства, имели отношение шансов (ОШ) умереть в 2,58 раза выше по сравнению со здоровыми пациентами, их 95%-й доверительный интервал (95 % ДИ) находился в пределах 1,44–4,62 [7]. В то время как у пациентов, использовавших инсулин, ОШ составляло 4,96 с 95 % ДИ 2,74–8,97 [7]. Однако на сегодняшний день в европейских клиниках наблюдаются большие вариации в допустимых целевых показателях периоперационной гликемии и, следовательно, в терапевтической тактике ведения пациентов с СД [8]. Согласно полученным данным многоцентрового исследования пациентов смешанного терапевтического и хирургического отделения интенсивной терапии, интенсивная терапия инсулином с поддержанием ГК от 4,5 до 6,0 ммоль/л увеличивала абсолютный риск 90-дневной летальности на 2,6 % по сравнению с пациентами, имевшими более либеральный подход с использование целевого уровня ГК 10,0 ммоль/л или менее [9]. В данной статье на основе обзора научных публикаций нам бы хотелось представить вниманию коллег современное видение патофизиологических эффектов гипергликемии, влияние разных типов анестезии на уровень ГК у хирургических больных, а также, основываясь на своем практическом опыте, представить несколько важных практических рекомендаций по лечению периоперационной гипергликемии.
Публикации для анализа отбирались путем поиска в базе данных PubMed по следующим комбинациям ключевых слов: “perioperative + hyperglycemia”, “perioperative + hyperglycemia + diabetes + anesthesia” и “perioperative + hyperglycemia + insulin”. Всего было отобрано 1327 статей, из которых в обзор было включено 96, процесс отбора изображен на рис. 1. Литературные источники, опубликованные за период с 1970 по 2021 г., были включены в обзор. Основными критериями отбора литературных источников для цитирования в данном обзоре были экспериментальные или клинические научные исследования, опубликованные в журналах с двойным независимым рецензированием, актуальность и новизна опубликованных данных, а также практические рекомендации профессиональных сообществ врачей анестезиологов стран Западной Европы и США.
Рис. 1. PRISMA-диаграмма процесса отбора и исключения статей для рассмотрения
Fig. 1. PRISMA flowchart for selection of publications

Согласно последним рекомендациям Всемирной организации здравоохранения [10], для диагностики СД необходимо наличие у больного следующих клинических симптомов: полиурия, полидипсия и необъяснимая потеря веса. Для диагностики СД также необходимо определение ГК. При этом диагноз СД правомерен при случайно выявленном уровне глюкозы в плазме более 11,1 ммоль/л или когда глюкоза в плазме натощак была более 7,0 ммоль/л в двух отдельных анализах крови. Диагноз СД также правомерен при проведении теста толерантности к глюкозе и выявлении концентрации глюкозы более 11,1 ммоль/л (норма менее 7–8 ммоль/л) через два часа после перорального приема 75 г глюкозы. Кроме того, для диагностики СД также используется значение гликированного гемоглобина (HbA1c) выше 6,5 %, что отражает высокий уровень глюкозы в плазме за предыдущие 8–12 нед. [10]. Однако необходимо отметить, что значение менее 6,5 % само по себе не исключает СД, диагностированный с помощью обычных тестов на глюкозу [11].
Основываясь на патогенетических механизмах, СД классифицируется как «тип 1, или инсулинозависимый диабет» (СД1), что обусловлено недостаточностью выработки эндогенного инсулина, или «тип 2, или инсулинонезависимый диабет» (СД2), что обусловлено развитием инсулинорезистентности, нарушением секреции инсулина или повышенной продукцией глюкозы. СД1 характеризуется отсутствием выработки эндогенного инсулина. Обычно он легко диагностируется в раннем в детстве и для его лечения требуется ежедневное введение инсулина. В свою очередь, СД2 — это результат неэффективного использования эндогенного инсулина организмом человека. В обычной клинической практике наблюдается значительное преобладание больных с СД2, и это связано с такими факторами, как избыточная масса тела, отсутствие физической активности и/или наличие генетической предрасположенности к развитию СД. Клинические симптомы СД2 обычно мало беспокоят пациента, поэтому данное заболевание диагностируется поздно, часто уже после того, как развились его осложнения.
Классификация ВОЗ включает в себя и другие типы диабета, такие как медленно развивающиеся гибридные типы, например иммуноопосредованный СД у взрослых. Выделяют также определенные типы моногенного СД, которые могут быть обусловлены прямым повреждением поджелудочной железы, что приводит к снижению продукции инсулина β-клетками. Факторами повреждения функции поджелудочной железы могут быть лекарственные или химические субстанции; инфекции, такие как, например, врожденная краснуха, вирус Коксаки; генетические нарушения; беременность и другие причины.
Макрососудистые и микрососудистые повреждения, такие как ретинопатия, невропатия и нефропатия, являются хорошо известными осложнениями длительной гипергликемии при СД [12]. На сегодняшний день наиболее изученные молекулярные механизмы этих осложнений включают в себя активацию биохимических каскадов полиола, диацилглицерина (ДАГ)/ протеинкиназы C (ПKC) и гексозамина, образование конечных продуктов гликирования (КПГ) и окислительный стресс (образование активных форм кислорода) [13, 14].
В то время как большинству клеток в организме человека требуется инсулин для поступления глюкозы в клетку, транспорт глюкозы в эндотелиальные клетки сетчатки, нервной ткани и тканей почек не зависит от инсулина [13–15]. Таким образом, глюкоза свободно перемещается через клеточные мембраны в данных эндотелиальных клетках из-за различий в концентрации глюкозы между внутри- и внеклеточным пространством [13–15]. Избыточная глюкоза, не используемая для получения энергии, попадает в биохимический каскад полиола, двухступенчатый процесс преобразования глюкозы в сорбитол, моносахарид с шестью углеродными спиртовыми группами (полиол), и далее во фруктозу (рис. 2) [13–15].
Рис. 2. Патофизиологические эффекты длительной гипергликемии в процессе активации биохимического каскада полиола
Fig. 2. Effects of long-term hyperglycaemia on polyol pathway activation

При нормальных концентрациях глюкозы альдозоредуктаза (АР) — фермент, превращающий глюкозу в сорбитол, имеет низкое сродство к глюкозе, и поэтому сорбитол не накапливается внутриклеточно [13–15]. Однако во время длительной гипергликемии происходит значительная активация биохимического каскада полиола, вызывая накопление сорбитола в клетках. Сорбитол не может свободно проходить через клеточные мембраны, поэтому он накапливается внутриклеточно, вызывая как увеличение осмотического давления, так и накопление внутриклеточной воды [16]. В свою очередь, никотинамидадениндинуклеотидфосфат (НАДФН), важный донор электронов, расходуемый в большом количестве для преобразования глюкозы в сорбитол, становится недоступным для других важных процессов клеточного метаболизма [13]. Низкая внутриклеточная концентрация НАДФН снижает клеточный синтез глутатиона, оксида азота (ОА), мио-инозита и таурина. Глутатион — это антиоксидант, который предотвращает повреждение важных клеточных компонентов, вызываемое активными формами кислорода (АФК), такими как свободные радикалы, пероксиды, пероксиды липидов и тяжелые металлы [17]. ОА вызывает расслабление гладкой мускулатуры артерий, что приводит к расширению сосудов и увеличению местного кровотока [18]. Мио-инозитол представляет собой карбоциклический сахар, который необходим в качестве вторичного посредника в ряде химических реакций по передаче внутриклеточного сигнала, в формировании цитоскелета, поддержании контроля концентрации внутриклеточного кальция (Ca2+), поддержании потенциала клеточной мембраны, разрушении жиров, экспрессии генов и т. д. [19, 20]. Мио-инозитол также участвует во внутриклеточной передаче сигнала в ответ на воздействие различных гормонов, нейротрансмиттеров и фактора роста и, следовательно, способствует нормальному функционированию нейронов [19, 20]. В заключение следует отметить, что активация биохимического каскада полиола приводит к ингибированию аденозинтрифосфатазы Na+/K+ -насосов (АТФазы), накоплению внутриклеточного Na+, отеку аксонов, снижению скорости проводимости потенциала действия в нервном волокне и снижению микроциркуляции крови вследствие отсутствия индуцированной ОА вазодилатации.
При длительной гипергликемии хроническая активация биохимического каскада ДАГ/ПKC приводит к различным сосудистым аномалиям сетчатки, почек, нервной и сердечно-сосудистой тканей [21]. Во внутриклеточной передаче сигнала ДАГ является вторичным мессенджером и продуктом гидролиза фосфолипидного фосфатидилинозитол-4,5-бисфосфата ферментом фосфолипазой C. Продукция ДАГ в клеточной мембране способствует перемещению ПKC из цитозоля клетки в плазматическую мембрану. ПKC существует как набор различных изоферментов: классических (α, β, γ), новых (ε, δ, θ, η) и атипичных (ξ, λ), где классические и новые изоформы чувствительны к изменениям внутриклеточного кальция и ДАГ [21–26]. Однако на сегодняшний день все еще существуют трудности в определении индивидуального влияния каждого из изотипов ПKC на конкретные процессы в клетке [22]. В исследованиях in vitro было показано, что активация ПKCα приводит к нарушению кадгериновых соединений эндотелия сосудов [23]. Более того, ПKCα также активирует киназу легкой цепи миозина, что способствует образованию щелей между эндотелиальными клетками, таким образом, происходит нарушение барьерной функции эндотелиальных клеток [24–26]. Кроме того, активация ПKCα приводит к вазоконстрикции и изменению проницаемости капилляров за счет повышенной продукции эндотелина-1 (ЭТ-1). ЭТ-1 является также мощным провоспалительным пептидом [27-30]. В культивируемых моноцитах человека ЭТ-1 стимулирует высвобождение фактора некроза опухолей альфа (ФНО-α), интерлейкина 1β (ИЛ-1β) и интерлейкина 6 (ИЛ-6) [29]. После добавления в малый круг кровообращения здоровых крыс ЭТ-1 вызывал адгезию лейкоцитов, агрегацию тромбоцитов и гистологические изменения, указывающие на интерстициальный отек легких [27–29]. В заключение, следует отметить, что повышенная активация ДАГ/ПKC связана со значительными изменениями местного кровотока, утолщением базальной мембраны, расширением внеклеточного матрикса, увеличением проницаемости сосудов, аномальным ангиогенезом, чрезмерным апоптозом и снижением активности ферментов, таких как Na+/K+ -АТФазы, фосфоинозитид 3-киназы и митоген-активированная протеинкиназы.
Патологический биосинтез гексозамина (ПБГ) является одним из важных патогенетических механизмов в развитии инсулинорезистентности и диабетических сосудистых осложнений [31, 32]. Значительная часть глюкозы, потребляемая клетками, метаболизируется посредством гликолиза, и в нормальных условиях только 2–5 % глюкозы попадает в каскад ПБГ [33]. При длительной гипергликемии избыточное количество глюкозы начинает поступать в ПБГ, биохимический каскад, отвечающий за выработку ключевого субстрата для гликозилирования протеинов, уридиндифосфат-N-ацетилглюкозамина (УДФ-ГлсНAc) (рис. 3) [33].
Рис. 3. Патофизиологические эффекты длительной гипергликемии в процессе активации каскада биосинтеза гексозамина
Fig. 3. Effects of long-term hyperglycaemia on hexosamine biosynthetic pathways
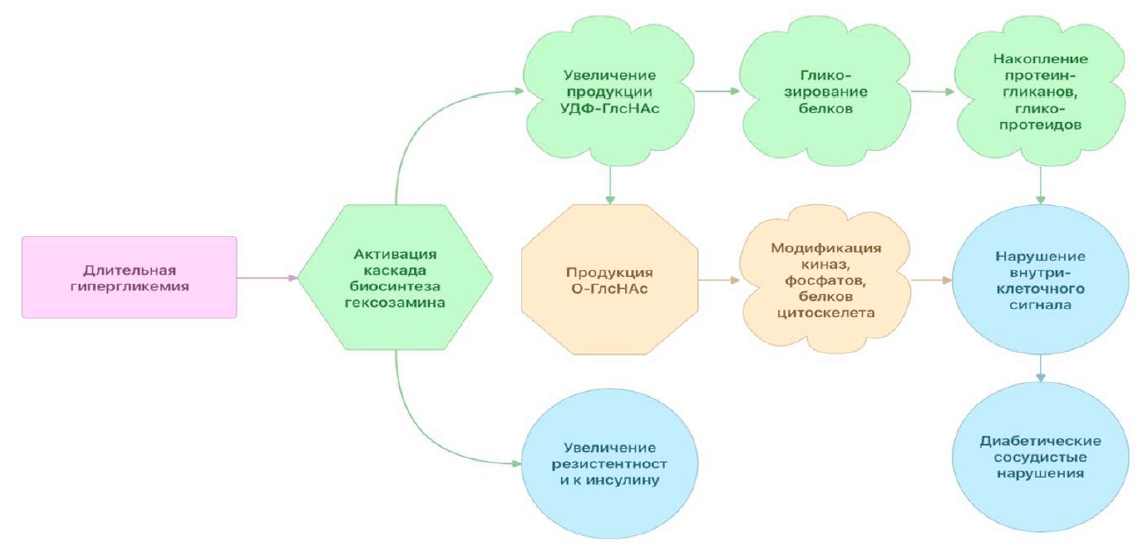
Известно также, что при снижении поступления питательных веществ и при стрессе образование УДФ-ГлсНAc приводит к модификации протеинов [33]. Продукция метаболитов ПБГ увеличивается при снижении гликолиза, что также способствует увеличению количества свободных жирных кислот. Интересно, что ПБГ может активироваться не только за счет гипергликемии, но и за счет быстрого снижения концентрации глюкозы или изменения внутриклеточного уровня кальция [33]. УДФ-ГлсНAc играет важную роль в обратимой посттрансляционной модификации протеинов и может влиять на передачу внутриклеточных сигналов [33]. Связывание УДФ-ГлсНAc с протеинами называется гликозилированием, данный процесс происходит в клеточном аппарате Гольджи. Гликозилирование протеинов приводит к образованию различных белковых форм, таких как протеогликаны и гликопротеины. ПБГ высокочувствителен к уровням глюкозы в крови, и его патологический биосинтез значительно увеличивается в некоторых тканях пациентов с СД, что приводит к повышенным уровням УДФ-ГлсНAc и, таким образом, к повышенному гликозилированию O-связи в N-ацетилглюкозамине (O-ГлсНAc) [33]. Постоянное увеличение продукции O-ГлсНAc на клеточном уровне изменяет реакцию нескольких ключевых сигнальных биохимических путей на стресс. На сегодняшний день хорошо известно, что O-ГлсНAc модифицирует множество различных белков, включая факторы транскрипции, киназы, фосфаты, цитоскелетные белки и рецепторы ядерных гормонов.
Конечные продукты гликирования (КПГ) представляют собой модификации протеинов и липидов, которые становятся гликированными из-за длительной гипергликемии [34, 35]. Первая стадия процесса гликирования белков приводит к образованию оснований Шиффа и продуктов Амадори. Дальнейшее гликирование белков и липидов вызывает молекулярные перестройки, которые приводят к еще большему образованию КПГ [34]. Через активацию реакции гликирования и цепи переноса электронов в митохондриях длительная гипергликемия может также вызывать избыточную продукцию АФК, которые, являясь цитостатиками, вызывают повреждение дезоксирибонуклеиновой кислоты (ДНК) и апоптоз клеток [13, 36]. Продукты КПГ накапливаются в стенке сосудов, где они могут нарушать как структуру, так и функцию клеток [37]. Накопление продуктов КПГ в стенке сосудов приводит к микрососудистым и макрососудистым осложнениям СД [37]. Более того, продукты КПГ могут накапливаться в периферических нервах, что способствует развитию диабетической невропатии [37]. Продукты КПГ снижают активность ОА, синтезируемого эндотелиальными клетками, таким образом КПГ способствуют развитию атеросклероза. Сегодня хорошо известно, что ОА подавляет многие механизмы, способствующие развитию атеросклероза, такие как адгезия лейкоцитов к стенкам сосудов, а также адгезия и агрегация тромбоцитов [38–40]. Необходимо отметить, что увеличение активности биохимического каскада полиола с последующим накоплением сорбитола может также гликировать азот на белках, таких как коллаген. Эти гликированные белки также являются продуктами КПГ, которые, в свою очередь, генерируют АФК различными патофизиологическими путями. Все эти биохимические изменения приводят к микрососудистым и макрососудистым патологиям.
Гипергликемия может быть выявлена еще до операции, как у больных с СД, так и у здоровых пациентов. Стрессовое состояние перед операцией само по себе, как и хирургическое вмешательство, увеличивает секрецию стресс-гормонов, таких как кортизол, глюкагон, гормон роста и катехоламины, которые, в свою очередь, вызывают снижение секреции инсулина и снижение периферической утилизации глюкозы [41,42]. Как следствие, усиливаются глюконеогенез и глюкогенолиз, что приводит к дальнейшему возрастанию стресс-гипергликемии [41, 42]. Неконтролируемая гипергликемия может вызывать осмотический диурез с дальнейшим дисбалансом жидкости и электролитов и повышенным образованием провоспалительных цитокинов. Все эти изменения могут приводить к развитию диабетического кетоацидоза, иммунной дизрегуляции и инсулинорезистентности (рис. 4).
Рис. 4. Патофизиологические эффекты стресс-индуцированной гипергликемии
Fig. 4. Pathophysiological effects of stress-related hyperglycaemia
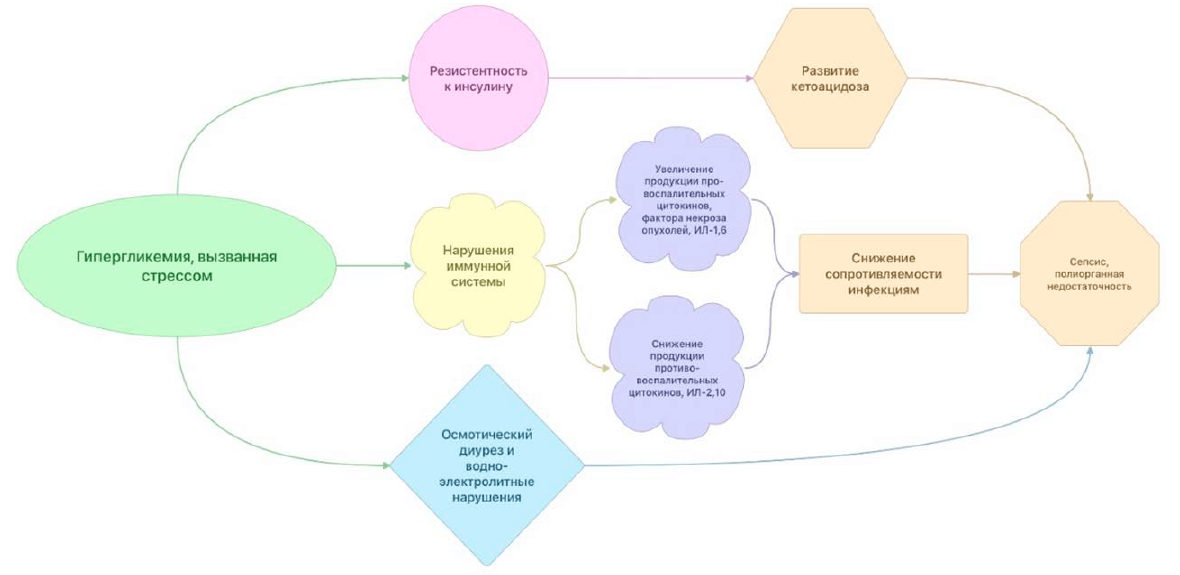
У хирургических пациентов с СД1 длительное предоперационное голодание в сочетании с прекращением введения инсулина и избыточной выработкой гормонов стресса приводит к усилению липолиза и протеолиза. Катаболический эффект гормонов стресса приводит к усилению глюконеогенеза и глюкогенолиза, расщеплению жиров на свободные жирные кислоты (СЖК) и глицерин, белков — на аминокислоты. Повышенные уровни гликогенных предшественников (глицерина и аминокислот) способствуют также глюконеогенезу и также ухудшают гипергликемию [43]. В свою очередь, СЖК связываются с альбумином и транспортируются в печень, где они трансформируются в кетоновые тела. Первичные кетоновые тела (β-гидроксибутират и ацетоуксусная кислота) несут основную ответственность за развитие метаболического ацидоза [43]. Далее уксусная кислота метаболизируется до ацетона, еще одного важного кетонового тела. Истощение запасов гликогена в печени стимулирует дальнейший кетогенез [43]. У хирургических пациентов диабетический кетоацидоз (ДКА) может развиться очень быстро, менее чем за 24 ч. Осмотический диурез из-за гипергликемии усугубляет потерю ионов калия почками, в то время как ион хлорида удерживается в обмен на выводимые кетоанионы. Потеря кетоанионов с мочой обычно сочетается со снижением уровня бикарбоната. Таким образом, на фоне выраженной кетонурии развивается гиперхлоремический ацидоз.
Стресс-индуцированная гипергликемия способствует активации воспалительного состояния, характеризующегося повышением уровней провоспалительных цитокинов, таких как ФНО-α, ИЛ-1β, ИЛ-6 и ИЛ-8 [44, 45]. Между тем высокий уровень глюкозы также подавляет выработку противовоспалительных цитокинов ИЛ-2 и ИЛ-10 [46]. Считается, что воспалительный иммунный ответ развивается также из-за апоптоза адипоцитов, инфильтрации и активации макрофагов. Стресс-индуцированная гипергликемия может подавлять различные аспекты защитной иммунной функции: хемотаксис, фагоцитоз, генерацию активных форм кислорода и внутриклеточное уничтожение бактерий [44]. Все эти изменения приводят к повышенной восприимчивости к инфекциям и постепенному развитию дисфункции многих органов. Эта иммунная дизрегуляция может вернуться к почти нормальным значениям при терапии инсулином и внутривенной инфузии в течение 24 ч.
Стресс-индуцированная гипергликемия и дальнейший катаболический метаболизм вызывают развитие инсулинорезистентности. Инсулинорезистентность — это состояние, когда обычный биологический ответ на инсулин значительно снижается независимо от концентрации инсулина [47]. Объем и степень хирургического вмешательства влияют на степень выраженности инсулинорезистентности [48–50]. Было обнаружено, что торакальные и обширные абдоминальные операции вызывают более глубокое и продолжительное состояние инсулинорезистентности, чем периферические или диагностические процедуры с меньшим объемом инвазии [49]. Более того, инсулинорезистентность в меньшей степени выражена при проведении лапароскопической хирургии по сравнению с открытыми полостными операциями [50]. Состояние инсулинорезистентности может способствовать дальнейшему усилению липолиза, увеличению выработки СЖК и, таким образом, создает порочный круг в развитии ДКА. У хирургических пациентов состояние инсулинорезистентности может также приводить к ряду побочных эффектов, таких как нарушение синтеза мышечного гликогена, снижение поглощения триглицеридов, приводящее к гипертриглицеридемии, повышение выработки глюкозы в печени, нарушение высвобождения и функции ОА и увеличение выработки прокоагулянтных факторов. Послеоперационная инсулинорезистентность может сохраняться до 2–3 нед. после неосложненного планового абдоминального хирургического вмешательства, следовательно, это состояние само по себе может существенно влиять на послеоперационное течение у пациентов с СД и у пациентов без СД [51].
На сегодняшний день частота осложнений и уровень летальности в плановой хирургии характеризуются достаточно низкими показателями. Этот факт сам по себе может создавать ложное ощущение, будто современные анестетики эффективно подавляют практически все стрессовые реакции на хирургическое вмешательство и, следовательно, предотвращают развитие гипергликемии в периоперационном периоде. Однако периоперационная гипергликемия выявляется у 20–80 % хирургических больных в зависимости от вида планового хирургического вмешательства, причем самый высокий показатель традиционно регистрируется в кардиохирургии [52–54]. Данный факт является одной из причин, по которой опиоиды в высоких дозах все еще применяются в кардиохирургии (эффективно подавляют секрецию гормонов гипоталамуса и гипофиза). Между тем стимулирующий эффект искусственного кровообращения настолько велик, что периоперационная гипергликемия все еще регистрируется у многих кардиохирургических пациентов [55]. Несмотря на эффективное подавление секреции гормонов стресса, опиоиды в высоких дозах плохо подходят для плановых не кардиохирургических операций из-за длительного послеоперационного пробуждения и повышенной потребности в послеоперационной искусственной вентиляции легких [56]. В то же время повышенная симпатоадреналовая активность может развиваться не только из-за хирургической травмы или стресса, но также из-за гипоксии, гиперкапнии, кровопотери и низкого артериального давления [57]. Выраженная инсулинорезистентность и, следовательно, периоперационная гипергликемия могут выявляться у пациентов во время хирургических вмешательств на верхних отделах брюшной полости, даже если эндокринный ответ минимален или отсутствует [58]. Интересно, что состояние инсулинорезистентности легко можно смоделировать у здоровых добровольцев с помощью инфузии гормонов стресса [59], а также оно может быть спровоцировано непосредственно повышением уровня в плазме крови провоспалительных цитокинов, таких как ФНО-α [60, 61] или ИЛ-6 [62]. Следует отметить, что повышенный уровень ИЛ-6 у хирургических пациентов считается ранним маркером повреждения ткани, и его повышение обычно прямо пропорционально степени повреждения ткани [63,64]. Более того, эндотелиальные клетки и лейкоциты начинают также синтезировать ИЛ-6 в ответ на повышенные уровни ИЛ-1β и ФНО-α [65]. Таким образом, необходимо помнить, что сама про себе иммунная дизрегуляция из-за повреждения тканей и увеличения выработки провоспалительных цитокинов может быть причиной как инсулинорезистентности, так и периоперационной гипергликемии, независимо от типа анестезии.
Используя метод изотопного индикатора для исследования кинетики интраоперационного метаболизма глюкозы (продукция, использование и клиренс глюкозы в организме), Lattermann R. et al. продемонстрировали, что повышение уровня глюкозы крови на 40 % от исходного уровня, наблюдаемое в ходе анестезии изофлураном у пациентов без СД, было следствием как нарушения клиренса глюкозы, так и увеличения продукции глюкозы [66]. В свою очередь, добавление эпидуральной анальгезии к общей анестезии изофлураном у таких пациентов эффективно предотвращало этот гипергликемический ответ за счет снижения продукции глюкозы [66]. Не так давно Cok O.Y. et al. сравнили влияние анестезии изофлураном или пропофолом в комбинации с ремифентанилом на уровень глюкозы, инсулина и кортизола в плазме крови во время операции у 40 пациентов, перенесших трепанацию черепа. Исследователи обнаружили достоверную разницу в значениях ГК между группами исследования [67]. Общая анестезия пропофолом обеспечивала более стабильный уровень глюкозы крови, особенно после первого часа операции, тогда как при использовании изофлурана наблюдалось постепенное нарастание уровня ГК [67]. Показатели инсулина в плазме крови на 60-й минуте операции были значительно ниже в группе изофлурана, чем в группе пропофола [67]. На сегодняшний день несколько экспериментальных и клинических исследований ясно демонстрируют, что изофлуран за счет стимуляции продукции и снижения утилизации глюкозы увеличивает уровень ГК как в ходе хирургического вмешательства, так и без него [68–71]. Проспективное рандомизированное исследование 40 пациентов без СД в ходе плановой абдоминальной гистерэктомии с использованием общей анестезии севофлураном (ОАС) или тотальной внутривенной анестезией (ТВА) пропофолом и ремифентанилом [72] выявило, что уровень адреналина, норадреналина, кортизола и глюкозы в плазме крови был значительно ниже при использовании ТВА по сравнению с ОАС, но при этом не отмечено различий в уровне ИЛ-6 плазмы между этими группами [72]. Несмотря на то что артериальное давление и частота сердечных сокращений были значительно ниже в группе ТВА, чем в группе ОАС, обе методики общей анестезии предотвращали повышение частоты сердечных сокращений и артериального давления на протяжении всей операции [72]. В клиническом исследовании 20 пациентов, перенесших абдоминальную гистерэктомию и рандомизированных для проведения общей анестезии севофлураном или изофлураном, метод изотопного индикатора не выявил каких-либо различий в продукции и клиренсе эндогенной глюкозы между этими двумя типами анестезии [73]. Авторы исследования пришли к выводу, что анестезия севофлураном снижает толерантность к глюкозе в той же степени, что и анестезия изофлураном [73]. Таким образом, толерантность к глюкозе во время анестезии севофлураном или изофлураном не зависела от типа ингаляционного агента при дозе данных анестетиков, не превышающей 1,5 минимальной альвеолярной концентрации [73]. У 50 пациентов, перенесших аортокоронарное шунтирование, гемодинамические показатели и уровень стресс-реакции, оцениваемый по уровням кортизола и креатининкиназы в плазме крови, лучше контролировались в группе больных с использованием пропофола, чем в группе с использованием десфлурана, добавленного к субанестетической дозе пропофола [74]. Более того, пациенты из группы пропофола были экстубированы в среднем на 2,3 ч раньше, провели меньше времени в отделении интенсивной терапии и раньше были выписаны домой по сравнению с пациентами из группы десфлурана [74]. Многочисленные клинические исследования показывают, что общая анестезия пропофолом в сочетании с опиоидами обеспечивает лучшую стабильность уровня ГК во время хирургической операции по сравнению с ингаляционными анестетиками, такими как энфлуран, изофлуран, севофлуран и десфлуран. Исследование 20 здоровых пациентов, перенесших абдоминальную гистерэктомию и получавших либо непрерывную инфузию пропофола с добавлением суфентанила, либо анестезию энфлураном, показало, что в группе внутривенной анестезии полностью отсутствовала стресс-индуцированная эндокринная реакция и концентрации глюкозы в плазме была стабильной на протяжении всего оперативного вмешательства [75]. Однако в этом исследовании анестезия пропофолом/суфентанилом не подавляла метаболические эндокринные изменения через 2 ч после операции, и они были даже более выраженными, чем у больных после ингаляционной анестезии [75]. Необходимо отметить, что все упомянутые выше исследования проводились на здоровых пациентах, и применение ингаляционных препаратов в этих исследованиях не приводило к тяжелой гипергликемии (уровень глюкозы в крови > 10 ммоль/л) [54–75]. Нам удалось найти только одно клиническое ретроспективное исследование, в котором сравнивалось влияние анестезии севофлураном или пропофолом на частоту гипергликемии у пациентов с СД2, перенесших операцию на легких [76]. Авторы исследования обнаружили, что, хотя уровень ГК через 2 ч после операции был значительно ниже у пациентов, получавших анестезию пропофолом, чем у пациентов, получавших анестезию севофлураном, не было никакой разницы в уровнях гипергликемии в периоперационном периоде [76]. Экспериментальные исследования на крысах показали, что анестезия пропофолом одновременно увеличивает и секрецию инсулина, и инсулинорезистентность по сравнению с анестезией севофлураном [77]. В экспериментах на свиньях севофлуран, как и другие ингаляционные агенты, активировал чувствительные к аденозинтрифосфату калиевые каналы в β-клетках и таким образом снижал секрецию инсулина поджелудочной железой [78]. По-видимому, пропофол может иметь некоторое преимущество в поддержании стабильного уровня ГК перед ингаляционными анестетиками. На данный момент проводится два больших проспективных клинических исследования, изучающих влияние различных типов анестезии на уровень гликемии в периоперационном периоде у пациентов с СД. Мы надеемся, что данные исследования помогут «расставить все точки над i» в данной проблеме [79, 80].
В нескольких клинических исследованиях предпринимались попытки оценить влияние региональной анестезии на развитие гипергликемии в периоперационном периоде. В проспективном рандомизированном контролируемом исследовании пациентов, перенесших плановую операцию по замене тазобедренного сустава, спинальная анестезия в отличие от общей анестезии значительно снижала уровень глюкозы как у пациентов, не страдающих диабетом, так и у больных с СД [81]. Исследование здоровых беременных женщин, перенесших плановое кесарево сечение, выявило значительно более низкие концентрации ГК в группе спинальной анестезии по сравнению с роженицами, получившими общую анестезию [82]. Применение торакальной эпидуральной анестезии в сочетании с общей анестезией улучшало гомеостаз глюкозы в течение 24 ч у пациентов из группы низкого риска, перенесших операцию по шунтированию сердца [83]. В клиническом исследовании пациентов из группы низкого риска, которым было запланировано плановое аортокоронарное шунтирование с заменой аортального клапана или без него, высокая торакальная эпидуральная анестезия (ТЭА) также лучше сохраняла метаболизм глюкозы и приводила к меньшей степени гипергликемии, связанной со стрессом, в послеоперационном периоде [85]. В этом исследовании количество пациентов, не получавших инсулин в послеоперационном периоде, было значительно выше в группе ТЭА [85]. У пациентов без СД, перенесших артропластику тазобедренного или коленного сустава, эпидуральная анестезия снижала частоту инсулинорезистентности в течение 48 ч после операции у тех лиц, кто изначально был резистентным к инсулину до операции [84]. В исследовании пациентов, перенесших колоректальное хирургическое вмешательство, эпидуральная блокада в качестве дополнения к общей анестезии эффективно снижала периоперационную гипергликемию за счет снижения продукции глюкозы [86]. У здоровых пациентов, перенесших гистерэктомию, нормальная толерантность к глюкозе и высвобождение инсулина наблюдались под эпидуральной анестезией, тогда как общая анестезия приводила как к снижению толерантности к глюкозе, так и к высвобождению инсулина [87]. Все эти исследования, по-видимому, указывают на то, что спинальная или эпидуральная анестезия, в отличие от общей анестезии, может эффективно снижать гипергликемический ответ на различные виды хирургического вмешательства как у пациентов, не страдающих диабетом, так и у больных с СД. Однако следует отметить, что до сих пор не проводились исследования, демонстрирующие, что региональная анестезия превосходит общую анестезию с точки зрения снижения смертности или серьезных осложнений у хирургических пациентов.
Планирование периоперационного контроля уровня глюкозы в сочетании с тщательной предоперационной оценкой наличия осложнений СД значительно влияет на показатели заболеваемости, продолжительности пребывания в стационаре и смертности у пациентов с СД [53]. Анестезиологу-реаниматологу, планирующему анестезию у больного с СД, необходимо учитывать несколько важных принципов, способствующих оптимальному лечению периоперационной гипергликемии.
Первый принцип заключается в том, что изменение режима приема пациентом инсулина и пероральных гипогликемических препаратов является необходимым компонентом предоперационной подготовки пациентов с СД. В марте 2021 г. Центр периоперативного лечения Королевского колледжа анестезиологов Великобритании опубликовал новое «Руководство по периоперационному лечению пациентов с СД при плановой и неотложной хирургии», которое содержит подробное описание необходимых изменений в предоперационном приеме антидиабетических препаратов [88]. Согласно этим рекомендациям, почти все пероральные гипогликемические препараты (кроме метформина) следует отменять в день операции, в то время как индивидуальный подбор дозы инсулина необходим. Например, суточная доза инсулина снижается на 20–50 %, если предполагается, что в результате хирургического вмешательства пациент пропустит только один прием пищи [88]. Считается, что одна единица подкожно введенного инсулина короткого действия может снижать уровень глюкозы крови примерно на 3 ммоль/л. Однако в ходе предоперационной беседы анестезиологу реаниматологу следует выяснить у больного его индивидуальную дозу инсулина, необходимую для коррекции гипергликемии [88]. Особого внимания требуют пациенты, получающие инсулин с помощью инсулиновой помпы. Инсулиновые помпы запрограммированы для введения постоянной базовой инфузии инсулина короткого действия через небольшой подкожный катетер с возможностью введения дополнительных болюсов инсулина по потребности. В целях профилактики гипогликемии, скорее всего, безопаснее остановить инсулиновую помпу перед хирургическим вмешательством. Однако в случае выполнения коротких хирургических операций в отделении хирургии одного дня и/или в случае, если больной пропустит только один прием пищи, возможно использование инсулиновой помпы и во время операции. В этом случае регулярный контроль ГК необходим.
Второй принцип заключается в том, что пациенты с СД1 предрасположены к развитию ДКА в ходе хирургического вмешательства, поэтому им необходимо постоянное введение «базальной дозы инсулина», если только у пациента, конечно же, отсутствуют признаки гипогликемии (рис. 5). Постоянная инфузия смеси инсулина/глюкозы/калия обычно продолжается до момента возобновления пациентом приема пищи и начала применения своего собственного инсулина [88]. На сегодняшний день существуют различные комбинации инсулина и глюкозы для проведения постоянной внутривенной инфузии [89]. Однако в нашей больнице мы используем 0,5 мл Инсулина лизпро (Хумалог) 100 ЕД/мл или 50 ЕД, добавленных к 500 мл 5 % глюкозы, таким образом, что концентрация смеси составляет 0,1 ЕД на 1 мл раствора. Скорость внутривенной инфузии данной смеси необходимо регулировать в соответствии с измерением ГК (табл. 1). В начале инфузии измерения ГК следует проводить ежечасно, в случае нестабильности ГК еще чаще (через 10–15 мин), чтобы убедиться, что скорость внутривенного введения смеси не приводит к гипогликемии.
Рис. 5. Периоперационные эффекты инсулина
Fig. 5. Peri-operative effects of Insulin (inhibition and stimulation)
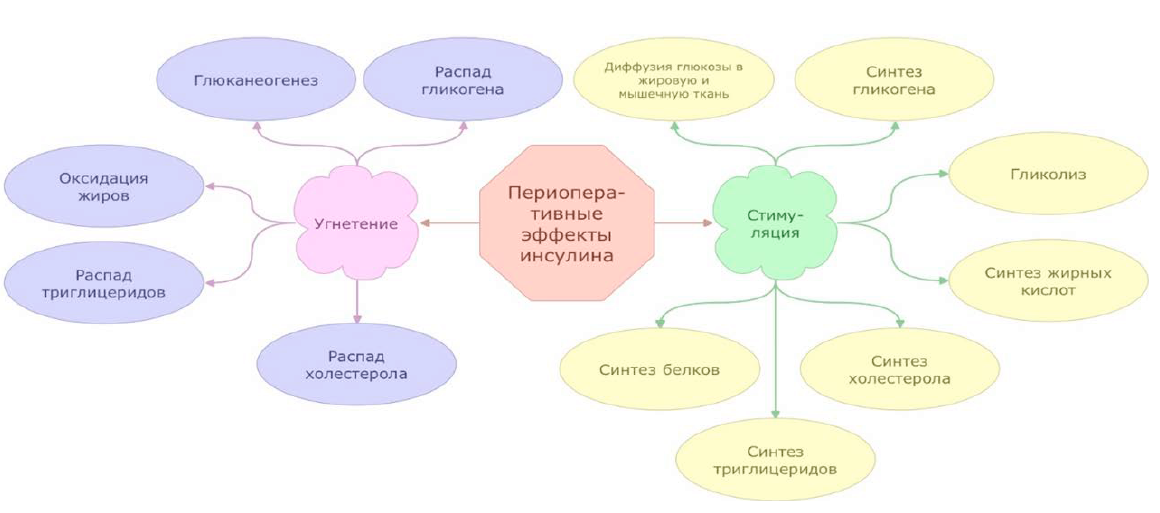
Таблица 1. Рекомендуемая скорость инфузии 5 % глюкозы с концентрацией инсулина 0,1 ЕД/мл в соответствии с уровнем глюкозы крови
Table 1. Proposed infusion rate of 5 % glucose with insulin 0.1 IE /ml according to capillary blood glucose measurement
| Глюкоза крови (ммоль/л) | < 5 | 5-6,9 | 7-9,9 | 10-12,9 | 13-18 | > 18 |
| Скорость инфузии (мл/ч) | 0 | 10 | 15 | 20 | 30 | 40 |
Третий принцип заключается в том, что целевой диапазон ГК необходимо поддерживать между 6–10 ммоль/л, хотя в некоторых ситуациях уровень ГК может быть приемлем и до 12 ммоль/л [88, 89]. В случае нескольких последовательных измерений ГК > 12 ммоль/л следует проверить анализ крови и/или мочи на наличие кетоновых тел [88]. При наличии кетоновых тел в крови > 3,0 ммоль /л или в моче 2+, pH < 7,3 или HCO3 < 15 необходимо начинать лечение ДКА. Пациенты, получающие лечение ингибиторами натрий-глюкозо-котранспортера-2 (SGLT2), требуют особого внимания, поскольку у них может развиться неклассический «эугликемический» ДКА, который может прогрессировать во время хирургической операции [89]. В периоперационном периоде диагностика «эугликемического» ДКА может быть затруднена тем, что из-за нормального уровня ГК наличие кетоновых тел в крови или моче обычно не контролируется [89]. Пациенты пожилого возраста, получавшие препараты SGLT2, могут быть предрасположены к развитию периоперационной гиповолемии и гипотензии из-за потери натрия с мочой и повышенного диуреза [89]. Лечение препаратами SGLT2 может также увеличить риск гипогликемии, когда данные препараты используются в комбинации с инсулинотерапией [90, 91]. Необходимо помнить, что препараты SGLT2 могут значительно влиять на баланс электролитов у пациентов с почечной недостаточностью, вызывая гипонатриемию и гиперкалиемию [90, 91].
Четвертый принцип заключается в том, что инфузия с более высокой концентрацией инсулина может потребоваться в случае плохо контролируемой гипергликемии и/или плохо контролируемого СД, при уровне гликированного гемоглобина HbA1c > 8,5 %, экстренной хирургии и/или для пациентов, которые долго не вернутся к нормальному приему пищи и своему обычному режиму инсулинотерапии. В данных клинических ситуациях мы рекомендуем использование шприц-насоса с 49,5 мл 0,9 % раствором хлорида натрия и добавлением 0,5 мл — 50 ЕД Инсулина лизпро (Хумалог) или Инсулина растворимого (Актрапид НМ) с заданной концентрацией инсулина 1 ЕД/мл раствора. Данный раствор необходимо вводить совместно с внутривенной инфузией 500 мл 10 % глюкозы и добавлением 20 ммоль KCl, если уровень калия в плазме пациента не более чем 5 ммоль/л, со скоростью 40 мл/ч с помощью волюметрического насоса. Скорость введения инсулина обычно начинается с 1 ЕД/ч, а затем уже регулируется в соответствии с измерениями ГК. Регулирование скорости внутривенной инфузии инсулина в зависимости от различных уровней ГК представлено в табл. 2. Важно помнить, что инфузии инсулина и глюкозы должны проводиться через один и тот же внутривенный катетер. Каждые 24 ч необходимо готовить свежий раствор инсулина для немедленного использования. Применение инфузии глюкозы также необходимо для предотвращения протеолиза, липолиза и кетогенеза. Смесь 5 % глюкозы и 0,45 % раствора натрия хлорида может быть использована для предупреждения развития ятрогенной гипонатриемии.
Таблица 2. Рекомендуемая скорость инфузии 0,9 % раствора натрия хлорида с концентрацией инсулина 1 ЕД/мл в соответствии с уровнем глюкозы крови
Table 2. Proposed infusion rate of 0.9 % saline with insulin 1 IE/ml according to capillary blood glucose measurement
| Глюкоза крови (ммоль/л) | < 3 | 3-6 | 6-8 | 8-12 | 12-15 | > 15 |
| Скорость инфузии (IE/кг/ч) | 0 | 0,01 | 0,025 | 0,05 | 0,075 | 0,1 |
Пятый принцип заключается в том, что у пациентов с СД следует избегать длительного предоперационного голодания [88]. Пациенты с СД всегда должны быть первыми в списке оперируемых или в начале программы оперативных вмешательств, и им следует уделять приоритетное внимание как в плановой, так и в неотложной хирургии.
Шестой принцип заключается в том, что пациенты с СД должны лечиться в дневном стационаре, если хирургическая процедура подходит для этого и пациент соответствует критериям для лечения в отделении хирургии одного дня [88]. Хорошо контролируемый диабет не должен быть противопоказанием к амбулаторной хирургии [88]. Не всем пациентам с СД требуется постоянная внутривенная инфузия инсулина с переменной скоростью. Для коротких хирургических операций и одного предполагаемого пропуска приема пищи уровень гликемии может поддерживаться различными модификациями собственных антидиабетических препаратов [88].
Седьмой принцип заключается в том, что уровень гликированного гемоглобина HbA1C является маркером гликемического контроля за длительный период времени, и его предоперационное измерение может помочь выявить пациентов с длительной гипергликемией. В ходе предоперационного обследования пациентов с длительной гипергликемией анестезиолог-реаниматолог должен обратить внимание на клинические проявления диабетической вегетативной нейропатии, такие как тахикардия в покое, непереносимость физических упражнений, ортостатическая гипотензия, запор, гастропарез, судомоторная дисфункция и нарушение нервно-сосудистой функции. Необходимо помнить, что синдром диабетического повреждения суставов может быть причиной неожиданной трудной интубации в ходе вводного наркоза [92, 93]. Кроме того, пациенты с осложнением СД в виде вегетативной желудочно-кишечной невропатии с гастропарезом могут иметь повышенный риск возникновения аспирации желудочным содержимым в ходе вводного наркоза [94, 95]. Сахарный диабет часто связан с метаболическим синдромом, который характеризуется четырьмя общими признаками: гипергликемией, гипертонией, висцеральным ожирением и дислипидемией. Таким образом, всем пациентам с СД необходимо тщательное и полное предоперационное клиническое и лабораторное обследование. Хотелось бы отметить, что на сегодняшний день нет убедительных доказательств того, что снижение HbA1C до нормального уровня до операции положительно влияет на исход хирургического вмешательства. Однако рекомендации некоторых профессиональных ассоциаций анестезиологов предлагают в случае HbA1C > 8,5 % отложить плановую операцию для оптимизации гликемического контроля [96].
Патофизиологические эффекты длительной и/или стресс индуцированной гипергликемии у пациентов с СД могут существенно влиять на уровень заболеваемости, продолжительности пребывания в больнице и смертности за счет различных молекулярных и патофизиологических механизмов. Клинические и лабораторные исследования демонстрируют, что общая анестезия, поддерживаемая пропофолом, может иметь небольшое преимущество в поддержании стабильного уровня ГК перед ингаляционными анестетиками. В свою очередь, в послеоперационном периоде у пациентов после общей анестезии пропофолом может наблюдаться подъем ГК из-за возможного «эффекта отскока». В настоящее время проводятся два клинических исследования, сравнивающих влияние различных анестетиков на периоперационный гликемический статус у пациентов с СД. Применение региональной блокады в качестве дополнения к общей анестезии эффективно снижает гипергликемический ответ на различные виды хирургического вмешательства как у здоровых пациентов, так и у больных с СД. В данном обзоре мы предложили вашему вниманию несколько важных практических принципов, способствующих оптимизации контроля и лечения периоперационной гипергликемии у пациентов с СД.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. В.Н. Куклин, Ю. Матри, Н.П. Барлоу, Щ.Х. Твейт, Я.Э. Квернберг, Э.-М. Рингвольд, В. Даль — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
Author contribution. Kuklin V.N., Matri J., Barlow N.P., Tveit S.H., Kvernberg J.E., Ringvold E.-M., Dahl V. — all authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.