Нозокомиальная пневмония (НП) является наиболее частым гнойно-септическим осложнением в отделениях реанимации и интенсивной терапии (ОРИТ) [1]. Среди всех инфекционных осложнений в ОРИТ на долю НП приходится 25 %, а для ее лечения используется более половины всех назначаемых антибиотиков [2]. Частота вентилятор-ассоциированной пневмонии (ВАП) достигает 86 % от всех случаев послеоперационной пневмонии у хирургических больных [3]. При задержке диагностики и назначения корректной стартовой антимикробной терапии ВАП значительно увеличивается длительность госпитализации и летальность [4]. Согласно некоторым данным, частота ВАП у пациентов нейрохирургического профиля достигает 40–50 % [5]. Пациенты нейрохирургического и неврологического профиля часто нуждаются в продленной искусственной вентиляции легких (ИВЛ), в связи с чем проблемы респираторных осложнений у таких больных особенно актуальны [6]. Как правило, у пациентов после плановых нейрохирургических вмешательств, а также у пациентов, перенесших острое нарушение мозгового кровообращения (ОНМК), нет признаков респираторной инфекции до момента перевода на ИВЛ. Развитие ВАП, таким образом, является следствием проводимой ИВЛ, и перевод на искусственную вентиляцию легких требует готовности к лечению ассоциированных инфекций [7].
Возникновение инфекционного процесса в легких в период госпитализации следует рассматривать как результат нарушения баланса между факторами противоинфекционной защиты и факторами, связанными с основным заболеванием и его лечением, способствующими попаданию в дыхательные пути потенциально патогенных микроорганизмов. Таким образом, обязательным условием развития нозокомиальной пневмонии является преодоление патогенной микрофлорой механизмов антимикробной защиты. Состояние иммунной реакции можно оценить по изменению концентрации цитокинов, выделяемых на разных стадиях пневмонии [8].
Согласно европейским рекомендациям по лечению НП и ВАП, опубликованным в 2017 г., биомаркеры, которые могут быть использованы для оценки течения пневмонии, включают С-реактивный белок (СРБ), прокальцитонин, копептин (белковый фрагмент прогормона вазопрессина) и среднерегионарный фрагмент прогормона активного предсердного натрийуретического пептида (МР-проАНП). Вместе с тем результаты исследований свидетельствуют о низкой специфичности и прогностической ценности данных маркеров. В связи с этим не рекомендуется рутинное измерение биомаркеров для прогнозирования исхода заболевания или эффективности терапии на 3–4-е сутки ВАП [9]. Кроме того, корреляция между известными медиаторами воспаления, маркерами эндотоксикоза или специфическими биомаркерами может значительно варьировать на уровне сывороточной, тканевой и клеточной концентраций [27]. Несмотря на это, многие работы указывают на перспективность изучения цитокинов в качестве предикторов тяжести течения как вне- так и внутрибольничной пневмонии [28].
Учитывая вышеизложенное, в настоящее время выявление потенциальных биомаркеров эффективности антибактериальной терапии ВАП является актуальной задачей.
Цель исследования — изучить изменение цитокинового профиля плазмы у больных нейрореанимационного профиля с вентилятор-ассоциированной пневмонией и определить потенциальные маркеры эффективности антибактериальной терапии.
Нами было проведено двухцентровое обсервационное исследование, выполненное на базе ФГАУ «НМИЦ Лечебно-реабилитационный центр» Минздрава РФ и Городской клинической больницы № 1 имени Н.И. Пирогова. Изучение биологического материала проводилось на базе ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. В исследование было включено 73 пациента (40 мужчин и 33 женщины) от 19 до 82 лет, соответствующих критериям включения и исключения.
Критерии включения: возраст от 18 до 85 лет включительно; ИВЛ более 3 суток; признаки ВАП по клиническим и радиологическим данным (компьютерная томография): более 5 баллов по шкале Clinical Pulmonary Infection Score (CPIS) [26]; наличие повреждения или заболевания головного мозга, в том числе требующие оперативного вмешательства.
Критерии исключения: наличие внелегочного инфекционного процесса (перитонит, менингит); наличие изолированного трахеобронхита (без признаков инфильтрации легочной ткани по данным компьютерной томографии); отлучение от ИВЛ в период наблюдения (1-е–3-и сутки от начала антибактериальной терапии).
Период наблюдения за каждым пациентом составлял 5 суток. Первыми сутками исследования являлся день назначения антибиотикотерапии при выявлении признаков ВАП. У всех пациентов на 1-е и 3-и сутки производили забор крови для определения концентрации цитокинов, измеряли количество лейкоцитов, СРБ, фиксировали температуру тела. На 1-е сутки забор биоматериала производили до введения антибактериальных препаратов. Плазму, полученную после центрифугирования образцов крови, помещали в пробирки с ингибиторами протеаз (SIGMAFAST Protease Inhibitor Tablets, кат. номер S8820, содержащие 4-(2-аминоэтил) бензолсульфонилфторид гидрохлорид, этилендиаминтетрауксусную кислоту, бестатин гидрохлорид, ингибитор цистеиновых протеаз Е-64, лейпептин и апротинин) и замораживали при температуре –70 °С. Клиническое состояние пациентов фиксировали в течение 5 суток, критерии разделения пациентов на группы применяли ретроспективно.
Все пациенты, включенные в исследование, получали антибактериальную терапию в соответствии с чувствительностью локальной нозокомиальной флоры ОРИТ. Респираторная поддержка проводилась в рамках концепции протективной ИВЛ: режимы вентиляции, управляемые по давлению, дыхательный объем — 6–8 мл/кг, положительное давление в конце выдоха — 8–12 см вод. ст.
Изучение отличий микробиологического пейзажа в лечебных учреждениях, а также спектр назначаемой антибактериальной терапии не входили в задачи данного исследования. Помимо этого, в исследовании не учитывались следующие различия: в тактике лечения основного заболевания, инфузионной терапии и энтеральном питании между группами.
Ретроспективно пациенты были разделены на две группы (условно обозначенные как «белая» и «красная») в зависимости от клинического течения заболевания. В «белую» группу включили пациентов, состояние которых улучшилось после начала антибиотикотерапии или замены антибиотикотерапии в период исследования (успешная антибиотикотерапия, n = 36). В «красную» группу включили пациентов, состояние которых не изменилось или ухудшилось, несмотря на проводимую антимикробную терапию (n = 37), оценка по шкале CPIS составила более 5 баллов к 5-м суткам наблюдения.
Принадлежность пациента к «белой» группе была определена путем экспертной оценки клинического состояния и результатов лабораторных исследований:
В работе были использованы наборы для измерения концентрации цитокинов и хемокинов Bio-Plex 27-plex и 37-plex (Bio-Rad, США), измерение было произведено с помощью системы мультиплексного анализа Bio-Plex® MAGPIX™ (Bio-Rad, США). Был произведен мультиплексный иммуноферментный анализ образцов плазмы на магнитных частицах Magpix (Bio-Rad, США). Были определены концентрации 59 цитокинов: антагонист рецептора интерлейкина-1 (IL-1RA), интерлейкин-1 β, интерлейкин-2, интерлейкин-4, интерлейкин-5, интерлейкин-6 (IL-6), интерлейкин-7, интерлейкин-8, интерлейкин-9, интерлейкин-10, интерлейкин-12 (IL-12), интерлейкин-13, интерлейкин-15, интерлейкин-17, индуцируемый гамма-интерфероном белок-10, эотаксин, гранулоцитарный колониестимулирующий фактор (G-CSF), колониестимулирующий фактор гранулоцитов и макрофагов, интерферон γ, моноцитарный хемотаксический протеин-1, макрофагальный воспалительный белок 1-α, макрофагальный воспалительный белок 1-β, основной фактор роста фибробластов, фактор роста тромбоцитов (PDGF-BB), фактор роста эндотелия сосудов, хемокин, экспрессируемый и секретируемый T-клетками при активации (RANTES), фактор некроза опухоли α, член надсемейства лигандов факторов некроза опухоли 13 (APRIL или TNFSF13), B-лимфоцит-активирующий фактор (BAFF), протеин клеточной мембраны из семейства рецепторов факторов некроза опухоли (sCD30), растворимый рецептор гемоглобина, экспрессируемый на клеточной мембране макрофагов (sCD163), хитиназа 3-подобный белок 1 (Chitinase 3-like), гликопротеин 130 (gp130/sIL-6Rb), интерферон α-2, интерферон β, рецептор интерлейкина-6 α, интерлейкин-11, интерлейкин-12р40, интерлейкин-19, интерлейкин-20, интерлейкин-22, интерлейкин-26, интерлейкин-27р28, интерлейкин-28А (IL-28A/IFN-lambda2), интерлейкин-29 (IL-29/IFN-lambda1), интерлейкин-32, интерлейкин-34, интерлейкин-35, белок надсемейства факторов некроза опухоли 14 (LIGHT или TNFSF14), матриксная металлопротеиназа 1, матриксная металлопротеиназа 2 (MMP-2), матриксная металлопротеиназа 3, остеокальцин, остеопонтин, пентраксин-3, растворимый рецептор фактора некроза опухоли 1, растворимый рецептор фактора некроза опухоли 2, тимический стромальный лимфопоэтин (TSLP), элемент 12 надсемейства лигандов фактора некроза опухоли (TWEAK). Подготовку проб и анализ производили согласно методике производителя. Расчет концентрации цитокинов проводили, используя программное обеспечение прибора.
Статистическую обработку данных проводили с использованием программы PASW Statistics 22. Выборки были исследованы на нормальность с помощью теста Шапиро—Уилкса. Описательные статистики для количественных переменных представлены в виде среднего, медианы и 25-го и 75-го перцентилей, выбросов, рассчитанных по эксклюзивной медиане. Для сравнения количественных данных в двух несвязанных между собой выборках применяли t-критерий Стьюдента для параметров, распределенных нормально, и U-критерий Манна—Уитни для параметров, распределение которых отличалось от нормального. Для сравнения количественных данных в двух связанных совокупностях использовали непараметрический критерий Уилкоксона. Уровень значимости (p) принимали равным 0,05 во всех сравнениях.
Для оценки прогностической значимости абсолютного значения концентрации цитокинов и их изменения течение 3 суток использовали ROC-анализ (Receiver Operator Characteristic). Были выбраны показатели с высокими значениями чувствительности/специфичности и статистической значимостью и определены пороги диагностических критериев. Общую прогностическую ценность маркеров оценили по показателю площади под кривой (AUC). Абсолютные значения цитокинов и изменения их концентрации были использованы для построения прогностической модели. Многофакторная прогностическая модель была построена методом логистической регрессии с пошаговым исключением переменных по алгоритму Вальда.
Исследование одобрено Межвузовским комитетом по этике, протокол № 03–15 от 19.03.2015.
Для анализа мы отобрали 73 пациента, удовлетворяющих критериям включения в исследование. Демографические характеристики выборки представлены в табл. 1.
Таблица 1. Описательные характеристики состава групп
Table 1. Descriptive characteristics of the clinical groups
| Характеристика | Все больные (n = 73) | «Белая» группа (n = 36) |
«Красная» группа (n = 37) |
|---|---|---|---|
| Возраст, лет | 54,8 ± 17,2 | 55,8 ± 17,2 | 53,8 ± 17,3 |
| Пол | |||
| Мужчины | 55 % (40) | 61,1 % (22) | 48,6 % (18) |
| Женщины | 45 % (33) | 38,9 % (14) | 51,4 % (19) |
| Основной диагноз (заболевание или повреждение ЦНС) | |||
| ОНМК по геморрагическому типу | 21,9 % (16) | 22,2 % (8) | 21,6 % (8) |
| ОНМК по ишемическому типу | 13,7 % (10) | 16,7 % (6) | 10,8 % (4) |
| Постреанимационная болезнь | 9,6 % (7) | 2,8 % (1) | 16,2 % (6) |
| Опухоль головного мозга | 19,2 % (14) | 19,4 % (7) | 18,9 % (7) |
| Аневризма мозговых артерий | 6,8 % (5) | 11,1 % (4) | 2,7 % (1) |
| Закрытая черепно-мозговая травма | 15,1 % (11) | 8,3 % (3) | 21,6 % (8) |
| Открытая черепно-мозговая травма | 6,8 % (5) | 8,3 % (3) | 5,4 % (2) |
| Прочие | 6,8 % (5) | 11,1 % (4) | 2,7 % (1) |
ОНМК — острое нарушение мозгового кровообращения.
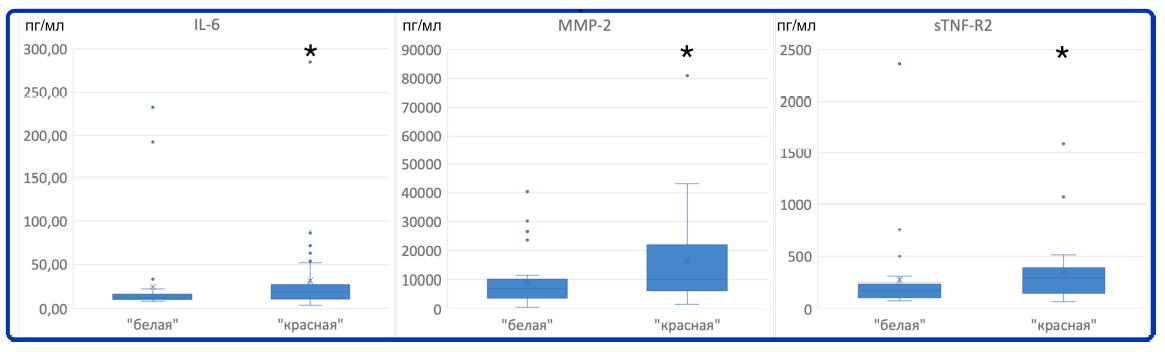
Для оценки изменений иммунного статуса у пациентов с различным ответом на лечение произведено сравнение концентрации цитокинов на 1-е и 3-и сутки внутри групп, а также между группами на 1-е сутки исследования. Наличие объективных различий в клиническом состоянии пациентов между «красной» и «белой» группами подтверждает статистически значимо отличающийся уровень лейкоцитоза на 1-е сутки и статистически значимые различия температуры тела на 3-и сутки. По абсолютному значению концентрации цитокинов на 3-и сутки статистически значимые отличия между группами не были выявлены. На 1-е сутки между «красной» и «белой» группами статистически значимо отличались концентрации IL-6, MMP-2 и sTNF-R2 в крови (критерий Манна—Уитни, р < 0,05, рис. 1).
Рис. 1. Статистически значимые различия в концентрации цитокинов IL-6, MMP-2, sTNF-R2 между группами пациентов с благоприятным течением ВАП («белая» группа) и неблагоприятным течением ВАП («красная» группа) в 1-е сутки. Звездочкой отмечены группы со статистически значимо большей концентрацией цитокинов (p < 0,05 по критерию Манна—Уитни)
Fig. 1. Statistically significant differences in concentration of cytokines IL-6, MMP-2, sTNF-R2 between patient group with favorable clinical course of VAP (“white group”) and patient group with unfavorable clinical course of VAP (“red group”) on day 1. Stars mark statistically significant higher levels of cytokine concentration (p < 0,05, Mann–Whitney U-test)

Далее была исследована динамика концентрации цитокинов между первыми и третьими сутками внутри каждой группы. С помощью критерия значимых рангов Уилкоксона (p < 0,05) были выявлены статистически значимые различия. В «белой» группе на 3-и сутки значимо увеличились концентрации цитокинов MMP-2, остеокальцина и TWEAK и уменьшились концентрации IL-1RA, IL-6, G–CSF, LIGHT, пентраксина, TSLP (рис. 2).
Рис. 2. Статистически значимые изменения концентрации цитокинов в «белой» группе. Звездочкой отмечены точки со статистически значимо большей концентраций цитокинов в данной группе по сравнению со второй исследованной временной точкой (р < 0,05 по критерию Уилкоксона)
Fig. 2. Statistically significant changes in cytokine concentration in the «white group». Stars mark the time point (day) with statistically higher cytokine concentration in this group in comparison with the second time point (day) (р < 0,05 Wilcoxon signed-rank test)
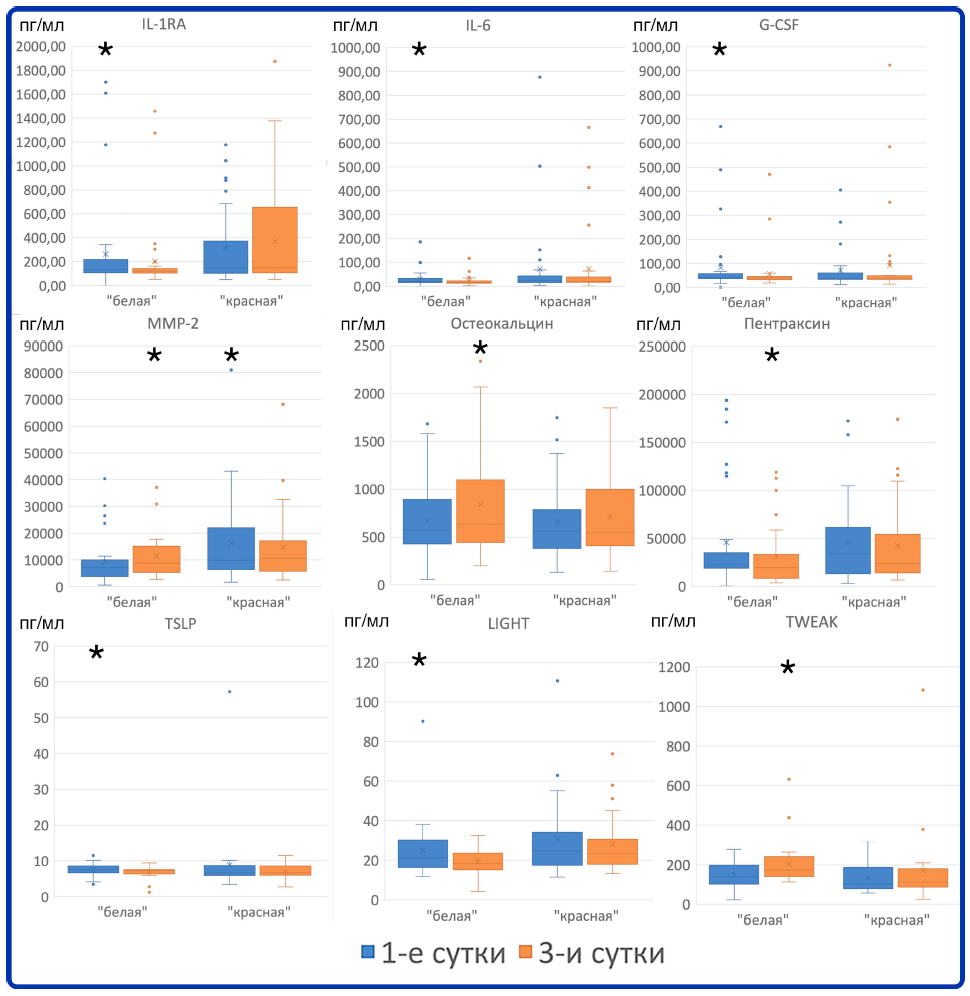
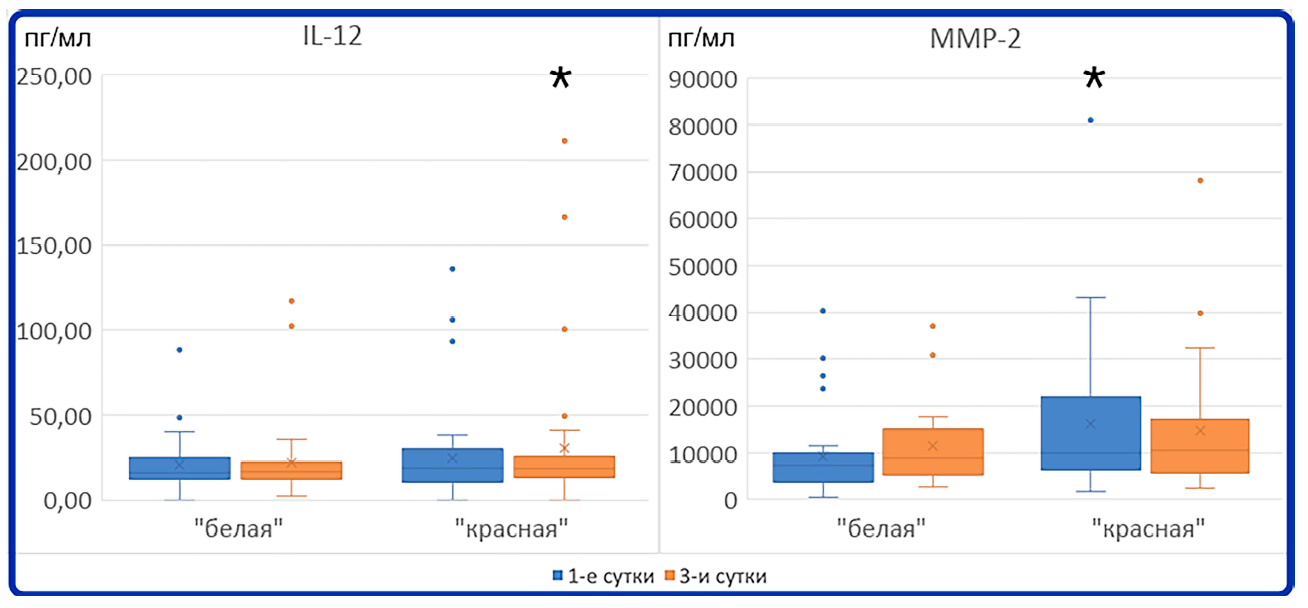
В «красной» группе к 3-м суткам статистически значимо уменьшилась концентрация ММР-2 и увеличилась концентрация IL-12 (рис. 3).
Рис. 3. Статистически значимые изменения концентрации цитокинов в «красной» группе. Звездочкой отмечены точки со статистически значимо большей концентраций цитокинов в данной группе по сравнению со второй исследованной временной точкой (р < 0,05 по критерию Уилкоксона)
Fig. 3. Statistically significant changes in cytokine concentration in the «red group». Stars mark the time point (day) with statistically higher cytokine concentration in this group in comparison with the second time point (day) (р < 0,05 Wilcoxon signedrank test)
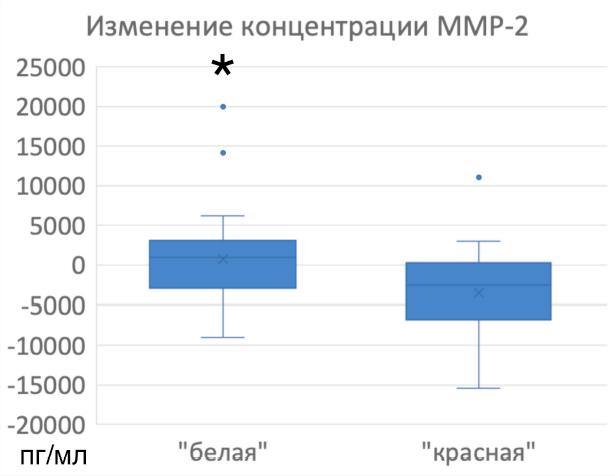
Несмотря на наличие статистически значимой динамики концентрации цитокинов, в среднем разница между абсолютными значениями на 1-е и 3-и сутки не превышала 50 пг/мл. В связи со значительным разбросом данных и небольшими размерами выборок изменение концентрации большинства цитокинов значимо не отличалось между «красной» и «белой» группами. Статистически значимо между группами отличалась только динамика концентрации ММР-2 (р < 0,05, критерий Манна—Уитни). В «белой» группе средний прирост концентрации ММР-2 составил 1265,25 пг/мл, в «красной» средняя убыль составила 2118,90 пг/мл (рис. 4).
Рис. 4. Изменение концентрации ММР-2 на 3-и сутки по сравнению с первыми сутками в «красной» и «белой» группах, различия статистически значимы (критерий Манна—Уитни, р < 0,05)
Fig. 4. Change in average concentration of MMP-2 on day 3 in comparison with day 1 in the «red» and “white” groups. The difference is statistically significant (p < 0,05, Mann–Whitney U-test)
Для оценки прогностической ценности динамики цитокинов, концентрация которых значимо изменилась, был проведен ROC-анализ. Показатели чувствительности и специфичности при различных пороговых значениях были использованы для построения ROC-кривых, общая эффективность маркера была оценена с помощью показателя площади под кривой (AUC). Результаты расчетов с 95%-ми доверительными интервалами (95% ДИ) представлены в табл. 2.
Таблица 2. AUC для значимых предикторов исхода заболевания
Table 2. AUC for significant predictors of clinical outcome
| Цитокин | AUC | 95% ДИ нижний | 95% ДИ верхний | Значимость |
|---|---|---|---|---|
| IL-1RA | 0,642 | 0,510 | 0,775 | 0,038 |
| G-CSF | 0,643 | 0,515 | 0,772 | 0,037 |
| IL-10 | 0,677 | 0,526 | 0,828 | 0,029 |
| LIGHT | 0,686 | 0,534 | 0,838 | 0,022 |
| MMP-2 | 0,768 | 0,636 | 0,900 | 0,001 |
| TWEAK | 0,680 | 0,530 | 0,830 | 0,026 |
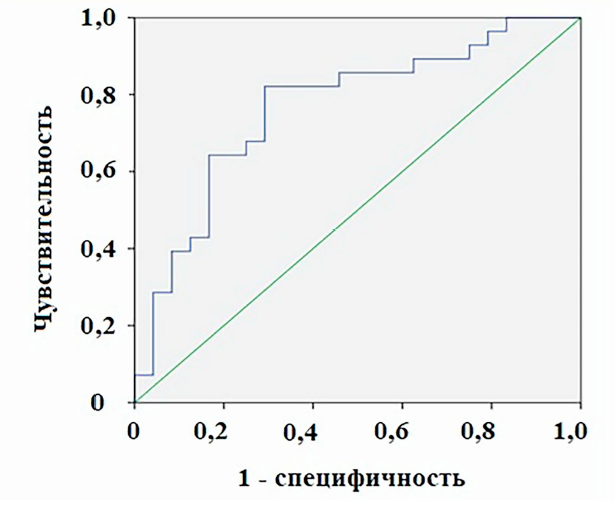
Существенно большей предиктивной силой по сравнению с другими цитокинами обладает ММР-2. Значения AUC ниже 0,7 свидетельствуют о низкой ценности прочих цитокинов в качестве предикторов исхода ВАП, поэтому для дальнейшего исследования был выбран ММР-2. На рис. 5 изображена ROC-кривая изменения концентрации данного цитокина в качестве критерия исхода ВАП. При выбранном пороговом значении –659,0 пикограмма (пг) чувствительность и специфичность составили 82,1 и 70,8 % соответственно.
Рис. 5. ROC-кривая для изменения концентрации ММР-2 между 1-ми и 3-ми сутками наблюдения как предиктор исхода лечения ВАП. Зеленая линия обозначает референтную прямую, синяя — ROC-кривую
Fig. 5. ROC-curve for the change of MMP-2 concentration between day 1 and day 3 as a predictor of treatment outcome of VAP. Green line- reference line, blue line — ROC-curve
С целью дальнейшего изучения прогностических маркеров динамики течения ВАП мы построили предиктивную модель на основании метода логистической регрессии. Путем пошагового включения переменных были отсеяны не увеличивающие точность предсказания цитокины. Модель была построена на основе изменения концентрации ММР-2. На основании построенной модели можно сделать вывод, что динамика показателя ММР-2 может быть предиктором попадания в «белую» или «красную» группу с точностью 69,2 % (p = 0,013).
Среди всех цитокинов по результатам изучения классическими методами статистики, ROC-анализом и моделью логистической регрессии концентрация ММР-2 оказалась наиболее чувствительным предиктором течения ВАП. Увеличение концентрации ММР-2 может предсказывать или свидетельствовать о благоприятном характере течения ВАП и успешной антибиотикотерапии, снижение — о высоком риске неблагоприятного клинического течения.
Литературные данные свидетельствуют о наличии связи между иммунным статусом пациента и клиническим течением ВАП [10, 11]. Клинический ответ на лечение во многом определяется взаимодействием между патогеном и компонентами иммунной системы. Активность того или иного компонента иммунной системы проявляется выделением цитокинов, необходимых для рекрутирования и фенотипирования определенных лейкоцитов. Поскольку легочная ткань обильно кровоснабжается, можно ожидать повышения концентрации цитокина при их выделении в очаге воспаления [12]. Мы исследовали широкий спектр цитокинов методом иммуноферментного анализа на 1-е и 3-и сутки после начала наблюдения за пациентом. Из 59 исследованных цитокинов только у нескольких концентрация значимо различалась между группами либо между 1-ми и 3-ми сутками. Можно предположить, что продукция большинства цитокинов стабильна вне зависимости от течения заболевания либо что их выделение в очаге воспаления не вызывает проникновения в плазму крови.
Наиболее перспективным цитокином, согласно результатам проведенной работы, оказалась ММР-2, основными субстратами которой являются коллаген 4 типа и эластин — компоненты базальных мембран. ММР-2 участвует в ремоделировании ткани и модуляции воспаления. В исследованиях указаны изменения плазменной концентрации ММР-2 при тяжелом сепсисе, отражающие степень органной дисфункции [13, 14]. Мы не нашли литературных данных о значении ММР-2 в качестве маркера эффективности антибактериальной терапии и тяжести течения ВАП. Hong et al. в экспериментальной работе показали, что матриксные металлопротеиназы-2 и -9 необходимы для адекватного иммунного ответа при пневмонии, вызванной типичным патогеном Streptococcus pneumoniae. Выделение ММР-2 имеет важное значение для фагоцитоза бактерий макрофагами и выделения активных форм кислорода нейтрофилами [15]. В исследовании Puljiz et al. была изучена концентрация ММР-2 при внебольничной пневмонии, вызванной Mycoplasma pneumoniae. Авторы обнаружили, что уровень ММР-2 в плазме при внебольничной пневмонии у пациентов выше в стадии реконвалесценции и ниже — при острой фазе заболевания, чем у пациентов в контрольной группе [16]. В работе Bircan et al. концентрация ММР-2 была выше у пациентов с внебольничной пневмонией и коррелировала с худшим прогнозом лечения [17]. Это целиком соответствует полученным результатам в нашей работе: концентрация ММР-2 была значимо выше на 1-е сутки в группе высокого риска по сравнению с группой низкого риска, но на 3-и сутки значительно уменьшалась. На основании метода логистической регрессии мы построили прогностическую модель для оценки предикторной способности динамики ММР-2 в качестве маркера для определения клинического ответа на проводимую терапию. С точностью около 70 % динамика ММР-2 позволила спрогнозировать благоприятное или неблагоприятное клиническое течение заболевания. Значимость ММР-2 также была подтверждена классическими статистическими критериями и ROC-анализом. ММР-2 имеет амбивалентное значение как необходимый компонент иммунного ответа и эффектор аутоповреждения [18]. Полученные результаты подтверждают, что как высокая изначальная концентрация ММР-2, так и ее снижение в динамике свидетельствуют о тяжелом течении пневмонии. На основании полученных данных можно предположить, что ММР-2 может служить маркером эффективности антибактериальной терапии при ВАП, однако для уточнения полученных данных требуются дальнейшие исследования с увеличением выборки.
Несколько цитокинов оказались слабыми предикторами тяжести течения ВАП, но статистически значимые различия между их концентрациями в «белой» и «красной» группах либо на 1-е и 3-и сутки наблюдения указывают на перспективность дальнейшего изучения на большей выборке пациентов. Исходные концентрации IL-6 и растворимого рецептора sTNFR-2 были значимо выше в «красной» группе по сравнению с «белой». В то время как IL-6 имеет амбивалентное действие и разными авторами относится как к провоспалительным, так и к противовоспалительным цитокинам, sTNFR-2 оказывает выраженное противовоспалительное действие [19, 20]. Вероятно, повышение концентрации этих цитокинов может быть связано с иммуносупрессивным действием патогенов при тяжелом течении пневмонии. В «белой» группе на 3-и сутки значимо увеличились концентрации остеокальцина и TWEAK и уменьшились концентрации IL-1RA, IL-6, G–CSF, LIGHT, TSLP. Снижение концентрации всех цитокинов, за исключением IL-1RA, напрямую свидетельствует о меньшей выраженности воспалительной реакции, что может быть напрямую связано с более легким клиническим течением ВАП [21–25]. IL-1RA является противоспалительным цитокином, уменьшение его концентрации в плазме может быть следствием как избыточной аутоагрессии иммунитета, так и нормальным проявлением иммунного ответа [26]. Изменение концентрации указанных цитокинов в плазме крови при ВАП требует дальнейшего изучения.
Отсутствие значимой разницы между абсолютной динамикой параметров в «белой» и «красной» группах может быть объяснено недостаточной величиной выборки. Для изучения прогностической ценности этих цитокинов в качестве маркеров эффективности антибактериальной терапии при ВАП требуются дальнейшие исследования. Помимо этого, представляется целесообразным изучение цитокинового профиля пациентов при назначении того или иного антибактериального препарата широко спектра действия.
При исследовании цитокинового профиля плазмы обнаружены статистически значимые отличия абсолютной динамики концентрации ММР-2 у пациентов с благоприятным и неблагоприятным течением ВАП. В группе благоприятного течения средняя концентрация значительно увеличилась, тогда как в группе неблагоприятного течения ВАП концентрация ММР-2 в плазме значительно уменьшилась на 3-и сутки от начала антибактериальной терапии.
Помимо ММР-2, в исследовании мы получили данные о динамических изменениях концентрации ряда других цитокинов, которые могут быть интересны для дальнейшего изучения и требуют большего объема выборки: IL-1RA, IL-6, G-CSF, LIGHT, остеокальцина, пентраксина, TSLP, TWEAK и IL-12.
Полученные результаты свидетельствуют о прогностической ценности измерения концентрации провоспалительных и противовоспалительных цитокинов в плазме крови при лечении ВАП.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Зинина Е.П., Царенко С.В., Логунов Д.Ю., Тухватулин А.И., Магомедов М.А., Бабаянц А.В., Аврамов А.А. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
Author contribution. Zinina E.P., Tsarenko S.V., Logunov D.Y., Tukhvatulin A.I., Magomedov M.A., Babayants A.V., Avramov А.А.- all authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.