Поиск простых и достоверных клинических и лабораторных признаков, позволяющих выявить высокий риск неблагоприятного течения заболевания, развития критического состояния и летального исхода до сих пор остается одной из наиболее актуальных проблем реаниматологии и интенсивной терапии [1, 2].
Несмотря на многочисленные исследования, в настоящее время отсутствуют объективные критерии, позволяющие достоверно прогнозировать исход тяжелой политравмы у пациентов ОРИТ (отделений реанимации и интенсивной терапии). Это особенно справедливо для педиатрической практики, поскольку организм ребенка имеет колоссальные резервы, которые позволяют ему не только выжить, но и выздороветь даже в тех случаях, когда смерть представляется непредотвратимой. Имеется значительное количество исследований, свидетельствующих о том, что многие клинико-лабораторные признаки могут использоваться как предикторы исхода, однако работы, посвященные поиску интегральных показателей, позволяющих выявить пациентов группы высокого риска, отсутствуют [3–11].
Одним из предикторов критических состояний у детей является концентрация лактата в плазме крови, которая широко используется для оценки тяжести пациентов педиатрических ОРИТ и прогнозирования исхода, поскольку отражает не только степень гипоперфузии, но и тканевой гипоксии, однако вопрос о его прогностической значимости по-прежнему остается открытым [12–20].
Лактат — центральный промежуточный метаболит, увеличение концентрации которого обычно отражает степень выраженности метаболического стресса, а не тканевой гипоксии [18, 20]. Marik в статье «Лактат-ориентированная реанимация — нет ничего опаснее, чем добросовестная глупость» утверждает, что в большинстве случаев гиперлактатемия у пациентов с сепсисом не связана с гипоперфузией и, следовательно, вряд ли будет реагировать на попытки врача увеличить доставку кислорода. Стимулирование доставки кислорода у пациентов с сепсисом и гиперлактатемией не увеличит потребление кислорода, а скорее всего, приведет к росту летальных исходов. Это подтверждают многочисленные работы, свидетельствующие о том, что реализация в клинической практике концепции «супранормальных» значений кислородного статуса зачастую приводит не к улучшению результатов лечения, а к увеличению смертности, хотя автор этой идеи Shoemaker полагает, что данная стратегия оправдана у пациентов с высоким риском летального исхода [22].
В то же время нельзя не отметить, что исследование концентрации лактата в динамике на фоне мероприятий интенсивной терапии может быть полезно для оценки эффективности лечения, при этом метаболические нарушения, отражением которых является гиперлактатемия, не могут быть устранены в течение нескольких часов, поэтому необходимо интерпретировать не абсолютные результаты отдельно взятого анализа, а оценивать динамику течения патологического процесса в целом [23].
Кроме этого, следует указать значение гипергликемии для прогнозирования течения и исхода критических состояний, как у взрослых, так и у детей, поскольку любое критическое состояние характеризуется повышением концентрации глюкозы в плазме крови [24–32].
Одним из предикторов неблагоприятного исхода политравмы являются тяжелые нарушения гемостаза, обусловленные травматической коагулопатией [33–35].
В качестве одного из предикторов политравмы Braun et al. (2019) предлагают оценивать концентрацию тропонина в крови на момент поступления в стационар. Ими установлено, что у детей с тяжелой травмой концентрация тропонина была значительно повышена, при этом у пациентов с увеличением уровня тропонина выше верхней границы референсных значений одновременно возрастала активность интерлейкина-6 и креатинкиназы, что ассоциировалось с увеличением длительности лечения в ОРИТ. Концентрация тропонина была наиболее высокой у детей с торакальной травмой, ушибом легких и оценкой по шкале Sequential organ failure assessment более 2 баллов, что свидетельствовало о высокой вероятности летального исхода [34]. Исследование концентрации D-димера также используют для верификации и оценки степени тяжести черепно-мозговой травмы. Его концентрация в плазме крови менее 0,5 мкг/мл позволяет исключить интракраниальные повреждения и переломы костей черепа [35].
Наличие большого количества исследований, отражающих диагностическую и прогностическую ценность отдельных клинико-лабораторных показателей при критических состояниях и политравме у детей, и отсутствие работ, демонстрирующих значимость совокупности признаков, определяющих исход тяжелых травматических повреждений в педиатрической практике, послужили основанием для настоящего исследования.
Цель исследования — анализ особенностей клинико-лабораторного статуса и мероприятий интенсивной терапии у детей с тяжелой политравмой, определяющих исход критического состояния.
Обследовано 230 детей с тяжелой политравмой, находившихся в педиатрических ОРИТ Северо-Западного федерального округа РФ, БУЗ ВО «Воронежская областная детская клиническая больница № 1», ГБУЗ «Самарская областная клиническая больница им. В.Д. Середавина», ГБУЗ «Республиканская детская клиническая больница» Республики Башкортостан.
Ретроспективное когортное мультицентровое неконтролируемое исследование. Критерии включения: дети старше 1 мес. жизни с тяжелой политравмой, нуждающиеся в искусственной вентиляции легких.
Критерии исключения: 1) наличие тяжелых сопутствующих заболеваний; 2) наличие органического поражения центральной нервной системы
Средний возраст детей составил 9,5 года. Распределение по полу: мальчиков — 151 (65,6 %), девочек — 79 (34,4 %). У 150 (65,2 %) детей травма была получена в результате дорожно-транспортного происшествия, падение с высоты стало причиной травмы у 75 (32,6 %) детей, железнодорожная травма имела место у одного (0,43 %) ребенка и несчастные случаи в быту явились причиной политравмы у 4 (1,73 %) пациентов. У всех детей в структуре политравмы имелось поражение центральной нервной системы различной степени тяжести.
Оценку тяжести состояния у пациентов с политравмой при поступлении проводили с помощью шкал Abbreviated Injury Score (AIS) и Pediatric Traumatic Score (PTS). Оценка по шкале AIS составила 34 балла, по шкале PTS — 5 (2–8) баллов. Признаки гиповолемического шока на фоне кровопотери при поступлении выявлены у 144 (62,6 %) детей, внутричерепные гематомы диагностированы у 42 (18,2 %) пациентов. Оценка по шкале PEdiatric Multiple Organ Dysfunction (PEMOD) в 1-е сутки после травмы составила 3 (2–6) балла, вероятность летального исхода — 2,8 (1,9–8,3 %). Инвазивная искусственная вентиляция легких (ИВЛ) проводилась у 142 (61,7 %) пациентов, ее средняя продолжительность составила 72 (22–177) ч. Длительность лечения в ОРИТ составила 3 (2–7) сут, в стационаре — 24 (15–32) сут. Летальный исход был зарегистрирован у 33 (14,3 %) детей. Оценка по шкалам AIS и PTS у пациентов с летальным исходом составила 48 (41–59) и 0 (0–2) баллов соответственно. Всем детям при поступлении проведено полное клинико-лабораторное обследование, включавшее в себя оценку уровня сознания, мониторинг витальных функций, клинический и биохимический анализ крови, коагулограмму, исследование газового состава и кислотно-основного состояния крови, концентрации лактата в крови, компьютерную томографию и нейросонографию при наличии показаний. Катехоламиновую поддержку проводили с использованием дофамина, добутамина, адреналина и норадреналина при наличии артериальной гипотензии, систолической дисфункции миокарда левого желудочка и синдроме малого сердечного выброса.
Тяжесть поражения центральной нервной системы при поступлении и в динамике оценивали по формуле BIG:
BIG = BD + (2,5 × INR) + (15 – GCS),
где BD — дефицит оснований (base deficit); GCS — шкала комы Глазго; INR — международное нормализованное отношение.
Наличие полиорганной недостаточности оценивали по шкале PEMOD. Уровень гемодинамической и катехоламиновой поддержки оценивали с учетом расчетной возрастной потребности в жидкости, водного баланса и величины катехоламинового индекса:
Катехоламиновый индекс = Дофамин (мкг/кг/мин) + Добутамин (мкг/кг/мин) + Адреналин (мкг/кг/мин) × 100 + Норадреналин (мкг/кг/мин) × 100.
Для верификации гипоксемической дыхательной недостаточности использовали индекс Горовица или соотношение сатурации гемоглобина в пульсирующем кровотоке (SpO2) к фракции кислорода во вдыхаемой смеси (FiO2).
Исследование показателей газового состава и кислотно-основного состояния осуществляли ежедневно на анализаторе ABL835 Flex (Radiometer, Дания). Все показатели оценивали в течение всего лечения в ОРИТ.
В качестве первичного исхода оценивали длительность ИВЛ и продолжительность лечения в ОРИТ. Вторичный исход был разделен на благоприятный (выздоровление) и неблагоприятный (наличие неврологического дефицита на момент перевода в профильное отделение, смерть).
Проверка нормальности распределения вероятности количественных признаков осуществлялась с помощью критерия Колмогорова—Смирнова и Шапиро—Уилка. Учитывая, что большинство количественных признаков не соответствовало закону о нормальном распределении, для сравнения показателей групп пациентов использовали непараметрические методы (U-тест Манна—Уитни и критерий Уилкоксона) и метод ANOVA с поправкой Бонферрони. За критический уровень значимости было принято значение р < 0,05. Все результаты исследования представлены в виде медианы (Me), верхнего (Q1) и нижнего (Q3) квартилей. Для формирования однородных групп пациентов и универсального подхода к оценке тяжести состояния детей в зависимости от исхода заболевания использовали кластерный анализ (метод K-средних). Для разработки моделей прогнозирования исходов лечения пациентов в критическом состоянии в ОРИТ использовали дисперсионный и множественный линейный регрессионный анализ.
Этическое одобрение. Исследование одобрено Этическим комитетом при ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России (Протокол № 9/4 от 26.09.2016).
Выявлено, что наиболее сильные корреляционные зависимости длительности лечения в ОРИТ характерны для таких признаков, как продолжительность ИВЛ, седации и гемодинамической поддержки с использованием инотропных и вазоактивных препаратов (табл. 1).
Таблица 1. Факторы, влияющие на длительность лечения в ОРИТ
Table 1. Factors affecting ICU length of stay
| Признаки | Spearman — R | p-value |
|---|---|---|
| Длительность лечения в ОРИТ / продолжительность ИВЛ | 0,86 | 0,000 |
| Длительность лечения в ОРИТ / продолжительность седации | 0,73 | 0,000 |
| Длительность лечения в ОРИТ / гемодинамической поддержки | 0,50 | 0,000 |
| Длительность лечения в ОРИТ / оценка по шкале комы Глазго при поступлении | –0,48 | 0,000 |
Наиболее значимыми признаками, влияющими на длительность пребывания пациента с тяжелой политравмой в ОРИТ, являются продолжительность седации, оценки по шкалам комы Глазго (ШКГ), AIS, PTS, а также наличие внутричерепной гематомы.
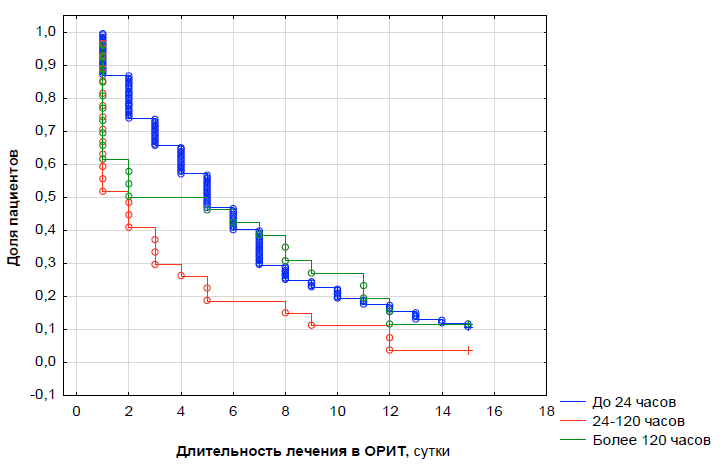
В табл. 2 и на рис. 1 продемонстрирована значимая зависимость между длительностью седации и лечением в ОРИТ. Минимальная длительность лечения в ОРИТ отмечается при кратковременной седации в течение суток. Обращает на себя внимание отсутствие корреляционной зависимости между продолжительностью седации и оценкой по шкалам, отражающих тяжесть состояния пациента и травматических повреждений. При длительности седации более 5 сут продолжительность лечения в ОРИТ значительно увеличивается.
Таблица 2. Длительность лечения в ОРИТ в зависимости от тяжести состояния пациента с политравмой на момент поступления
Table 2. ICU length of stay depending on the severity of the patientʼs condition with polytrauma at the time of admission
| Характеристика признака | Длительность лечения в ОРИТ (медиана) |
Среднее значение | δ | Общее количество случаев |
|---|---|---|---|---|
| Длительность седации, сут | ||||
| До 1 | 2,0 | 3,6 | 1 | 27 |
| 1–5 | 3,5 | 5,8 | 3 | 26 |
| Более 5 | 5,0 | 6,28 | 19 | 177 |
| Всего | 5,0 | 5,6 | 23 | 230 |
| Оценка по шкале AIS, баллы | ||||
| 0–30 | 2,0 | 3,6 | 1 | 91 |
| 31–45 | 5,0 | 6,7 | 9 | 79 |
| Более 45 | 7,5 | 8,3 | 13 | 60 |
| Всего | 5,0 | 5,9 | 23 | 230 |
| Оценка по шкале PTS, баллы | ||||
| Менее 5 | 7,0 | 7,6 | 19 | 131 |
| Более 5 | 2,0 | 3,6 | 4 | 99 |
| Всего | 5,0 | 5,9 | 23 | 230 |
| Наличие внутричерепной гематомы | ||||
| Есть | 4,0 | 5,0 | 9 | 188 |
| Нет | 10,5 | 9,6 | 14 | 42 |
| Всего | 5,0 | 5,9 | 23 | 230 |
| Оценка по шкале комы Глазго на момент поступления в ОРИТ, баллы | ||||
| Менее 9 | 2,0 | 3,7 | 1 | 109 |
| Более 9 | 5,0 | 7,3 | 6 | 35 |
| Всего | 3,0 | 4,6 | 7 | 144 |
Рис. 1. Длительность лечения в ОРИТ в зависимости от продолжительности седации
Fig. 1. ICU length of stay depending depending on duration of sedation
X-axis — time, days; Y-axis — Cumulative Proportion Surviving; blue line — less than 24 hours; red line — 24–120 hours, green line — more than 120 hours.

Аналогичная зависимость отмечается и при исследовании продолжительности лечения в ОРИТ в зависимости от оценки по шкале PTS — при оценке менее 5 баллов время лечения пациента в ОРИТ значительно увеличивается. Пациенты с тяжелой политравмой при наличии внутричерепной гематомы нуждаются в длительном лечении, при этом время их пребывания в ОРИТ в два раза больше по сравнению с детьми без внутричерепной гематомы. Минимальная длительность лечения в ОРИТ отмечается при оценке тяжести травмы по шкале AIS до 30 баллов, с увеличением оценки, а соответственно, и тяжести политравмы, длительность лечения в ОРИТ значительно увеличивается.
Обращает на себя внимание, что при оценке по шкале комы Глазго < 9 баллов средняя длительность лечения в ОРИТ составляет около 2 сут, что, вероятнее всего, связано с тем, что большинство пациентов умирают в первые 48–72 ч после поступления.
Таким образом, оценка по шкале AIS > 30 баллов, по шкале PTS — > 5 баллов, необходимость длительной седации и наличие внутричерепной гематомы ассоциируются с увеличением длительности лечения в ОРИТ, что сопряжено с высокой вероятностью летального исхода.
C помощью однофакторного дисперсионного анализа были выявлено влияние отдельных клинико-лабораторных признаков при поступлении на исход политравмы у детей (табл. 3).
Таблица 3. Влияние показателей клинико-лабораторного статуса на исход политравмы
Table 3. Effect of clinical and laboratory status indicators on polytrauma outcome
| Показатель | Однофакторный дисперсионный анализ (ANOVA) | |
|---|---|---|
| F | p | |
| Оценка по шкале AIS, баллы | 19,8 | 0,000 |
| Оценка по шкале PTS, баллы | 44,2 | 0,000 |
| Оценка по ШКГ, баллы | 37,8 | 0,000 |
| Систолическое артериальное давление, мм рт. ст. | 17,56 | 0,000 |
| Диастолическое артериальное давление, мм рт. ст. | 21,34 | 0,000 |
| Среднее артериальное давление, мм рт. ст. | 25,98 | 0,000 |
| Индекс Альговера—Бури | 9,578 | 0,000 |
| Индекс циркуляции | 7,634 | 0,000 |
| Сатурация гемоглобина кислородом в пульсирующем кровотоке (SpO2), % | 29,07 | 0,000 |
| Гемоглобин, г/л | 9,607 | 0,000 |
| Тромбоциты, × 109/л | 5,882 | 0,000 |
| Натрий, ммоль/л | 16,987 | 0,000 |
| Креатинин, мкмоль/л | 13 | 0,000 |
| рН (отрицательный десятичный логарифм концентрации ионов водорода) | 31,37 | 0,000 |
| Напряжение углекислого газа в венозной крови, мм рт. ст. | 14,5 | 0,000 |
| Дефицит оснований, ммоль/л | 19,4 | 0,000 |
| Лактат, ммоль/л | 55,03 | 0,000 |
| Международное нормализованное отношение | 25,06 | 0,000 |
| Оценка по шкале PEMOD, баллы | 66,16 | 0,000 |
Выявлено максимальное статистически значимое различие средних величин при оценке влияния на исход следующих признаков:
С помощью кластерного анализа на основании показателей клинико-лабораторного статуса в 1-е сутки лечения в ОРИТ все пациенты были разделены на два кластера: «Благоприятный исход» и «Неблагоприятный исход» (оценка тяжести травматических повреждений по шкале PTS; оценка тяжести поражения центральной нервной системы по шкале комы Глазго; оценка степени тяжести гипоксии смешанного генеза на основании концентрации лактата в венозной крови и оценка степени выраженности клинических проявлений полиорганной недостаточности по шкале PEMOD) (рис. 2).
Рис. 2. Распределение пациентов с тяжелой политравмой по кластерам в зависимости от показателей клинико-лабораторного статуса при поступлении
GCS_1 — оценка по шкале комы Глазго; LACT_1 — концентрация лактата в плазме крови при поступлении в ОРИТ; PEMOD_1 — оценка по шкале PEMOD при поступлении в ОРИТ; PTS — оценка по шкале Pediatric Traumatic Score.
Fig. 2. Distribution of patients with severe polytrauma by cluster according to clinical and laboratory status at admission
GCS_1 — score on Glasgow Come Scale; LACT_1 — plasma lactate concentration on admission to the ICU; PEMOD_1 — score on PEMOD scale on admission to the ICU; PTS —– score on Pediatric Traumatic Score

Наиболее значимые мероприятия интенсивной терапии в 1-е сутки лечения в ОРИТ, влияющие на исход политравмы, представлены в табл. 4.
Таблица 4. Влияние мероприятий интенсивной терапии на исход политравмы
Table 4. Effect of intensive care interventions on polytrauma outcome
| Показатель | ANOVA | |
|---|---|---|
| F | p | |
| Объем волемической нагрузки | 12,1 | 0,000 |
| Применение коллоидных растворов | 7,9 | 0,005 |
| Объем трансфузии эритроцит-содержащих компонентов крови | 33,4 | 0,000 |
| Объем трансфузии свежезамороженной плазмы | 42,0 | 0,000 |
| Величина катехоламинового индекса | 109,4 | 0,000 |
| Применение маннитола | 9,4 | 0,002 |
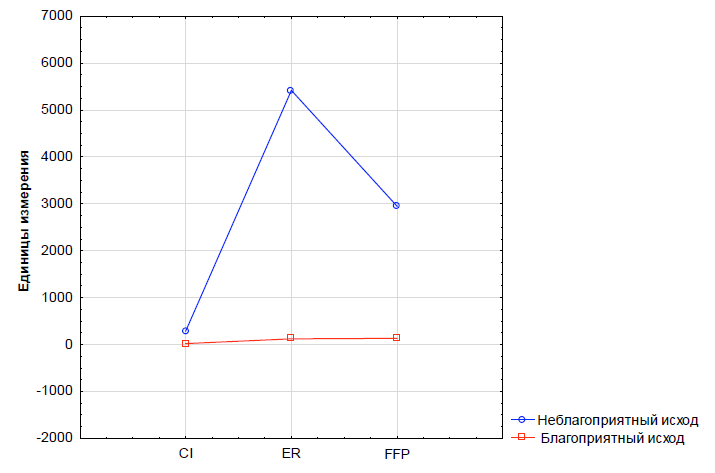
Выявлено максимальное статистически значимое различие средних величин при оценке влияния на исход следующих признаков: катехоламиновый индекс (F = 109,4; p = 0,000); объем трансфузии свежезамороженной плазмы (F = 42,0; p = 0,000); объем трансфузии эритроцит-содержащих сред (F = 33,4; p = 0,000), что отражено на рис. 3.
Рис. 3. Распределение пациентов с политравмой по кластерам в зависимости от особенностей интенсивной терапии в 1-е сутки лечения в ОРИТ
CI — катехоламиновый индекс; ER — объем трансфузии донорских эритроцитов; FFP — объем трансфузии свежезамороженной плазмы.
Fig. 3. Distribution of patients with polytrauma by clusters depending on the features of intensive care on the first day of treatment in ICU
CI — catecholamine index; ER — transfusion volume of donor erythrocytes; FFP — fresh frozen plasma transfusion volume.
Установлено, что наиболее значимыми клинико-лабораторными признаками, определяющими исход тяжелой политравмы у детей, являются оценка тяжести травматических повреждений по шкалам PTS, AIS, степени угнетения сознания по шкале комы Глазго и наличие внутричерепной гематомы, что сопоставимо с результатами исследований других авторов [1, 2, 8]. Оценка по шкале AIS > 30 баллов, по шкале PTS > 5 баллов, необходимость длительной седации и наличие внутричерепной гематомы ассоциируются с увеличением длительности лечения в ОРИТ, что сопряжено с высокой вероятностью летального исхода. Необходимость применения высоких доз инотропных и вазоактивных препаратов, проведения массивной трансфузии донорских эритроцитов и свежезамороженной плазмы в 1-е сутки лечения в ОРИТ является предиктором неблагоприятного исхода политравмы и сопряжена с высокой вероятностью смерти пациента. Аналогичные результаты были продемонстрированы в работе Rajasekaran et al. [9].
На основании оригинальных результатов кластерного анализа был разработан алгоритм скринингового прогнозирования исхода политравмы у детей спустя сутки после поступления в ОРИТ на основании особенностей клинико-лабораторного статуса и мероприятий интенсивной терапии:
Можно утверждать, что тяжесть состояния детей с политравмой при поступлении в ОРИТ обусловлена нарушениями витальных функций и тяжестью травматических повреждений, системной гипоксией и гипоэргозом, маркером тяжести которых является концентрация лактата в венозной крови и вторичной полиорганной дисфункцией в структуре тяжелой политравмы. Исследование концентрации лактата необходимо у всех детей с тяжелой политравмой, нуждающихся в искусственной вентиляции легких и медикаментозной гемодинамической поддержке, что позволяет оценить вероятность неблагоприятного исхода и принять обоснованное решение о необходимости коррекции мероприятий интенсивной терапии. Интегральная оценка уровня лактатемии в сочетании с другими показателями газового состава, кислотно-основного состояния и кислородного статуса крови особенно оправдана спустя 6–12 ч после поступления пациента в ОРИТ, поскольку позволяет оценить эффективность проводимого лечения и исключить наличие тяжелых сопутствующих заболеваний [23].
Отличительной особенностью данной работы явилось то, что в качестве предикторов неблагоприятного исхода политравмы рассматривались не только показатели клинико-лабораторного статуса, но и мероприятия интенсивной терапии, поскольку их неоправданная инвазивность и агрессивность также могут стать причиной прогрессирования механизмов танатогенеза и неблагоприятного исхода, что подтверждается концепцией «двойного удара» [36]. В качестве ограничений исследования следует отметить недостаточно большой объем выборки и ретроспективный характер анализа.
Информация о финансировании: Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы подтверждают соответствие своего авторства, согласно международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Author contribution. Pshenisnov K.V., Aleksandrovich Yu.S., Lipin A.S., Kaziakhmedov V.A., Kozubov M.U., Pastukhova N.K. — all authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.