Возможность стандартизованной оценки клинического состояния ребенка имеет своей целью определить вероятность смерти или тяжелой болезни, а также принять решение о транспортабельности, что остается неотъемлемым элементом работы неонатальной транспортной службы [1]. Несмотря на то что транспортировка новорожденных является ключевым компонентом неонатально-перинатальной помощи, по-прежнему отсутствуют общепринятые инструменты для оценки тяжести и принятия решений относительно трансфера новорожденного [2]. Кроме того, оцениваемая угрозометрическими шкалами тяжесть состояния не всегда эквивалентна транспортабельности [3]. Мнения исследователей по вопросу принятия тактического решения в отношении возможности применения оценки по той или иной шкале неоднозначны. Шкала интегральной оценки тяжести недоношенных новорожденных (клиническая шкала оценки недоношенных новорожденных, КШОНН) предложена авторами в качестве инструмента для принятия тактического решения о транспортировке новорожденного, однако не опубликовано данных, аргументирующих в пользу такого подхода [4]. В англоязычной литературе попытки применять шкалы в качестве инструмента принятия решений оказались неудачными. Авторы указывают, что угрозометрическая шкала не может быть непосредственно применена как инструмент сортировки для транспортной бригады [5]. Отсутствие консенсуса по этому разделу организации работы транспортных бригад послужило аргументом для проведения настоящего исследования.
Цель исследования — сравнить возможности угрозометрических шкал в отношении оценки риска нетранспортабельности новорожденного пациента.
В обсервационное когортное ретроспективное исследование включены данные 640 выездов транспортной бригады реанимационно-консультативного центра для новорожденных Областной детской клинической больницы Екатеринбурга в период с 1 августа 2017 г. по 31 декабря 2018 г. Полный объем данных или исходы были недоступны для 36 случаев. Итоговую выборку составляют 604 случая выезда транспортной бригады к 564 новорожденным детям, госпитализированным в медицинские организации Свердловской области и находящимся на дистанционном наблюдении в реанимационно-консультативном центре для новорожденных в связи с тяжестью состояния. Решение о транспортировке принималось врачом анестезиологом-реаниматологом транспортной бригады на основании действующего регионального приказа (Приказ Министерства здравоохранения Свердловской области № 1687п от 04.10.2017) и внутренних нормативных актов Областной детской клинической больницы после оценки тяжести состояния и возможных рисков.
Источником данных об исходах госпитального этапа была первичная медицинская документация. В исследуемой выборке по принятому тактическому решению транспортной бригады выделены подгруппы транспортабельных (n = 497) и нетранспортабельных (n = 46) пациентов. Проведена оценка по трем угрозометрическим шкалам: КШОНН, NTISS и TRIPS. Выполнено разделение подгрупп транспортабельных и нетранспортабельных пациентов в зависимости от оценки по шкалам.
Статистические инструменты. Описательная статистика: медиана и межквартильный интервал, доля, 95%-ный доверительный интервал (95 % ДИ) доли, ошибка доли. При анализе количественных данных с ненормальным распределением двух независимых выборок применен критерий Манна—Уитни. При анализе бинарных данных двух независимых выборок применялся точный критерий Фишера. Выполнен расчет отношения рисков (RR) нетранспортабельности между подгруппами в зависимости от оценки по шкале. Осуществлен расчет AUC (Area Under Curve) ROC (Receiver Operator Characteristic). Анализ выполнен программными средствами BioStas Pro 7.0.1.0. и Matlab R2017a.
Представленные данные анамнеза подгрупп транспортабельных и нетранспортабельных пациентов не имеют достоверных различий (табл. 1).
Таблица 1. Данные анамнеза
Table 1. Anamnestic data
| Данные анамнеза | Транспортабельные (n = 497), медиана [IQR] | Нетранспортабельные (n = 46), медиана [IQR] | р |
|---|---|---|---|
| Возраст пациентов (сут) на момент обращения за консультацией | 1 [0–2] | 0 [0–1] | 0,799 |
| Возраст пациентов (сут) на момент выезда бригады | 1 [0,5–3] | 2 [1–4] | 0,799 |
| Масса при рождении, г | 2500 [1620–3245] | 2910 [1000–3370] | 0,843 |
| Гестационный возраст, нед. | 36 [32–38] | 36 [28–38] | 0,308 |
| Оценка по шкале Апгар на 1-й минуте, баллы | 6 [4–7] | 5 [4–7] | 0,538 |
| Оценка по шкале Апгар на 5-й минуте, баллы | 7 [6–8] | 6 [5–8] | 0,058 |
При анализе структуры обращений по уровню медицинской организации установлены достоверные различия между группами. Транспортабельные пациенты достоверно чаще находились в медицинских организациях 1-го и 2-го уровней, не имеющих возможности проведения длительной интенсивной терапии новорожденным. Нетранспортабельные пациенты в 75 % случаев находились в учреждениях 2-го и 3-го уровней, имеющих в составе педиатрическое или неонатальное реанимационное отделение. Это указывает как на пренатальную маршрутизацию наиболее тяжелых пациентов в учреждения с более высоким уровнем помощи, так и на возможное стремление эвакуировать пациентов из медицинских организаций, не имеющих возможности проведения длительной интенсивной терапии новорожденным. Анализ распределения по массе тела показал достоверное превалирование детей с массой менее 1000 г в группе нетранспортабельных пациентов (23,92 %) в сравнении с транспортабельными (9,25 %), р = 0,003. Данное наблюдение также является результатом перинатальной маршрутизации (табл. 2). Эвакуация транспортированных пациентов в 92,15 % случаев осуществлена после первого осмотра реаниматолога транспортной бригады и в 7,04 % случаев после повторного осмотра.
Таблица 2. Структура выборки по массе тела при рождении
Table 2. Birth weight structure
| Масса при рождении, г | Транспортабельные (n = 497), доля [95% ДИ] | Нетранспортабельные (n = 46), доля [95% ДИ] | р |
|---|---|---|---|
| Менее 750 | 3,62 [2,16–5,66] | 15,22 [6,34–28,87] | 0,0029 |
| 750–999 | 5,63 [3,77–8,04] | 8,70 [2,42–20,79] | 0,336 |
| 1000–1499 | 12,07 [9,34–15,27] | 8,70 [2,42–20,79] | 0,636 |
| 1500–2499 | 27,57 [23,68–31,72] | 8,70 [2,42–20,79] | 0,0043 |
| 2500–3499 | 34,21 [30,04–38,56] | 41,30 [27,00–56,77] | 0,336 |
| Более 3500 | 16,90 [13,71–20,49] | 17,39 [7,82–31,42] | 1 |
Наблюдаются достоверные различия в объеме интенсивной терапии между эвакуированными пациентами и новорожденными, которые были признаны нетранспортабельными. В подгруппе нетранспортабельных пациентов наблюдается более высокая потребность в искусственной вентиляции легких (ИВЛ), в том числе высокочастотной (ВЧИВЛ), инфузии катехоламинов, седации (табл. 3).
Таблица 3. Структура проводимой интенсивной терапии
Table 3. Intensive care
| Интенсивная терапия | Транспортабельные (n = 497), доля [95% ДИ] | Нетранспортабельные (n = 46), доля [95% ДИ] | р |
|---|---|---|---|
| ИВЛ | 48,49 [44,02–52,98] | 78,26 [63,64–89,05] | < 0,0001 |
| ВЧИВЛ | 0,60 [0,12–1,75] | 21,74 [10,95–36,36] | < 0,0001 |
| Дофамин | 7,46 [5,31–10,14] | 36,96 [23,21–52,45] | < 0,0001 |
| Адреналин | 0,40 [0,05–1,45] | 28,26 [15,99–43,46] | < 0,0001 |
| Добутамин | 0,20 [0,01–1,12] | 4,35 [0,53–14,84] | 0,02 |
| Бензодиазепины | 4,23 [2,64–6,40] | 30,43 [17,74–45,75] | < 0,0001 |
| Пипекурония бромид | 0,40 [0,05–1,45] | 2,17 [0,06–11,53] | 0,234 |
Параметры ИВЛ при этом имели достоверные отличия между группами эвакуированных и нетранспортабельных пациентов. В подгруппе нетранспортабельных новорожденных наблюдалась потребность в большем давлении на вдохе (PIP, peak inspiratory pressure) и большей фракции кислорода во вдыхаемой смеси (FiO2), положительное давление конца выдоха (PEEP, positive end-expiratory pressure) достоверно не отличалось (табл. 4).
Таблица 4. Параметры искусственной вентиляции легких
Table 4. Respiratory settings
|
Параметры ИВЛ |
Транспортабельные (n = 241), медиана [IQR] |
Нетранспортабельные (n = 46), медиана [IQR] |
р |
|---|---|---|---|
|
PIP, см вод. ст. |
18 [19–20] |
23 [20–25] |
< 0,0001 |
|
PEEP, см вод. ст. |
5 [5–5] |
5 [5–6] |
0,979 |
|
FiO2, % |
30 [25–40] |
60 [40–95] |
< 0,0001 |
При оценке по угрозометрическим шкалам получено достоверное различие между транспортабельными и нетранспортабельными пациентами. Этот результат закономерен, однако требует более подробного анализа и детализации (табл. 5).
Таблица 5. Оценка по угрозометрическим шкалам
Table 5. Evaluation with disease severity scoring systems
|
Угрозометрические шкалы |
Транспортабельные (n = 497), медиана [IQR] |
Нетранспортабельные (n = 46), медиана [IQR] |
р |
|---|---|---|---|
|
КШОНН |
4 [3–5] |
7 [6–9] |
< 0,0001 |
|
NTISS |
15 [11–17] |
22 [20–28] |
< 0,0001 |
|
TRIPS |
14 [1–20] |
32 [31–47] |
< 0,0001 |
Анализ распределения выборки на подгруппы в зависимости от оценки по шкале КШОНН показал достоверное отличие между подгруппами транспортабельных и нетранспортабельных пациентов. Более 80 % транспортабельных пациентов сосредоточены в 1-й и 2-й подгруппах по КШОНН (оценка 1–5 баллов) и только 14,49 % транспортабельных пациентов отнесено к подгруппе 6–8 баллов по КШОНН. При этом 2,21 % транспортированных новорожденных имели оценку более 8 баллов по КШОНН, что, согласно рекомендациям шкалы, предполагает нетранспортабельность этих пациентов. Напротив, подгруппа нетранспортабельных новорожденных более чем в 30 % случаев имела оценку по КШОНН более 8 баллов. Однако большинство нетранспортабельных пациентов было отнесено к группе 6–8 баллов по КШОНН, что предполагает, согласно рекомендации шкалы, возможность межгоспитальной транспортировки. Оценка 6–8 баллов ассоциирована с решением бригады о нетранспортабельности пациента с отношением рисков 61,36 [0,48–138,06], при оценке более 8 баллов — 150,58 [9,27–2446,08] (табл. 6).
Таблица 6. Структура выборки по шкале КШОНН и отношение рисков нетранспортабельности
Table 6. Sample structure according to the KSHONN scale and the risk ratio of non-transportability
| Оценка по КШОНН, баллы | Транспортабельные (n = 497), доля [95% ДИ] | Нетранспортабельные (n = 46), доля [95% ДИ] | р | RR нетранспортабельности | р |
|---|---|---|---|---|---|
| 1–2 | 24,35 [20,63–28,37] | 0,00 [0,00–0,00] | < 0,0001 | Не применимо | |
| 3–5 | 58,95 [54,49–63,31] | 21,74 [10,95–36,36] | < 0,0001 | 8,15 [0,48–138,06] | 0,206 |
| 6–8 | 14,49 [11,51–17,89] | 47,83 [32,89–63,05] | < 0,0001 | 61,36 [3,77–999,47] | < 0,0001 |
| 9–14 | 2,21 [1,11–3,93] | 30,44 [17,74–45,76] | < 0,0001 | 150,58 [9,27–2446,08] | < 0,0001 |
При сравнении распределения подгрупп транспортабельных и нетранспортабельных пациентов при оценке по шкале NTISS наблюдается достоверное различие по всем категориям оценок. 88,32 % транспортированных пациентов были отнесены к группам низкого и незначительного риска и только 11,67 % — к группам умеренного и высокого риска. Более 76 % нетранспортабельных пациентов были классифицированы в категорию умеренного и высокого риска. Оценка по NTISS 20–29 баллов ассоциирована с нетранспортабельностью с отношением рисков 51,37 [3,18–829,11], при оценке 30 баллов и более отношение рисков нетранспортабельности составило 96,33 [5,86–1582,35] (табл. 7).
Таблица 7. Структура выборки по шкале NTISS и отношение рисков нетранспортабельности
Table 7. Sample structure according to the NTISS scale and the risk ratio of non-transportability
| Оценка по NTISS, баллы | Транспортабельные (n = 497), доля [95% ДИ] | Нетранспортабельные (n = 46), доля [95% ДИ] | р | RR нетранспор-табельности | р |
|---|---|---|---|---|---|
| 0–9 | 16,29 [13,16–19,85] | 0,00 [0,00–0,00] | < 0,001 | Не применимо | |
| 10–19 | 72,03 [67,86–75,94] | 23,91 [12,59–38,77] | < 0,0001 | 4,69 [0,28–78,79] | 0,543 |
| 20–29 | 10,46 [7,91–13,49] | 58,69 [43,32–73,00] | < 0,0001 | 51,37 [3,18–829,11] | < 0,0001 |
| 30 и более | 1,21 [0,44–2,61] | 17,39 [7,82–31,42] | < 0,0001 | 96,33 [5,86–1582,35] | < 0,0001 |
Сравнительный анализ распределения по группам в зависимости от оценки по TRIPS указал на достоверные различия между транспортабельными и нетранспортабельными пациентами по всем категориям, за исключением 24–30 баллов. 84,9 % транспортированных пациентов были отнесены к категории с прогнозируемым риском смерти менее 5 %. Напротив, подгруппа нетранспортабельных на 84,78 % сосредоточена в категории предполагаемой летальности 18 % и более. Оценка по TRIPS 17–23 балла ассоциирована с нетранспортабельностью с отношением рисков 18,81 [1,09–327,26], оценка 31–38 баллов — 133,24 [8,19–2167,89], при оценке более 38 баллов отношение рисков составило 288,54 [17,78–4683,43] (табл. 8).
Таблица 8. Структура выборки по шкале TRIPS и отношение рисков нетранспортабельности
Table 8. Sample structure according to the TRIPS scale and the risk ratio of non-transportability
| Оценка по TRIPS, баллы | Транспортабельные (n = 497), доля [95% ДИ] | Нетранспортабельные (n = 46), доля [95% ДИ] | р | RR нетранспортабельности | р |
|---|---|---|---|---|---|
| 0–7 | 43,06 [38,66–47,54] | 0,00 [0,00–0,00] | < 0,0001 | Не применимо | |
| 8–16 | 8,65 [6,33–11,48] | 0,00 [0,00–0,00] | 0,04 | Не применимо | |
| 17–23 | 33,19 [29,07–37,53] | 15,22 [6,34–28,87] | 0,012 | 18,81 [1,09–327,26] | 0,018 |
| 24–30 | 1,61 [0,69–3,15] | 0,00 [0,00–0,00] | 1 | Не применимо | |
| 31–38 | 11,47 [8,80–14,60] | 52,17 [36,95–67,12] | < 0,0001 | 133,24 [8,19–2167,89] | < 0,0001 |
| 39 и более | 2,01 [0,97–3,67] | 32,61 [19,53–46,16] | < 0,0001 | 288,54 [17,78–4683,43] | < 0,0001 |
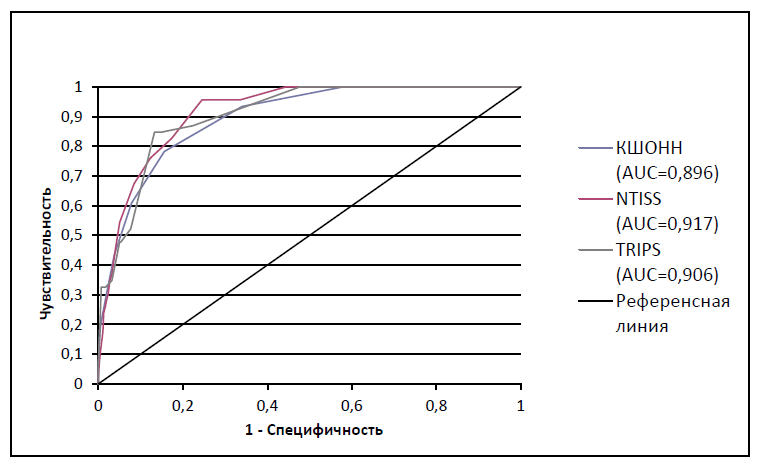
При анализе площади под ROC-кривой прогнозирования нетранспортабельности обращает на себя внимание достоверное отличие между шкалами КШОНН и NTISS в пользу последней (р = 0,003). При этом оценка по NTISS обладает наибольшим значением индекса Юдена, т. е. чувствительность и специфичность в отношении прогнозирования нетранспортабельности наиболее сбалансированы в сравнении с двумя другими шкалами (табл. 9, рис. 1).
Таблица 9. Предикторная ценность шкал в отношении нетранспортабельности
Table 9. Predictor Scales for Nontransportability
| Шкалы | AUC | Cut-off | Чувствительность | Специфичность | PPV | NPV | Индекс Юдена |
|---|---|---|---|---|---|---|---|
| КШОНН | 0,896 [0,857–0,935] | > 5 | 0,783 | 0,844 | 0,346 | 0,938 | 0,627 |
| NTISS | 0,917 [0,886–0,947] | > 17 | 0,957 | 0,754 | 0,243 | 0,995 | 0,711 |
| TRIPS | 0,906 [0,871–0,941] | > 28 | 0,874 | 0,867 | 0,345 | 0,986 | 0,715 |
Рис. 1. ROC-кривые шкал в отношении прогнозирования решения бригады о нетранспортабельности пациента
Fig. 1. ROC of scale in predicting team decisions about patient nontransportability

Сопоставление оценки по той или иной угрозометрической шкале с решением транспортной бригады мало представлено в доступных исследованиях. Основной акцент в публикациях, посвященных оценке предикторных свойств шкал, традиционно делается на прогнозирование летального исхода или развитие тех или иных осложнений. Lee et al., предложившие шкалу TRIPS, указывают, что прогнозируемая 7-суточная смертность при оценке менее 8 баллов составляет всего 0,7 %, при значении 31–38 баллов — 17,6 %, при значении 39 и более баллов — 26,7 % [2]. По данным Lucas da Silva et al., шкала TRIPS прогнозировала летальный исход в течение первых 7 сут жизни со значением площади под ROC-кривой 0,80 [6]. Karlsson et al. при выполнении сравнительного анализа различных модификаций шкалы TRIPS определили максимальную предикторную ценность в отношении летального исхода именно ее оригинальной версии. Значение AUC ROC составило 0,8 [7]. Важная деталь для понимания прогностической ценности шкалы TRIPS во время транспортировки имеется в работе Romanzeira et al. Авторы указывают, что дети, не демонстрировавшие ухудшения в дороге, в 46,4 % случаев имели оценку по TRIPS менее 10 баллов, в то время как дети, чье состояние ухудшилось за время транспортировки, в 80 % случаев также имели оценку по TRIPS менее 10 баллов. Пороговое значение в 10 баллов выбрано авторами цитируемого исследования эмпирически и не совпадает с предложенным ранее делением оценки по прогнозируемой летальности [2]. Такое деление выборки не позволяет сопоставить данные этой работы с полученными нами результатами. Важно также, что пациенты, состояние которых ухудшилось во время транспортировки, не продемонстрировали достоверного роста оценки по TRIPS. Другими словами, отнесение пациента к той или иной подгруппе по TRIPS не прогнозирует ухудшения во время транспортировки [8]. Наши данные свидетельствуют о значительном и достоверном росте отношения рисков нетранспортабельности при оценке по шкале TRIPS более 16 баллов; проведенный нами ROC-анализ указал уровень cut-off > 28 баллов для принятия решения о нетранспортабельности.
Оригинальное исследование Gray et al., предложивших шкалу NTISS, указывает, что при оценке менее 10 баллов по NTISS прогнозируемая смертность составляет 1 %, при оценке 10–19 баллов — 4–5 %, при оценке 20–29 баллов — 19 %, при оценке более 30 баллов по NTISS ожидаемая летальность превышает 20 % [9]. Однако работ, сопоставляющих изменение состояния пациента в дороге с оценкой по NTISS, в доступной литературе мы не встретили.
Предложенная В.А. Буштыревым и соавт. КШОНН рассматривалась авторами, как потенциальный инструмент принятия решения транспортной бригадой относительно транспортировки пациента. Оценка функции каждого органа и системы организма осуществляется в баллах от 0 до 2. Полученная сумма баллов описывает тяжесть состояния: оценка 1–2 балла — состояние средней степени тяжести, от 3 до 5 баллов — тяжелое состояние, от 6 до 9 баллов — очень тяжелое состояние, ребенку показан перевод в отделение реанимации новорожденных, от 10 до 14 баллов — крайне тяжелое состояние недоношенного новорожденного, транспортировка не должна осуществляться [4, 10, 11]. Вместе с тем работ, аргументирующих в пользу такой стратегии, в доступной литературе не представлено. По нашим данным, даже оценка более 5 баллов ассоциирована с достоверным ростом отношения рисков нетранспортабельности.
А.Н. Шмаков и соавт. исследовали состояние детей, требовавших межгоспитальной транспортировки, и выделили наиболее информативные клинические параметры, на основании которых был разработан критерий выбора тактического решения, позволявший транспортной бригаде принимать взвешенное и рациональное решение. Авторы указывают, что компоненты этого расчетного параметра не допускают противоречивых трактовок. Методика демонстрирует высокую чувствительность, она составила 0,89. В качестве значения показателя, при котором транспортировка не может быть осуществлена, принята оценка более 5,0. В таких случаях требуется продолжить дистанционное наблюдение и оценить состояние через 2–4 ч [12].
Несколько иной подход рассматривается в работах Ю.С. Александровича и соавт. Для педиатрической интенсивной терапии предложена ранговая система оценки риска транспортировки, основанная на тяжести органной дисфункции и определяющая предположительную безопасную длительность транспортировки на основании статуса пациента и потребности в интенсивной терапии. Безопасное время и риск транспортировки устанавливаются на основании подсчета баллов по шкале оценки риска транспортировки. Риск транспортировки может быть уточнен в зависимости от необходимости инфузии в пути, если инфузионная терапия является основным методом лечения, необходимости управления оксигенацией в пути, если риск смерти в пути определяется дефицитом оксигенирующей функции легких. Превышение безопасного времени транспортировки требует обоснования: вероятная польза перевода больного в стационар более высокого уровня должна аргументированно перевешивать риск превышения безопасного времени транспортировки [13–15]. Однако работ, исследующих валидность предложенного способа в популяции новорожденных пациентов, в доступной литературе не обнаружено, что делает невозможным сопоставление предложенной технологии с описанными в нашем исследовании методами оценки транспортабельности.
Ограничения проведенного исследования. Ограничениями данного исследования являются его ретроспективный характер, обусловленный этической и организационной невозможностью выполнения проспективного рандомизированного исследования, отсутствие данных об объеме первичной реанимации новорожденных при рождении.
Все три исследуемые угрозометрические шкалы обладают высокой предиктивной ценностью в отношении решения транспортной бригады о нетранспортабельности пациентов. Максимальным значением AUC ROC обладает шкала NTISS, что достоверно лучше шкалы КШОНН.
Сравнительный анализ оценок по шкалам указывает, что оценка по КШОНН более 5 баллов, по шкале NTISS более 19 баллов и по шкале TRIPS более 16 баллов ассоциирована с достоверным ростом отношения риска нетранспортабельности.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Мухаметшин Р.Ф., Давыдова Н.С. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
Author contribution. Mukhametshin R.F., Davydova N.S. — all authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.