Начиная с 1990-х гг. улучшение мозгового кровотока при стенозирующем каротидном атеросклерозе — наиболее частой причине ишемического инсульта — путем использования транслюминальной баллонной ангиопластики со стентированием внутренних сонных артерий (ТЛБА ВСА), стало рутинной процедурой во всем мире, в том числе и в нашей стране. Результаты анализа проведенных в мире оперативных вмешательств показали, что этот метод является эффективным и достаточно безопасным [1]. Вместе с тем в ряде случаев ТЛБА ВСА сопровождается периоперационными осложнениями, в том числе с развитием летального исхода, что нивелирует «хирургический» успех операции: острым нарушением мозгового кровообращения (ОНМК), транзиторной ишемической атакой (ТИА), преходящим нарушением мозгового кровообращения (ПНМК), острым коронарным синдромом (ОКС), острым инфарктом миокарда (ОИМ) [2–5]. Данные «большие сосудистые события» в первую очередь обусловлены синдромом каротидного синуса (в зарубежной литературе, гемодинамической нестабильностью) вследствие вмешательства в области каротидных синусов, контролирующих в норме, как известно, ответ сердечно-сосудистой системы на различные триггеры [2, 6–8].
В 1998 г. Farrell O. Mendelsohn была установлена взаимосвязь между каротидной ангиопластикой со стентированием и «гемодинамической нестабильностью», аналогичной синдрому каротидного синуса (СКС). У каждого пятого пациента (21 %) имели место церебральные и/или кардиальные осложнения [2]. До настоящего времени обсуждается тактика ведения этих пациентов в периоперационном периоде, которая могла бы предупредить нежелательные события [4, 9–12]. Мы попытались определить роль блокады каротидного синуса (БКС) непосредственно перед ТЛБА ВСА в профилактике СКС и периоперационных осложнений.
Цель исследования — оценить эффективность и безопасность блокады каротидного синуса при выполнении ангиопластики со стентированием внутренних сонных артерий и определить показания для ее выполнения.
Проведено проспективное одноцентровое исследование, выполненное и одобренное локальным этическим комитетом ФГБНУ «Научный центр неврологии» (протокол № 1–5/18 от 07.02.18). В исследование включено 120 пациентов (мужчины, n = 88; женщины, n = 32) в возрасте от 44 до 91 года с атеросклеротическими стенозами внутренних сонных артерий (ВСА) («симптомные» стенозы не менее 60 % и «асимптомные» стенозы не менее 70 %), которым было выполнено плановое оперативное вмешательство — транслюминальная балонная ангиопластика со стентированием внутренних сонных артерий.
Критерии включения: пациенты с атеросклеротическими стенозами ВСА, которым показано выполнение ангиопластики со стентированием; наличие подписанного информированного согласия на проведение обследования и лечения, обработку персональных данных, а также согласие пациента на проведение БКС (при необходимости).
Критерии невключения: наличие абсолютных противопоказаний для ТЛБА ВСА (декомпенсация хронической сопутствующей патологии или острая соматическая патология); аллергические реакции в анамнезе при использовании рентгеноконтрастных веществ и местных анестетиков; оперативное вмешательство на шее в анамнезе, в том числе трахеостомия, каротидная эндартерэктомия и ТЛБА ВСА на ипсилатеральной стороне; острое нарушение мозгового кровообращения менее чем за 1 мес. до операции.
Участники исследования были рандомизированы на две группы: 60 пациентов с БКС (выполнена с письменного согласия пациента непосредственно перед оперативным вмешательством) и 60 пациентов без БКС. Перед началом исследования эти группы были сопоставлены между собой по факторам, ассоциированным с развитием СКС (анатомическим, демографическим, коморбидным, особенностями самого стеноза). Первичная конечная точка исследования — развитие СКС (кардиоингибиторного, вазодепрессорного, смешанного типов), частоту которого оценивали на следующих этапах — интраоперационно (1-й этап), в течение первого часа после дилатации (2-й этап) и свыше одного часа после дилатации (3-й этап).
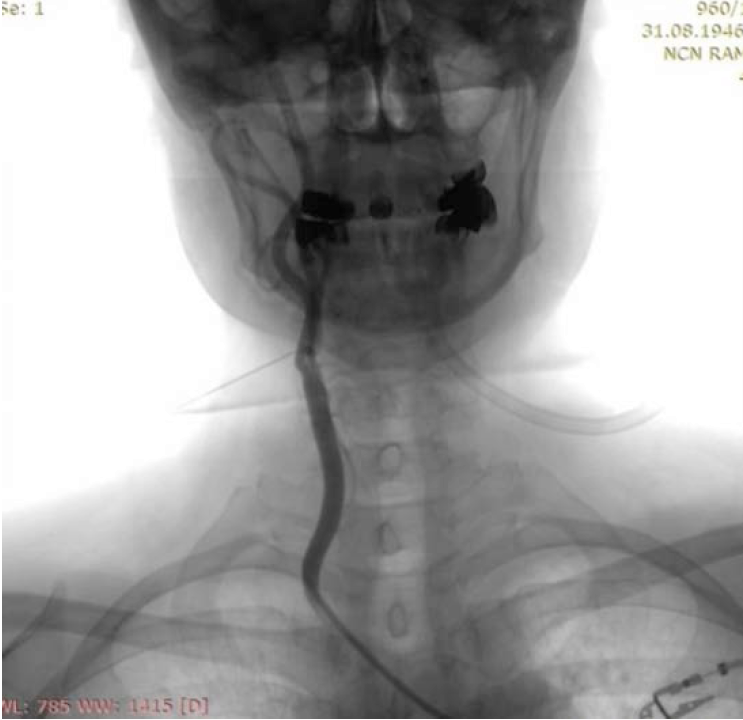
Методика блокады каротидного синуса. Раствор анестетика вводился в проекцию каротидной вилки путем чрескожной пункции в точке пересечения линий, образованных верхним краем щитовидного хряща и передним краем грудино-ключично-сосцевидной мышцы, под рентгеноскопическим контролем с коррекцией уровня по результатам ангиографии. Положение пациента на операционном столе — лежа на спине, голова прямо. При выполнении блокады анестезиолог-реаниматолог находился у головы пациента. Проводилась обработка операционного поля и выполнялась инфильтрационная анестезия раствором лидокаина 2 % 2 мл. При выполнении БКС справа указательным и средним пальцами правой руки определяли пульсацию сонной артерии, пункцию выполняли с медиальной стороны указательного пальца анестезиолога-реаниматолога с учетом анатомических ориентиров, полученных при ангиографии (рис. 1).
Рис. 1. Блокада каротидного синуса справа
Fig. 1. Blockade of the carotid sinus on the right

При выполнении БКС слева указательным и средним пальцами левой руки определяли пульсацию сонной артерии, пункцию выполняли с медиальной стороны указательного пальца врача с учетом анатомических ориентиров, полученных при ангиографии. Иглу 22G 1 1/2 со срезом 45° продвигали в тканях под рентгеноскопическим контролем в двух проекциях, с необходимой коррекцией положения ангиографической установки для улучшения визуализации сосудов, к каротидной вилке, где и вводили раствор анестетика. Для БКС применялся раствор ропивакаина 7,5 мг — 5 мл. Изучались следующие осложнения БКС: системные реакции ропивакаина — системная токсичность, кардиотоксичность (нарушение ритма сердца и проводимости, гипотония, гипертония, остановка сердечной деятельности), нейротоксичность (психомоторное возбуждение, судороги, утрата сознания), индивидуальная непереносимость анестетика и местные реакции (отечно-инфильтративные изменения мягких тканей шеи, гематомы и кровотечение, травма подчелюстной слюнной железы). Проводился анализ периоперационных исходов при выполнении БКС: летального исхода, церебральных (ОНМК, ПНМК, ТИА, реперфузионного синдрома, «немых» ишемических очагов в «зоне интереса») и кардиальных осложнений (ОКС, ОИМ, периоперационного обратимого повреждения миокарда, нарушения сердечного ритма).
Всем пациентам интраоперационно и в послеоперационном периоде до перевода из отделения анестезиологии и реанимации в профильное отделение осуществляли мониторинг неврологического статуса и жизненно важных функций: инвазивный и неинвазивный артериального давления, частоты сердечных сокращений, частоты дыхания, SpO2. СКС его типы диагностировали согласно классификации Weiss и Baker [7]. Коррекцию СКС проводили лекарственными препаратами (допамин 25 мг/5 мл в/в с использованием инфузионного шприцевого насоса в средней дозе 2–10 мкг/кг/мин; атропина сульфат 0,5 мг в/в на введение до достижения необходимой ЧСС (максимальная суточная доза 3 мг)). При наличии противопоказаний к использованию атропина сульфата в предоперационном периоде пациентам под рентгенологическим контролем устанавливался временный внутривенный эндокардиальный стимулятор в режиме «on demand» (по требованию).
Статистическая обработка полученных результатов проводилась с применением программ Microsoft Excel, пакета прикладных программ Statistica 9.0 (Statsoft Inc, USA). Использовались параметрические и непараметрические методы анализа, описательная статистика с вычислением абсолютного и относительного количества больных, среднего значения, квадратного отклонения, максимального и минимального значения по выборке, медианы, 25 % и 75 % квартилей. Достоверными считались показатели p < 0,05. Разница частот между группами оценивалась по таблицам сопряженности с помощью критерия χ².
Для достоверной оценки эффективности БКС выполнен сравнительный анализ частоты и типов СКС между группами пациентов с БКС и без БКС. Также между этими группами проведен сравнительный анализ сроков развития и продолжительности СКС. Предварительно обе группы были сопоставлены по факторам, ассоциированным с развитием СКС, широко обсуждаемым в литературе (табл. 1). Необходимо отметить, что коморбидная патология несколько чаще была представлена у пациентов с БКС, однако статистически значимой разницы между группами получено не было (p > 0,05), за исключением частоты фактора курения и сахарного диабета (p < 0,05).
Таблица 1. Сравнительная характеристика пациентов с БКС и без БКС
Table 1. Comparative characteristics of patients with BCS and without BCS
| Факторы, ассоциированные с развитием СКС | БКС (50 %; n = 60) |
Без БКС (50 %; n = 60) |
p |
|---|---|---|---|
| Анатомические | |||
| Высокое расположение каротидной бифуркации | 1,6 %; (n = 1) | 5 %; (n = 3) | 0,297 |
| Демографические | |||
| Пол | мужчины 70 % (n = 42) | мужчины 47 % (n = 28) | p > 0,05 |
| женщины 30 % (n = 18) | женщины 53 % (n = 32) | ||
| Возраст | 64,4 (44–91) | 67,7 (57–82) | p > 0,05 |
| Коморбидные | |||
| Артериальная гипертония | 93,3 %; (n = 56) | 58,3 %; (n = 35) | p > 0,05 |
| Мерцательная аритмия | 16,6 %; (n = 10) | 6,6 %; (n = 4) | 0,087 |
| Хроническая почечная недостаточность | 16,6 %; (n = 10) | 13,3 %; (n = 8) | 0,612 |
| Гиперлипидемия | 13,3 %; (n = 8) | 6,6 %; (n = 4) | 0,22 |
| Курение | 67 %; (n = 40) | 33,3 %; (n = 20) | 0,0002 |
| Ишемическая болезнь сердца | 48,3 %; (n = 29) | 30 %; (n = 18) | 0,05 |
| Сахарный диабет | 33,3 %; (n = 20) | 11,7 %; (n = 7) | 0,0046 |
| ОНМК в анамнезе | 23,3 %; (n = 14) | 16,6 %; (n = 10) | 0,358 |
| ОИМ в анамнезе | 18,3 %; (n = 11) | 13,3 %; (n = 8) | 0,453 |
| Характеристики стеноза | |||
| «Асимптомный» стеноз не менее 70 % | 50 %; (n = 30) | 50 %; (n = 30) | p > 0,05 |
| «Симптомный» стеноз не менее 60 % | 50 %; (n = 30) | 50 %; (n = 30) | p > 0,05 |
| Контралатеральная каротидная окклюзия | 8,3 %; (n = 5) | 11,7 %; (n = 7) | 0,535 |
| Стеноз справа | 57 %; (n = 34) | 48,3 %; (n = 29) | 0,339 |
| Стеноз слева | 43 %; (n = 26) | 51,7 %; (n = 31) | 0,339 |
Частота СКС в группе пациентов с БКС составила 68,3 % (n = 41) vs 71,6 % (n = 43) в группе пациентов без БКС (р > 0,05). В группе пациентов с БКС, так же как и в группе пациентов без БКС, наиболее частым типом СКС являлся смешанный. Он развился у 60 % пациентов (n = 24). Достоверной разницы между группами по типам СКС не получено (р > 0,05) (рис. 2). Однако ни у одного из пациентов, которым была выполнена БКС, не отмечены асистолия и АВ-блокада (p < 0,05) (табл. 2).
Рис. 2. Типы синдрома каротидного синуса при БКС и без БКС
Fig. 2. Types of carotid sinus syndrome with and without BCS
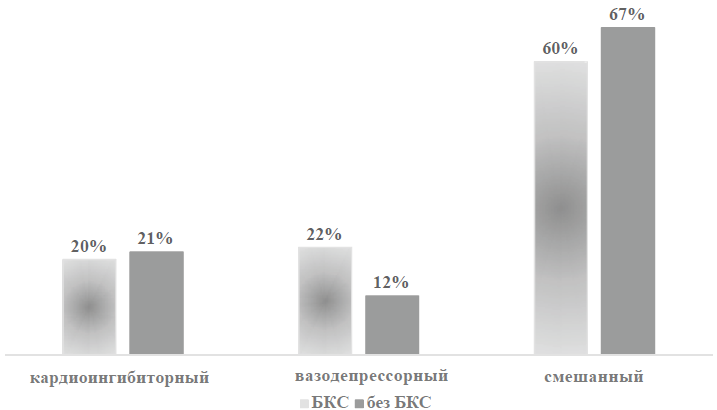
Таблица 2. Сроки развития СКС у пациентов с БКС и без БКС
Table 2. Timing of development of SCS in patients with BCS and without BCS
| Тип СКС | Физикальные данные | Сроки развития | БКС (n = 60; 50 %) | Без БКС (n = 60; 50 %) | р |
|---|---|---|---|---|---|
| Кардиоингибиторный | Синусовая брадикардия | Интраоперационно (дилатация) | 1; 12,5 % | 3; 33,3 % | 0,313 |
| 1-й час после дилатации | 4; 50 % | 2; 22,3 % | 0,233 | ||
| Более 1 ч | 3; 37,5 % | 1; 11,2 % | 0,202 | ||
| АВ-блокада | – | 2; 22,2 % | 0,156 | ||
| Асистолия | – | 1; 11,2 % | 0,329 | ||
| Вазодепрессорный | Интраоперационно (дилатация) | 4; 44,4 % | 3; 60 % | 0,576 | |
| 1-й час после дилатации | 3; 33,3 % | 2; 40 % | 0,802 | ||
| Более 1-го часа | 2; 22,3 % | — | 0,254 | ||
| Смешанный | Синусовая брадикардия | Интраоперационно (дилатация) | 4; 16,7 % | 25; 83,3 % | 0,046 |
| 1-й час после дилатации | 4; 16,7 % | 2; 6,7 % | 0,251 | ||
| Более 1 ч | 16; 66,6 % | 2; 6,7 % | 0,043 | ||
| АВ-блокада | – | 1; 3,3 % | 0,369 | ||
| Асистолия | – | – | |||
| Артериальная гипотония | Интраоперационно (дилатация) | 4; 16,7 % | 27; 93 % | 0,329 | |
| 1-й час после дилатации | 6; 25 % | 1; 3,5 % | 0,021 | ||
| Более 1 ч | 14; 58,3 % | 1; 3,5 % | 0,037 | ||
Анализ сроков развития СКС у пациентов с БКС и без БКС показал, что при вазодепрессорном типе достоверной разницы во времени возникновения СКС нет (p > 0,05). У большинства пациентов в обеих группах СКС развивался интраоперационно и в течение первого часа после баллонной ангиопластики: 77,7 % (БКС) и 100 % (без БКС) (см. табл. 2).
При кардиоингибиторном типе достоверной разницы также получено не было, однако если учесть интраоперационное развитие АВ-блокады и асистолии, то частота развития СКС интраоперационно у пациентов с БКС достоверно меньше, чем без БКС (p < 0,05) (табл. 3).
Таблица 3. Сроки развития кардиоингибиторного типа СКС у пациентов с БКС и без БКС
Table 3. The timing of the development of the cardioinhibitory type of SCS in patients with BCS and without BCS
| Физикальные данные | Сроки развития | БКС (n = 8) | Без БКС (n = 9) | р |
|---|---|---|---|---|
| Синусовая брадикардия, АВ-блокада, асистолия | Интраоперационно (дилатация) | 1; 12,5 % | 6; 66,5 % | 0,024 |
| 1-й час после дилатации | 4; 50 % | 2; 22,3 % | 0,233 | |
| Более 1 ч | 3; 37,5 % | 1; 11,2 % | 0,202 |
При наиболее часто развивающимся типе СКС, смешанном, частота развития СКС при дилатации баллона также была достоверно меньше — 16,7 % (БКС) и 83,3 % (без БКС) (p < 0,05). У большинства пациентов (58,3–66,6 %) с БКС СКС развивался отсрочено (свыше 1 ч после операции) (p < 0,05) (см. табл. 2).
В рамках оценки безопасности БКС для пациента мы оценивали возникновение системных и местных реакций (табл. 4).
Таблица 4. Осложнения блокады каротидного синуса
Table 4. Complications of carotid sinus blockade
| Осложнения | Частота развития (n; %) | |
|---|---|---|
| Системные реакции ропивакаина | Системная токсичность (кардио- и нейротоксичность) | – |
| Индивидуальная непереносимость анестетика | – | |
| Местные реакции | Отечно-инфильтративные изменения мягких тканей шеи | 2; 3,3 % |
| Гематома | 1; 1,6 % | |
| Кровотечение | 1; 1,6 % | |
| Травма подчелюстной слюнной железы с развитием сиалоаденита | 1; 1,6 % | |
Принимая во внимание полученные результаты эффективности БКС, дополнительную лучевую нагрузку на пациента и медицинский персонал, увеличение экономических затрат на оперативное вмешательство, возможные технические трудности и местные реакции, с целью четкого определения показаний к этой манипуляции нами проведен сравнительный анализ пациентов с СКС и без оного при БКС (табл. 5), а также частоты цереброкардиальных осложнений в этих группах (табл. 6).
Таблица 5. Сравнительная характеристика пациентов с СКС и без СКС при выполнении БКС
Table 5. Comparative characteristics of patients with SCS and without SCS when performing BCS
| Факторы, ассоциированные с развитием СКС | СКС (68,3 %; n = 41) | Без СКС (31,7 %; n = 19) | p |
|---|---|---|---|
| Анатомические | |||
| Высокое расположение каротидной бифуркации | 4,9 %; (n = 2) | 5,2 %; (n = 1) | 0,96 |
| Демографические | |||
| Пол | мужчины 66 % (n = 27) | мужчины 79 % (n = 15) | 0,306 |
| женщины 34 % (n = 14) | женщины 21 % (n = 4) | ||
| Возраст | 69,6 (44–91) | 65,7 (53–82) | p > 0,05 |
| Коморбидные | |||
| Артериальная гипертония | 92,7 %; (n = 38) | 95 %; (n = 18) | 0,768 |
| Мерцательная аритмия | 12 %; (n = 5) | 15,8 %; (n = 3) | 0,738 |
| Хроническая почечная недостаточность | 73 %; (n = 30) | 74 %; (n = 14) | 0,935 |
| Гиперлипидемия | 19,5 %; (n = 8) | 0 %; (n = 0) | 0,042 |
| Курение | 44 %; (n = 18) | 52 %; (n = 10) | 0,563 |
| Ишемическая болезнь сердца (ИБС) | 46,3 %; (n = 19) | 52,6 %; (n = 10) | 0,649 |
| Сахарный диабет | 31,7 %; (n = 13) | 36,8 %; (n = 7) | 0,696 |
| ОНМК в анамнезе | 14,6 %; (n = 6) | 42,1 %; (n = 8) | 0,019 |
| ОИМ в анамнезе | 17 %; (n = 7) | 21 %; (n = 4) | 0,709 |
| Характеристики стеноза | |||
| «Асимптомный» стеноз не менее 70 % (I группа) | 56 %; (n = 23) | 36,8 %; (n = 7) | 0,171 |
| «Симптомный» стеноз не менее 60 % (II группа) | 44 %; (n = 18) | 63,2 %; (n = 12) | 0,171 |
| Контралатеральная каротидная окклюзия | 12 %; (n = 5) | 0 %; (n = 0) | 0,011 |
| Стеноз справа | 61 %; (n = 25) | 47,4 %; (n = 9) | 0,323 |
| Стеноз слева | 39 %; (n = 16) | 52,6 %; (n = 10) | 0,309 |
Из таблицы 5 видно, что в группе пациентов без СКС достоверно выше частота ОНМК в анамнезе в «заинтересованном» бассейне ВСА и во всех случаях отсутствует контралатеральная окклюзия ВСА (p < 0,05), что может говорить об эффективности БКС именно у этих пациентов.
Анализ периоперационных исходов у пациентов с СКС и без СКС при выполнении БКС представлен в табл. 6.
Таблица 6. Периоперационные исходы у пациентов с СКС и без СКС при выполнении БКС
Table 6. Perioperative outcomes in patients with SCS and without SCS when performing BCS
|
|
СКС (68,3 %; n = 41) | Без СКС (31,7 %; n = 19) | р | |
|---|---|---|---|---|
| Летальный исход | 0 %; (n = 0) | 0 %; (n = 0) | ||
| Церебральные осложнения | ОНМК | 7,3 %; (n = 3) | 0 %; (n = 0) | 0,227 |
| ПНМК | 0 %; (n = 0) | 5,3 %; (n = 1) | 0,137 | |
| ТИА | 2,4 %; (n = 1) | 5,3 %; (n = 1) | 0,559 | |
| Реперфузионный синдром | 0 %; (n = 0) | 0 %; (n = 0) | ||
| Периоперационные острые «немые» ишемические очаги | 78 %; (n = 32) | 53 %; (n = 10) | 0,05 | |
| Кардиальные осложнения | ОИМ | 0 %; (n = 0) | 5,3 %; (n = 1) | 0,137 |
| ОКС | 0 %; (n = 0) | 0 %; (n = 0) | ||
| Периоперационное обратимое повреждение миокарда | 14,6 %; (n = 6) | 0 %; (n = 0) | 0,079 | |
| Острое нарушение ритма сердца | 2,4 %; (n = 1) | 0 %; (n = 0) | 0,496 | |
В настоящее время, несмотря на широкое обсуждением проблемы гемодинамической нестабильности при ТЛБА ВСА, в нашей стране выполнено мало работ в поисках оптимальной тактики периоперационного ведения этой категории пациентов [9, 13]. Во многих зарубежных центрах, выполняющих эти операции, практические единодушным является мнение о целесообразности «анестезиологического обеспечения во время каротидного стентирования и госпитализации пациентов в отделения интенсивной терапии в течение нескольких часов после операции», которое стало «стандартом оказания медицинской помощи» [11, 12].
В противоположность ранее опубликованным работам, сообщающим об высокой эффективности БКС [11, 13], в нашем исследовании установлено, что БКС, являясь безопасной в условиях рентгенологического контроля методикой, не позволяет исключить развитие СКС. Однако крайне важно, что она предотвращает такие жизнеугрожающие осложнения ТЛБА ВСА, как асистолия и АВ-блокада, в пять раз уменьшая возникновение СКС непосредственно в момент баллонной ангиопластики и откладывая его развитие на более поздние сроки после операции, что, возможно, может оказаться важным для адаптации головного мозга к новым условиям мозгового кровообращения.
По нашему мнению, показанием для выполнения БКС при каротидном стентировании может являться наличие у пациентов кардиальной патологии, а именно ИБС (стабильной стенокардии напряжения 1-го и 2-го функциональных классов, постинфарктного кардиосклероза, хронической сердечной недостаточности I–II степени, любых нарушений сердечного ритма и проводимости). Проведение БКС с целью профилактики синдрома каротидного синуса пациентам с контралатеральной каротидной окклюзией нецелесообразно, в том числе и пациентам с кардиальной патологией. Полученные в результате исследования данные позволяют персонализировать оказание медицинской помощи пациентам со стенозирующим атеросклерозом ВСА. Проблемами, требующими дальнейшего изучения, являются: методика проведения БКС, доза и вид вводимого местного анестетика, использование ультразвукового контроля взамен рентгенологического и ряд других.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Полищук Р.В., Пирадов М.А., Рябинкина Ю.В., Щипакин В.Л., Кощеев А.Ю. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
Author contribution. Polishchuk R.V., Piradov M.A., Ryabinkina Y.V., Shchipakin V.L., Koshcheev A.Yu. — all authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.