Первые публикации, раскрывшие анальгетические свойства неселективных агонистов пуриновых рецепторов, датируются концом прошлого столетия [1]. С тех пор подавляющее число исследований подтвердило способность этой группы препаратов снижать интенсивность боли в различных клинических ситуациях.
Сегодня хорошо известно, что анальгетический эффект неселективных агонистов пуриновых рецепторов развивается в результате активации А1-рецепторов [2]. Этот подкласс пуриновых рецепторов является тормозным для нейронов, участвующих в проведении ноцицептивного сигнала, а их активность ведет к редукции импульсного трафика и снижению болевых ощущений.
Исследователи, изучавшие возможность клинического применения этого класса препаратов, концентрировали свое внимание главным образом на периоперационном обезболивании [1, 3]. В то же время ряд работ был посвящен эффективности аденозина и его фосфорилированных производных у пациентов с хронической болью [4]. При этом было установлено, что для достижения анальгетического эффекта продолжительность инфузии неселективного агониста пуриновых рецепторов должна быть более 60 мин, а темп введения — от 35 до 100 мкг/кг/мин [5].
Течение онкологического процесса часто сопровождается болевым синдромом. Боль является самым частой «проблемной» жалобой у пациентов со злокачественными новообразованиями. Этот вариант боли характеризуется длительным существованием, а поэтому относится к хроническому ее типу. Для назначения обезболивающей терапии принято использовать анальгетическую лестницу ВОЗ. Тем не менее эффективность схемы терапии болевого синдрома у пациента со злокачественным новообразованием не всегда достаточна. Было показано, что 50–66 % людей, имеющих онкологическое заболевание, предъявляют жалобы на боль на фоне применения той или иной схемы обезболивания [6]. Несмотря на большие достижения в фармакологии обезболивания, значительная доля онкологических пациентов не удовлетворены качеством медицинской помощи в этом вопросе. Поэтому поиск новых технологий обезболивания таких пациентов представляется актуальной современной задачей.
Таким образом, целью настоящей работы стала оценка применения внутривенной инфузии трифосаденина у онкологических пациентов с жалобами на интенсивную боль на фоне схемы обезболивания, включающей неселективный ингибитор циклооксигеназы и слабый опиоид трамадол.
В настоящее проспективное неконтролируемое исследование, протокол которого был одобрен локальными этическими комитетами СЗГМУ им. И.И. Мечникова (протокол № 10 от 02.11.2011) и НМИЦ онкологии им. Н.Н. Петрова (протокол № 2 от 10.04.2014), вошли 67 взрослых онкологических пациентов, которые страдали от боли высокой или средней степени интенсивности по вербально-цифровой шкале. В этой группе наблюдались пациенты, которым проводили неоадъювантную лучевую и/или полихимиотерапию в качестве подготовки к хирургическому лечению, а также лица, которым оперативное вмешательство не планировалось (запущенные формы онкологических заболеваний, мелкоклеточный рак легкого, лимфопролиферативные заболевания и др.). Болевые ощущения локализовались в регионах роста опухоли и/или метастазов, которые находились в грудной и брюшной полостях, забрюшинном пространстве, области таза, тканях конечностей.
На момент исследования все пациенты для обезболивания получали один из препаратов группы неселективных ингибиторов циклооксигеназы (кеторолак по 30 мг 2 раза/сут внутримышечно или кетопрофен по 100 мг 2 раза/сут внутримышечно) и слабый опиоидный агонист трамадол (по 100 мг 3 раза/сут внутримышечно). Во всех случаях применение какого-либо варианта нейроаксиальной блокады было признано либо противопоказанным из-за инфекционного процесса, либо нецелесообразным из-за большой распространенности болевых ощущений.
В табл. 1 показано распределение пациентов по полу и возрасту.
Таблица 1. Распределение пациентов по полу и возрасту
Table 1. Distribution of patients by sex and age
| Группы | Число пациентов | Средний возраст (лет) |
|---|---|---|
| Мужчины | 31 | 64,6 ± 7,2 |
| Женщины | 36 | 55,8 ± 12,3 |
| Всего | 67 | 61,4 ± 9,9 |
Критерии включения в исследование:
Критерии невключения:
Инфузию трифосаденина выполняли в палате профильного отделения, в процедурном кабинете на кушетке или в палате интенсивной терапии. После катетеризации периферической вены устанавливали капельную систему и начинали инфузию 0,9 % раствора натрия хлорида с малой скоростью. Затем подсоединяли линию с 1 % раствором трифосаденина, который подавали в темпе 35–45 мкг/кг/мин с помощью шприцевого дозатора. Внутривенное введение исследуемого препарата производили в течение 110–160 мин.
Интенсивность боли оценивали с помощи вербально-цифровой шкалы в диапазоне от 0 (нет боли) до 10 баллов (боль максимальной интенсивности). Оценку интенсивности боли производили за 30 мин до начала процедуры и через 30 мин после ее окончания. Во время инфузии трифосаденина контролировали частоту сердечных сокращений и сатурацию гемоглобина кислородом в пульсирующем потоке с помощью портативного пульсоксиметра.
У всех пациентов с целью апробации для оценки возможности предсказания эффективности инфузии трифосаденина была использована оригинальная шкала локализованности боли со следующим распределением таксономических критериев:
Результаты, полученные применением шкалы локализованности боли, легли в основу корреляционного анализа с эффективностью инфузии аденозинтрифосфата натрия, где «1» — снижение интенсивности боли не менее чем на 20 %, а «0» — отсутствие обезболивающего эффекта.
После получения результатов и формирования электронной матрицы статистическая обработка данных была произведена в среде программ Statistica 10.0 (StatSoft Inc., США). Для статистического анализа были использован непараметрический критерий — W-критерий Уилкоксона (Wilcoxon signed rank test) для связанных выборок. При выполнении корреляционного анализа применяли τ-критерий Kendall (Kendall tau rank correlation coefficient).
После проведения внутривенной инфузии раствора трифосаденина в темпе 35–45 мкг/кг/мин снижение интенсивности боли более чем на 2 балла отметили 53 из 67 пациентов, что составляет 79 %.
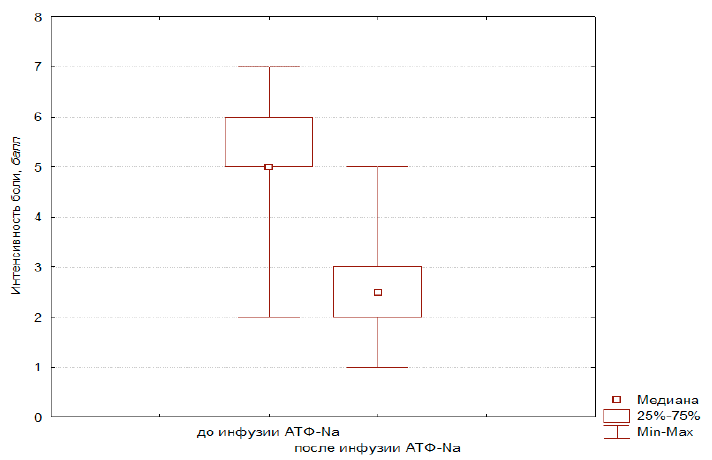
При статистическом анализе полученных результатов была выявлена достоверная разница между величинами интенсивности боли (табл. 2) до процедуры и после нее (Z = 7,0; р = 0,0000001 — W-критерий Уилкоксона). На рис. 1 показаны графики положения медианы интенсивности боли, квартильный доверительный интервал (25–75 %) и границы крайних — минимального и максимального — значений, которые оценивались до и после процедуры.
Таблица 2. Динамика интенсивности боли до и после инфузии трифосаденина
Table 2. Dynamics of pain intensity before and after triphosadenin infusion
| Точка исследования | Среднее значение; стандартное отклонение | Медиана | Квартильный доверительный интервал (25; 75 %) | Минимальное/максимальное значение |
|---|---|---|---|---|
| До инфузии | 5,5; 1,1 | 5,0 | 5,0; 6,0 | 2,0/7,0 |
| После инфузии | 1,9; 0,9 | 2,5 | 2,0; 3,0 | 1,0/5,0 |
Рис. 1. Сравнение интенсивности боли до и после внутривенной инфузии трифосаденина (n = 67)
Fig. 1. Comparison of pain score before and after the adenosine triphosphate infusion (n = 67)

При использовании шкалы локализованности боли была выявлена (табл. 3) статистически достоверная корреляционная связь между эффективностью инфузии трифосаденина и болью с высокой локализованностью (Z = 0,31; р = 0,02 — τ-критерий Kendall). На рис. 2 представлены графики корреляционного анализа между эффективностью инфузии трифосаденина и варианта боли, характеризующийся высокой локализованностью.
Таблица 3. Распределение пациентов по классам шкалы локализованности боли и частоте эффективности инфузии трифосаденина в этих группах
Table 3. Distribution of patients by class of pain localization scale and frequency of effectiveness of triphosadenine infusion in these groups
| Класс 1 | Класс 2 | Класс 3 | |
|---|---|---|---|
| Число пациентов | 3 | 49 | 15 |
| Число случаев снижения интенсивности после инфузии трифосаденина | 3 | 47 | 10 |
Рис. 2. Результат корреляционного анализа между эффективностью инфузии трифосаденина и варианта боли, характеризующийся высокой локализованностью, где на левой панели: 1 — число пациентов, распределенных в 1-й класс шкалы локализованности боли; 2 — число пациентов, распределенных во 2-й класс той же шкалы; 3 — число пациентов, распределенных в 3-й класс той же шкалы; на правой верхней панели: 1 — число пациентов, отметивших снижение интенсивности боли после инфузии трифосаденина; 2 — число пациентов, не отметивших снижение интенсивности боли после инфузии трифосаденина (n = 67)
Fig. 2. The result of the correlation analysis between the effectiveness of the triphosadenine infusion and the pain variant characterized by high localization, where 1 on the left panel is the number of patients assigned to grade 1 of the pain localization scale; 2 — the number of patients assigned to grade 2 of the same scale; 3 — the number of patients assigned to grade 3 of the same scale; on the top right panel 1 — the number of patients who noted a decrease in pain intensity after the triphosadenine infusion; 2 — number of patients who did not notice a decrease in pain intensity after triphosadenine infusion (n = 67)

Ни у кого из пациентов никаких побочных эффектов во время и после применения инфузии трифосаденина выявлено не было.
Лечение боли у онкологических пациентов иногда представляет собой сложную задачу. И хотя последовательные шаги по подбору схемы обезболивания широко известны и хорошо стандартизированы [7], болевой синдром может упорствовать. В таких случаях нередко приходится принимать нетривиальные решения. И поэтому для достижения прогресса в таком важном вопросе необходимо интенсифицировать изучение схем терапии боли, включающих препараты с различными механизмами обезболивания.
Использование анальгетической активности неселективных агонистов пуриновых рецепторов пока еще не стало рутинной медицинской практикой. Поэтому выявление новых групп пациентов с хронической болью, в которых препараты этой фармакологической группы могут улучшить их состояние, необходимо для формирования представления о возможностях клинического применения трифосаденина и его дефосфорилированных аналогов.
Согласно анальгетической лестнице ВОЗ, при интенсивной боли онкологическим пациентам должны быть назначены неселективный ингибитор циклооксигеназы и слабый опиоид. Неэффективность такой схемы лечения онкологической боли требует замены слабого опиоида на сильный [7]. Однако применение сильного опиоида может сопровождаться серьезными побочными эффектами: тошнотой/рвотой, обстипацией, зудом, нарушением дыхания, развитием зависимости и др. Это вынуждает более осмотрительно относиться к назначению морфина и его аналогов.
В то же время следует отметить, что современный вариант анальгетической лестницы обезболивания ВОЗ рекомендует назначение анальгетических адъювантов, в число которых включены антиконвульсанты. А учитывая нарастающее количество научных работ, показывающих участие в развитии хронического онкологической боли нейропатических механизмов [8], недостаточная эффективность комбинации ингибитора циклооксигеназы с трамадолом требует не усиления активности опиатергического компонента антиноцицептивной системы организма, а назначения препаратов из фармакологической группы антиконвульсантов [9].
Как показали многочисленные исследования, неселективные агонисты пуриновых рецепторов эффективны как при ноцицептивной боли [10], так и при нейропатической [4, 11]. И поскольку онкологические пациенты получают мощные анальгетики против ноцицептивной боли, то логично предположить, что результаты настоящей работы следует связать в большей степени с антиконвульсантным действием трифосаденина [12, 13] и с его противодействием механизмам нейропатической боли.
Некоторой части пациентов может быть выполнен какой-либо вариант нейроаксиальной блокады. Чаще всего применяют эпидуральную блокаду и проводниковую блокаду с катетеризацией эпидурального или периневрального пространства для перманентного подведения к нервному стволу раствора местного анестетика. Однако данные методы не являются универсальными и имеют ряд существенных ограничений. В случае их использования пристальное внимание должно быть уделено контролю за положением катетера (т. е. отсутствием смещения), а также профилактике и раннему выявлению бактериального воспаления в месте расположения катетера.
Данная работа является еще одним примером практического использования метода анальготестирования [14], когда в течение малого промежутка времени с помощью лекарственного средства с подходящими фармакологическими свойствами можно определить механизмы, участвующие в развитии боли у конкретного пациента.
Кроме того, результаты этого исследования определяют предпосылки создания, валидизации и внедрения в практическую работу клинического инструмента для прогнозирования эффектов терапии боли у онкологических пациентов антиконвульсантами — шкалы локализованности боли.
Положительные результаты этого исследования может нивелировать следующее ограничение: среди показаний к применению раствора трифосаденина отсутствует болевой синдром. Поэтому практическое применение исследованного метода обезболивания в настоящее время невозможно. При исследовании обезболивающего действия этого препарата в научных целях следует учесть, что противопоказаниями к применению неселективных агонистов пуриновых рецепторов являются: 1) подагра и другие виды патологии пуринового обмена; 2) артериальная гипотензия; 3) стенокардия напряжения III–IV функционального класса; 4) нарушения проводимости и возбудимости миокарда в виде синдрома слабости синусового узла, сино-атриальной и атрио-вентрикулярной блокад любой степени и блокады левой ножки пучка Гиса; 5) заболевания органов внешнего дыхания, сопровождающиеся обструкцией бронхов; 6) острый инфекционно-воспалительный процесс.
В заключение следует сказать, что результаты настоящей работы еще раз продемонстрировали, что применение неселективного агониста пуриновых рецепторов трифосаденина может стать эффективным методом обезболивания пациентов с хронической болью, в том числе и тех, у кого болевой синдром связан с онкологическим процессом.
Финансирование. Исследование не имело спонсорской поддержки.
Funding source. This study was not supported by any external sources of funding.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы подтверждают соответствие своего авторства, согласно международным критериям ICMJE (все авторы внесли существенный вклад в разработку концепции, проведение исследования и подготовку статьи, прочли и одобрили финальную версию перед публикацией).
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.