Вертикализация — диагностическая и тренировочная процедура контролируемого перевода тела в вертикальное положение для определения гравитационного градиента и ортостатической тренировки. Как компонент мобилизации, веритикализация направлена на профилактику и лечение нарушений гравитационного градиента у пациентов, находящихся (находившихся) в условиях постельного режима более 24 ч вне зависимости от ментального и двигательного статуса пациента.
Гравитационный градиент (ГГ) — максимальный угол подъема пациента, не приводящий к развитию признаков ортостатической недостаточности. Нормальное значение соответствует 90°, т. е. физиологическому состоянию прямостояния.
Диссомния ОАРИТ (син.: диссомния, приобретенная в отделении анестезиологии, реанимации и интенсивной терапии [ОАРИТ]) — нарушение сна у пациентов ОАРИТ, связанное с режимом круглосуточного пребывания в особых технологических условиях постоянной освещенности и шума.
Дисфагия — (от дис... и греч. phagein — есть, глотать) — клинический симптом нарушения функции глотания, дискомфорт или трудности продвижения пищевого комка от ротовой полости до желудка, возникающие вследствие нарушения пассажа пищи из ротовой полости в желудок. Для пациентов с трахеопищеводным разобщением (эндотрахеальная канюля и назогастральный зонд) при выявлении признаков дисфагии используется термин «постэкстубационная дисфагия», или дисфагия, приобретенная в ОАРИТ.
Кинезиотерапия (от греч. kinesis, движение, + терапия — лечение, или лечение через движение) — основный метод лечебной физкультуры, используемый специалистами мультидисциплинарной реабилитационной командой при мобилизации пациентов ОАРИТ, включающий активный и пассивный режимы в зависимости от уровня сознания и двигательного дефицита.
Когнитивно-афферентный диссонанс — состояние дезориентированности в пространстве, времени и собственной личности в результате лечебной деафферентации.
Лечебная деафферентация — искусственное снижение сенсорного потока от органов чувств (перцепция) и внутренних органов (проприоцепция) посредством медикаментозной анальгоседации.
Лечебная иммобилизация (ЛИ) — состояние искусственного ограничения двигательной и когнитивной активности пациента в результате применения анальгоседации, направленные на снижение метаболических потребностей при лечении неотложных состояний в условиях ОАРИТ.
Мобилизация — стратегия активизации пациента в условиях вынужденной иммобилизации и постельного режима, предполагающая активные или пассивные движения во всех суставах и вертикализацию. Ранняя мобилизация — это повышение физической активности пациента ОАРИТ в период со 2-х по 5-е сутки от его поступления.
Мультидисциплинарная реабилитационная команда ОАРИТ (МДРК) — производственная кооперация специалистов, проводящих комплекс лечебно-диагностических мероприятий по профилактике и лечению ПИТС, предусмотренная «Порядком оказания помощи по медицинской реабилитации» [5].
Ортостатическая недостаточность (ОСН) — состояние нарушенного механизма вегетативного контроля ГГ, проявляющееся в утрате способности гемодинамического обеспечения перехода пациента из горизонтального в вертикальное положение.
ПИТ-синдром педиатрический — синдром последствий интенсивной терапии, развивающийся у детей и членов семьи пациента детского или подросткового возраста (ПИТС-П) [4].
ПИТ-синдром — синдром последствий интенсивной терапии (ПИТС) — совокупность ограничивающих и снижающих качество повседневной жизни пациента соматических, неврологических и социально-психологических последствий пребывания в условиях ОАРИТ более 72 ч, требующих реабилитации [1–3].
Позиционирование, или постуральная коррекция, — лечебное и профилактическое воздействие, при котором пациенту помогают принять (придают) оптимальные позы, способствующие предупреждению осложнений иммобилизации (bed-rest, или премобилизационный период критического состояния) и восстановлению механизмов обеспечения ГГ и локомоции, в частности прямохождения. Основу позиционирования составляет метод управления постуральными рефлекторными мышечно-тоническими реакциями с опорой на онтогенетические механизмы поддержания баланса. В зависимости от контекста использования позиционирование разделяют на вертикальное и горизонтальное.
Вертикализирующее (антигравитационное) позиционирование (ВП) — способ размещения пациента в положение вертикальной ориентации тела для поддержания и/или восстановления нормального ГГ и лечения ОСН. ВП призвано адаптировать пациента к достигнутому в ходе маневров вертикализации ГГ. ВП как реабилитационное мероприятие должно обеспечивать последовательное повышение длительности пребывания в каждой точке ГГ, достигнутой в ходе вертикализации, так, чтобы максимально приблизиться к целевому позиционированию — высадке на полный день (6–8 ч) в положении сидя с периодами возвращения в горизонтальное положение для отдыха. Следует помнить, что ВП сопровождается повышением энергозатрат, что ограничивает его использование в острейшем периоде критического состояния, когда применяется стратегия поддержки «метаболического покоя».
Невертикализирующее (антипролежневое) горизонтальное позиционирование (НВП) — периодическое изменение позы пациента по отношению к горизонтальной плоскости постели, замещающее отсутствие самопроизвольных движений пациента из-за патологической (парез, плегия) или лечебной (наркоз, анальгоседация; использование миорелаксантов) иммобилизации. Цель НВП — профилактика формирования аномальных позных установок и нарушений микроциркуляции в местах продолжительного давления на кожу в точках контакта (лопатки, затылок, крестец, вертелы бедренных костей и пр.) с поверхностью постели. Вовремя и правильно выполняемое НВП снижает риск нейротрофических осложнений (пролежней), тихой аспирации, патологической (болевой) сенситизации, повреждения суставов, формирования контрактур, способствует оптимальной легочной вентиляции и клиренсу мокроты, обеспечивает комфорт среды для пациента и адекватное восприятие окружающего пространства, оптимизирует условия для гигиенических мероприятий при уходе за пациентом. НВП не сопровождается повышением энергозатрат пациента, поэтому, в отличие от ВП, не имеет ограничений в использовании в острейшем периоде критического состояния.
Полимионейропатия критических состояний (ПМНКС) (син.: ICUAW — ICU-acquired weakness, приобретенная в ОАРИТ слабость) — приобретенный вследствие критического состояния и его лечения в условиях иммобилизации комплекс нервно-мышечных нарушений по типу полинейропатии и/или миопатии, клинически проявляющийся общей мышечной слабостью, периферическими парезами конечностей. В случае наличия затруднений в отлучении от искусственной вентиляции легких у длительно находящихся ОАРИТ пациентов следует применять термин «респираторная полимионейропатия» [5].
Постельный (bed-rest) режим — способ позиционирования пациента как компонент иммобилизации в остром периоде заболевания или раннем послеоперационном периоде, используемый в условиях ОАРИТ как метод лечебной иммобилизации.
Реабилитационный потенциал (для пациентов ОАРИТ) — оценка вероятности возвращения пациента к преморбидному статусу социализированности на момент перевода из ОАРИТ по шкале реабилитационной маршрутизации (ШРМ).
Реабилитация в интенсивной терапии (РеабИТ) — комплекс лечебных стратегий, направленных на профилактику и лечение начальных проявлений ПИТС в условиях ОАРИТ, осуществляемый МДРК отделения ранней реабилитации (ОРР).
Стретчинг (англ. stretching) — растяжка. Пассивный стретчинг — маневр легкой растяжки сухожилий и мышц при выполнении суставной гимнастики у пациентов ОАРИТ. Принцип: кратковременный (до 10 с) маневр фиксации в слегка растянутом состоянии мышечно-связочного аппарата в крайней точке анатомического объема движения сустава. Стретчинг выполняет специалист по кинезиотерапии как элемент пассивной суставной гимнастики. В момент растяжения происходит генерация потенциала действия как первичного элемента двигательной проприоцепции, что имитирует эффект активного мышечного сокращения, способствует повышению уровня бодрствования пациента и служит для профилактики феномена функционального бездействия.
Суставная гимнастика — базовый метод ранней мобилизации, направленный на профилактику гипокинезии как триггера формирования контрактур при иммобилизации. Суставная гимнастика может выполняться пациентом (активная) или специалистом физической и реабилитационной медицины (ФРМ) (пассивная). Общий принцип: активные (пассивные) непрерывно повторяемые движения в основных суставах верхних и нижних конечностей.
Феномен наученного неиспользования (феномен learned non-use), или искусственное функциональное бездействие, — механизм расстройства условных и безусловных рефлекторных связей, связанных с сенсорной изоляцией и вынужденным двигательным бездействием в период иммобилизации, приводящий к формированию устойчивых полиорганных нарушений в форме ПИТС: полимионейропатии, дисфагии, снижению ГГ, когнитивно-афферентному диссонансу.
Хендлинг (манипулирование положением тела пациента-ребенка с целью оптимизации его позиционирования) — лечебное и профилактическое воздействие, при котором родитель (опекун) пациента придает пациенту оптимальную позу у себя на руках и сам занимает оптимальное положение с ребенком на руках с оптимальной экспозицией для предупреждения осложнений иммобилизации у детей от 0 до 3 лет.
Эрготерапия (лат. ergon — труд, занятие, греч. therapia — лечение) — комплекс мер, направленных на восстановление самостоятельности и независимости в повседневной жизни пациента на преморбидном уровне.
Острейший период острого заболевания, требующий лечения в отделении анестезиологии, реанимации и интенсивной терапии (ОАРИТ), соответствует в эволюционном процессе саногенеза самой низкой точке состояния личной независимости пациента. Это обусловлено тем, что технологии интенсивной терапии в виде аппаратного мониторинга, частично или полного замещения витальных функций, по сути, создают для пациента статус частичной или полной утраты автономности жизнедеятельности. При успешном исходе интенсивного этапа лечения пациента ожидает восстановление независимости в повседневной жизни, которое может достигнуть преморбидного уровня, но может снизиться в зависимости от индивидуальных репаративных процессов. «Парадокс» интенсивной терапии состоит в том, что комплекс жизнесберегающих технологий может стать причиной длительного и неполного восстановления, снижения качества жизни, т. е. приводить к более значимым последствиям, чем при неотложном состоянии, по поводу которого оказывалась помощь в ОАРИТ. Это явление получило название синдрома последствий интенсивной терапии. Впервые термин появился в начале XXI в. в материалах конференции по мультидисциплинарному взаимодействию реаниматологов и специалистов по реабилитации [1, 2]. В русскоязычном варианте он звучит как «синдром последствий интенсивной терапии», или ПИТC [3].
Пребывание в условиях ОАРИТ или специально выделенных палатах неотложной помощи отделения по профилю заболевания (травматологических, кардиологических, хирургических) — первый этап лечения пациента в медицинской организации на время оказания неотложной помощи в связи с острым заболеванием или в раннем сроке после планового оперативного лечения и иных лечебно-диагностических манипуляций, предполагающих круглосуточное наблюдение за пациентом. Потребность в проведении медицинской реабилитации на 1-м этапе помощи определяется необходимостью профилактики развития ПИТС, риск которого напрямую связан с длительностью пребывания в ОАРИТ [1, 7–9].
Данные о ключевых симптомокомплексах, факторах риска их развития и эволюции в постреанимационном периоде, объединенные на основе разрозненных публикаций ПИТС [9–15], представлены в табл. 1. Принципиально то, что к ПИТС относятся только те синдромы, не имеющие непосредственной причинно-следственной связи с неотложным состоянием, послужившим поводом для госпитализации в ОАРИТ.
Таблица 1. Структура и факторы риска ПИТС (в редакции А.А. Белкина)
Table 1. Structure and risk factors of PITCS (as amended by A.A. Belkin)
| № п/п |
Симптомокомплексы ПИТС | Факторы риска | Проявления ПИТС в ОАРИТ | Последствия ПИТС |
|---|---|---|---|---|
| 1 | Инфекционно-трофические осложнения | |||
| Нутритивный дефицит Неадекватное позиционирование |
Пролежни | Хронические трофические язвы | ||
| Трахеотомия Длительная назо- и оротрахеальная интубация |
Инфекции дыхательных путей | Трахеопищеводный свищ Синуситы Постинтубационный стеноз трахеи |
||
| Длительное стояние мочевого катетера | Уроинфекция | Стриктуры уретры Носительство эпицистостомы |
||
| Иммобилизация/ «постельный» режим | Тромбозы нижних конечностей и эмболии | Вторичные трофические нарушения и риск тромбоэмболии | ||
| 2 | Вегетативно-метаболические осложнения | |||
| Хронизирующийся болевой синдром | Неадекватная анальгезия Гиподиагностика болевых триггеров и болевого поведения |
Стойкая симпатическая гиперактивность (гипертензия, тахикардия, потливость, судорожные пароксизмы и пр.) | Хронизирующийся болевой синдром (висцеральный, мышечно-скелетный, суставной, нейропатический), регрессирующий в течение 6 мес. при адекватном специфическом лечении | |
| Нарушение циркадных ритмов | Анальгоседация Технологический шум ОАРИТ Ночной режим питания Постоянный свет Преморбидно: Прием снотворных Дети: Нарушение привычного ритма сон/бодрствование у детей грудного и младшего возраста |
Диссомния ОАРИТ Констипация (запор) Нарушение пассажа мочи Дети: Повышенная раздражительность, плаксивость, негативное отношение к медперсоналу |
Хроническая диссомния, регрессирующая в течение 1 года Длительные нарушения функции тазовых органов |
|
| Нарушение гравитационного градиента | Иммобилизация/ постельный режим Позиционирование с опущенным головным концом |
Ортостатическая недостаточность | Стато-координаторные нарушения, создающие неуверенность при ходьбе, регрессирующие пропорционально продолжительности постельного режима до 6 мес. | |
| Снижение толерантности к физическим нагрузкам | Преморбидный статус низкой активности Снижение дыхательного объема и жизненной емкости легких Снижение ударного объема миокарда Пожилой возраст Иммобилизация/ постельный режим Нутритивный дефицит |
Снижение выносливости Кислородная зависимость |
Снижение активности в повседневной жизни за счет устойчивого снижения толерантности к физическим нагрузкам Прогноз: улучшение в течение месяца с остаточными явлениями дефицита активности в течение 1 года у 50 % пациентов |
|
| 3 | Нейромышечные осложнения | |||
| Полимионейропатия критических состояний (ПМНКС) | Иммобилизация/ постельный режим Снижение массы тела Нутритивный дефицит Миорелаксанты Кортикостероиды Гипергликемия Сепсис Полиорганная недостаточность |
Снижение мышечной силы, в первую очередь в кистях Периферический тетрапарез |
Персистирующая потеря мышечной массы у 55–95 % пациентов до 2–5 лет Нарушение мелкой моторики |
|
| Снижение объема активных движений в крупных суставах конечностей | Мягкотканые контрактуры в дистальных суставах (голеностопный, лучезапястный) | |||
| Спастичность в дистальных отделах | ||||
| Гетеротопная оссификация | ||||
| Респираторная нейропатия [5] | Искусственная вентиляция легких (ИВЛ) с контролируемыми режимами Иммобилизация/ постельный режим Пневмония |
Снижение жизненной емкости легких и дыхательная усталость, зависимость от ИВЛ Ослабление кашлевого точка Гипофония |
Сниженная толерантность к нагрузкам Удлинение сроков отлучения от ИВЛ |
|
| Дисфагия ОАРИТ (бездействия) | Трахеопищеводное разобщение (трахеостома, эндотрахеальная трубка) более 72 ч Пищевое оральное бездействие Преморбидно: Перенесенные инсульты |
Тихая аспирация после деканюляцииНевозможность перорального питания | Рецидивирующие аспирационные пневмонии Канюленосительство Носительство гастростомы Дефицит массы тела вплоть до кахексии |
|
| Возможно спонтанное восстановление в течение 2–4 нед. | ||||
| 4 | Эмоционально-когнитивные осложнения | |||
| Когнитивные нарушения | Преморбидные психические нарушения и низкий уровень интеллекта Седация <–2 по RASS Анальгоседация Иммобилизация/ постельный режим Когнитивно-афферентный диссонанс ОАРИТ Длительная ИВЛ Нутритивный дефицит Гипогликемия Делирий ОАРИТ Диссомния ОАРИТ Воспоминания об ОАРИТ Женский пол Преморбидно: Прием антидепрессантов и/или нейролептиков Алкоголизм Дети: Срыв первичного стереотипа поведения неадекватное общение с ребенком Негативное отношение медперсонала Длительная фиксация |
Когнитивно-афферентный диссонанс: дезориентация в месте, времени и собственной личности | Нарушение памяти, внимания 30–80 % пациентов имеют когнитивные нарушения, которые могут персистировать от 1 до 6 лет с неполным регрессом до преморбидного уровня |
|
| Амнезия ретроградная | Нарушение управляющих функций | |||
| Заторможенность | Снижение нейродинамики | |||
| Утрата навыков самообслуживания | Снижение исполнительных функций вплоть до полной апраксии | |||
| Эмоциональные нарушения | Ажитация | У 10–50 % пациентов и у 33 % членов их семей симптомы депрессии и тревожности, нарушения сна могут персистировать более 4 лет | ||
| Тревожность | Депрессия | |||
| Психические нарушения | Делирий ОАРИТ | Подострые и отдаленные психические расстройства Повышенный риск ранней деменции |
||
| 5 | Снижение качества жизни по сравнению с преморбидным уровнем | |||
| Неготовность к возвращению прежнего образа жизни без реабилитации | Снижение социального статуса (снижение квалификации, потеря работы) Снижение независимости в повседневной жизни (инвалидность) |
|||
| RASS — шкала возбуждения-седации Ричмонда. | ||||
Не следует смешивать понятия ПИТС и хронического критического состояния (ХКС). Они имеют различную патофизиологическую основу, траекторию саногенеза и прогноз. Известно, что ПИТС предрасполагает к формированию ХКС [16].
Несмотря на очевидную причинно-следственную связь ПИТС с оказанием помощи в ОАРИТ, считать его ятрогенным осложнением нет никаких оснований ни с физиологической, ни с юридической точки зрения [17].
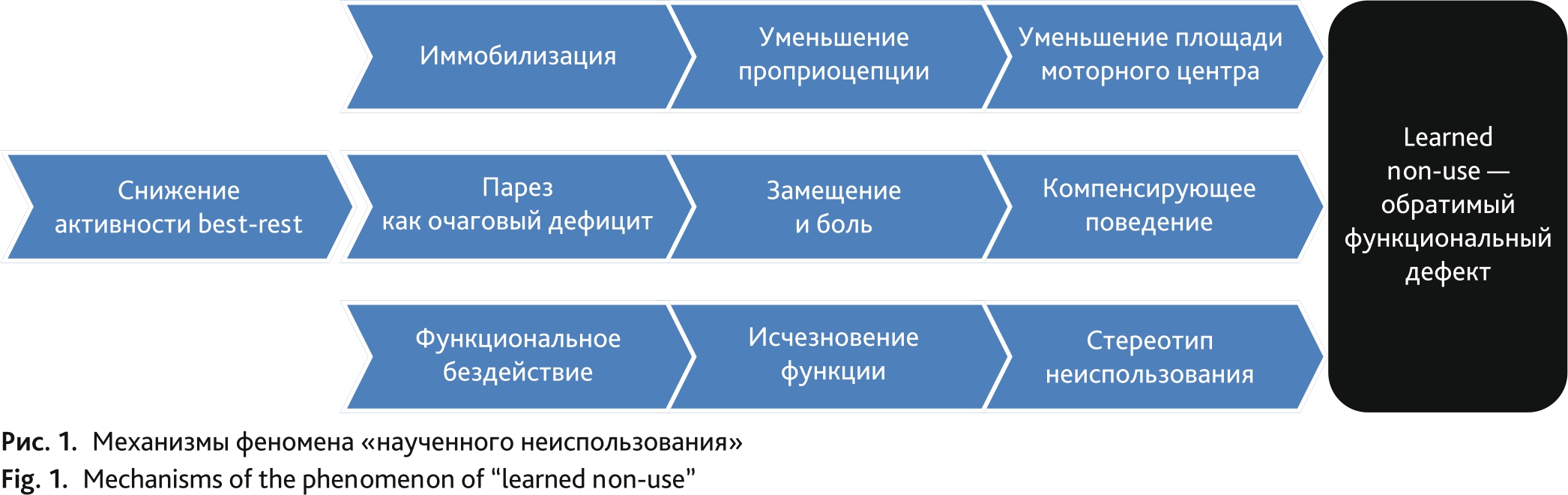
Патофизиологическую основу иммобилизационного синдрома составляет феномен «наученного неиспользования» (феномен learned non-use), «искусственного функционального бездействия». Суть данного феномена заключается в том, что двигательное бездействие и когнитивная изоляция способствуют сенсомоторному разобщению, т. е. нарушению целостности условных и безусловных рефлекторных циклов [4]. Этот и прочие механизмы феномена «наученного неиспользования» представлены на рис. 1.
Рис. 1. Механизмы феномена «наученного неиспользования»
Fig. 1. Mechanisms of the phenomenon of “learned non-use”

Реализации феномена «наученного неиспользования» способствует состояние лечебной иммобилизации (ЛИ). Иммобилизация подразделяется на первичную и вторичную. Первичная иммобилизация — результат вынужденного двигательного ограничения при острой церебральной недостаточности (инсульт, черепно-мозговая и спинномозговая травма, инфекции и интоксикации центральной нервной системы и т. д.) и нервно-мышечных заболеваниях (полирадикулонейропатии, миопатии, миастенический криз). Вторичная, или лечебная, иммобилизация — комбинация медицинских воздействий (постельный режим, седация, миорелаксация, ИВЛ и т. д.) [16].
Классической моделью ЛИ является bed-rest (постельный) режим — способ позиционирования пациента в период пребывания в условиях отделения интенсивной терапии, провозглашенный в XIX в. английским хирургом John Hilton в качестве основной терапевтической стратегии лечения тяжелых больных. В XX в. она укрепилась более широким понятием иммобилизации (состояние обездвиженного пребывания в горизонтальном положении, поддерживаемое с использованием седации и миоплегии и обеспечивающее «метаболический покой» пациента в период критического нарушения перфузии и оксигенации). ЛИ способствует решению важнейших проблем интенсивной терапии:
Вместе с тем иммобилизация продемонстрировала множество полиорганных негативных явлений, составляющих основу ПИТС. Патологические проявления ЛИ приведены в табл. 2 [3, 8, 9, 12, 13, 19].
Таблица 2. Основные побочные эффекты и осложнения лечебной иммобилизации
Table 2. The main side effects and complications of therapeutic immobilization
| Костно-мышечная система | Сниженный синтез мышечного белка |
| Мышечная атрофия со снижением общей массы тела | |
| Снижение мышечной силы | |
| Снижение толерантности к физической нагрузке | |
| Укорочение сухожилий и контрактуры суставов с начальными проявлениями через 8 ч | |
| Резорбция кости и гиперкальциемия 1 % в неделю | |
| Болезненность суставов | |
| Дыхательная система | Снижение инспираторного давления и жизненной емкости легких |
| Ателектазы | |
| Пневмония | |
| Сердечно-сосудистая система | Уменьшение общего размера сердца и левого желудочка |
| Снижение венозного комплайнса вен нижних конечностей | |
| Снижение сердечного выброса, ударного объема и общего периферического сосудистого сопротивления | |
| Микроциркуляторная недостаточность | |
| Снижение сердечной реактивности на стимуляцию каротидного синуса | |
| Метаболизм | Нейротрофические нарушения |
| Снижение чувствительности к инсулину | |
| Снижение активности альдостерона и плазменного ренина | |
| Повышение концентрации предсердного натрийуретического пептида | |
| Мочеполовая система | Нарушение мочеиспускания |
| Повышение риска инфекции | |
| Уролитиаз | |
| Желудочно-кишечная система | Нарушение перистальтики |
| Констипация (запор) | |
| Нервная система | Ортостатическая недостаточность |
| Когнитивная изоляция | |
| Посттравматический стресс |
К ранним и наиболее клинически значимым осложнениям ЛИ относятся: ПМНКС, дисфагия ОАРИТ (бездействия), снижение ГГ, когнитивно-афферентный диссонанс, диссомния ОАРИТ.
ПМНКС — комбинация миопатии и полинейропатии, проявляется общей мышечной слабостью и является основной причиной затруднений в прекращении ИВЛ. В отличие от других состояний, способных вызвать клинику нейромышечной слабости у пациентов в ОАРИТ, ПМНКС является исключительным проявлением ПИТС как пример «функционального полного или частичного бездействия». Актуальным примером такого механизма служит респираторная полимионейропатия у пациентов на длительной ИВЛ (более 7 сут), приводящая в 25 % случаев к трудному переводу на спонтанное дыхание. Ее патогенетическую основу составляет поражение нервно-мышечного аппарата внешнего дыхания, в первую очередь диафрагмы, толщина которой уменьшается в среднем на 25 % к 7-му дню ИВЛ [21].
Прогрессированию ПМНКС способствует полиорганная недостаточность, водно-электролитные нарушения, нутритивный дефицит, применение миорелаксантов и глюкокортикостероидов [22, 23].
Дисфагия бездействия (дисфагия, приобретенная в ОАРИТ) — клинический симптом нарушения функции глотания, препятствующий полноценному энтеральному питанию и деканюляции из-за риска аспирационных осложнений.
У реанимационных пациентов встречается, как правило, нейрогенная орофарингеальная дисфагия. Кроме вышеописанного механизма learned non-use из-за длительного кормления через зонд, при котором пациент не имеет физиологического 3-фазного глотания, выделяют следующие виды дисфагии: а) постэкстубационную дисфагию как осложнение длительного стояния эндотрахеальной трубки, из-за которой нарушается физиологическая частота глотательных движений (от 8 раз в час во время сна до 5 раз в минуту во время еды); б) дисфагию вследствие исчезновения подскладочного давления при канюленосительстве; в) дисфагию как проявление синдрома приобретенной в ОАРИТ слабости [24]. Развитию дисфагии способствует использование анальгоседации, включающей морфин и диазепам [25].
Снижение ГГ (ОСН). Способность поддерживать витальные параметры стабильными в любом положении тела по отношению к гравитационному полю Земли обусловлена тем, что при смене положения тела с горизонтального на вертикальное происходит перераспределение крови в сосудистой системе относительно некоторой гидростатически индифферентной точки, располагающейся на несколько сантиметров ниже уровня диафрагмы. Этот процесс запускается импульсацией из полукружных каналов лабиринта и прессорецепторов стоп. В ответ на афферентную стимуляцию в стволе головного мозга срабатывает сложный рефлекторный стереотип: повышение тонуса емкостных сосудов, расположенных ниже диафрагмы; закрытие части функционирующих тканевых артериовенозных анастомозов; первичное повышение тонуса периферических артерий; начальное падение тонуса мозговых артерий. В результате происходит «централизация кровообращения», при которой депонированные в сосудах расслабленных в горизонтальном положении мышц 300–800 мл крови идут на повышение преднагрузки и сердечного выброса. Увеличенное таким образом среднее артериальное давление (САД) в сочетании с пониженным сопротивлением церебральных сосудов обеспечивает нормальное церебральное перфузионное давление и отсутствие каких-либо ортостатических реакций.
При неэффективности первичного механизма срабатывает неспецифический рефлекторный ответ на гипотензию:
При нарушении указанных механизмов поддержания ГГ развивается ОСН: головокружение, нарушение зрения, когнитивный дефицит, потеря сознания, падения, дисавтономия (тахикардия, повышенное потоотделение, побледнение кожных покровов, диспноэ, болезненный спазм в мышцах плечевого пояса и шеи, олигурия).
У реанимационного пациента риск ОСН увеличивают:
Диссомния ОАРИТ. Среди прочих вегетативных нарушений в структуре ПИТС заметное место занимают проблемы циркадного ритма. Циркадность является естественным процессом, определяющим поведенческие реакции на смену освещенности. В их число входит цикличность выработки гормонов, чередования сна и бодрствования. Условия пребывания пациента в ОАРИТ неизбежно приводят к их изменению. Этому способствует постоянный режим освещенности, круглосуточные манипуляции, шум, ночное питание и прочие ситуации, нормальные для регламента неотложного отделения, но неестественные с позиции физиологии. Среди «шумов» ОАРИТ реальное негативное воздействие имеют разговоры персонала. Большинство прочих шумов не приводят к пробуждению пациента, но снижают глубину сна и вызывают его фрагментацию. Возникающая таким образом диссомния (нарушение сна) сохраняется длительное время уже после выписки из стационара и влечет за собой снижение толерантности к физическим и интеллектуальным нагрузкам, а также усугубляет течение еще одной специфической ятрогении, определяющей ПИТС: когнитивно-афферентного диссонанса.
Когнитивно-афферентный диссонанс — состояние человека с искусственно сниженным притоком сенсорной импульсации от органов чувств (перцепция) и собственных органов (проприоцепция). Именно нарушение перцепции в сочетании с нарушением циркадности из-за длительного гипнотического медикаментозного состояния составляет основу когнитивно-афферентного диссонанса у пациента ОАРИТ. Суть этого явления заключается в том, что из-за отсутствия привычных ощущений (запахов, прикосновений, звуков голосов близких), взамен которых действуют другие стимулы, носящие чаще отрицательный и даже агрессивный характер (тревоги мониторов, стоны и неадекватная речь других пациентов, грубый тон персонала и т. д.), у пациента при пробуждении возникает сбой в ассоциативной сфере и развивается состояние дереализации и деперсонализации. Самым тяжелым проявлением когнитивно-афферентного диссонанса является делирий ОАРИТ.
Физические осложнения после критического состояния болезни могут возникать примерно у 70 % человек [9, 54]. Общая частота ПИТС составляет 20 % через год после пребывания в ОАРИТ [4, 15, 23]. Больше 50 % всех пациентов ОАРИТ с новой коронавирусной инфекцией COVID-19 и 80 % среди тех из них, кто находился на ИВЛ [10, 25], демонстрируют развитие ПИТС [11].
Частота иммобилизационных осложнений у пациентов с острой церебральной недостаточностью достигает 65–80 %, а у пациентов общих ОАРИТ с длительностью пребывания более 48 ч — 55–60 % [14]. Частота ПМНКС среди взрослых пациентов ОАРИТ, находящихся на ИВЛ более 2 нед., с сепсисом или полиорганной недостаточностью составляет 46 % [15]. 50 % пациентов с РДСВ в среднем возрасте 45 лет неработоспособны в течение 1 года, а 33 % приобретают стойкую инвалидизацию. Летальность в течение 1 года составляет 26–63 %. 50 % пациентов нуждаются в посторонней помощи в течение 1 года после выписки [13].
Около 60 % интубированных демонстрируют признаки дисфагии, около 50 % с аспирацией. У трети орально интубированных пациентов с острым респираторным дистресс-синдромом взрослых (ОРДСВ) дисфагия сохраняется после выписки, у 23 % — в течение 6 мес. Более 60 % пациентов с острой дыхательной недостаточностью (ОДН) имеют нарушения глотания после ИВЛ [33]. Для сравнения: только 30 % пациентов с инсультом имеют первичную нейрогенную дисфагию [28].
Когнитивный дефицит отмечен у 30–80 % пациентов и сохраняется до 1 года, при этом может не регрессировать до преморбидного уровня [15]. Не менее 10–50 % пациентов испытывают симптомы депрессии и тревожности, нарушения сна с многолетним персистированием [29].
Для ПИТС не предусмотрен отдельный код МКБ-10. Для описания клинически значимых его проявлений могут применяться следующие коды:
T98.1. Последствия других и неуточненных воздействий внешних причин
R13. Дисфагия
F05.8. Другой делирий
G47.2. Нарушения цикличности сна и бодрствования
G62.8. Другие уточненные полинейропатии
G72.8. Другие уточненные миопатии
G97.8. Другие нарушения нервной системы после медицинских процедур
Есть мнение, что диагноз ПИТС целесообразно представлять с позиций Международной классификации функционирования, ограничений жизнедеятельности и здоровья. В настоящее время ведется активный поиск адекватных комбинаций кодов, что открывает перспективы персонализированной оценки динамики состояния в ходе этапной реабилитации [16].
Несмотря на нарастающий поток качественных публикаций, на сегодняшний день нет международной клинической классификации ПИТС, кроме единичных публикаций [30]. Для практического использования приемлемым вариантом следует признать выработанный консенсусом специалистов Союза реабилитологов России (СРР) и Федерации анестезиологов и реаниматологов (ФАР) подход к оценке наличия ПИТС с применением клиниметрических шкал, позволяющих выделить основные модальности симптомов и оценить их эволюцию в ходе лечения (см. далее).
Клиническая картина ПИТС определяется выраженностью отдельных его компонентов, детализируемых членами МДРК. Для реаниматолога актуальна общая картина, мотивирующая на расширение реабилитационного процесса и принятие решение по дальнейшей маршрутизации пациента. Характерную клиническую картину ПМНКС можно наблюдать у пациента после сепсиса на 3–4-й неделе продленной ИВЛ. Объем мышечной массы и сила мышц снижены, пациент не может приподнять руки и ноги или же делает это с большим усилием. Парезы симметричные, могут преобладать как в проксимальных, так и в дистальных сегментах конечностей. Отмечается патологическое сгибание (эквинус) стоп. Редко наблюдаются парезы глазодвигательных, мимических мышц и мышц бульбарной группы. Мышечный тонус и сухожильные рефлексы симметрично снижены либо отсутствуют. В дистальных сегментах конечностей определяются снижение болевой, температурной и вибрационной чувствительности. Кожа пациента, как правило, сухая, шелушащаяся; дериваты кожи с признаками трофических нарушений. Вышеперечисленные симптомы указывают на сочетание двух синдромов: симметричного периферического тетрапареза и нервно-мышечной дыхательной недостаточности. При отключении от аппарата ИВЛ спонтанное дыхание представлено одышкой с малыми дыхательными объемами, при этом пациент проявляет выраженное беспокойство. При санации трахеобронхиального дерева обращает на себя внимание сниженный кашлевой толчок как проявление сниженной силы дыхательной мускулатуры. По этой же причине в сочетании с нарушением 1–2-й фазы глотания перевод на питание per os и деканюляция откладываются. Отмечается дезориентированность в текущем состоянии, месте, времени, часто имеет место ретроградная амнезия. Пациент с трудом и неохотно общается, крайне медленно и мало эмоционально реагирует на общение. Отмечается плохой сон и сниженный аппетит. При попытке вертикализации даже на небольших углах подъема развивается ОСН.
Клинически ПИТС напоминает ХКС [16], но эти два состояния принципиально различаются: ХКС представляет собой продленную полиорганную недостаточность со сменяющимся преобладающим синдромом недостаточности жизненных функций, а ПИТС — это совокупность симптомов, развивающихся после купирования неотложного состояния, но затрудняющих восстановление пациента до преморбидного уровня.
Рекомендация 1. Пациентам любого возраста, находящимся в ОАРИТ более 48 ч, рекомендуется проводить оценку признаков ПИТС каждые 24 ч всеми членами МДРК на основании клинического осмотра с использованием балльных шкал (Приложения 2–14) (УДД — 4, УУР — С) [37–40].
Комментарий. При интерпретации результатов осмотра в пользу диагноза ПИТС следует относить симптомы, не связанные с основным заболеванием. Например, признаки ПМНКС, дисфагии, депрессии, когнитивных нарушений, диссомнии у пациента, перенесшего неотложное состояние, не связанное с поражением ЦНС, трактуются как проявления ПИТС. Критерии диагностики ПИТС сформулированы в национальном руководстве по интенсивной терапии [41–43]. Анализ использования разнообразных клиниметрических шкал для диагностики и оценки динамики ПИТС специалистами МДРК в 26 неотложных госпиталях Великобритании в период пандемии подтвердил их неспецифичность в отношении формы неотложного состояния и чувствительность при оценке динамики статуса в рамках краткосрочной госпитализации в ОАРИТ [30]. Это дает основание считать возможным масштабирование методических подходов к ПИТС, описанных в национальном руководстве, несмотря на то что все они не прошли полноценную процедуру валидизации [42]. В табл. 3 приведен полный перечень клиниметрических шкал, нормативы значений и специальности членов МДРК, ответственных за контроль и интерпретацию данных по соответствующей шкале. Общее правило диагностики ПИТС: отклонение от нормальных значений клиниметрик не должны быть связаны с основным заболеванием, послужившим поводом для госпитализации в ОАРИТ.
Таблица 3. Свод клиниметрических шкал и распределение в соответствии с компетенциями специалистов МДРК
Table 3. A set of wedge and metric scales and distribution in accordance with the competencies of MDRT specialists
| № | Модальность симптомов | Вид | Клинические метрики* | Норматив значений | Ответственный специалист МДРК |
|---|---|---|---|---|---|
| 1 | Инфекционно-трофические осложнения | Пролежни | Клинические и лабораторные данные, специфические шкалы и метрики | Отсутствие клинических и лабораторных проявлений | |
| Инфекции дыхательных путей | Врач анестезиолог-реаниматолог (АР) | ||||
| Уроинфекция | |||||
| 2 |
Вегетативно-метаболические осложнения |
Боль | ВАШ/ BPS (Приложение 2) NIPS (дети до 1 года) (Приложение 3) FLACC (дети до 3 лет) Шкала Эланда (дети от 3 до 7 лет) |
0/0 | Врач АР Врач ФРМ |
| Нарушение циркадных ритмов: диссомния | Опросник качества сна (в том числе для детей > 7 лет) | 0 | Врач ФРМ | ||
| Снижение гравитационного градиента | Тест на вертикализацию в постели (проба на полуортостаз, сидя в кровати со спущенными ногами) (в том числе для детей > 7 лет) | Врач ФРМ Специалист по ФРМ |
|||
| Снижение переносимости нагрузок | Шкала выносливости Борга (в том числе для детей > 14 лет) | < 4 | Врач ФРМ | ||
| Метаболометрия | Врач АР | ||||
| Нутритивная недостаточность | Шкала NRS (нутритивного риска) | Врач ФРМ Врач АР |
|||
|
Дефицит массы тела |
Индекс массы тела |
> 18 |
Врач АР |
||
| 3 | Нейромышечные осложнения | Полинейропатия критических состояний | Шкала MRC (Приложение 4) (в том числе для детей > 14 лет) | > 3 во всех конечностях | Врач ФРМ |
| Динамометрия (в том числе для детей > 14 лет) | муж. > 10 кг жен. > 6 кг |
Специалист по ФРМ | |||
| Респираторная нейропатия | Индекс Тобина (Приложение 5) | > 100 | Врач АР | ||
| Дисфагия ОАРИТ (бездействия) | Шкала оценки степени тяжести дисфагии | 0 | Медицинский логопед | ||
| Тест трех глотков (Приложение 6) | Положительный | Медсестра МР Медсестра ОАРИТ |
|||
| 4 | Эмоционально- когнитивные осложнения | Нарушение памяти, ориентированности | Батарея специальных тестов (FAB; MMSE, MOCA) | Клинический психолог | |
| Делирий/галлюцинации | Шкала RASS | 0; –1 | Врач АР | ||
| Тревога/депрессия | Шкала депрессии (HADS) (в том числе для детей > 14 лет) | 0 | Клинический психолог | ||
| Экспресс-оценка наличия ПИТС | |||||
| Мобильность | Индекс мобильности Ривермид (Приложение 7) (в том числе для детей > 14 лет) [143] | > 6 | Врач АР | ||
| Коммуникация | Шкала Ходкинсона (Приложение 8) [142] | > 7 | |||
* В тексте настоящих методических рекомендаций (Приложения 2–14) приведены только те клиниметрики, которые используются членами МДРК совместно с врачом анестезиологом-реаниматологом. Остальные упомянутые в таблице шкалы и методы описаны в соответствующих профильных руководствах.
Рекомендация 2. Взрослым пациентам в период пребывания в ОАРИТ рекомендуется использование невалидизированного индекса тяжести ПИТС членами МДРК для его диагностики и динамической оценки тяжести (Приложение 9) (УУД — 5, УУР — С) [44].
Комментарий. Расчет ПИТС индекса производится на основании суммирования ранжированных симптомов, установленных членами МДРК по своему профилю. Сумма баллов в диапазоне от 0 до 10 отражает как факт наличия ПИТС, так и степень тяжести и эффективность реабилитационных мероприятий.
Рекомендация 3. При переводе взрослых пациентов из ОАРИТ рекомендуется проводить оценку состояния с использованием экспресс ПИТС-индекса (Приложение 10) для определения тяжести ПИТС (УУД — 5, УУР — С).
Комментарий. Экспресс-оценка ПИТС — это минимально достаточный набор клиниметрических шкал, достаточный для скрининга ПИТС врачом анестезиологом-реаниматологом при отсутствии в лечебно-профилактическом учреждении (ЛПУ) лицензированного ОРР или иной формы организации работы МДРК. Экспресс-оценка производится при первичном осмотре пациента с учетом информации о преморбидном статусе и при переводе пациента из ОАРИТ. Оценка положительная, если пациент не соответствует нормативному показателю хотя бы по одному показателю мобильности или/и коммуникации, и это не связано с перенесенным неотложным состоянием.
Рекомендация 4. Пациентам всех возрастов для диагностики ПНМКС в условиях ОАРИТ рекомендуется использовать следующие критерии:
Комментарий. Полимионейропатия критических состояний — наиболее частое и тяжелое проявление ПИТС, что наглядно демонстрирует опыт COVID-19 [19], поэтому его диагностика должна быть понятной и воспроизводимой не только для МДРК, но и врача анестезиолога-реаниматолога [42].
Рекомендация 5. Взрослым пациентам на ИВЛ рекомендуется использовать определение индекса поверхностного учащенного дыхания (индекс Тобина) для диагностики респираторной полимионейропатии (УУД — 3, УУР — В) [27, 32].
Комментарий. Индекс Тобина (Приложение 5) — индекс частого и поверхностного дыхания (rapid shallow breathing index, RSBI). Индекс Тобина продемонстрировал эффективность при определении недостаточности дыхательной мускулатуры у пациента при попытке перевода на спонтанное дыхание после ИВЛ [1]. Индекс Тобина имеет несколько преимуществ: высокая чувствительность (0,97) и специфичность (0,64); легко поддается определению; не зависит от усилий и сотрудничества пациента; обладает высокой прогностической ценностью [27, 28]. Установление высокого RSBI при нормальных значениях других показателей механики легких является признаком слабости дыхательных мышц, т. е. респираторной полимионейропатии [33].
Для профилактики ПИТС Союзом реабилитологов России совместно с Федерацией анестезиологов и реаниматологов России разработан реабилитационный комплекс РеабИТ [41, 42]. Цель РеабИТ: сохранение преморбидного статуса социализированности пациента посредством профилактики ПИТС, обусловленного иммобилизацией, когнитивными и социально-бытовыми ограничениями как неизбежным сопутствующим эффектом использования методов интенсивной терапии и реанимации, необходимых для лечения неотложного состояния и спасения пациента. В англоязычной литературе такой комплекс называется “Awakening and Breathing Coordination, Delirium monitoring/management, and Early exercise/mobility” (ABCDEF bundle) [37].
Первый массовый опыт применения реабилитационных технологий в ОАРИТ был получен в период COVID-19, когда в крупных реанимационных центрах были организованы бригады ранней реабилитации. Результаты применения РеабИТ свидетельствуют о снижении потребности в последующих этапах реабилитации и повышении качества жизни выживших [30, 40].
Рекомендация 6. Пациентам любого возраста, получающим помощь в условиях ОАРИТ более 48 ч, рекомендуется осуществлять профилактику ПИТС, вне зависимости от нозологии заболевания, вида оперативного вмешательства, тяжести состояния и респираторного статуса (УУД — 2, УУР — А) [35, 38, 46].
Комментарий. Основными синдромами, формирующими картину ПИТС, являются [19, 21, 29, 50, 54]:
По данным зарубежных многоцентровых исследований [44, 46], объединение признаков ПИТС в технологические лечебно-диагностические модули «позиционирование и мобилизация», «профилактика дисфагии и нутритивного дефицита», «профилактика эмоционально-когнитивных нарушений и делирия», «профилактика утраты навыков самообслуживания» способно обеспечить диагностический скрининг и полный спектр реабилитационной помощи пациентам ОАРИТ. Алгоритм взаимодействия АР и МДРК приведен в Приложении 1.
Рекомендация 7. Всем пациентам ОАРИТ рекомендуется ежедневно проводить индивидуальную программу реабилитации продолжительностью не менее 1 ч, но не более 3 ч с учетом статуса сознания и уровня мобильности с акцентом на респираторный статус для профилактики ПИТС (УУД — 3, УУР — В) [35, 36, 39, 40].
Комментарий. В зависимости от возможности участия пациента в реабилитационных мероприятиях (тяжесть состояния, уровень сознания) реабилитация проводится в активном, пассивном и активно-пассивном режиме. Программа реабилитации [35] должна включать комбинацию методик кинезиологических маневров (позиционирования, вертикализации и мобильности, велокинетические нагрузки и электронейромиостимуляцию), а также практики клинических психологов, эрготерапевтов и медицинских логопедов [37]. Удельный вес хронометража кинезиотерапии должен быть не менее 50 % [39]. Номенклатура основных и адъювантных кинезиотерапевтических практик приведена в Приложении 11.
Рекомендация 8. Пациентам, пребывавшим в ОАРИТ менее 48 ч, включая тех, кто перенес интубацию, ИВЛ и неосложненное кардиохирургическое вмешательство, не рекомендуется ежедневная реабилитация (УУД — 3, УУР — В) [46].
Рекомендация 9. Пациентам ОАРИТ всех возрастов не рекомендуется начинать реабилитационные мероприятия по мобилизации и вертикализирующему позиционированию при наличии абсолютных и без учета относительных противопоказаний, которые следует оценивать ежедневно вне зависимости от их отсутствия накануне (Приложение 12) (УУД — 3, УУР — А) [47–49].
Рекомендация 10. Пациентам ОАРИТ всех возрастов не рекомендуется проводить реабилитационные маневры по мобилизации и вертикализирующему позиционированию без надлежащего гемодинамического мониторинга из-за риска развития осложнений РеабИТ (УУД — 3, УУР — А) [47–49].
Рекомендация 11. Пациентам ОАРИТ всех возрастов рекомендуется прекратить реабилитационные маневры по мобилизации и вертикализирующему позиционированию при отклонении мониторируемых показателей от нормативных значений — развитии СТОП-сигналов (Приложение 12) с целью профилактики осложнений РеабИТ (УУД — 3, УУР — В) [47–49].
Комментарий. В список СТОП-сигналов включены признаки, обладающие максимальным уровнем воспроизводимости, полученные в результате тщательного анализа литературы и клинического опыта отделений ОАРИТ, использующих клинические рекомендаций ФАР и СРР в период пандемии новой коронавирусной инфекции (НКИ) COVID-19 [43, 44]. При оценке наличия СТОП-сигналов применяются невалидизированные специальные шкалы для оценки боли (BPS) (Приложение 4); при появлении любого одного из этих симптомов РеабИТ следует не начинать или прекратить. Если СТОП-сигналы развились в момент вертикализации, процедуру следует прекратить и вернуть пациента к предшествующей позиции (опустить на 20°) или опустить до 0° без остановок на углах подъема [65]. У детей препятствием для ранней мобилизации является седация, отличающаяся от таковой у взрослых из-за проблем безопасности и невозможности оценить боль и тревогу у маленьких детей [67]. Уровень доказательности приведенных в таблице признаков не превышает уровня С, но получение более качественных аргументов для пациентов в ОРИТ в данном контексте сложно из-за соображений неэтичности формирования контрольной группы в таких исследованиях.
Рекомендация 12. Взрослым пациентам ОАРИТ рекомендуется проводить «тест поднятых ног» (passive leg raising test) (Приложение 13) перед началом каждой сессии маневров мобилизации и вертикализирующего позиционирования для определения риска гемодинамических СТОП-сигналов при мобилизации и вертикализирующем позиционировании (УУД — 3, УУР — В) [56, 57].
Комментарий. С одной стороны, положительный «тест поднятых ног» указывает на гиповолемию, которая при маневре вертикализации приведет к развитию ОСН, что при любом неотложном состоянии крайне нежелательно. С другой стороны, эту ситуацию не следует считать окончательным противопоказанием для мобилизации. Следует оценить причины и план восстановления эуволемии, после чего, получив отрицательный результат при повторном тестировании, возобновить реализацию реабилитационного плана [56].
Рекомендация 13. Пациентам всех возрастов в первые сутки пребывания в ОАРИТ рекомендуется проводить невертикализирующее позиционирование (хендинг для детей) посредством изменения положения конечностей и туловища пациента по отношению к горизонтальной плоскости, в зависимости от статуса вертикализированности, не реже чем каждые 2 ч с перерывом на ночной сон для профилактики осложнений ЛИ (УУД — 3, УУР — В) [59, 62].
Комментарий. В отличие от мобилизации, невертикализирующее позиционирование не имеет абсолютных противопоказаний и должно использоваться с 1-х суток независимо от объема прочих модальностей ранней реабилитации дежурным медицинским персоналом [65]. Позиционирование используется для гравитационной стимуляции при подъеме головного конца, поэтому головной конец всегда должен быть приподнят не ниже 30°. Последовательное изменение положения тела пациента осуществляется на 3-секционной кровати с формированием позы в соответствии со статусом вертикализации, при этом необходимо стремиться к тому, чтобы пациент как можно больше времени проводил в состоянии полусидя или сидя (поднятый головной конец, опущенный ножной конец). Пациентам помогают последовательно принимать позы лежа (на правом и/или левом боку или на спине), на приподнятом изголовье или сидя. Следует иметь в виду, что сгибание должно быть в тазобедренных суставах, а не в грудном и поясничном отделе. При этом во избежание рефлекторного нарушения мышечного тонуса поза на спине должна всегда сохранять симметричность. Позиционирование на боку способствует лучшей дренажной функции, предупреждает застой мокроты [64]. Позиционирование на возвышенном изголовье и в положении сидя с полной поддержкой увеличивает дыхательный объем и способствует эффективному откашливанию [65]. При всех вариантах позиционирования необходимо избегать свободного свисания стоп, для чего необходимо использовать любые подставки с поверхностью для раздражения рецепторов стоп. Следует сознавать, что ни один из вариантов позиционирования не идеален — у любого положения имеются показания и противопоказания. Задача специалистов заключается в подборе оптимальных в конкретной ситуации поз и обеспечении их чередования. Это позволяет избежать осложнений и безопасно провести раннюю мобилизацию и вертикализацию пациента. В ходе позиционирования необходимо учитывать индивидуальную переносимость и наличие СТОП-сигналов (Приложение 12).
Рекомендация 14. Всем пациентам ОАРИТ любого возраста рекомендуется начать активно-пассивную мобилизацию, в том числе вертикализацию и вертикализирующее позиционирование, не ранее 24 ч, но не позже 72 ч от начала неотложного состояния (послеоперационного периода) либо непосредственно после установления факта отсутствия противопоказаний к началу или продолжению мобилизации (Приложение 3) с целью профилактики осложнений иммобилизации (УУД — 2, УУР — В) [73, 140].
Комментарий. Ранняя мобилизация — элемент реабилитационного процесса для пациентов в ОАРИТ [35, 42]. Ранняя мобилизация — процесс улучшения функциональной активности пациента, в частности, способности к поворотам в постели, возможности садиться, вставать, делать шаги в как можно более ранние сроки. Минимальная, но самостоятельная мышечная активность предупреждает развитие атрофии мышц как раннего признака иммобилизационного синдрома. Реабилитационные действия по мобилизации в ОАРИТ делятся в зависимости степени участия пациента на активные (для пациентов, способных к кооперации с членами МДРК) и пассивные (для пациентов с низким количественным и/или измененным качественным уровнем сознания).
При планировании ежедневных занятий специалисты МДРК классифицируют состояние пациента по шкале mRMI-ICU (модифицированный индекс мобильности Ривермид) (Приложение 7), с помощью которой определяется степень мобильности пациента. В совокупности с уровнем сознания создается модель пациента как основа для формирования программы мобилизации [35–44].
Рекомендация 15. Взрослым пациентам ОАРИТ рекомендуется использовать для мобилизации кинезиотерапевтические методики: активно-пассивные движения во всех суставах с растяжением, активно-пассивную велоэргометрию, переходы в сидячее положение с поддержкой, баланс сидя, переходы в кресло, баланс стоя, шаги на месте (УУД — 2, УУР — В) [38, 58, 76].
Комментарий. Мобилизация является одним из видов вмешательства в рамках реабилитации, которая облегчает передвижение пациентов и увеличивает расход энергии с целью улучшения исходов. Мобилизация оптимизирует дыхание, центральную и периферическую перфузию, мышечный метаболизм и снижает риск венозного тромбообразования в нижних конечностях.
Пассивная мобилизация для неконтактных пациентов представляет собой серию из 10 повторяющихся пассивных движений (пассивная суставная гимнастика) в каждом из основных (межфаланговые, лучезапястные, локтевые, плечевые, бедренные, коленные, голеностопные, межпястные) суставах с легчайшим растяжением (стретчингом) в крайних точках физиологического объема движений, которые производятся специалистом ФРМ не менее 2 раз в день. Также пассивная кинезиотерапия может выполняться с использованием механотренажеров (в том числе роботизированных), обеспечивающих циклические тренировки для отдельных суставов и имеющих сенсоры на определение вклада пациента при активно-пассивном режиме. Пассивно-активный велокинез с использованием прикроватного велоэргометра для нижних/верхних конечностей с возможностью реверсивного движения и созданием дозированного сопротивления может быть использован в качестве подготовительного этапа перед вертикализацией.
Активная кинезиотерапия представляет собой серию упражнений с активным участием доступного контакту пациента для поддержания и повышения двигательной активности, необходимой для вертикализации. Активная мобилизация предполагает обучение пациента и контроль за выполнением доступных самостоятельных движений во всех суставах (активная суставная гимнастика) в режиме 10 повторов 3–6 раз в день. На реализацию этой рекомендации будет влиять состояние организации проведения реабилитационных/мобилизационных мероприятий в отделениях интенсивной терапии [16].
Рекомендация 16. Взрослым пациентам ОАРИТ не рекомендуется проводить кинезиотерапевтические процедуры продолжительностью менее 30 мин в день из-за их недостаточной эффективности (УУД — 2, УУР — В) [55, 58].
Комментарий. Максимальный эффект в виде снижения длительности ИВЛ был достигнут у пациентов, которые получали не менее 30 мин ежедневных занятий, включая циклическую велоэргометрию [55]. Занятия у пациентов на ИВЛ менее 20 мин за сеанс и менее чем 2 раза в день пользы не приносят.
Рекомендация 17. Пациентам ОАРИТ всех возрастов, доступным контакту, рекомендуется включать упражнения с индивидуально подобранным нарастающим уровнем градуированных отягощений: простой подъем конечностей, подъем конечностей с утяжелителями, преодоление сопротивления эластичных жгутов для профилактики потери мышечной массы и снижения толерантности к нагрузкам (УУД — 2, УУР — В) [78].
Комментарий. По данным метаанализа [78], включение упражнений на сопротивление при условии адекватного белкового обеспечения не ниже 1,3 г/кг/сут позволяет сохранить мышечную массу в условиях вынужденной иммобилизации пациента в критическом состоянии. Без мышечной активности профилактика ПНМКС даже при достаточном белково-энергетическом балансе менее эффективна.
Рекомендация 18. Пациентам ОАРИТ всех возрастов с низким уровнем самостоятельной мобильности рекомендуется проводить процедуру пассивной вертикализации, исходя из технических возможностей, для профилактики ОСН (УУД — 2, УУР — В) [40, 59, 60].
Комментарий. Этот раздел мобилизации занимает особое место в РеабИТ, так как существенно уменьшает отрицательные эффекты постельного режима и готовит пациента к скорейшему переводу из ОАРИТ в другое отделение [61]. Подробный протокол вертикализации изложен в соответствующих клинических рекомендациях [60]. В ходе процедур производится непрерывный мультимодальный мониторинг с целью раннего выявления СТОП-сигналов (см. Приложение 12).
Рекомендация 19. Пациентам ОАРИТ всех возрастов рекомендуется ежедневно проводить маневры вертикализации с последующим вертикализирующим позиционированием, начиная от высокого изголовья (30–60°) до положения сидя с опущенными ногами и стояния около постели, с целью пошагового восстановления ГГ (УУД — 3, УУР — В) [59, 61, 62].
Комментарий. Максимальная точка подъема головного конца (верхней части тела) по отношению к горизонтальной плоскости, при которой нет ОСН, называется ГГ пациента [35]. У здорового человека он составляет 90° и соответствует положению стоя. Стояние — это лучшее положение тела для эффективного дыхания пациента и поддержания объема легких. До тех пор, пока пациент чувствует себя хорошо, пациенту следует стремиться к положению стоя и постепенно увеличивать время стояния. Чем выше ГГ и продолжительность пребывания в нем пациента, тем ниже риск аспирации, пролежней, полимионейропатии, контрактур, патологической (болевой) сенситизации и прочих факторов ПИТС.
Пациентам на спонтанном дыхании и ИВЛ в любых режимах следует стремиться к поддержанию максимально длительного вертикализирующего антигравитацию позиционирования на уровне ГГ [59], достигнутого при пассивной вертикализации. У контактных пациентов ГГ определяется по индивидуальному запросу пациента. Таких пациентов следует обучить наклонам вперед — в этом положении благодаря силе тяжести улучшается дренирование экскреции из задненижних сегментов легких.
Процедуры вертикализации следует проводить 3 раза в день по 30 мин. Продолжительность процедуры зависит от переносимости, но должна составлять не менее 15 мин. Например, возвышение кровати до 60° (нижняя граница подушки должна располагаться над лопаткой, чтобы избежать чрезмерного перенапряжения головы и шеи, подушка должна располагаться над подколенной ямкой, чтобы расслабить живот и нижние конечности). В любой позиции голова должна быть в положении по средней линии для предотвращения затруднения венозного оттока, вторичного повышения внутричерепного и внутриглазного давления, а также нарастания патологического мышечного тонуса в паретичных конечностях [65]. У детей младшего возраста (0–6 лет) вертикализация начинается от 0–10°до уровня вертикализации, соответствующего возрасту пациента, и осуществляется на руках у родителя или опекуна при помощи приемов хендинга [68].
Рекомендация 20. Взрослым пациентам на ИВЛ рекомендуется использовать методики избирательной респираторной тренировки основных и вспомогательных мышц вдоха, в том числе специальные статические и динамические дыхательные упражнения, включая применение маневров мануальной или аппаратной (VEST) перкуссионной терапии, для профилактики респираторной полимионейропатии (УУД — 2, УУР — В) [65, 65].
Комментарий. Процедуры, направленные на снижение одышки, улучшение трахеобронхиального клиренса, тренировку скелетных мышц и поддержание уровня самообслуживания, показаны в период перевода пациента на самостоятельное дыхание или непосредственно после него, можно использовать выдох с применением положительного давления. Для этого целесообразно применение тренажеров стимулирующей спирометрии (типа Akapella, Сoach), устройств с высокочастотными интра-/экстрапульмональными колебаниями (например, TheVest, MetaNeb, Percussionaire), электростимуляции диафрагмы и межреберных мышц [44, 65, 73]. Для восстановления голосового дыхания и возможности вербальной коммуникации эффективно использование голосового клапана, который создает полезное сопротивление выдоху и способствует улучшению эмоционального статуса пациента [106–108]. Все эти маневры ограничены у пациентов с новой коронавирусной инфекцией из-за риска инфицирования персонала [40].
Рекомендация 21. Взрослым пациентам после кардиохирургических вмешательств рекомендуется проводить дыхательные упражнения, в частности СРАР-терапию и активные упражнения по диафрагмальному (глубокому дыханию), для профилактики гиповентиляции (УУД — 2, УУР — В) [69, 70].
Комментарий. По данным немногочисленных исследований, известно, что рутинные дыхательные упражнения не показали эффективности после неосложненной операции аортокоронарного шунтирования [71]. Однако установлено, что пациенты, выполнявшие упражнения на глубокое дыхание после операции, имели значительно меньшие ателектатические области и лучшую функцию легких на 4-й послеоперационный день по сравнению с контрольной группой, не выполнявшей упражнений [72]. Значительно повышенная оксигенация была обнаружена у пациентов, выполнявших 30 глубоких вдохов в первые два послеоперационных дня, по сравнению с контрольными пациентами, выполнявшими 10 глубоких вдохов в час [73].
Рекомендация 22. Взрослым пациентам на ИВЛ рекомендуется ежедневно проводить циклы спонтанного дыхания в период остановки седации в сочетании с маневрами вертикализации, дополненными активными упражнениями для верхних конечностей, для профилактики респираторной нейропатии (УУД — 3, УУР — В) [74–76].
Комментарий. Проблемы с отлучением от ИВЛ связаны с неспособностью дыхательных мышц возобновить вентиляцию легких [64]. Действительно, высокие показатели эффективности дыхательной мускулатуры (соотношение нагрузки и мышечной емкости (PI/PI max)) являются основной причиной зависимости от ИВЛ и предсказывают исход успешного отлучения. Этому способствуют: недостаточная вентиляция легких, слабость дыхательных мышц, утомляемость дыхательных мышц, повышенная работа дыхания или сердечная недостаточность [62, 63]. Дисфункция дыхательной мускулатуры в когорте механически вентилируемых пациентов наблюдается у 80 % пациентов ОАРИТ, что свидетельствует о снижении трансдиафрагмального давления примерно на 2–4 % в сутки в первые недели пребывания в ОАРИТ [73]. Это наблюдение подтверждает идею о том, что хорошо сбалансированная периодическая нагрузка дыхательных мышц в процессе механической вентиляции может быть полезной для предотвращения их атрофии. Действительно, было показано, что такие способы индуцирования (прерывистой) нагрузки дыхательных мышц, как спонтанное дыхание и ранняя мобилизация, увеличивают мышечную силу. У пациентов, недавно отлученных от искусственной вентиляции легких, добавление упражнений для верхних конечностей усиливало влияние общей мобилизации на показатели выносливости при физической нагрузке и одышку [77].
Рекомендация 23. Взрослым пациентам, длительно находящимся в ОАРИТ, в том числе в условиях искусственной вентиляции легких, рекомендуется использование электростимуляции мышц для профилактики ближайших и долгосрочных осложнений ПИТС (УУД — 2, УУР — В) [79].
Комментарий. Электростимуляция мышц (ЭСМ) была исследована в качестве лечения для профилактики ПМНКС. Она включает в себя размещение чрескожных электродов на коже, которые активируют нижележащие нервы для создания изометрического сокращения мышц. Лечение включает минимальное движение суставов и не требует взаимодействия с пациентом. Лечение с помощью ЭСМ, проводимое в ходе исследований, длилось 30–60 мин ежедневно в течение не менее 4 дней. Три систематических обзора (включавших 8 рандомизированных исследований) показали, что ЭСМ может быть эффективным вмешательством для пациентов в критическом состоянии и способствовать поддержанию мышечной массы в условиях интенсивной терапии, особенно у пациентов, длительно пребывающих в отделении интенсивной терапии в условиях ИВЛ [79, 80]. В метаанализе были проанализированы шесть рандомизированных клинических исследований, включавших 718 пациентов. Достоверной разницы между ЭСМ и обычным лечением по глобальной мышечной силе, летальности или продолжительности пребывания в отделении интенсивной терапии по сравнению со стандартной реабилитацией у тяжелобольных пациентов выявлено не было. В противоположность этому результаты другого метаанализа [81] с включением 11 рандомизированных контролируемых исследований с участием 576 пациентов, показали, что раннее использование ЭСМ у пациентов в отделении интенсивной терапии позволило сократить время искусственной вентиляции легких, продолжительность пребывания в отделении интенсивной терапии и общий койко-день в клинике. В последующем это может положительно повлиять на качество жизни пациента за счет улучшения способности пациентов выполнять повседневную деятельность. Однако нет никаких доказательств того, что ЭСМ может улучшить функциональное состояние пациентов ОАРИТ во время госпитализации, способствовать раннему пробуждению после наркоза или снизить летальность (р > 0,05).
Рекомендация 24. Взрослым пациентам ОАРИТ с признаками ПИТС рекомендуется медикаментозная модуляция посредством применения инозина + никотинамида + рибофлавина + янтарной кислоты с целью повышения эффективности мобилизации [82] (УУД — 3, УУР — В).
Комментарий. В единственном исследовании, посвященном влиянию лекарственного воздействия на эффективность лечения ПИТС, показано, что в сочетании с базовыми кинезиотерапевтическими практиками инфузионное введение лекарственного комплекса «Цитофлавин» не влияет скорость восстановления ГГ при вертикализации, но, по данным метаболографии, приводит к увеличению потребления кислорода. Авторы сделали вывод о том, что применение препаратов с компонентами энерготропного действия может оказывать положительное модулирующее действие на повышение переносимости реабилитационных мероприятий по профилактике ПИТС у разных категорий пациентов ОАРИТ [82].
Рекомендация 25. Взрослым пациентам ОАРИТ рекомендуется проведение оценки нутритивного статуса с применением шкалы NRS 2002 как обязательного элемента планирования индивидуальной программы ранней реабилитации (УУД — 1, УУР — А) [89].
Комментарий. Оценка нутритивного статуса является обязательным элементом оценки состояния пациента ОАРИТ с момента госпитализации. Данные анамнеза, клинического осмотра и лабораторных показателей, объединенные в шкале NRS 2002 (Nutrition Risk Screening) [90], позволяют получить картину нутритивного дефицита для дальнейшего планирования нутритивной поддержки в рамках действующих рекомендаций СРР [94].
Рекомендация 26. Всем взрослым пациентам ОАРИТ рекомендуется использовать данные непрямой калориметрии, проводимой в покое и во время реабилитационных маневров, при наличии технической возможности для формирования индивидуальной программы нутритивной поддержки (УУД — 3, УУР — В) [89].
Комментарий. Известно, что мышцы содержат самый большой пул белка в организме. Критическое заболевание связано с выраженным протеолизом и потерей мышечной массы (до 1 кг в день), что связано с приобретенной в ОАРИТ слабостью [95]. Это обстоятельство нашло отражение в рекомендации по составлению нутриционной программы с использованием простой номограммы: Энергетическая потребность = Масса тела × 20–25 ккал/кг/сут, при этом потребность в белке составляет 1,3 г/кг [89]. Такой подход не учитывает индивидуальные особенности пациента и тем более потребность в метаболическом обеспечении реабилитационного процесса, особенно маневров мобилизации. Достаточное количество работ показало, что пациенты с низким индексом массы тела и недостаточным белково-энергетическим обеспечением имеют очень низкую толерантность даже к процедурам пассивной мобилизации [96]. Между тем показано, что активная кинезиотерапия и прикроватная велоэргометрия повышают потребность в энергии, что должно учитываться при планировании состава и регламента проведения нутритивной поддержки [97]. C учетом данных обстоятельств наиболее оптимальным методом оценки индивидуальной потребности в уровне калоража является непрямая калориметрия с применением метаболографа. Использование метаболографии [89, 99] позволяет повысить безопасность реабилитации, так как критическое изменение концентрации углекислоты в выдыхаемом воздухе наступает раньше, чем срабатывают гемодинамические СТОП-сигналы [98].
Рекомендация 27. Взрослым пациентам с высоким риском развития пролежней рекомендуется обеспечить нутритивную поддержку с калорийностью 30–35 ккал/кг массы тела/день и содержанием белка 1,5 г/кг массы тела/день (УУД — 3, УУР — В) [91, 92].
Комментарий. Поддержание достаточного уровня восполнения белка при его потере и/или утилизации, а также рациональный подсчет энергетических затрат организма и их коррекция снижают риск возникновения пролежней у взрослых и способствуют ускорению реабилитации у пациентов, которые уже имеют пролежни.
Рекомендация 28. Взрослым пациентам, начиная с первых суток пребывания в ОРИТ, рекомендуется применять прогрессивное увеличение суточного содержания белка и калорий в энтеральных смесях до расчетно-целевых значений с целью предупреждения перекармливания (УУД — 3, УУР — В) [89, 93].
Комментарий. Ступенчатая нутритивная поддержка является достаточной для коррекции баланса макро- и микронутриентов и восполнения энергетических затрат у пациентов реанимационного профиля. Избыточное кормление (восполнение энергетических затрат организма в объеме ≥ 110 % от целевого) способно привести к увеличению концентрации глюкозы в плазме крови, что может повлечь за собой дополнительную потребность в назначении пациентам инсулина. Перекармливание ассоциируется с ростом рисков инфекционных осложнений и летальностью.
Рекомендация 29. Взрослым пациентам ОАРИТ c временным трахеопищеводным разобщением (эндотрахеальная интубация в сочетании с назогастральным зондом) продолжительностью более 48 ч рекомендуется непосредственно после экстубации проводить скрининг постэкстубационной дисфагии с применением теста трех глотков (Приложение 6) для оценки риска аспирации и планирования способа нутритивной поддержки (УУД — 3, УУР — В) [100, 101].
Рекомендация 30. Взрослым пациентам ОАРИТ в первые 48 ч после деканюляции трахеи рекомендуется использовать для питья специально загущенную жидкость с уровнем вязкости киселя для профилактики аспирационных осложнений (УУД — 5, УУР — С) [100, 104].
Комментарий. Частота постэкстубационной дисфагии у пациентов ОАРИТ составляет 18,3 % до выписки из ОАРИТ, из которых до 80 % сохраняют признаки дисфагии при выписке из стационара [105]. При этом у 36 % отмечена «тихая» аспирация. При наличии постэкстубационной дисфагии следует проводить мероприятия по восстановлению глотания под контролем логопеда МДРК [35, 107]. В отдельных случаях показан индивидуальный подбор текстуры пищи с использованием специальных тестов [107, 109]. В случае отсутствия такой возможности следует использовать загущенные жидкости, что снижает аспирационный риск [103].
Рекомендация 31. Пациентам всех возрастов с трахеопищеводным разобщением в связи с эндотрахеальной интубацией или трахеостомой рекомендуется ежедневно проводить глотательные маневры, а также комбинированную вкусовую и термальную стимуляцию для восстановления нормального глотания и профилактики постэкстубационной дисфагии (УУД — 4, УУР — С) [100, 105].
Комментарий. Логопедический комплекс ведения пациентов с трахеопищеводным разобщением в связи с эндотрахеальной интубацией или трахеостомой, особенно на ИВЛ, имеет свои особенности, которые пока не оформлены в специальный протокол. Тем не менее логопедическая практика у пациентов ОАРИТ показывает, что дифференцированный логопедический массаж, пассивная и активная артикуляционная гимнастика, тренировочное глотание, стимуляция чувствительности слизистых оболочек полости рта, поддержка вкусовых ощущений и гигиена ротовой полости позволяют предотвратить развитие дисфагии и распространения бактерицидной флоры в нижние дыхательные пути [24, 107]. Эффективная профилактика дисфагии, в свою очередь, минимизирует риски осложнений длительного назогастрального питания (назофарингит, синусит, стриктура, пролежни) и облегчает нормализацию нутритивного статуса [109].
Рекомендация 32. Взрослым пациентам ОАРИТ рекомендуется проведение многокомпонентного нефармакологического вмешательства, включающего мобилизацию, оптимизацию анальгоседации, нормализацию сна, поддержание когнитивного статуса и уровня бытовой адаптации для снижения риска делирия (УУД — 3, УУР — В) [35, 84, 88].
Комментарий. На сегодняшний день не существует обоснованных с позиций доказательной медицины методов фармакологической [113] и комбинированной профилактики делирия в ОАРИТ, так как ни одна стратегия не привела к снижению частоты делирия [112]. Тем не менее сложилось мнение о том, что многокомпонентные вмешательства, осуществляемые МДРК ОАРИТ, способны минимизировать риски когнитивных нарушений и делирия [114–116].
Основу профилактики делирия и прочих эмоционально-когнитивных нарушений составляет выполнение основных требований рекомендательных протоколов анальгоседации как основного приоритета в профилактике ПИТС [86]. Действующие рекомендации ФАР [87] предписывают регулярный скрининг болевого статуса пациента вне зависимости от уровня сознания и его сбалансированный медикаментозный контроль.
Комбинированные физические упражнения и когнитивные тренировки позитивно влияют на пролиферацию нейронов, снижение фактора некроза опухоли α (TNF-α), интерлейкина (IL)-1, -6, -8 и С-реактивного белка [82]. Эти изменения, в свою очередь, способствуют нормализации структуры мозга (увеличение лобной и височной плотности серого вещества) и нейронной активации, а также снижению астроцитарной и микроглиальной активности [снижение S-100β и глиального фибриллярного кислого белка (GFAP)], что клинически проявится снижением риска развития делирия и минимизирует отдаленные эмоционально-когнитивные нарушения [88].
Многокомпонентная реабилитационная программа профилактики содержит простые комплексы движений конечностями, циклы спонтанного дыхания, поддержание у пациента актуального уровня ориентированности в месте и времени (чему в немалой степени способствует разрешение использования слуховых аппаратов, очков, наручных часов, съемных зубных протезов) [114, 115], меры по обеспечению ночного сна, выполнение элементарных действий по самообслуживанию [35, 110].
Рекомендация 33. Детям, находящимся в ОАРИТ, рекомендуется обеспечение совместного пребывания в отделении с родителем или опекуном при условии соблюдения последними правил поведения в ОАРИТ для профилактики эмоционально-когнитивных нарушений и делирия (УУД — 3, УУР — В) [117, 134].
Рекомендация 34. Всем пациентам ОАРИТ любого возраста рекомендуется ежедневно проводить оценку выраженности болевого синдрома вне зависимости от уровня сознания и, в случае его наличия, проводить соответствующее лечение для профилактики когнитивно-афферентного диссонанса (УУД — 3, УУР — В) [85, 121].
Комментарий. На боль в покое влияют как психологические (например, тревога, депрессия), так и демографические факторы (например, молодой возраст, одно или несколько сопутствующих заболеваний, операции в анамнезе).
На боль во время процедуры влияют интенсивность боли до процедуры, тип процедуры, основные хирургические или травматические диагнозы и демографические факторы (младший возраст, женский пол). Шкалы самооценки боли: самостоятельная оценка боли пациентом является эталонным стандартом для оценки боли у пациентов, которые могут адекватно общаться. Среди взрослых больных в критическом состоянии, которые могут самостоятельно сказать о боли, оценка по числовой шкале от 0 до 10, осуществляемая устно или визуально, является наиболее воспроизводимой в практике шкалой оценки интенсивности боли. Шкала болевого поведения (BPS) (Приложение 2) — наиболее достоверная шкала для мониторинга боли в послеоперационном, общем и травматологическом ОАРИТ для малоконтактных пациентов с контролируемыми поведенческими реакциями и двигательными функциями, неспособных самостоятельно сообщать о боли.
Физиологические показатели: жизненно важные показатели (т. е. частота сердечных сокращений, артериальное давление, частота дыхания, насыщение кислородом и EtCO2) не являются достоверными показателями боли у взрослых в критическом состоянии и должны использоваться только в качестве подсказок для начала дальнейшей оценки с использованием соответствующих и проверенных методов. Когда это уместно и когда пациент не может самостоятельно сообщить о своих ощущениях, семья может быть вовлечена в процесс оценки боли близкого человека [124]. В детском ОАРИТ самые простые шкалы оценки боли применяются с 3-летнего возраста (Приложение 3). В более раннем возрасте значимыми являются плач, выражение лица, расположение и характер движения конечностей. Вовлечение в оценку боли родителей или законных представителей детей, как правило, приводит к гипердиагностике в оценке боли [123].
Рекомендация 35. Всем пациентам ОАРИТ любого возраста в ночное время рекомендуется надевать глазные маски и беруши индивидуального применения в сочетании с профилактическим использованием медикаментов для сохранения циркадных ритмов и профилактики делирия (УУД — 1, УУР — А) [118, 119, 121].
Комментарий. Режим пребывания в ОАРИТ, постоянный свет, разговор персонала, тревоги мониторов, звуки респираторов — все эти раздражители неизбежно влияют на качество сна [124]. Между тем обеспечение сна в период пребывания в ОАРИТ является способом снижения риска когнитивных нарушений, в том числе психомоторного возбуждения и делирия. Помимо этого, сохранение структуры сна позволяет поддержать позитивное эмоциональное состояние пациента, его мотивированность в участии в лечебно-реабилитационной программе, а также повышает толерантность к мышечной активности [110].
Объединенный анализ исследований продемонстрировал общее снижение распространенности делирия по протоколу, способствующему сну [124]. Во всех исследованиях протоколы применялись ко всем пациентам ОАРИТ. Обязательным компонентом протоколов является создание оптимальной среды пребывания пациента для обеспечения нормального сна (естественные маркеры для сна — окно или регулировка свет/темнота, отказ от ночных процедур, регулярные перерывы в уходе на 60–90 мин). Для восстановления фазности ночного сна возможно применение снотворных средств небензодиазепиновой структуры. Для профилактики нарушений циркадности возможно рассмотреть применение мелатонинсодержащих препаратов [120]. Несмотря на отсутствие статистически доказанных утвержденных рекомендаций по фармакотерапии нарушений сна у пациентов ОАРИТ возможно представить перечень мероприятий по обеспечению гигиены сна пациента ОАРИТ, который продемонстрировал эмпирическую эффективность [29, 35].
Дневные маневры:
Ночные маневры:
Из всего перечисленного наиболее доказанными средством противодействия неблагоприятному воздействия обстановки ОАРИТ оказалось использование глазной маски и берушей.
Рекомендация 36. Взрослым пациентам ОАРИТ, в том числе и находящимся на ИВЛ, рекомендуется включение музыки как элемента мультисенсорного воздействия в программе профилактики когнитивно-афферентного диссонанса (УУД — 3, УУР — В) [47, 52].
Комментарий. Применение музыкотерапии не требует привлечения специалиста по музыкотерапии. Достаточно использования музыкальных фрагментов любимых, по информации родственников, пациентом произведений или популярных классических или эстрадных фрагментов. Музыка способствует снижению потребности в анальгетиках [53], снижает уровень тревожности и повышает приверженность к реабилитационному лечению.
Рекомендация 37. Пациентам ОАРИТ всех возрастов рекомендуется обеспечивать регламент дефекации, основываясь на сведениях из анамнеза, с целью профилактики нарушений циркадных ритмов и дополнительного эмоционального дискомфорта, обусловленного негативными проприоцептивными ощущениями при запоре (УУД — 3, УУР — В) [111].
Комментарий. Иммобилизация в горизонтальном положении в сочетании с недостаточным (нутритивный дефицит) или непривычным (зондовая доставка) способом питания являются ключевыми причинами нарушения функциональных привычек кишечника, включая стереотип и ритуальность дефекации. Недооценка этой темы в общении с пациентом и формальность регламента опорожнения кишечника в условиях ОАРИТ (1 раз в 2 сут) диссимулирует наличие проблемы, но не снижает ее вклад в развитие ПИТС. Учитывая, что преморбидный ритуал дефекации установить не всегда возможно, целесообразно для профилактики запора считать нормой ежедневную дефекацию, если нет особых указаний (абдоминальная хирургия, неотложные гастроэнтерологические состояния). Для этого следует установить рутинный контроль среднего персонала и выполнять плановые назначения слабительных в виде суппозиториев, обеспечивающих дополнительное раздражение ануса как элемент модуляции дефекации.
Рекомендация 38. Всем пациентам при длительном пребывании в ОАРИТ рекомендуется проводить занятия по восстановлению навыков самообслуживания в соответствии с возрастом и когнитивным статусом для профилактики бытовой дезадаптации (УУД — 3, УУР — В) [126, 127, 135].
Комментарий. Отдельным разделом эмоционально-когнитивной реабилитации является эрготерапия. В условиях ОАРИТ эрготерапевт обучает пациента простым повседневным бытовым действиям, обеспечивающим уход за своим телом (персональная гигиена, одевание, еда, пользование судном, альтернативная и дополнительная коммуникация). Значение эрготерапии в структуре РеабИТ состоит в том, что она способствует ускорению восстановления преморбидного паттерна жизнедеятельности (performance patterns) пациента, т. е. возврату к привычкам, режиму жизни, социальному статусу.
Включение эрготерапии в реабилитационный комплекс позволяет сократить длительность пребывания в ОАРИТ [127, 135], у пациентов на ХКС — время адаптации к спонтанному дыханию [124], предупредить развитие делирия [135]. В практике ОАРИТ элементы эрготерапии включены в обязанности среднего и младшего персонала, но в перспективе развития РеабИТ для данного раздела работы потребуется квалифицированный специалист.
Рекомендация 39. Взрослым пациентам с ПИТС рекомендуется использовать ШРМ (Приложение 14) для обеспечения этапности реабилитационного лечения (УУД — 2, УУР — А) [38].
Рекомендация 40. Всех пациентов с признаками ПИТС и/или с ХКС, соответствующим 5–6 баллам оценки по ШРМ, рекомендуется маршрутизировать в отделения медицинской реабилитации (ОМР) или реабилитационные центры (3–4-й уровень) с ОАРИТ для оказания реабилитационной помощи, используя телемедицинское консультирование (УУД — 3, УУР — С) [128].
Комментарий. Для пациентов, чей статус независимости в повседневной жизни к концу пребывания в ОАРИТ и профильном отделении не достиг уровня домашнего пребывания (ШРМ 4–6 баллов), предусмотрено направление в ОМР [128] по месту жительства. Пациентам с регрессирующим ПИТС, не требующим пребывания в ОМР (ШРМ 1–3 балла), предоставляется лечение в условиях дневного реабилитационного стационара или с применением телемедицинских программ. Объем реабилитационной программы и частоты ее предоставления определяется реабилитационным потенциалом пациента и условиями государственных гарантий системы обязательного медицинского страхования, установленными в регионе его проживания. Пациенты, оказавшиеся в состоянии хронического нарушения сознания (ареактивное бодрствование, «малое сознание») после 28 сут пребывания в ОАРИТ, направляются в соответствующие экспертные центры 3–4-го уровня для оценки реабилитационного потенциала и специфической реабилитации.
Критерии для перевода в специализированный реабилитационный центр с отделением реанимации для проведения мероприятий по медицинской реабилитации 2-го этапа пациентам с ПИТС и/или находящимся в ХКС:
При отсутствии регионального центра реабилитации для организации телеконсультирования следует подать заявку на проведение телеконсультации на сайт ФГБУ «Всероссийский центр медицины катастроф «Защита» Минздрава России по установленному образцу. Запрашивая тип консультации, следует указать «хроническое нарушение сознания. ШРМ 6». В назначенный день после телеконсилиума со специалистами одного из аккредитованных центров реабилитации должно быть сформировано заключение о направлении пациента на 2-й этап реабилитации или в паллиативное отделение по месту жительства. Для маршрутизации детей младшего возраста следует привлекать психолога и социального работника [129].
Рекомендация 41. В программе подготовки пациентов или родителей (опекунов) детей к оперативному лечению рекомендуется предусмотреть индивидуальное обучение приемам послеоперационной психологической и физической профилактики ПИТС (УУД — 4, УУР — С) [130, 131, 133].
Комментарий. Важное значение для организации послеоперационного ухода имеют анамнестические сведения о регламенте мочеиспускании и дефекации (частота и потребность в стимуляции), а также сомнологических привычках (сонный ритуал, длительность комфортного сна) пациента. Внимания заслуживают судорожные и прочие пароксизмальные события, постоянный прием гипотензивных, антидепрессивных, снотворных препаратов, отмена которых может провоцировать развитие нежелательных явлений. В качестве резюме полезна общая оценка уровня независимости пациента в повседневной жизни по шкале ШРМ. Результаты первичного мультидисциплинарного осмотра следует документировать в медицинских документах для последующей объективной оценки динамики и, в некоторой степени, правовой защиты в случае претензий со стороны пациента или опекунов по причине неудовлетворенности результатами лечения.
Подготовка к планируемой операции состоит в создании психологического настроя пациента на ограничение двигательной активности и вероятность остаточных эффектов действия препаратов для наркоза. Пациента следует обучить приемам их компенсации и профилактики явлений наученного неиспользования (learned non-use). Накануне операции пациента осматривают все члены МДРК, после чего составляется индивидуальная программа преабилитации. Программа включает активную суставную гимнастику во всех конечностях, растяжения (stretching) здоровой конечностью парализованных сегментов, дыхательные упражнения на мобилизацию глубокого диафрагмального вдоха, идеомоторные тренировки с представлениями движений в парализованных конечностях (особенно при процессах на спинальном уровне) и пр. Беседу и обучение пациента проводят клинический психолог и врач ФРМ.
В качестве компонента преабилитации следует рассматривать само анестезиологическое пособие. Основанное на концепции ускоренного послеоперационного восстановления (в англоязычной литературе — Enhanced Recovery After Surgery, ERAS), оно представляет алгоритм проведения анестезиологического пособия, включающий оптимизацию седативного и анальгетического компонентов, направленный на их минимально достаточное использование. В раннем послеоперационном периоде, когда пациент становится доступным контакту, члены МДРК начинают самостоятельные занятия пациента по освоенной методике, в первую очередь активные движения во всех свободных от иммобилизации конечностях, а для иммобилизированных идеомоторные упражнения, т. е. представление (воспоминания о том, как конечности совершают движения). Обязательным условием для начала активной двигательной реабилитации в условиях ОАРИТ является отсутствие абсолютных противопоказаний.
Одновременно начинается общение с родственниками, беседы с пациентом с целью восстановить его память на предшествующие операции события и восстановление ориентированности в месте, времени и собственной личности.
Рекомендация 42. Региональным министерствам здравоохранения совместно с территориальными фондами медицинского страхования рекомендуется издавать локальные нормативные акты для поэтапного внедрения технологии РеабИТ и ее адекватного финансирования (УУД — 2, УУР — А) [38].
Комментарий. В соответствии с федеральным Порядком организации реабилитационной помощи [38] для реализации РеабИТ предусмотрена организация ОРР. Основу отделения составляет МДРК, в которую входит врач по медицинской реабилитации, не менее 2 специалистов по физической реабилитации, специалист по эргореабилитации, медицинский психолог/врач-психотерапевт, медицинский логопед, медицинская сестра по медицинской реабилитации (до 1 сентября 2023 года — врач лечебной физкультуры (ЛФК), врач-физиотерапевт, врач-рефлексотерапевт, инструктор-методист по ЛФК, медицинский логопед, медицинские сестры по физиотерапии, массажу, рефлексотерапии). Отделение не располагает коечным фондом, так как оказывает помощь прикроватно непосредственно в ОАРИТ. 1 МДРК обеспечивает реабилитационное сопровождение 12 коек ОАРИТ или 90 хирургических коек, т. е. количество МДРК определяется в соответствии с коечной мощностью медицинского учреждения. ОРР обеспечивает 1-й этап реабилитации, после чего пациенту предоставляется индивидуальная программа восстановительного лечения на основании оценки статуса функциональной активности по ШРМ (Приложение 14) [128]. Обязательным условием успешного внедрения технологии РеабИТ является тщательно рассчитанный тариф. Для определения потребности в РеабИТ и финансовой емкости бюджета обязательного медицинского страхования можно использовать следующий подход:
Ведомственный контроль качества оказываемых реабилитационных услуг осуществляется в соответствии с установленным в ЛПУ регламентом контроля качества, а медико-экономическая экспертиза страховыми компаниями в соответствии с едиными критериями качества (см. далее) [132].
В целях оценки качества медицинской помощи применяются следующие критерии (табл. 4).
Таблица 4. Критерии оценки качества медицинской помощи
Table 4. Criteria for assessing the quality of medical care
| № | Критерии качества | Уровень достоверности доказательств | Уровень убедительности рекомендаций |
|---|---|---|---|
| 1 | Профилактика синдрома последствий интенсивной терапии (ПИТС) начата не позднее 48 ч от момента поступления пациента любого возраста в ОАРИТ | А | 2 |
| 2 | Ежедневное проведение реабилитационных мероприятий по программе РеабИТ не менее 60 мин пациентам с длительностью пребывания в ОАРИТ более 48 ч | B | 3 |
| 3 | Реабилитационные мероприятия по мобилизации осуществлялись под контролем СТОП-сигналов, перед началом каждой сессии проводился тест «поднятых ног» | В | 3 |
| 4 | Проведена оценка нутритивного статуса при планировании программы ранней реабилитации | А | 1 |
| 5 | Проведен скрининг постэкстубационной дисфагии с использованием теста трех глотков | В | 3 |
| 6 | Ежедневно оценивалась выраженность болевого синдрома | В | 3 |
| 7 | Ежедневно применялись беруши и лицевая маска для профилактики диссомнии ОАРИТ | А | 1 |
| 8 | При переводе пациента из ОАРИТ использована оценка тяжести ПИТС с использованием ПИТС-индекса. Значение экспресс ПИТ-индекса более 10 на момент перевода из ОАРИТ пациента, находившегося там более 48 ч | С | 5 |
| 9 | Для маршрутизации взрослых пациентов с ПИТС на этапах реабилитационного лечения использована ШРМ | А | 2 |
| 10 | В ЛПУ с коечным фондом ОАРИТ более 12 коек организовано отделение ранней реабилитации | А | 2 |
| Примечание. Критерии применимы на всех трех уровнях оказания медицинской помощи. | |||
Рекомендации разработаны в соответствии с Приказом Минздрава России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588), а также с Приказом Минздрава России от 23.06.2020 № 617н «О внесении изменений в Приложения № 1, 2 и 3 к приказу Министерства здравоохранения Российской Федерации от 28 февраля 2019 г. № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
Конфликт интересов. Белкин А.А. был главным исследователем в исследовании «Цитофлавин как компонент реабилитационного лечения с ишемическим инсультом, осложненным ПИТ-синдромом», финансированном компанией ООО «НТФФ “Полисан”». Остальные авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.