Оказание помощи пострадавшим с политравмой и нестабильной гемодинамикой (шоком) составляет одну из сложнейших проблем хирургии повреждений и анестезиологии-реаниматологии на современном этапе. Большинство таких пациентов погибает на месте происшествия и в первые часы после доставки в стационар от продолжающегося внутриполостного (т. е. некомпрессируемого) кровотечения. Основу лечения таких пациентов составляет быстрая и качественная догоспитальная помощь и по возможности раннее применение тактики «реанимации и интенсивной терапии при травмах» (что примерно соответствует концепции, обозначенной в англоязычной литературе как damage control resuscitation [DCR]). Ключевыми элементами последней являются: акцент на поиск и остановку продолжающегося кровотечения в ходе первичного обследования (протокол «C-ABC», где первая «С» — Catastrophic hemorrhage, массивное кровотечение), управляемая артериальная гипотония как метод контролируемой остановки кровотечения, «агрессивная» трансфузионная и минимальная инфузионная терапия в целях предотвращения острой посттравматической коагулопатии, гемостатическая «реанимация» с применением транексамовой кислоты и факторов свертывания и, наконец, хирургическая тактика сокращенных вмешательств damage control surgery [1–3].
Арсенал средств, способных временно стабилизовать гемодинамику для выполнения доступного объема диагностики и неотложных вмешательств, в последние годы пополнился новыми методами эндоваскулярной реанимации (ЭР): реанимационной эндоваскулярной баллонной окклюзией аорты (РЭБОА), селективной перфузией дуги аорты (СПДА) и экстракорпоральной мембранной оксигенацией (ЭКМО). Метод СПДА еще не внедрен в клиническую практику, а число случаев применения ЭКМО при травмах еще крайне мало. В свою очередь, простота выполнения и эффективность РЭБОА уже способствовали широкому внедрению этой технологии в практику хирургии повреждений и военно-полевой хирургии [4].
Цель исследования — сравнение исходов лечения пострадавших в крайне тяжелом и терминальном состоянии в России и за рубежом в аспекте применения тактики реанимации и интенсивной терапии при травмах (damage control resuscitation) и эндоваскулярной реанимации. В качестве нулевой гипотезы мы предположили, что метод РЭБОА, примененный изолированно, без соответствующей реаниматологической поддержки, не является достаточно эффективным и не приводит к улучшению выживаемости при крайне тяжелых травмах.
В исследование включено 265 случаев оказания помощи раненым и пострадавшим, которым был применен метод РЭБОА в России и мире с 2013 по 2020 г. Отечественная группа сравнения была представлена 24 случаями (клиника военно-полевой хирургии Военно-медицинской академии, г. Санкт-Петербург, n = 21; Научно-исследовательский институт скорой помощи им. И.И. Джанелидзе, г. Санкт-Петербург, n = 3), зарубежная группа — 241 наблюдением, предоставленным Международным регистром РЭБОА (ABO Trauma Registry, Швеция), участником которого Военно-медицинская академия является с момента его создания [5]. В регистр вошли пострадавшие с крайне тяжелыми травмами и ранениями (индекс тяжести травмы Injury Severity Score (ISS) > 25, что соответствует крайне тяжелой травме [6]), которым ввиду продолжающегося некомпрессируемого кровотечения и нестабильных показателей гемодинамики (систолическое артериальное давление (САД) на догоспитальном этапе или при поступлении < 90 мм рт. ст.) была выполнена РЭБОА.
В состав регистра вошли следующие сведения: об анамнезе жизни и травме; о догоспитальном и госпитальном этапах оказания помощи; о показателях витальных функций при поступлении в стационар; общие данные о РЭБОА и возникших осложнениях; о выполненных хирургических вмешательствах; о проводимой интенсивной терапии и об общих исходах лечения.
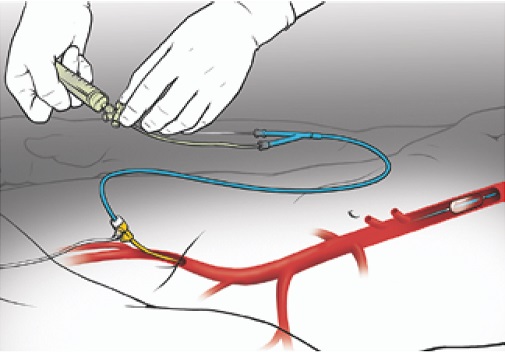
Окклюзию аорты тяжелопострадавшим осуществляли путем заведения через прокол бедренной артерии специального баллона-окклюдера, позиционирования его в соответствии с показаниями в 1-й (от левой подключичной артерии до чревного ствола) или 3-й (от почечных артерий до бифуркации) зоне аорты и раздувания баллона (2-я зона соответствует уровню висцеральных артерий и не рекомендуется к окклюзии) (рис. 1). Показанием к такому вмешательству в мире является тяжелая сочетанная травма (политравма), приводящая к поддиафрагмальному кровотечению и сопровождающаяся нестабильными показателями гемодинамики (САД < 90 мм рт. ст.) [7, 8]. При этом во многих случаях, в том числе в нашей выборке, основным показанием являлось крайне тяжелое, терминальное состояние пострадавших с САД < 60–70 мм рт. ст.
Рис. 1. Схематичное изображение техники выполнения реанимационной эндоваскулярной баллонной окклюзии аорты. После пункции бедренной артерии выполняют установку интродьюсера, соответствующего по диаметру вводимому аортальному катетеру. Сам катетер заводят по проводнику на искомую глубину (по внешним ориентирам: мечевидный отросток — для 1-й зоны, пупок — для 3-й зоны; лучше выполнить контрольный рентгеновский снимок, подтверждающий верное положение баллона) и раздувают смесью физиологического раствора и контрастного вещества. Удаление баллона и интродьюсера производят в обратном порядке
Fig. 1. A schematic illustration of the REBOA (resuscitative endovascular balloon occlusion of the aorta) technique. An introducer sheath compatible with the aortic balloon catheter is inserted after a femoral arterial puncture. The catheter is introduced over the wire using external landmarks to reach the target position (the xiphoid process — for zone 1, the umbilicus — for zone 3; a completion X-Ray is recommended to confirm correct balloon position) and then inflated using a mixture of saline and contrast medium. Balloon and sheath removal is performed in a reverse order
Временное прекращение кровотока в зоне окклюзии способствует остановке продолжающегося кровотечения и обеспечивает поддержание адекватной перфузии жизненно важных органов. Помимо РЭБОА, в нашем исследовании акцент сделан на проводимой инфузионно-трансфузионной терапии (ИТТ), ее качестве, объеме и сроках в контексте современной концепции DCR. Для точного анализа и сравнения объемов трансфузионной терапии выполнен перерасчет доз компонентов крови (в мл), исходя из представленных в регистре данных (средняя доза в отечественной и зарубежной выборках составила 300 мл и 450 мл (для эритроцитной взвеси), 280 мл и 450 мл (для свежезамороженной плазмы [СЗП]), 200 мл и 300 мл (для тромбоконцентрата) соответственно.
С целью проведения корректного анализа и устранения систематических различий между двумя группами был применен метод псевдорандомизации, позволяющий обеспечить максимальную «схожесть» сравниваемых групп [9]. Подбор пары сравнения к каждому отечественному клиническому наблюдению проводили методом «ближайших соседей» в соотношении 1 : 1. В качестве конфаундеров выбраны: возраст, механизм травмы, проведение сердечно-легочной реанимации (СЛР) на момент доставки в стационар, тяжесть травмы по шкале ISS, наличие травмы головы, нижний уровень АД на момент поступления, наличие критической гипотонии на момент поступления (САД < 40 мм рт. ст.) и применение РЭБОА в варианте частичной окклюзии. Ввиду того, что в нашу выборку попали пострадавшие с критически низкими значениями САД, в группу сравнения по конфаундеру САД также попали пострадавшие в терминальном состоянии.
После проведения псевдорандомизации и подбора группы сопоставления в группе сравнения из 241 осталось 24 случая, представленных 8 странами (Израиль, Швеция, Финляндия, Япония, Италия, Германия, Колумбия, Турция). Наибольшее число сопоставлений было сделано с Италией (n = 6) и Колумбией (n = 8). Относительно малое число наблюдений (n = 3) вошло в группу сравнения из Японии, несмотря на колоссальный опыт в вопросах РЭБОА [10–13].
Статистическую обработку данных проводили в программе R (R Foundation for Statistical Computing, v. 4.0.0). Количественные данные представлены значением медианы и межквартильного интервала вне зависимости от характера распределения данных. Описание частот значения (долей) приведено с указанием 95%-го доверительного интервала (95% ДИ). Выборки оценивали на нормальность распределения путем построения квантильных графиков и с помощью критерия Шапиро—Уилка. Сравнение двух несвязанных выборок, если распределение хотя бы одной из них отличалось от нормального, проводили с помощью теста Манна—Уитни. Множественное сравнение несвязанных выборок, распределенных нормально, проводили с помощью дисперсионного анализа (ANOVA) с поправкой Бонферрони, в случае ненормального распределения — с помощью критерия Краскела—Уоллиса с той же поправкой. Уровень достоверности различий установлен при p < 0,05. Для анализа таблиц сопряженности размером 2 × 2 использован либо критерий χ-квадрат (χ2) Пирсона (если в таблице сопряженности размер хотя бы одной из выборок ≤ 5), либо точный тест Фишера (если размер каждой из выборок > 5). Для анализа таблиц сопряженности большего размера всегда использовали критерий χ2 Пирсона. Анализ таблиц сопряженности с более чем 20 % пустых ячеек не проводили. Уровень достоверности различий для этих параметров в таблицах не указан.
Проведение исследования одобрено локальным независимым этическим комитетом при Военно-медицинской академии имени С.М. Кирова, протокол № 238 от 23.06.2020.
При анализе «отечественной» (n = 24) и «зарубежной» (n = 241) групп наибольшие различия были выявлены в характере интенсивной терапии, некоторых аспектах применения РЭБОА, а также в конечных результатах лечения (табл. 1). Наглядные различия в группах продемонстрировал подход к ИТТ. Несмотря на отсутствие достоверных отличий в общих выборках (до псевдорандомизации) по объему проводимой ИТТ, имелись очевидные различия по ее характеру (см. табл. 1). Так, еще до РЭБОА пострадавшим зарубежной выборки было перелито 1800 (0–3488) мл эритроцитной взвеси, в то время как в отечественной выборке максимально введенный объем до РЭБОА составил 600 мл (медиана 0 (0–300) мл) (p < 0,0001). Пострадавшим зарубежной выборки достоверно чаще переливали тромбоконцентрат и вовсе не использовали коллоидные растворы. До 40 % пациентов в зарубежной выборке получили более 10 доз крови в первые сутки нахождения в стационаре, в то время как в отечественной выборке больше 10 доз не получил ни один из пострадавших (p < 0,0001). Суммарно (за сутки) только 12,5 % наших пациентов был введен тромбоконцентрат (по 2 дозы каждому), в то время как в зарубежной группе тромбоциты были перелиты 34 % пациентов (р < 0,001).
По технике РЭБОА также имел место ряд отличий: достоверно чаще в отечественной выборке применен открытый доступ к бедренной артерии, все вмешательства выполнены сосудистым хирургом и крайне редко РЭБОА выполняли в варианте частичной окклюзии. Выживаемость в отечественной выборке была достоверно ниже: 42 % (95% ДИ 24–61 %) против 63 % (95% ДИ 57–69 %) в первые 24 ч пребывания в клинике и 17 % (95% ДИ 7–36 %) против 50 % (95% ДИ 43–56 %) — за 30-дневный период лечения (см. табл. 1).
Таблица 1. Общие сведения о группах пострадавших, включенных в регистр, и их сравнительный анализ между отечественной и зарубежной выборками
Table 1. Comparative data on Russian and non-Russian (foreign) trauma patients included in the ABO Trauma Registry
| Параметр | РЭБОА в России | РЭБОА в мире | p |
|---|---|---|---|
| Число наблюдений, n | 24 | 241 | |
| Механическая травма, n (%) | 22 (92 %) | 176 (73 %) | |
| Тяжесть травмы, балл по ISS | 41,0 (34,0–55,3) | 38,0 (25,0–50,0) | 0,181 |
| Минимальное САД при поступлении, n | |||
| < 50 | 10 | 82 | |
| 50–100 | 14 | 116 | |
| > 100 | — | 27 | |
| не указано | — | 16 | |
| РЭБОА | |||
| метод пункции | 0,002 | ||
| вслепую, n | 8 | 113 | |
| УЗИ-навигация | 3 | 49 | |
| открытый доступ | 13 | 45 | |
| флюороскопия | — | 9 | |
| Размер интродьюсера, n (%) | < 0,001 | ||
| ≤ 8 Fr | 2 (8 %) | 138 (57 %) | |
| > 8 Fr | 22 (92 %) | 71 (30 %) | |
| не указан | — | 32 (13 %) | |
| Специалист, выполнявший РЭБОА, n | |||
| сосудистый хирург | 16 | 39 | |
| врач по РЭДиЛ | — | 24 | |
| врач скорой помощи (стационара) | — | 75 | |
| травмохирург* | 3 | 71 | |
| общий хирург | 3 | 8 | |
| анестезиолог-реаниматолог | — | 15 | |
| Применялась частичная окклюзия аорты, n (%) | 3 (13 %) | 104 (43 %) | 0,004 |
| Реанимация и интенсивная терапия | |||
| До РЭБОА, мл | |||
| кристаллоидов | 1500 (1000–2000) | 1900 (900–3000) | 0,695 |
| коллоидов | 500 (0–500) | 0 (0–0) | < 0,0001 |
| эритроцитной взвеси | 0 (0–300) | 0 (0–1800) | 0,012 |
| СЗП | 0 (0–280) | 0 (0–900) | 0,426 |
| тромбоконцентрат | 0 (0–0) | 0 (0–0) | 0,055 |
| Общий объем ИТТ до РЭБОА | 0 (0–560) | 0 (0–1000) | 0,468 |
| После РЭБОА (первые 24 ч), мл | |||
| кристаллоидов | 3250 (1625–4000) | 3000 (2000–5364) | 0,378 |
| коллоидов | 750 (500–1000) | 0 (0–0) | < 0,0001 |
| эритроцитной взвеси | 1500 (600–2400) | 2700 (0–5850) | 0,086 |
| CЗП | 840 (560–1400) | 1800 (0–5400) | 0,220 |
| Тромбоконцентрат | 0 (0–0) | 0 (0–2000) | < 0,001 |
| Общий объем ИТТ после РЭБОА | 870 (0–2000) | 1000 (0–4500) | 0,130 |
| ИТТ за сутки | 1300 (400–2500) | 1800 (0–5400) | 0,076 |
| Исход | |||
| 24-часовая выживаемость, n (%) | 10/24 (42 %) | 146/232 (63 %) | 0,049 |
| 30-дневная выживаемость, n (%) | 4/24 (17 %) | 113/227 (50 %) | 0,002 |
| * Под травмохирургом здесь и далее подразумевается общий хирург, прошедший дополнительную подготовку по хирургии повреждений (несмотря на то, что специальности «хирургия повреждений» в России не существует, она имеется во многих странах из зарубежной выборки). ISS — индекс тяжести травмы; ИТТ — инфузионно-трансфузионная терапия; РЭБОА — реанимационная эндоваскулярная баллонная окклюзия аорты; РЭДиЛ — рентгенэндоваскулярные диагностика и лечение (в зарубежной выборке под этим термином подразумевается врач-интервенционный радиолог); САД — систолическое артериальное давление; СЗП — свежезамороженная плазма; УЗИ — ультразвуковое исследование. |
|||
Примечание: жирным шрифтом выделены статистически достоверные отличия.
По полу, возрасту, наличию фоновых заболеваний, механизму и тяжести травмы достоверных различий между группами выявлено не было (табл. 2). Все пострадавшие обеих групп имели крайне тяжелые повреждения по индексу ISS (41,0 [34,0–55,3] в отечественной и 49,0 [32,5–65,0] в зарубежной выборке; p = 0,287). Выраженность системной гипоперфузии и шока на момент поступления в обеих группах отчетливо подтверждались высокими показателями избытка оснований, BE (−15,1 [−19,0 ... −10,0] в отечественной и −11,1 [−18,8 ... −8,9] в зарубежной выборке; p = 0,384), и выраженностью ацидоза, pH (7,04 [6,92–7,21] в отечественной и 7,18 [7,03–7,26] в зарубежной выборке; p = 0,198).
После сопоставления групп как суточная, так и 30-дневная выживаемость достоверно не отличались между группами, хотя последняя в нашей выборке была вдвое ниже: 17 % (95% ДИ 7–36 %) против 33 % (95% ДИ 18–53 %), р = 0,182. В обеих группах одна половина умерших пострадавших скончалась в операционной, вторая половина — уже в отделении реанимации и интенсивной терапии (ОРИТ). Более 50 % пострадавших в каждой группе умерли в течение первых суток пребывания в стационаре. Остальные пациенты (n = 6 в отечественной группе, n = 3 в зарубежной) умерли в раннем послеоперационном периоде от последствий кровотечения с присоединением инфекции либо без нее (полиорганная недостаточность и сепсис; р = 0,130). Количество койко-дней пребывания в ОРИТ достоверно не различалось.
Таблица 2. Сравнение групп РЭБОА, выполненных в России и за рубежом, после псевдорандомизации выборок
Table 2. Comparative data between Russian and non-Russian groups after propensity score matched analysis
| Параметр | РЭБОА в России | РЭБОА в мире | p |
|---|---|---|---|
| Число наблюдений, n | 24 | 24 | |
| Возраст, годы | 38 (32–50) | 47 (32–64) | 0,284 |
| Механическая травма, n | 22 | 22 | 1,000 |
| Тяжесть травмы, балл по ISS | 41,0 (34,0–55,3) | 49,0 (32,5–65,5) | 0,287 |
| СЛР на месте травмы, n | 0 | 5 | 0,049 |
| Транспортировка с места происшествия вертолетом, n | 0 | 4 | 0,037 |
| Минимальное САД при поступлении, n | 0,493 | ||
| не определялось | 7 | 6 | |
| < 50 мм рт. ст. | 3 | 6 | |
| 50–100 мм рт. ст. | 14 | 12 | |
| pH | 7,04 (6,92–7,21) | 7,18 (7,03–7,26) | 0,198 |
| BE, ммоль/л | −15,1 (−19,0 ... −10,0) | −11,1 (−18,8 ... −8,9) | 0,384 |
| Лактат, ммоль/л | Не определялся | 9,4 (6,7–11,9) | |
| РЭБОА | |||
| Время от момента поступления до РЭБОА, мин | 22,5 (13,8–37,5) | 22,0 (13,8–66,8) | 0,669 |
| Размер интродьюсера > 8 Fr, n (%) | 20 (83 %) | 8 (33 %) | < 0,001 |
| Специалист, выполнявший РЭБОА, n | |||
| сосудистый хирург | 16 | 2 | |
| врач по РЭДиЛ | — | 4 | |
| врач скорой помощи (стационара) | — | 4 | |
| хирург, травмохирург | 6 | 8 | |
| анестезиолог-реаниматолог | — | 4 | |
| Зона окклюзии аорты (первичная), n | 0,502 | ||
| Зона 1 | 16 | 18 | |
| Зона 2 | 1 | 1 | |
| Зона 3 | 7 | 5 | |
| Реанимация и интенсивная терапия | |||
| До РЭБОА, мл | |||
| кристаллоидов | 1500 (1000–2000) | 2000 (1250–4000) | 0,107 |
| коллоидов | 500 (0–500) | 0 (0–0) | 0,001 |
| эритроцитной взвеси | 0 (0–300) | 1800 (0–3488) | < 0,0001 |
| СЗП | 0 (0–280) | 0 (0–1800) | 0,063 |
| тромбоконцентрат | 0 (0–0) | 0 (0–1200) | 0,009 |
| Общий объем ИТТ до РЭБОА | 0 (0–560) | 150 (0–2000) | 0,012 |
| После РЭБОА (первые 24 ч), мл | |||
| кристаллоидов | 3250 (1625–4000) | 3310 (500–6327) | 0,875 |
| коллоидов | 750 (500–1000) | 0 (0–0) | < 0,0001 |
| эритроцитной взвеси | 1500 (600–2400) | 2475 (1013–5288) | 0,045 |
| CЗП | 840 (560–1400) | 2700 (0–4388) | 0,258 |
| тромбоконцентрат | 0 (0–0) | 300 (0–1800) | 0,001 |
| Общий объем ИТТ после РЭБОА | 870 (0–2000) | 1350 (0–4500) | 0,178 |
| ИТТ за сутки | 1300 (400–2500) | 3600 (0–6000) | 0,001 |
| Транексамовая кислота, n | 2 | 4 | 0,383 |
| Вазопрессорная поддержка при поступлении в стационар, n | 21 | 19 | 0,701 |
| Осложнения, n | |||
| Ишемия конечности | 4 | 2 | 0,383 |
| Сепсис | 4 | 2 | 0,383 |
| Исход | |||
| 24-часовая выживаемость, n (%) | 10 (42 %) | 11 (46 %) | 0,771 |
| 30-дневная выживаемость, n (%) | 4 (17 %) | 8 (33 %) | 0,182 |
| ISS — индекс тяжести травмы; ИТТ — инфузионно-трансфузионная терапия; РЭБОА — реанимационная эндоваскулярная баллонная окклюзия аорты; РЭДиЛ — рентгенэндоваскулярные диагностика и лечение; САД — систолическое артериальное давление; СЗП — свежезамороженная плазма. | |||
Примечание: жирным шрифтом выделены статистически достоверные отличия.
Анализ блока «догоспитальная помощь» выявил, что по уровню сознания, средним значениям АД достоверных различий между группами не было. При этом пяти из 24 пострадавших зарубежной выборки уже на месте травмы проводилась СЛР, в то время как ни одному пострадавшему отечественной выборки СЛР не проводили (p = 0,0496). Также достоверно чаще пострадавшие за рубежом были эвакуированы с места происшествия вертолетом (p = 0,037), тогда как вертолетная эвакуация тяжелопострадавших с места травмы в России применяется казуистически редко (ни разу в изученной нами группе).
На момент доставки в стационар не было выявлено различий между группами по числу пострадавших, доставленных в терминальном состоянии, включая травматическую остановку сердца, уровню САД, частоте пульса, частоте развития жизнеугрожающих последствий травм (гемоторакс, пневмоторакс и др.).
Время от поступления до выполнения РЭБОА («дверь — баллон») достоверно не различалось между группами и составляло в среднем 22 мин (p = 0,669). Заведение баллона, как правило, осуществляли вслепую, используя внешние ориентиры (мечевидный отросток грудины для зоны 1 и пупок для зоны 3). Раздувание баллона в большинстве случаев приводило к стабилизации гемодинамики и значимому увеличению значений САД на 40–50 мм рт. ст. от исходного (р < 0,0001 в обеих группах). Однако в 4 и 5 случаях в каждой из групп соответственно гемодинамический статус пациента оставался без изменений, несмотря на окклюзию аорты, что, по-видимому, связано с терминальным состоянием этих пациентов. В большинстве случаев общее время окклюзии аорты составило менее 60 мин (92 % в отечественной выборке, 67 % в зарубежной; p = 0,205). При этом в каждой из групп у одного пострадавшего была отмечена миграция баллона после установки, что потребовало коррекции его положения.
Ввиду того, что в России по-прежнему не зарегистрирован ни один специальный аортальный баллонный окклюдер с малой системой доставки, наиболее часто используемым баллоном в нашей выборке являлся катетер Reliant (Medtronic, США), сопоставимый с 11–12-Fr интродьюсером, в то время как за рубежом все чаще используют 7-Fr катетеры Rescue (Tokai, Япония) и ER-REBOA (Prytime, США). В связи с этим группы достоверно различались по размерам используемых для РЭБОА интродьюсеров. В зарубежной выборке вмешательство, как правило, выполнялось сотрудниками приемного отделения стационара либо врачом скорой помощи или травмохирургом, а в четырех случаях РЭБОА была выполнена анестезиологом-реаниматологом. Извлечение интродьюсера проводили в максимально короткие сроки — через 3,3 и 1,8 ч от момента установки в отечественной и зарубежной выборках соответственно (p = 0,397).
Подход к осуществлению ИТТ в представленных выборках принципиально различался. В обеих группах проведение РЭБОА сопровождалось большеобъемной ИТТ, причем восполнение кровопотери компонентами крови очевидно запаздывало в отечественной выборке по сравнению с пациентами из группы сопоставления.
Обращает на себя внимание практика отсутствия введения коллоидных растворов в зарубежных травмоцентрах, причем во всех странах из представленного списка, в то время как в отечественной выборке до РЭБОА было введено около 500 мл гидроксиэтилкрахмала (ГЭК) и после РЭБОА — еще около 1000 мл (p < 0,001). Средний объем инфузии кристаллоидных растворов до и после РЭБОА в зарубежной и отечественной выборках достоверно не различался. Однако общий объем ИТТ (инфузионные растворы + компоненты крови) до РЭБОА (p = 0,012) и в целом за сутки (p = 0,001) был достоверно больше в зарубежной выборке, причем в первую очередь за счет гемотрансфузии (см. табл. 2).
Как эритроцитной взвеси (p < 0,0001), так и СЗП (p = 0,063) нашим пострадавшим до раздувания баллона было введено значимо меньше. После РЭБОА в зарубежной выборке было введено вдвое больше эритроцитной взвеси (p = 0,045) и втрое больше СЗП (p = 0,258) при одинаковом объеме кристаллоидов (p = 0,875). Практически полная недоступность тромбоконцентрата в остром периоде травмы даже в ведущих травмоцентрах Санкт-Петербурга также отчетливо выявляется по соотношению между группами и значимости различий как до (p = 0,009), так и после выполнения РЭБОА (p = 0,001) (см. табл. 2).
Анализ результатов исследования показал, что параметры, отражающие состояние пострадавшего, общие характеристики стационарного этапа лечения, осложнения и общий исход достоверно не различались между сравниваемыми группами. Основные различия были выявлены в параметрах, отражающих характеристики выполненной операции РЭБОА и характер проводимой интенсивной (противошоковой) терапии у данных пострадавших. Мы показали, что на исход лечения оказывает влияние в первую очередь характер интенсивной терапии, так как маловероятно, что размер интродьюсера и уровень подготовки специалиста могли существенно повлиять на общий исход.
При этом различия коснулись как объема, так и характера ИТТ, как инфузионной, так и трансфузионной терапии, как до выполнения РЭБОА (ранние сроки от момента поступления), так и после. Традиционно объем догоспитальной инфузионной терапии в России ограничен только сроками доставки пострадавшего в стационар, в то время как в мире широко распространены концепции «управляемой артериальной гипотонии», гемостатической реанимации, агрессивной трансфузионной трансфузии, объединенных понятием DCR, ограничивающей объем вводимых кристаллоидных растворов (с учетом раннего госпитального этапа) 1–2 л [14].
Многочисленные публикации и международные клинические рекомендации подтверждают негативный эффект от применения инфузионной терапии при массивной кровопотере, какой бы сбалансированной она ни была [15–20]. Как видно из зарубежной выборки (что подтверждается результатами крупных многоцентровых исследований), коллоиды в принципе не применяют для восполнения объема циркулирующей крови при острой кровопотере ввиду негативного влияния ГЭК на функцию почек, свертывающую систему крови и ряд других побочных эффектов, что отражает современную тенденцию к минимизации вливания растворов ГЭК и заменой их компонентами крови, вводимыми в начальном соотношении 1 : 1 : 1 (эритроцитная взвесь : СЗП : тромбоконцентрат) [21, 22].
Как показал анализ результатов, за рубежом уже в первые минуты–десятки минут от момента поступления критического пострадавшего может быть перелито до 6 доз эритроцитной взвеси и 6 доз СЗП, что, безусловно, снижает частоту летальных исходов от кровопотери и ее последствий. Еще до поступления тяжелопострадавшего активируется «красный код» (Code Red), предусматривающий вызов всех задействованных членов дежурной бригады в приемное отделение, в том числе службы крови. Затем в большинстве случаев инициируют протокол массивной гемотрансфузии, предусматривающий переливание не менее 10 доз крови в первые 24 ч.
В отечественных реалиях кровь редко бывает доступна по дежурству в полноценном объеме и в адекватные сроки — на определение группы, доставку ее в операционную, совмещение и подготовку к трансфузии уходит не менее 30–40 мин. Переливание крови даже универсального донора без совмещения запрещено законодательством РФ [23], в то время как за рубежом несколько доз крови O(I) резус-отрицательной могут быть перелиты в первые минуты после прибытия гемодинамически нестабильного пострадавшего в стационар. Негласное правило «сначала останови кровотечение, потом переливай кровь» признано порочным. С этим связано большое расхождение в объемах трансфузионной терапии между отечественной и зарубежной группами (в первую очередь касательно эритроцитной взвеси и тромбоконцентрата).
Различия в специальностях врачей, выполняющих РЭБОА, на наш взгляд, обусловлены тем, что в некоторых стационарах за рубежом анестезиологи-реаниматологи не только проводят анестезиологическое пособие, но и активно участвуют в диагностике, некоторых оперативных вмешательствах (например, дренирование плевральной полости) и зачастую являются ответственными специалистами по приему пострадавших. Кроме того, навык пункции и катетеризации сосудов у анестезиологов-реаниматологов развит значимо лучше, чем у общих и даже сосудистых хирургов.
В отечественных реалиях, когда каждая клиническая специальность юридически наделена определенными компетенциями, вопрос выбора специалиста, выполняющего РЭБОА, особенно актуален. Так, катетеризация магистрального сосуда входит в компетенцию врача — специалиста по рентгенэндоваскулярным диагностике и лечению (РЭДиЛ), сердечно-сосудистого хирурга и анестезиолога-реаниматолога и не входит в компетенцию врача-хирурга [24]. Соответственно, в рамках действующего законодательства дежурный хирург противошоковой бригады должен вызывать для выполнения РЭБОА соответствующего специалиста, что далеко не всегда возможно.
Выполненное исследование имеет ряд недостатков. Во-первых, результаты исследований, набор материала в которые проводили ретроспективно, обладают меньшей достоверностью, в отличие от проспективных исследований. Во-вторых, сравнение выборок с 10-кратной разницей в исходном материале дает значимые статистические ошибки, однако мы постарались предотвратить их путем псевдорандомизации, что привело к исключению ряда наблюдений, содержащих пропущенные переменные из числа конфаундеров.
В целом комплексный анализ Международного регистра (ABO Trauma Registry) позволил выявить принципиальные отличия в подходах к оказанию помощи тяжелопострадавшим в первые минуты нахождения в стационаре в пользу ранней трансфузионной терапии в зарубежных клиниках, что обладает наибольшим влиянием на выживаемость пациентов. При этом техника РЭБОА, особенно в варианте частичного перекрытия кровотока в аорте, позволяет не только остановить или замедлить кровотечение, но и избежать нежелательных реперфузионных последствий. Создание отечественных баллонных катетеров малого диаметра, определение ниши их применения в структуре хирургии повреждений, а также взаимодополняемость РЭБОА и DCR еще нуждаются в дальнейшем изучении.
Метод РЭБОА позволяет временно стабилизовать гемодинамику за счет подъема САД на 40–50 мм рт. ст., но, несмотря на свою эффективность, является лишь одним из факторов на правильном пути ранней остановки внутреннего кровотечения, восполнения кровопотери и устранения жизнеугрожающих нарушений, а основное влияние на общий результат лечения пострадавших оказывает сама тяжелая травма и сопровождающая ее тяжелая кровопотеря. 30-дневная выживаемость после РЭБОА напрямую связана с методами восполнения кровопотери. При избыточном введении инфузионных растворов РЭБОА неэффективна в плане отдаленной выживаемости (17 %; 95% ДИ 7–36 %). При раннем введении достаточного объема компонентов крови, наоборот, выживаемость возрастает до 50 % (95% ДИ 18–53 %). Полученные в нашем исследовании результаты помогут сфокусировать внимание на видимых отличиях отечественной системы оказания скорой медицинской помощи пострадавшим от мировой с целью ее дальнейшего совершенствования.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Этическое утверждение. Исследование было одобрено локальным этическим при Военно-медицинской академии имени С.М. Кирова, Санкт-Петербург, Россия (протокол № 238 от 23.06.2020).
Ethics approval. The present study protocol was approved by the local Ethics Committee of the Military Medical Academy, St. Petersburg, Russia (reference number: 238-23/06/2020).
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.