Гелий является инертным газом с меньшей плотностью, чем воздух, поэтому поток гелия через дыхательные пути менее турбулентный. Это приводит к снижению сопротивления, позволяя газу лучше проникать через суженные бронхи, а также по каналам Ламберта и порам Кона к плохо вентилируемым альвеолам [1–3]. Кислородно-гелиевая смесь (КГС) в эксперименте улучшала транспорт кислорода через альвеолокапиллярную мембрану, а высокий коэффициент диффузии углекислого газа (СО2) способствовал его элиминации [2, 4]. Подогреваемая КГС, достигая респираторной части легких, вызывает длительную гиперемию альвеолярной ткани с увеличением диаметра капилляров в 3–10 раз, что обеспечивает поддержание газообмена [2, 5]. Систематический обзор Beurskens et al. (2015) показал, что и в педиатрических, и во взрослых группах КГС улучшала газообмен, позволяя проводить менее инвазивную вентиляцию в широком спектре моделей, использующих ее различные режимы. Клинические исследования показали снижение работы дыхания при вентиляции КГС с соответствующим повышением рН и снижением уровня PaCO2 по сравнению с вентиляцией кислородно-воздушной смесью [6].
Чаще всего гелий используется для снижения работы дыхания во время обострений бронхиальной астмы, хронической обструктивной болезни легких (ХОБЛ) [7–10]. В литературе большая часть данных о действии КГС была собрана в этих группах пациентов. При остром респираторном дистресс-синдроме (ОРДС) большинство данных о гелиевой вентиляции также получены у педиатрических пациентов, что может быть связано с повышенным сопротивлением дыхательных путей у новорожденных и младенцев по сравнению со взрослыми [11, 12]. Лечение дыхательной недостаточности при пневмонии, вызванной новой коронавирусной инфекцией COVID-19, — пока еще нерешенная проблема, требующая комплексного подхода и разработки новых методов, расширяющих диапазон возможностей современной терапии. Благодаря своим физическим свойствам КГС может улучшить оксигенацию, работу дыхания и, возможно, избежать необходимости интубации и ИВЛ у пациентов с дыхательной недостаточностью [2, 6, 13]. Следует отметить, что проблема использования КГС при лечении взрослых пациентов с вирусной и бактериальной пневмонией освещена недостаточно. Учитывая необходимость ограничения применения ИВЛ, мы изучали, обладает ли КГС терапевтическим потенциалом при пневмониях, обобщив результаты клинических исследований по ее применению у взрослых.
Цель исследования. Для проведения этого систематического обзора был разработан следующий вопрос: «Оказывает ли КГС клинически значимый эффект у взрослых пациентов при пневмониях в качестве адъюванта к традиционной терапии?»
Этот систематический обзор и метаанализ были проведены в соответствии с требованиями отчетности для систематических обзоров и метаанализов (PRISMA — Preferred ReportingItems for Systematic Reviews and Meta-Analyses). Языковое ограничение не устанавливалось.
Критерии включения были предварительно определены с использованием стратегии PICOS (patient, population or problem [P]; intervention [I]; comparison [C]; outcomes [O] and study design [S]), оптимизированной для разработки всех этапов интервенционного систематического обзора и метаанализа (табл. 1). Выработка критериев включения/исключения осуществлялась совместно всеми авторами до начала поиска соответствующих публикаций. Разногласия были разрешены консенсусом.
Таблица 1. Критерии включения в систематический обзор и метаанализ (PICOS)
Table 1. Criteria for inclusion in a systematic review and meta-analysis (PICOS)
| PICOS | Критерии включения в систематический обзор и метаанализ |
|---|---|
| Пациенты | Взрослые пациенты (возраст пациентов ≥ 18 лет) с подтвержденным или предполагаемым диагнозом «пневмония» |
| Вмешательство | Ингаляция КГС, добавленная к традиционной терапии |
| Сравнение | Сравнение пациентов, которые получали традиционное лечение, с пациентами, которым добавляли ингаляцию КГС к традиционному лечению |
| Результаты | Эффективность лечения пневмонии, дыхательной недостаточности, уровень острофазовых ферментов, летальность, длительность нахождения в ОРИТ, стационаре |
| Дизайн исследования | Проспективное рандомизированное клиническое исследование или проспективное/ретроспективное нерандомизированное клиническое исследование |
В систематический обзор и метаанализ включали исследования, в которых были адекватно представлены бинарные и непрерывные данные (наличие среднего значения/медианы; интерквартильного размаха, стандартного отклонения и/или 95%-го доверительного интервала [95% ДИ] для среднего значения). Данные извлекали только из опубликованных работ, связи с авторами не проводилось. С целью увеличения статистической мощности в метаанализ также были включены исследования, рассматривающие использование КГС для лечения ХОБЛ. Это допущение было сделано для тех исследований, в которых исследовались пациенты с обострением ХОБЛ, развитием пневмонии и дыхательной недостаточности. Педиатрические популяции были исключены для минимизации неоднородности.
К критериям исключения были отнесены: низкодоказательный дизайн исследования (тезисы конференций, протоколы заседаний, клинические случаи и серии случаев, технические статьи, рекомендации); исследования на животных. Следует отметить, что количество включенных в исследования пациентов не являлось определяющим фактором отбора.
Поиск литературы производился в базах данных PubMed (за период 1964–2022 гг.), GoogleScholar (за период 2000–2022 гг.) и eLIBRARY.RU (за период 2000–2022 гг.).
Поисковый запрос в базе данных PubMed: (helium) OR (heliox) OR (helium-oxygen mixture)) AND ((pneumonia) OR (lung inflammation)).
Для поиска в базе данных Google Scholar использовали запрос: helium, heliox, helium-oxygen mixture, pneumonia, lung inflammation.
Поисковый запрос в базе данных eLIBRARY.RU: гелий, пневмония.
Последний поиск производился 23 января 2022 г.
Все найденные цитаты были импортированы в базу данных, удаление дубликатов статей было выполнено вручную. После исключения дубликатов названия и тезисы были проанализированы на предмет соответствия цели систематического анализа. После исключения публикаций, не соответствующих цели исследования, были отобраны 37 статей. Для них производили поиск и анализ полного текста на соответствие установленным критериям включения и исключения. После поиска литературы по вышеописанной методике были отобраны 10 публикаций, соответствующие критериям включения. Из исследований были извлечены основные данные, включая информацию о стране, годе, характеристиках участников (размер выборки и возраст), используемой КГС, проведенном лечении, результатах и статистическом анализе.
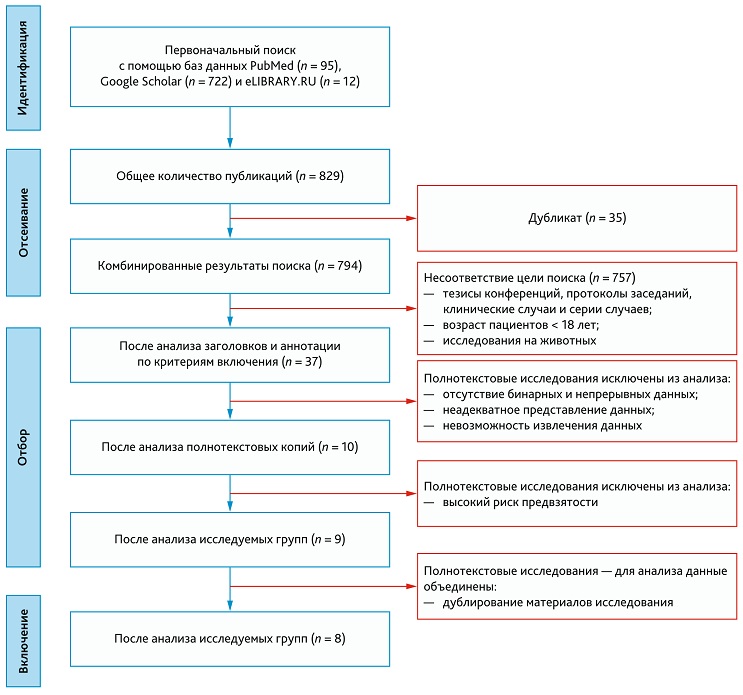
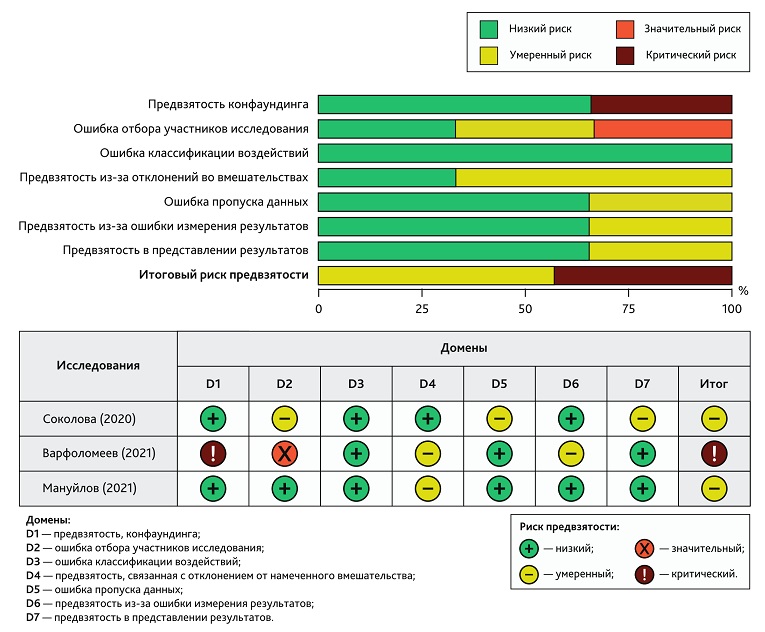
Оценка методологического качества отобранных рандомизированных исследований проводилась с использованием критериев руководства Кокрейновского сообщества с помощью программного обеспечения Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020). Согласно вышеупомянутым критериям, рандомизированные клинические исследования (РКИ) изучались помощью контрольного списка из 5 ключевых пунктов (RoB 2 (Risk-Of-Bias 2)): 1) предвзятость, возникающая в результате процесса рандомизации; 2) предвзятость из-за отклонений от запланированных вмешательств; 3) предвзятость из-за отсутствия данных о результатах; 4) предвзятость в оценке результата; 5) предвзятость в отчетности. Для нерандомизированного клинического исследования (неРКИ) контрольный список состоял из 7 ключевых пунктов (ROBINS-I (Risk Of Bias In Non-randomized Studies I)): 1) предвзятость конфаундинга; 2) ошибка отбора участников исследования; 3) ошибка классификации воздействий; 4) предвзятость, связанная с отклонением от намеченного вмешательства; 5) ошибка пропуска данных; 6) предвзятость из-за ошибки измерения результатов; 7) предвзятость в представлении результатов [14]. Для каждого исследования оценивали риск предвзятости; общая оценка определялась как высокий, низкий или неопределенный риск для всех включенных исследований.
В метаанализ были включены исследования, которые рассматривались как имеющие «низкий» или «неопределенный» риск предвзятости. Исследования, которые имели высокий риск предвзятости на основании вышеупомянутых критериев и/или не имели достаточного данных для количественного анализа, были исключены из метаанализа.
Все оценки, включая поиск, отбор исследований, извлечение и оценку качества данных, были выполнены независимо двумя авторами и проверены третьим автором в случае разногласий. Разногласия были разрешены консенсусом.
Первичной конечной точкой стала летальность за период стационарного лечения. Вторичными конечными точками явились влияние КГС на уровень SpO2, скорость восстановления SpO2, частота перевода на ИВЛ, длительность нахождения в ОРИТ, длительность госпитализации, длительность кашля, уровень С-реактивного белка (СРБ), ферритина, D-димеров.
Для каждой метааналитической модели мы использовали d-критерий Коэна (Cohen’s d) и его стандартную ошибку (SD). Эффекты были взвешены по обратной дисперсии ошибок внутри Cohen’s d для каждого исследования. Размеры эффекта d ~ 0,20; ~ 0,50 и ~ 0,80 рассматривались как малые, средние и большие эффекты соответственно [15].
Достоверность доказательств эффектов, обнаруженных в метаанализе, была оценена с использованием подхода GRADE (Grading of Recommendations Assessment, Development and Evaluation) — системы классификации, оценки, разработки и экспертизы рекомендаций [16]. Качество оценивалось как high (высокое), moderate (умеренное), low (низкое) или very low (очень низкое) в соответствии с критериями GRADE. Сводная таблица результатов была построена с использованием онлайн-программы GRADEpro GDT.
Статистическая обработка данных выполнялась в программе Review Manager (RevMan), версия 5.4.1 (The Cochrane Collaboration, 2020).
Метаанализ бинарных данных производился на основании разности эффектов в виде отношения шансов (ОШ) с 95% ДИ. Метаанализ непрерывных данных выполнялся на основании разности средних значений показателей (MD, mean difference) в исследуемой и контрольной группах. Он проводился с использованием средних значений, стандартных отклонений и числа исследуемых. В случае неизвестного стандартного отклонения его расчет выполнялся с помощью инструментов программы RevMan 5.4.1 по известным среднему значению и 95% ДИ. Метаанализ непрерывных данных, представленных в различных единицах измерения, выполнялся на основании стандартизированной разности средних (SMD, standardized mean difference).
Результаты метаанализа представлялись в виде листовидного графика (forest plot). Оценка статистической гетерогенности выполнялась с использованием критерия хи-квадрат Пирсона (χ2) и индекса гетерогенности I2. Метаанализ проводился с использованием следующих моделей: модели случайных эффектов (Random (Rnd)) в случае обнаружения статистически значимой гетерогенности в исследованиях (I2 > 40) и модели фиксированного эффекта (Fixed) при отсутствии статистически значимой гетерогенности (р ≥ 0,10 в тесте χ2 и I2 ≤ 40). В случае если р ≥ 0,10, но I2 > 40, то при выборе математической модели метаанализа принимались во внимание результаты оценки статистической гетерогенности согласно тесту χ2 [метод обратной дисперсии (IV, inverse variance)].
Поиск литературы первоначально выявил 829 источников. Из них 95 публикаций получено из базы данных PubMed, 722 результата — с помощью базы данных Google Scholar и 12 публикаций — из базы данных eLIBRARY.RU. Из найденных 829 результатов были исключены дублированные публикации (n = 35). После анализа заголовков и их аннотаций поставленной цели соответствовали 37 публикаций. После оценки полнотекстовых статей и применения критериев включения было отобрано 10 публикаций. Алгоритм отбора представлен на рис. 1.
Рис. 1. Блок-схема отбора литературы в соответствии с принципами PRISMA
Fig. 1. Flowchart of literature selection according to PRISMA principles

Причиной развития пневмонии в 6 исследованиях явилась коронавирусная инфекция [17–22], в работе Красновского А.Л. и соавт. авторы исследовали внебольничную пневмонию [5], а в работах Jolliet Р. (2003, 2017) [23, 24] и Мaggiore S. [25] пневмония и дыхательная недостаточность были осложнением ХОБЛ.
Респираторная поддержка при включении пациентов в отобранные исследования была различной. В работах Соколовой О.П. и соавт. (2021) [22], Лахина Р.Е. и соавт. (2021) [20], Мануйлова В.М. и соавт. (2021) [19], Красновского А.Л. и соавт. (2013) [5], Варфоломеева С.Д. и соавт. (2021) [19], Петрикова С.С. и соавт. (2020) [17], Шогеновой Л.В. и соавт. (2020) [18] пациенты находились на самостоятельном дыхании. В исследованиях Jolliet Р. et al. (2003, 2017) [23, 24], Мaggiore S. et al. [25] пациентам проводили неинвазивную вентиляцию легких.
Оборудование и методика использования КГС отличались. В работе Jolliet Р. et al. (2003) газовую смесь (78 % гелий, 22 % кислород) вводили путем подсоединения 50-литрового баллона, содержащего смесь под давлением 150 бар, подаваемую через регулятор давления 6 бар непосредственно во входное отверстие вентилятора, обычно используемое для подачи воздуха. Вентиляцию легких пациентов в этом исследовании проводили с помощью Veolar FT (Hamilton Medical, Rhäzuns, Switzerland) и Servo 300 (Siemens-Elema, Solna, Sweden). Длительность ингаляции КГС составляла 30 мин [23]. В исследовании Jolliet Р. et al. (2017) газовую смесь (78 % гелий, 22 % кислород) вводили через ороназальную маску для неинвазивной вентиляции аппаратом искусственной вентиляции легких Hamilton-G5 с опцией Heliox (Hamilton Medical AG, Bonaduz, Switzerland). Если неинвазивная вентиляция не проводилась, то ингаляцию КГС проводили с помощью лицевой маски ручным аппаратом (Pulmanex Hi-OX80; Cardinal Health, Dublin, Ohio), используя специально разработанный смеситель (SentryHe/O2; Cardinal Health). Длительность ингаляции КГС составляла 30 мин [24]. В работе Maggiore S. et al. пациентов вентилировали с помощью PB760 (Tyco Health care, Puritan Bennett, Pleasanton) газовой смесью (65 % гелий, 35 % кислород), которую подводили путем подсоединения 50-литрового баллона, содержащего смесь под давлением 150 бар, непосредственно во входное отверстие вентилятора, обычно используемое для подачи воздуха. Каждый сеанс ингаляции КГС длился от 30 мин до 3 ч в зависимости от клинической реакции, параметров газов крови и переносимости пациентом [25]. В публикации Красновского А.Л. и соавт. (2013) ингаляцию газовой смеси (77 % гелий, 23 % кислород) проводили на аппарате «Ингалит-В» (ЗАО «Специализированное конструкторское бюро экспериментального оборудования при Институте медико-биологических проблем Российской академии наук», РФ) трехинтервальной методикой (5 мин ингаляции, 5 мин отдыха); 1 процедура в день в течение 7 дней [5]. В исследованиях Соколовой О.П. и соавт. (2021) [22], Лахина Р.Е. и соавт. (2021) [20], Мануйлова В.М. и соавт. (2021) [21] ингаляции на самостоятельном дыхании проводили с помощью ингалятора «Ингалит-В2-01» (ЗАО «Специализированное конструкторское бюро экспериментального оборудования при Институте медико-биологических проблем Российской академии наук», РФ) подогретой КГС (70 % гелий, 30 % кислород). Продолжительность курса в работе Соколовой О.П. и соавт. (2021) [20] составила 7 дней, частота ингаляций — 3 раза/сут по 10 мин; в публикации Лахина Р.Е. и соавт. (2021) [18] — по 10 мин 4 раза/сут в течение 7 дней; в исследовании Мануйлова В.М. и соавт. (2021) [21] ингаляцию КГС проводили трехинтервальной методикой (5 мин ингаляции, 5 мин отдыха); время ингаляции могло увеличиваться до 10 мин с сохранением 5-минутных интервалов отдыха, частота ингаляций — до 4 раз/сут. В работе Варфоломеева С.Д. и соавт. (2021) методика ингаляции не указана, есть только название аппарата «Гелиокс Экстрим» (ООО «Медтехинновации») [19]. В работах Петрикова С.С. и соавт. (2020) [17], Шогеновой Л.В. и соавт. (2020) [18] ингаляцию газовой смесью выполняли на аппарате «Гелиокс Экстрим» (ООО «Медтехинновации»), куда раздельно подавались кислород и гелий. В аппарате происходило смешивание этих газов, затем КГС подавалась через термистор аппарата, к которому были подсоединены клапан выдоха и лицевая маска. Длительность однократной ингаляции — не менее 7–10 мин в зависимости от состояния пациента, общая длительность всех ингаляций — до 60 мин в сутки в течение 10 дней. Концентрация гелия и кислорода подбиралась индивидуально каждому пациенту в пределах 50–79 % (гелий) и 21–50 % (кислород) для поддержания SpO2 в пределах 97–99 %.
Температурный режим ингаляции был описан почти во всех исследованиях. В работах Петрикова С.С. и соавт. (2020) [17], Шогеновой Л.В. и соавт. (2020) [18] указано, что выбор температурного режима также осуществлялся индивидуально в пределах 75–100 °С. В работе Лахина Р.Е. и соавт. (2021) [20] нагрев смеси производился до 80 °С. В статье Красновского А.Л. и соавт. (2013) [5] указано, что нагретая газовая смесь подавалась через маску; температура смеси составляла 40 °С. В исследовании Мануйлова В.М. и соавт. (2021) [21] газовую смесь нагревали до 95 °С. В публикации Варфоломеева С.Д. и соавт. (2021) [19] сказано, что подавалась высокотемпературная газовая смесь. В остальных публикациях температурный регламент не указывался. Общая характеристика исследований представлена в табл. 2.
Таблица 2. Характеристика исследований
Table 2. Characteristics of studies
| Исследование | Дизайн исследования | Кол-во пациентов (исследуемая группа/ контроль) | Не : О2, % | Возраст, лет | Респираторная терапия | Этиология пневмонии | Конечные точки |
|---|---|---|---|---|---|---|---|
| Jolliet (2003) | РКИ проспективное | 59/64 | 78 : 22 | 71,0 ± 9,0 | НИВЛ | ХОБЛ + пневмония | Длительность госпитализации Частота перевода на ИВЛ Летальность Длительность нахождения в ОРИТ |
| Мaggiore (2010) | РКИ проспективное | 102/102 | 65 : 30 | 67,9 ± 8,9 | НИВЛ | ХОБЛ + пневмония | Длительность госпитализации Частота перевода на ИВЛ Летальность Длительность нахождения в ОРИТ |
| Красновский (2013) | РКИ проспективное | 25/25 | 77 : 23 | 44,4 ± 11,5 | СД | Внебольничная пневмония | Скорость купирования кашля Уровень острофазовых показателей |
| Jolliet (2016) | РКИ проспективное | 225/220 | 78 : 22 | 68,9 ± 11,4 | НИВЛ | ХОБЛ + пневмония | Длительность госпитализации Частота перевода на ИВЛ Летальность Длительность нахождения в ОРИТ |
| Петриков (2020) | РКИ проспективное | 38/32 | 65 : 3570 : 3079 : 21 | 56,0 ± 16,3 | СД | Вирус SARS-CoV-2 | Частота перевода на ИВЛ Уровень сатурации Уровень острофазовых показателей |
| Шогенова (2020) | РКИ проспективное | 30/30 | 65 : 3570 : 3079 : 21 | 56,0 ± 10,8 | СД | Вирус SARS-CoV-2 | Частота перевода на ИВЛ Уровень острофазовых показателей |
| Варфоломеев (2021) | НеРКИ проспективное | 30/30 | Н/д | 58,0 ± 10,7 | СД | Вирус SARS-CoV-2 | Количество (+) результатов ПЦР Уровень IgM, IgG |
| Лахин (2021) | РКИ проспективное | 30/30 | 70 : 30 | 51,0 ± 10,0 | СД | Вирус SARS-CoV-2 | Частота перевода на ИВЛ Летальность Влияние на оксигенацию Длительность нахождения в ОРИТ Уровень сатурации |
| Мануйлов (2021) | НеРКИ ретроспективное | 28/31 | 70 : 30 | 62,5 ± 18,3 | СД | Вирус SARS-CoV-2 | Длительность госпитализации Влияние на оксигенацию Скорость купирования кашля Уровень острофазовых показателей |
| Соколова (2021) | НеРКИ проспективное | 41/45 | 70 : 30 | 59,4 ± 13,8 | СД | Вирус SARS-CoV-2 | Длительность госпитализации Частота перевода в ОРИТ Уровень острофазовых показателей |
| Ig — иммуноглобулин; ИВЛ — искусственная вентиляция легких; н/д — нет данных; неРКИ — нерандомизированное клиническое исследование; НИВЛ — неинвазивная вентиляция легких; ОРИТ — отделение реанимации и интенсивной терапии; ПЦР — полимеразная цепная реакция; РКИ — рандомизированное клиническое исследование; СД — самостоятельное дыхание; ХОБЛ — хроническая обструктивная болезнь легких. | |||||||
В общей сложности согласно критериям руководства Кокрейновского сообщества были оценены 7 РКИ (рис. 2) и 3 неРКИ (рис. 3). Ключевыми областями, выбранными для исследований с высоким риском предвзятости, были предвзятость конфаундинга, ошибка пропуска данных, ошибка классификации воздействий. Исследование Варфоломеева С.Д. и соавт. (2021) [19] в связи с высоким риском предвзятости из исследования было исключено.
Рис. 2. Оценка риска систематической ошибки рандомизированных клинических исследований
Fig. 2. Assessing the risk of bias in randomized trials
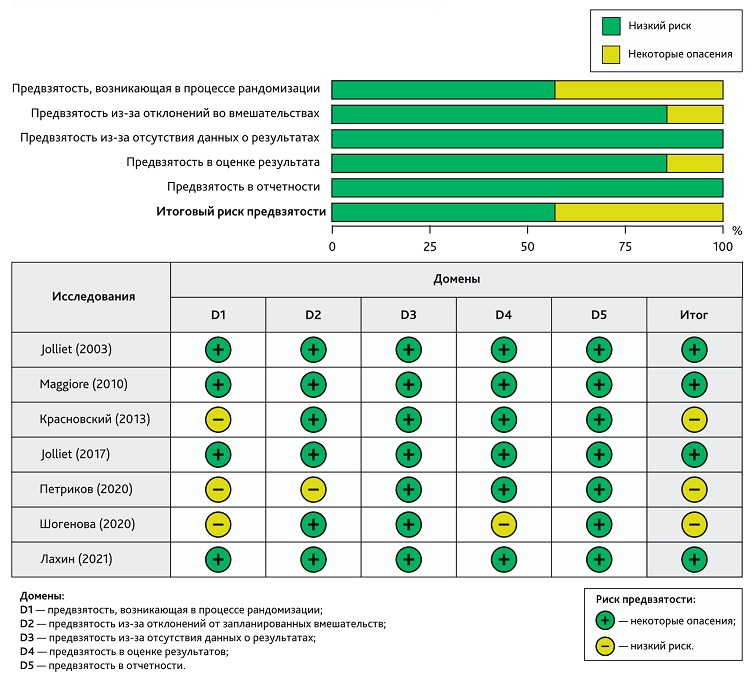
Рис. 3. Оценка риска систематической ошибки нерандомизированных клинических исследований
Fig. 3. Assessing the risk of bias in non-randomized trials
Полностатейный анализ исследуемых групп показал, что в 2 публикациях использована одна и та же выборка пациентов (Петриков С.С. (2020) [17], Шогенова Л.В. (2020) [18]). Было принято решение рассматривать эти публикации как один источник; извлечение данных осуществляли из выборок наибольшего размера, в случае равенства групп — по достаточности для оценки представленных данных или последней по дате статьи. Таким образом, из первичных результатов поиска для статистического анализа были отобраны 8 источников (см. рис. 1). Результаты метаанализа были представлены отдельно по каждой конечной точке.
Метаанализ влияния ингаляции КГС на летальность
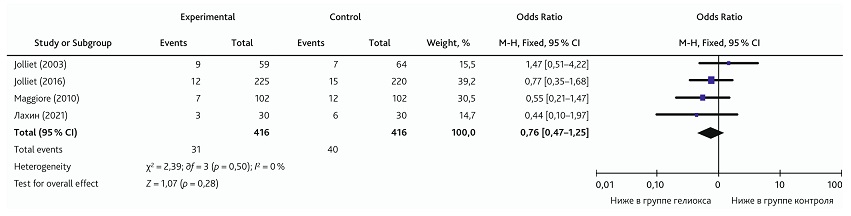
В метаанализ были включены 4 клинических исследования. Общее количество пациентов, включенных в анализ, составило 832, в том числе 416 пациентов, получавших КГС. В одной работе причиной развития пневмонии была коронавирусная инфекция [20], а в трех исследованиях пневмония и дыхательная недостаточность были осложнением ХОБЛ [21–23]. Гетерогенность публикаций, рассчитанная с использованием модели фиксированного эффекта, была низкая (I2 = 0, р = 0,48). Общий результат не показал влияния на летальность добавления КГС к традиционной терапии (ОШ 0,76; 95% ДИ 0,47–1,25; p = 0,28) (рис. 4).
Рис. 4. Метаанализ эффекта влияния ингаляции КГС на летальность в группах
Fig. 4. Meta-analysis of the effect from HOM inhalation on mortality in groups
Метаанализ влияния ингаляции КГС на оксигенацию
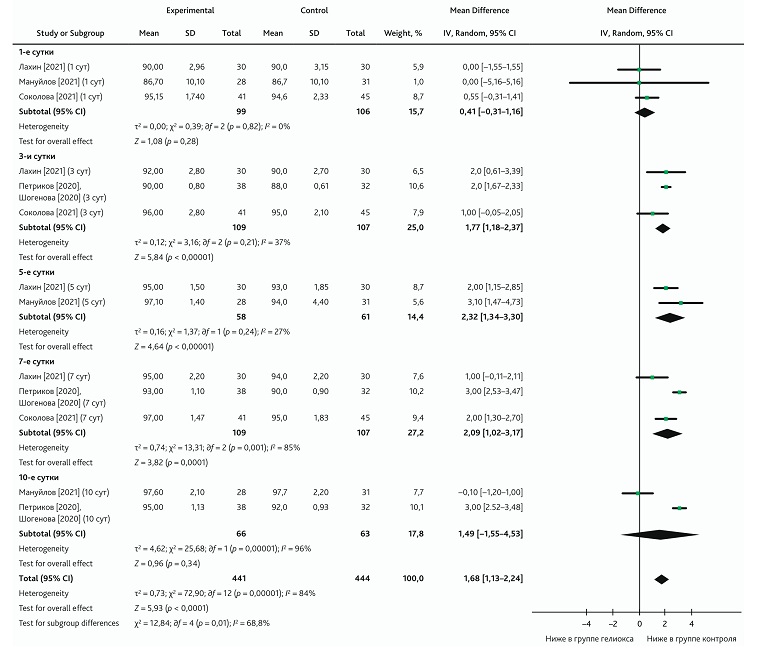
В общий метаанализ были включены 4 публикации, исследовавшие уровень SpO2 на разных этапах лечения [17, 20–22]. Общий метаанализ показал разницу, свидетельствующую о средней величине эффекта (Cohen’s d ± SD = 0,49 ± 0,07) увеличения уровня SpO2 при добавлении ингаляции КГС к традиционной терапии (MD: 1,68; 95% ДИ 1,13–2,24; p < 0,001). Однако положительные результаты эффекта следует интерпретировать осторожно из-за высокой гетерогенности (I2 = 84), которая может приводить к статистическому искажению объединенного результата. В подгруппах были изучены контрольные точки на 1, 3, 5, 7 и 10-е сутки проведения терапии. Количество включенных работ на контрольных точках составило от 2 до 3, поэтому гетерогенность (I2) публикаций колебалась в интервале 0–96. В течение первых 5 сут гетерогенность не была высокой (I2 = 0–27). На 7-е и 10-е сутки была обнаружена значительная неоднородность (I2 = 85 и 96 соответственно), поэтому метаанализ был рассчитан с использованием модели случайных эффектов. Метаанализ показал влияние добавления к традиционной терапии КГС на оксигенацию на 3-и сутки (MD: 1,77; 95% ДИ 1,18–2,37; p < 0,001), 5-е сутки (MD: 2,32; 95% ДИ 1,34–3,30; p < 0,001), 7-е сутки (MD: 2,09; 95% ДИ 1,02–3,17; p = 0,0001). Изучаемая сатурация на этих этапах в контрольной группе была ниже (рис. 5).
Рис. 5. Метаанализ эффекта добавления КГС к традиционной терапии на уровень SpO2
Fig. 5. Meta-analysis of the effect from adding HOM to conventional therapy on SpO2 levels
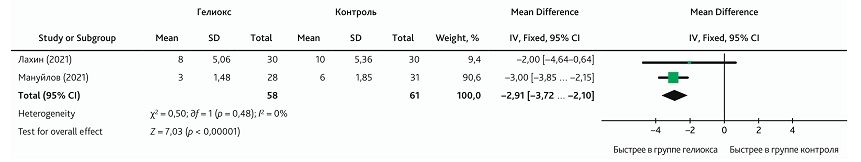
Положительное влияние добавления КГС к традиционной терапии на оксигенацию приводило к более быстрому восстановлению SpO2 (MD: −2,91; 95% ДИ −3,72 ... −2,10; p < 0,001). Величина эффекта по d-критерию Коэна была оценена как выраженная (Cohen’s d ± SD = 1,29 ± 0,2). В этот метаанализ было включено всего 2 исследования [20, 21] с группой 119 пациентов, среди которых 58 получали КГС. Гетерогенность публикаций, рассчитанная с использованием модели фиксированного эффекта, была низкая (I2 = 0, р = 0,48) (рис. 6).
Рис. 6. Метаанализ эффекта влияния ингаляции КГС на сроки восстановления SpO2
Fig. 6. Meta-analysis of the effect from HOM inhalation on the timing of SpO2 recovery
Метаанализ эффекта ингаляции КГС на частоту перевода на ИВЛ
Метаанализ влияния ингаляции КГС на частоту перевода на ИВЛ был основан на 4 исследованиях [20, 23–25]. Всего в анализ было включено 832 пациента, в том числе 416 пациентов, получавших КГС. В одной работе пациенты исходно находились на самостоятельном дыхании [20], в трех публикациях при включении в исследование пациентам проводили неинвазивную вентиляцию легких [21–23]. Несмотря на это, гетерогенность публикаций, рассчитанная с использованием модели фиксированного эффекта, была низкая (I2 = 0, р = 0,74). Проведенный метаанализ добавления КГС к традиционной терапии показал, что оно не влияло на частоту перевода пациентов на ИВЛ (ОШ 0,78; 95% ДИ 0,54–1,12; p = 0,18) (рис. 7).
Рис. 7. Метаанализ влияния добавления КГС к традиционной терапии на частоту перевода на ИВЛ
Fig. 7. Meta-analysis of the effect from adding HOM to conventional therapy on the frequency of transfer to mechanical ventilation

Метаанализ влияния ингаляции КГС на длительность нахождения в ОРИТ
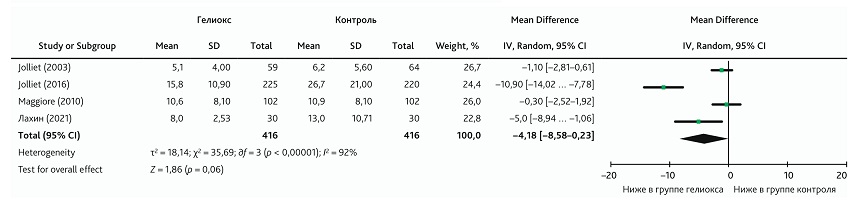
В этот метаанализ были включены 4 клинических исследования [20, 23–25]. Общий результат не показал влияния добавления КГС к традиционной терапии на длительность нахождения в ОРИТ; доверительный интервал общего эффекта был слишком широким и пересекал линию нулевого эффекта (MD: −4,18; 95% ДИ −8,58–0,23; p = 0,06) (рис. 8). Неоднородность также была слишком высокой, что указывало на возможный риск статистического искажения общего эффекта (I2 = 92, р < 0,001).
Рис. 8. Метаанализ влияния добавления КГС к традиционной терапии на длительность нахождения в ОРИТ
Fig. 8. Meta-analysis of the effect from adding HOM to conventional therapy on length of stay in the ICU
Метаанализ влияния ингаляции КГС на длительность госпитализации
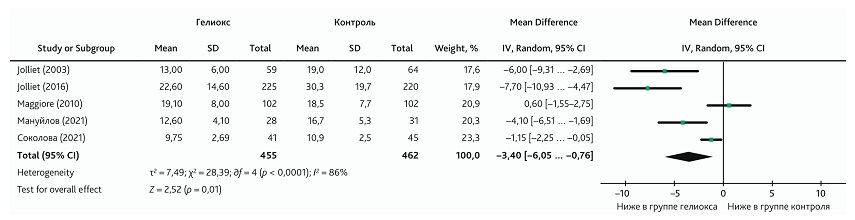
В метаанализ, оценивающий воздействие КГС на длительность госпитализации, были включены 5 публикаций [21–25]. Всего в анализ было включено 917 пациентов, в том числе 455 пациентов, получавших КГС. Нами была выявлена высокая гетерогенность в результатах исследований (I2 = 86), поэтому метаанализ был проведен с использованием модели случайных эффектов. Доверительный интервал был широким, но не пересекал линию нулевого эффекта. Общий результат, который был оценен как малый (Cohen’s d ± SD = 0,17 ± 0,07), показал, что добавление ингаляции КГС приводило к снижению длительности госпитализации (MD = −3,40; 95% ДИ −6,05 ... −0,76; р = 0,01) (рис. 9).
Рис. 9. Метаанализ влияния добавления КГС к традиционной терапии на длительность госпитализации
Fig. 9. Meta-analysis of the effect from adding HOM to conventional therapy on length of hospitalization
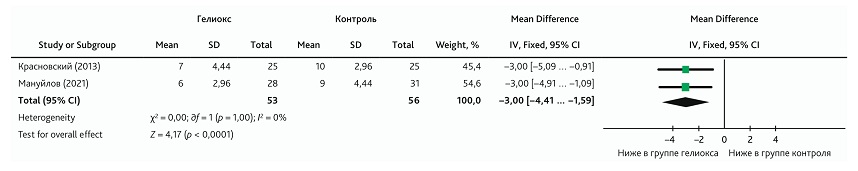
Метаанализ влияния ингаляции КГС на длительность кашля
Для оценки длительности кашля при добавлении КГС к традиционной терапии в метаанализ было включено 2 исследования [5, 21]. Всего в анализ было включено 109 пациентов, в том числе 53 пациента, получавших КГС. Гетерогенность публикаций, рассчитанная с использованием модели фиксированного эффекта, была низкая (I2 = 0, р = 1,0). Проведенный метаанализ показал выраженный эффект (Cohen’s d ± SD = 0,8 ± 0,2) снижения длительности кашля при добавлении КГС к традиционной терапии (MD: −3,00; 95% ДИ −4,41 ... −1,59; p < 0,001) (рис. 10). Однако результат эффекта следует интерпретировать осторожно из-за его небольшого размера выборки.
Рис. 10. Метаанализ эффекта добавления КГС к традиционной терапии на длительность кашля
Fig. 10. Meta-analysis of the effect from adding HOM to conventional therapy on cough duration
Метаанализ влияния ингаляции КГС на уровень СРБ
В данный метаанализ были включены 4 работы, исследовавшие динамику С-реактивного белка (СРБ) [5, 17, 21, 22]. Общий метаанализ показал разницу, свидетельствующую о малом эффекте (Cohen’s d ± SD = 0,3 ± 0,08) снижения СРБ при добавлении ингаляции КГС к традиционной терапии (MD: −16,83; 95% ДИ −25,69 ... −7,98; p = 0,0002). Однако положительные результаты эффекта следует интерпретировать осторожно из-за высокой гетерогенности (I2 = 97), которая может привести к статистическому искажению объединенного результата. Анализ подгрупп был проведен на контрольных точках 1, 3, 7 и 10-х суток проведения терапии. Количество включенных работ на контрольных точках составило от 2 до 3, поэтому гетерогенность (I2) публикаций колебалась в интервале 0–88. На 1, 3 и 7-е сутки была обнаружена значительная неоднородность (I2 = 71, 88 и 70 соответственно), поэтому метаанализ был рассчитан с использованием модели случайных эффектов. На 10-е сутки гетерогенность была низкой (I2 = 0). На контрольных точках 1-х и 3-х суток не было выявлено эффекта влияния ГКС на уровень СРБ. Метаанализ показал эффект добавления к традиционной терапии КГС в виде более низкого уровня СРБ на 7-е сутки (MD: −18,31; 95% ДИ −25,06–11,57; p < 0,001), 10-е сутки (MD: −25,84; 95% ДИ −28,02 ... −23,65; p < 0,001) (рис. 11).
Рис. 11. Метаанализ влияния добавления КГС к традиционной терапии на уровень СРБ
Fig. 11. Meta-analysis of the effect from adding HOM to conventional therapy on CRP levels

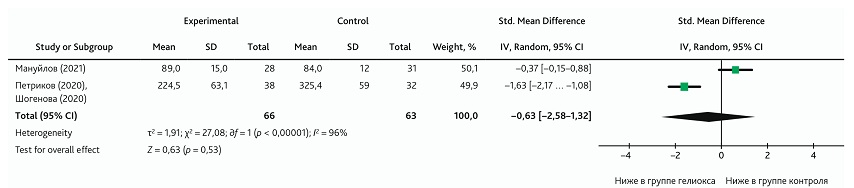
Метаанализ влияния ингаляции КГС на уровень ферритина
В метаанализ, изучающий влияние КГС на уровень ферритина, были включены 2 клинических исследования [17, 21]. Общий результат не показал влияния добавления КГС к традиционной терапии на уровень ферритина; доверительный интервал общего эффекта был широким и пересекал линию нулевого эффекта (SMD: −0,63; 95% ДИ −2,58–1,32; p = 0,53) (рис. 12). Гетерогенность также была высокой, что указывает на риск возможного статистического искажения результата.
Рис. 12. Метаанализ эффекта влияния ингаляции КГС на уровень ферритина
Fig. 12. Meta-analysis of the effect from HOM inhalation on ferritin levels
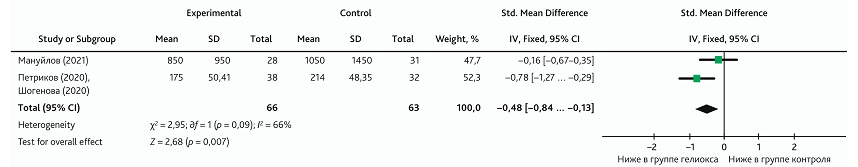
Метаанализ влияния ингаляции КГС на уровень D-димеров
В проведенный метаанализ, изучающий влияние КГС на уровень D-димеров, были включены 2 клинических исследования [17, 21]. Данные уровня D-димеров были извлечены из исследований на контрольной точке 10-е сутки от включения в исследование. Общий результат показал средний эффект (Cohen’s d ± SD = 0,47 ± 0,18) влияния добавления КГС к традиционной терапии: уровень D-димеров в группе с КГС был ниже (SMD: −0,48; 95% ДИ −0,84 ... −0,13; p = 0,007) (рис. 13). Гетерогенность была высокой, что указывает на риск возможного статистического искажения результата. Положительный результат эффекта также следует интерпретировать осторожно из-за небольшого размера выборки.
Рис. 13. Метаанализ эффекта влияния ингаляции КГС на уровень D-димеров
Fig. 13. Meta-analysis of the effect from HOM inhalation on the level of D-dimers
Оценка достоверности доказательств была произведена с использованием подходов GRADE (табл. 3). Важными результатами работы были расценены следующие исходы: влияние КГС на оксигенацию, скорость восстановления уровня SpO2 и длительность кашля. Влияние КГС на длительность кашля было оценено как доказательство высокого качества (качество доказательств было повышено из-за высокого уровня эффектов по Cohen (d ≥ 0,8)). Влияние КГС на скорость восстановления сатурации рекомендации было умеренного качества (качество доказательств было повышено из-за высокого уровня эффектов по Cohen (d ≥ 0,8)). Влияние на оксигенацию было низкого качества. Остальные результаты анализа GRADE показали, что общее качество этих доказательств было очень низким, что не способствовало их убедительности. Качество доказательств было понижено из-за значительного и высокого уровня гетерогенности результатов исследований (I2 > 50).
Таблица 3. Достоверность доказательств с использованием метода GRADE
Table 3. Certainty of evidence using the GRADE method
| Оценка достоверности | Количество пациентов | Эффект | Результат | Важность | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Количество исследований | Дизайн исследования | Риск предвзятости | Непоследовательность | Косвенность | Неточность | Прочее | Гелиокс | Гелиокс + стандартная терапия | Относительный (95% ДИ) | Абсолютный (95% ДИ) | ||
| Влияние на оксигенацию, SpO2, % | ||||||||||||
| 4 | РКИ + неРКИ | Не выражен | Не выражена | Не выражена | Выражена | Высокий размер эффекта | 441 | 444 | — | MD на 1,68 выше (1,13–2,24) | + + − − Низкий |
Важный |
| Восстановление сатурации, дни | ||||||||||||
| 2 | РКИ + неРКИ | Не выражен | Не выражена | Не выражена | Не выражена | Высокий размер эффекта | 58 | 61 | — | MD на 2,91 ниже (2,1–3,72) | + + + − Умеренный |
Важный |
| Длительность кашля, дни | ||||||||||||
| 2 | РКИ + неРКИ | Не выражен | Не выражена | Не выражена | Не выражена | Очень высокий размер эффекта | 53 | 56 | — | MD на 3,0 ниже (1,59–4,41) | + + + + Высокий |
Важный |
| СРБ, мг/л | ||||||||||||
| 4 | РКИ + неРКИ | Не выражен | Не выражена | Не выражена | Выражена | Нет | 318 | 318 | — | MD на 16,83 ниже (7,68–25,69) | + − − − Очень низкий |
Неважный |
| D-димер, нг/мл | ||||||||||||
| 2 | РКИ + неРКИ | Не выражен | Не выражена | Не выражена | Выражена | Нет | 66 | 63 | — | SMD на 0,48 ниже (0,13–0,84) | + − − − Очень низкий |
Неважный |
| Длительность госпитализации, дни | ||||||||||||
| 5 | РКИ + неРКИ | Не выражен | Не выражена | Не выражена | Выражена | Нет | 455 | 462 | — | MD на 3,4 ниже (0,76–6,05) | + − − − Очень низкий |
Неважный |
| MD — разность средних значений показателей; SMD — стандартизированная разность средних; 95% ДИ — 95%-й доверительный интервал; неРКИ — нерандомизированное клиническое исследование; РКИ — рандомизированное клиническое исследование. | ||||||||||||
В медицине КГС применяют в основном в неонатологии и педиатрической практике при лечении обструктивной патологии [12, 26–28]. У взрослых пациентов использование КГС сосредоточено у 3 групп пациентов: при лечении ХОБЛ и бронхиальной астмы, пневмонии, а также в качестве газа-носителя для доставки лекарственных средств [6, 24, 29–32]. В этом обзоре мы проанализировали 8 исследований, в которых объективно оценивалось влияние добавления КГС к стандартной терапии при лечении пневмонии у 1097 пациентов [5, 17, 20–25].
Мы изучили 10 основных эффектов. Для 4 из них (летальность, частота перевода на ИВЛ, длительность нахождения в ОРИТ, уровень ферритина) объединенные результаты не продемонстрировали какого-либо эффекта от добавления КГС к традиционной терапии. Следует отметить, что в некоторых исследованиях на педиатрических группах пациентов КГС показала свою эффективность и положительное влияние на летальность, частоту перевода на ИВЛ. Так, в систематическом обзоре Long C. еt al. (2016) у недоношенных детей при респираторном дистресс-синдроме метаанализ показал значительное снижение потребности в инвазивной вентиляции в группе КГС по сравнению с группой стандартной терапии (р = 0,006) [33]. В исследовании Elleau С. еt al. (2016) недоношенным новорожденным в группе КГС требовалась более низкая концентрация вдыхаемого кислорода, более короткая продолжительность вентиляции, что приводило к уменьшению летальности и случаев бронхолегочной дисплазии [34].
Метаанализ влияния ингаляции КГС на оксигенацию показал положительный эффект. В анализ были включены 4 исследования с общим количеством 275 пациентов [17, 20–22], 2 из которых были выполнены у пациентов с коронавирусной инфекцией [17, 20]. Максимальный эффект был достигнут на 3–5-е сутки и продолжался до 7-х суток, затем различия снижались. Улучшение оксигенации при добавлении КГС были обнаружены и в исследовании Ma J. еt al. (2016): добавление КГС к вентиляции легких у новорожденных с аспирационным синдромом приводило увеличению индекса РаО2 /FiO2 (P/F) и сокращало время до экстубации по сравнению с традиционной терапией [28]. В работе Seliem W., Sultan A.M. (2018) через 2 ч ингаляции КГС сатурация и РаО2 значительно улучшились по сравнению с контрольной группой (98,3 против 92,9; 62,0 мм рт. ст. против 43,6 мм рт. ст.; р = 0,04 и 0,01 соответственно). Кроме того, индекс PaO2/FiO2 был значительно выше в группе КГС по сравнению с традиционной терапией (206,7 против 145,3) [35].
Сложно представить, что ингаляция КГС напрямую влияет на острофазовые ферменты, но полученные результаты метаанализа уровня СРБ свидетельствуют о его снижении при включении КГС в проводимую терапию. В метаанализ были включены 4 работы с общим количеством 265 пациентов [5, 17, 21, 22]. Эффект снижения уровня СРБ был достигнут к 7-м суткам исследования и далее. Возможно, улучшение оксигенации, которое достигало эффекта к 5-м суткам за счет положительной динамики, влекло за собой и снижение острофазовых показателей. В исследовании Ma J. еt al. (2016) маркеры воспаления снижались уже через 6 ч по сравнению с исходными. Уровни интерлейкина-6 (p < 0,001), фактора некроза опухоли-альфа (p < 0,001), СРБ (p = 0,012) в группе с применением КГС были ниже по сравнению с теми же показателями контрольной группы [28].
Положительной динамикой течения заболевания можно объяснить и сокращение сроков госпитализации, хотя качество этих доказательств является низким. Возможно, высокой гетерогенности способствовало включение в этот анализ разнородных по тяжести групп пациентов, находившихся на неинвазивной вентиляции легких и на самостоятельном дыхании.
Полученные в результате систематического обзора метаанализа данные свидетельствуют о том, что добавление КГС к традиционной терапии может улучшить оксигенацию. Эти положительные эффекты проявлялись независимо от того, какой протокол ингаляции КГС использовался. Тем не менее не было отмечено снижения летальности, частоты перевода на ИВЛ, длительности нахождения в ОРИТ. Включение КГС в проводимую терапию может сократить продолжительность кашля, а также снизить уровень острофазовых ферментов (СРБ) и D-димеров. Необходимы дальнейшие исследования с однородной методикой применения КГС у пациентов с дыхательной недостаточностью, вызванной развитием пневмонии, и более однородными группами пациентов (самостоятельное дыхание и вентиляция легких). Такие исследования позволили бы получить необходимую информацию о месте КГС в интенсивной терапии дыхательной недостаточности при пневмонии.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.