В настоящее время при лечении сепсиса принято широко применять неинвазивные методы мониторинга кровообращения [1]. Лишь в последних международных рекомендациях по лечению сепсиса появилось указание на необходимость максимально рано начинать инвазивный контроль артериального давления (АД) при септическом шоке [2, 3]. Остается общепринятым алгоритм [4], который при удовлетворительном состоянии больного предусматривает контроль общеклинических показателей, при ухудшении состояния — эхокардиографическое (ЭхоКГ) обследование, а начало инвазивного мониторинга центральной гемодинамики (ЦГД) только тогда, когда ЭхоКГ не дает исчерпывающей информации о функции сердца либо когда прогрессирует нестабильность кровообращения и рефрактерность к симпатомиметическим препаратам. Вполне закономерно, что при такой «эскалационной тактике» многие лечебные меры могут оказаться несвоевременными. Кроме того, рутинное использование ЭхоКГ как основной меры мониторинга ЦГД в отделениях реанимации и интенсивной терапии (ОРИТ) общего профиля не всегда реализуемо и достаточно эффективно [5]. Вместе с тем есть основания полагать, что инвазивный мониторинг ЦГД показан больным с высоким риском летального исхода — не как крайняя мера, а как стандартный компонент интенсивного лечения, направленный на выявление самых ранних признаков миокардиальной дисфункции [6]. Транспульмональная термодилюция (ТПТД), например, позволяет выявить нарушения функции сердца, повышающие риск летальности и, вероятно, требующие целенаправленной коррекции [3, 7, 8]. Таким образом, для объективизации показаний к раннему началу инвазивного мониторинга, в частности с помощью ТПТД, и углубленной оценки функции сердца необходимо установление предикторов летального исхода, которые доступны для рутинного определения и могут проявиться в течение первых суток от поступления больного в ОРИТ. Для проверки этой гипотезы выполнили двухэтапное ретроспективное исследование.
Цель исследования: проанализировать предикторную значимость в отношении риска летальности клинико-лабораторных показателей, оценка которых доступна в первые 24 ч нахождения больных с сепсисом в ОРИТ, и оценить целесообразность начала инвазивного мониторинга ЦГД у больных с предикторами неблагоприятного исхода.
В соответствии с разрешением этического комитета ФУВ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского (протокол № 11 от 13.12.2018) выполнили ретроспективное обсервационное исследование на базе ОРИТ ГБУЗ ГКБ им. В.М. Буянова ДЗМ и ГБУЗ МО МОНИКИ им. М.Ф. Владимирского. В ретроспективное исследование включили больных с абдоминальным сепсисом или септическим шоком, находившихся в ОРИТ с 01.06.2019 по 01.06.2020.
Критерии включения в исследование:
Критерии невключения:
Критерии исключения:
Всего было отобрано 267 медицинских карт, полное соответствие критериям включения установлено у 157 больных. Причины невключения в исследование: смерть в первые часы после поступления в ОРИТ до выполнения лабораторных исследований (n = 13), терминальная стадия онкологического заболевания (n = 55), наличие сопутствующих клапанных заболеваний сердца и осложненных форм ишемической болезни сердца, хронической недостаточности кровообращения (n = 40), беременность (n = 2). Исключены из исследования 23 пациента, причины исключения: летальный исход, не связанный с сепсисом (n = 17), перевод в другое отделение или стационар (n = 6).
Проанализированы данные 134 больных (мужчины, n = 82; женщины, n = 52) в возрасте 22–85 (58,5 [43–71]) лет с абдоминальным сепсисом, осложнившим острый деструктивный панкреатит (n = 45), острый гангренозный аппендицит (n = 7), перфоративную язву двенадцатиперстной кишки или желудка (n = 26), перфорацию кишечника (n = 25), кишечную непроходимость (n = 8), острый деструктивный холецистит (n = 4), острый холангит (n = 7), обструктивный пиелонефрит (n = 4), язвенный колит (n = 1), мезентериальный тромбоз (n = 4), перфорацию мочевого пузыря (n = 1), разрыв яичника (n = 1), ножевое ранение толстой и тонкой кишки (n = 1). Тяжесть состояния при поступлении в ОРИТ по шкале APACHE II составила 4–31 (13 [11–17]) балл, по шкале SOFA — 1–14 (6[4–8]) баллов. Симпатомиметические препараты в первые 24 ч нахождения в ОРИТ были назначены в 86 (64 %) наблюдениях; септический шок был диагностирован в 26,9 % случаев (n = 36); летальность в ОРИТ составила 47 % (n = 63).
Все больные получали стартовую антибиотикотерапию препаратом широкого спектра, имеющим антианаэробный эффект, либо комбинацию, один из компонентов которой имел антианаэробный эффект. В 25 % наблюдений назначали меропенем (3 г/сут), в 25 % — имипенем-циластатин (3 г/сут), в 50 % — комбинацию цефтриаксона (4 г/сут) и метронидазола (1,5 г/сут). По результатам бактериологических посевов продолжали стартовую терапию либо начинали применять цефоперазон-сульбактам, цефепим или комбинацию ципрофлоксацина и амикацина.
Инфузии сбалансированных кристаллоидных растворов, назначение симпатомиметических препаратов и другие лечебные меры выполняли в соответствии с рекомендациями «Сепсис-3» [9]. Решение о назначении норэпинефрина (НЭ) принимали в течение первого часа после поступления больного в ОРИТ, если в результате инфузии среднее АД (АДср) не достигало уровня 65 мм рт. ст. В первые 24 ч от момента поступления всем больным выполняли катетеризацию магистральной вены (подключичная и/или внутренняя яремная).
На первом этапе исследования во всех 134 наблюдениях проанализированы демографические показатели, оценка тяжести состояния больных при поступлении в ОРИТ по шкалам APACHE II и SOFA, АДср, частота сердечных сокращений (ЧСС), лабораторные показатели (лактатемия, pH центральной венозной крови), определенные стандартными лабораторными методами в первые сутки интенсивного лечения после первичной стабилизации состояния больного в результате рекомендованных мер интенсивной терапии [9]. Кроме того, анализировали информацию о содержании в плазме венозной крови N-терминального отрезка предшественника натрийуретического пептида B-типа (NT-proBNP) и прокальцитонина (ПКТ), если эти данные были получены в первые 24 ч пребывания больных в ОРИТ. NT-proBNP определяли фотометрическим методом с помощью автоматического анализатора Dimension Xpand Plus (Siemens, США); ПКТ — иммуноферментным методом с помощью анализатора miniVIDAS (BioMerieux, Франция). Ретроспективно рассчитывали инотропный индекс (ИИ) и вазоактивно-инотропный индекс (ВИИ) в условных единицах (у.е.) [10]:
На втором этапе исследования отобрали больных, у которых в интервале 24–72 ч от поступления в ОРИТ по общеклиническим показаниям был налажен инвазивный мониторинг ЦГД с помощью ТПТД по стандартной методике [11]. В эту выборку вошли 52 пациента (мужчины, n = 33; женщины, n = 19) в возрасте 22–83 (48 [39–64]) года. Симпатомиметические препараты были назначены в 63,4 % наблюдений (n = 33); летальность в ОРИТ составила 30,7 % (n = 16). К моменту начала ТПТД все больные находились на ИВЛ и получали седацию пропофолом.
При ретроспективном анализе пациентов разделили на 2 подгруппы: с наличием сочетания факторов риска летальности (n = 14) и без факторов риска (n = 38). В качестве факторов риска рассматривали предикторы летального исхода, установленные на первом этапе исследования (SOFA > 8 баллов и лактатемия > 1,8 ммоль/л).
Регистрировали сердечный индекс (СИ), индексированные общее периферическое сосудистое сопротивление (ИОПСС), ударный объем (ИУО), глобальный конечно-диастолический объем (ИГКДО), а также глобальную фракцию изгнания сердца (ГФИС) и индекс функции сердца (ИФС = ИГКДО/СИ, норма — 4,5–6,5 мин−1). Ретроспективно рассчитали индекс мощности сердца (ИМС = СИ × АДср /451) и показатель «производительность сердца, обусловленная постнагрузкой» (ПСОП) [6]:
СИ / (ИОПСС − 0,64 × 394,07) × 100 (%).
Статистический анализ выполнили с помощью программных пакетов Microsoft Office Excel и MedCalc 15. Характер распределения данных определяли с помощью критериев Колмогорова—Смирнова и Шапиро—Уилка. Данные представили в виде максимального (max) и минимального (min) значений, медианы (Me), 25-го и 75-го квартилей (P25–P75), а при нормальном распределении — дополнительно в виде средних величин (M) и ошибок средних (m). Отличие несвязанных выборок при распределении, отличном от нормального, определяли с помощью критерия Манна—Уитни, при нормальном — с помощью t-критерия Стьюдента. Отличия частот признаков (Р) оценивали с помощью точного критерия Фишера.
Влияние независимых переменных на зависимую, закодированную бинарно, оценили с помощью логистической регрессии. Рассчитывали отношение шансов (ОШ), 95%-й доверительный интервал (95% ДИ) и значимость влияния (р). Для оценки разделительной способности независимых переменных (разграничение больных с наличием и отсутствием признака) выполняли ROC-анализ. В последний включали только те показатели, которые продемонстрировали предикторную значимость по данным логистической регрессии. Анализировали площади под ROC-кривыми (ППК), 95% ДИ ППК и статистическую значимость (p). Качество модели считали при ППК > 0,9 — отличным, 0,8–0,89 — очень хорошим, 0,7–0,79 — хорошим, 0,6–0,69 — средним, 0,5–0,59 — неудовлетворительным. Пороговое значение (ПЗ) переменной определяли по индексу Юдена (требование максимальной суммы чувствительности и специфичности), требованию чувствительности теста, приближающейся к 80 %, и требованию баланса между чувствительностью и специфичностью (минимальная разность между этими значениями). За ПЗ принимали значение, в наибольшей степени соответствующее всем трем требованиям.
На первом этапе исследования в качестве зависимой переменной использовали летальный исход (1 — умер, 0 — выжил), а в качестве независимых — возраст, пол, оценки по шкалам APACHE II и SOFA, АДср, ЧСС, уровень лактатемии, pH, ИИ и ВИИ. На втором этапе исследования в качестве зависимых переменных использовали значение СИ (1 — СИ < 2,5 л/мин/м2, 0 — СИ > 2,5 л/мин/м2) и ИФС (1 — ИФС < 5,8 мин−1, 0 — ИФС > 5,8 мин−1) [7], а в качестве независимой — наличие комбинации факторов риска, также закодированной бинарно (1 — сочетание факторов риска есть, 0 — сочетания факторов риска нет).
Отличия и выявленные зависимости считали значимыми при р < 0,05.
При поступлении в ОРИТ оценка по шкалам APACHE II и SOFA указывала на наличие сепсиса и свидетельствовала о тяжелом состоянии большинства больных. Медианное значение АДср (табл. 1) соответствовало рекомендуемому уровню для больных с сепсисом. У 7 % больных АДср было ниже 70 мм рт. ст., у 14,9 % — выше 100 мм рт. ст. Медиана ЧСС указывала на умеренную тахикардию. ЧСС более 90 мин−1 регистрировали у 76 % больных. НЭ был назначен 61,2 % больных, дополнительные симпатомиметические средства — 26,1 % больных, значения ВИИ и ИИ варьировали. Гиперлактатемию ( > 2 ммоль/л) выявили в 37,3 % наблюдений. Значения sVO2 и pH колебались в широких пределах, выходя за границы физиологической нормы. Однако средние значения показателей соответствовали последней. Наличие бактериальной инфекции подтверждалось уровнем ПКТ > 0,05 нг/мл у 92,5 % больных, причем в 76 % наблюдений значения биомаркера были выше 0,5 нг/мл. Значения NT-proBNP, превышающие верхнюю границу нормы (450 пг/мл), выявили у 87 % больных, во многих наблюдениях это превышение было многократным.
Таблица 1. Клинико-лабораторные показатели у больных (n = 134) с абдоминальным сепсисом при поступлении в ОРИТ
Table 1. Clinical and laboratory data in patients (n = 134) with abdominal sepsis on admission to the ICU
| Показатели | Min | Max | Me [P25–P75] (M ± m) |
|---|---|---|---|
| APACHE II, баллы | 4 | 31 | 13 [11–17] |
| SOFA, баллы | 2 | 14 | 6 [4–8] |
| ЧСС, мин−1 | 57 | 150 | 102 [90,3–112,8] (102,3 ± 1,7) |
| АДср, мм. рт. ст. | 57 | 128 | 88 [77–101] (89,0 ± 1,8) |
| ИИ, у.е. | 1 | 29,5 | 7,4 [4,25–14,5] |
| ВИИ, у.е. | 3 | 240 | 27 [14–50] |
| Лактатемия, ммоль/л | 0,5 | 20,3 | 2,1 [1,1–3,2] |
| sO2v, % | 56,4 | 90,3 | 75,3 [68–79,9] (74,2 ± 1,0) |
| рН | 6,97 | 7,52 | 7,319 [7,27–7,39] |
| ПКТ, нг/мл | 0,05 | 200 | 7,0 [0,655–41,8] |
| NT-proBNP, пг/мл (n = 54) | 117 | 35000 | 2570 [1116–6559] |
Среди показателей, регистрация которых была возможна в ранние сроки после поступления больных в ОРИТ (табл. 2), прогностическую значимость продемонстрировали оценки по APACHE II и SOFA, а также лактатемия. Остальные параметры не были ассоциированы с летальностью.
Таблица 2. Предикторная значимость в отношении летального исхода клинико-лабораторных показателей, зарегистрированных в первые 24 ч нахождения в ОРИТ
Table 2. Predictive significance of clinical and laboratory data in first 24 hours in ICU for mortality
| Показатели | ОШ | 95% ДИ | p |
|---|---|---|---|
| Пол | 0,7540 | 0,2545–2,2337 | 0,6115 |
| APACHE II | 1,1814 | 1,0112–1,3804 | 0,0297 |
| SOFA | 1,5712 | 1,1934–2,0686 | 0,0001 |
| АДср | 1,0016 | 0,9734–1,0307 | 0,9124 |
| ЧСС | 0,9835 | 0,9527–1,0153 | 0,2999 |
| ИИ | 0,8820 | 0,7052–1,1031 | 0,2148 |
| ВИИ | 0,9884 | 0,9643–1,0130 | 0,2888 |
| Лактат | 3,5293 | 1,7421–7,1500 | 0,0001 |
| sO2v | 0,9701 | 0,9026–1,0428 | 0,4091 |
| рН | 6,8555 | 0,014–3230,30 | 0,5342 |
| ПКТ | 0,9948 | 0,9846–1,0051 | 0,3225 |
| NT-proBNP | 1,0000 | 0,9999–1,0001 | 0,545 |
Множественный регрессионный анализ с включением трех независимых предикторов подтвердил значимость оценки по шкале SOFA (ОШ 1,4179; 95% ДИ 1,0374–1,9380; р = 0,029) и лактатемии (ОШ 2,7536; 95% ДИ 1,2859–5,8965; р = 0,009). Оценка по APACHE II предикторную значимость потеряла (ОШ 1,006; 95% ДИ 0,8177–1,2390; р = 0,951).
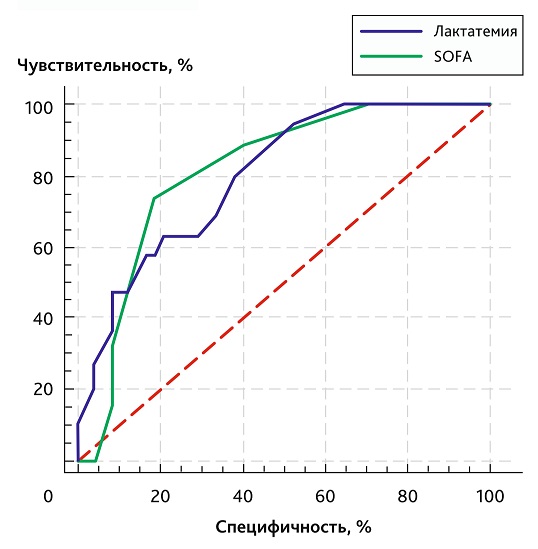
При ROC-анализе оценка по SOFA обеспечила модель очень хорошего качества (ППК 0,813; 95% ДИ 0,698–0,897; р < 0,0001); ПЗ > 8 баллов продемонстрировало чувствительность 74 % и специфичность 81 %. Модель лактатемии также приближалась к уровню очень хорошего качества: ППК 0,799 (95% ДИ 0,684–0,887; р < 0,0001); ПЗ > 1,8 ммоль/л обеспечивало чувствительность 63 % и специфичность 79 %. При совместном ROC-анализе обоих предикторов (рис. 1) ППК возрастала до 0,847 (95% ДИ 0,738–0,923; р < 0,0001), что указывает на улучшение разделительной способности модели.
Рис. 1. ROC-кривые, отражающие разделительную способность лактатемии и тяжести состояния по шкале SOFA в отношении летальности
Fig. 1. ROC-curves of lactatemia and SOFA in mortality prediction

При начале инвазивного мониторинга ЦГД (2-й этап исследования) сочетание факторов риска летального исхода выявили в 26,9 % наблюдений. В подгруппах больных с наличием или отсутствием факторов риска стандартные показатели кровообращения и интенсивность симпатомиметической терапии не различались (табл. 3). Вместе с тем ряд параметров ЦГД, интегрально характеризующих насосную функцию сердца (СИ, ИМС, ПСОП, ИФС, ГФИС), у больных с сочетанием факторов риска были значимо ниже. В 1-й подгруппе частота снижения СИ до уровня менее 2,5 л/мин/м2 составила 50 %, а во 2-й — 2,7 % (р = 0,0002). Частота снижения ИФС до уровня менее 5,8 мин−1 составила 78,6 и 26,3 % (р = 0,00002) соответственно.
Таблица 3. Показатели кровообращения при начале инвазивного мониторинга (n = 52)
Table 3. Hemodynamics at the begining of invasive monitoring (n = 52)
| Группа Показатель |
Сочетание факторов риска есть (n = 14) | Сочетания факторов риска нет (n = 38) | p |
|---|---|---|---|
| SOFA, баллы | 10,5 [9–12] (10,37 ± 0,4) | 7 [6–8,5] (7,3 ± 0,34) | < 0,0001 |
| Лактатемия, ммоль/л | 2,9 [2,3–3,2] (2,8 ± 0,2) | 1 [0,8–1,5] | < 0,0001 |
| АДср, мм рт. ст. | 88,8 [77,2–110] (95,5 ± 6,0) | 89,7 [77,3–104] (90,9 ± 2,4) | 0,742 |
| ЧСС, мин–1 | 100 [88–115,5] (100 ± 5,0) | 100 [89,8–110,5] (98,8 ± 2,7) | 0,880 |
| ИИ, у.е. | 8 [4,5–10,3] (7,8 ± 1,9) | 5 [3,8–9,7] | 0,679 |
| ВИИ, у.е. | 17,5 [0–27] | 3,25 [0–16] | 0,373 |
| СИ, л/мин/м2 | 2,9 [2,4–3] (2,8 ± 0,2) | 3,8 [3,5–4,1] | 0,0006 |
| ИМС, Вт | 0,694 [0,455–0,805] | 0,821 [0,707–1,019] | 0,0372 |
| ПСОП, % | 78,8 [73,5–87,7] (81,1 ± 4,0) | 86,7 [82,1–95,7] | 0,041 |
| ИФС, мин–1 | 5,1 [4–5,5] (4,9 ± 0,3) | 6 [5,42–7] | 0,003 |
| ИУО, мл/м2 | 35,7 [23,0–45,5] (35,9 ± 3,2) | 41 [35,7–53] (43,1 ± 1,8) | 0,08 |
| ГФИС, % | 20,7 [17,2–27,0] (21,3 ± 2,0) | 28,9 [21,52–32,7] | 0,01 |
| ИГКДО, мл/м2 | 694 [573–783] (690 ± 38) | 625 [502–761] | 0,3 |
| ИОПСС, дин×с×см5×м2 | 2124 [1788–2578] (2324 ± 214) | 1895 [1691–2420] (2060 ± 97,5) | 0,22 |
Сочетание установленных в исследовании факторов риска летального исхода являлось независимым предиктором уровня СИ < 2,5 л/мин/м2 (ОШ 37,0; 95% ДИ 3,9167–349,5290; р = 0,002) и значений ИФС < 5,8 мин−1 (ОШ 11,8182; 95% ДИ 2,8189–49,5303; р = 0,0007).
Летальность при сепсисе остается высокой даже в самых развитых странах мира [12], что поддерживает постоянный интерес к улучшению в этой клинической ситуации мер интенсивной терапии [2]. Важным компонентом последней является мониторинг кровообращения, однако его оптимальный вариант однозначно не установлен. Отношение к инвазивному контролю ЦГД остается крайне сдержанным, его рекомендуют только у наиболее тяжелых больных [4]. Сохраняется неопределенное отношение к поддержанию насосной функции сердца: с одной стороны, не рекомендуют целенаправленно корригировать СИ [13], с другой, указывают, что назначение инотропных лекарственных средств показано при миокардиальной дисфункции [2], методика выявления которой также остается предметом дискуссии. В частности, рекомендуют рассматривать в качестве основного показания к назначению препаратов, улучшающих инотропизм миокарда, персистирующую, несмотря на инфузии и введение вазопрессоров, гипоперфузию [2].
В последних согласительных документах по лечению сепсиса [2, 14] для оценки функции сердца рекомендуют использовать ЭхоКГ, не детализируя протокол последней. Вместе с тем ранние стадии септической миокардиальной дисфункции, тем более нарушение процессов расслабления, могут быть выявлены только с помощью достаточно сложных ЭхоКГ-методик, предполагающих применение аппаратуры экспертного уровня и высокую квалификацию исследователя [15, 16]. В практике отечественных ОРИТ общего профиля чаще всего доступна стандартная прикроватная ЭхоКГ с оценкой насосной функции сердца по фракции изгнания левого желудочка и его объемам. Это исследование не обеспечивает надежной диагностики септической кардиомиопатии и не дискриминирует больных с высоким риском летальности [5, 17]. В результате своевременное выявление сердечной дисфункции становится затруднительным, а назначение адекватных корригирующих мер, в частности инотропных препаратов, может запаздывать, заметно не улучшая состояние больных с выраженными признаками персистирующей гипоперфузии. Рискнем предположить, что наиболее современные данные о более высокой летальности у больных с сепсисом, получающих добутамин и эпинефрин [18], объясняются не столько ятрогенными эффектами этих симпатомиметиков, сколько отсутствием верифицированных показаний к их своевременному назначению.
Полагаем, что задача ранней диагностики нарушения насосной функции сердца и установления показаний к началу инотропной терапии может быть решена с помощью инвазивного мониторинга ЦГД, в частности ТПТД, достаточно легко реализуемой в ОРИТ общего профиля [11]. Ранее выполненные исследования показали, что ряд параметров, определяемых с помощью ТПТД, обладает предикторной значимостью в отношении риска летальности [5 ,8, 19]. Одним из таких показателей является ИФС, отражающий соотношение сердечного выброса и преднагрузки [11]. Определенный уровень ИФС, сохраняющийся на фоне стандартной интенсивной терапии (инфузионная нагрузка, вазопрессоры), указывает на наличие миокардиальной дисфункции [3, 7]. Есть основания рассматривать ИФС как возможный целевой показатель при назначении инотропных лекарственных средств.
Очевидно, максимально раннее начало инвазивного мониторинга ЦГД нельзя рекомендовать всем больным с сепсисом, но оно может быть вполне обосновано у больных с риском летального исхода, высокая вероятность которого установлена в первые сутки интенсивной терапии. Поэтому 1-й этап исследования посвятили выявлению ранних предикторов летального исхода. Проанализировав прогностическую значимость в отношении риска летальности общеклинических и лабораторных показателей, регистрация которых возможна в первые 24 ч нахождения больного в ОРИТ, установили, что наиболее уверенно можно предсказать летальный исход у больных с сочетанием достаточно высокой оценки по SOFA и тенденции к гиперлактатемии. Все остальные показатели, включая уровень ПКТ и биомаркер напряжения миокарда NT-proBNP [20], не обеспечивали раннего выявления больных с риском летальности.
Оба установленных фактора риска являются стандартными компонентами клинико-лабораторного обследования больных с сепсисом. Оценка по SOFA, предложенная более 25 лет назад [21], сохраняет несомненную актуальность при оценке риска летальности [22, 23]. Более того, в настоящее время получены свидетельства связи компонентов этой шкалы с нарушениями при сепсисе внутриклеточных сигнальных путей, изменениями уровня матричной и митохондриальной РНК [24]. Указывают, что кардиальная подшкала SOFA в первые 24 ч нахождения в ОРИТ может стратифицировать риск летальности у больных с сепсисом и сопутствующими сердечно-сосудистыми заболеваниями, а также при сочетании септического и кардиогенного шока [25]. Установленные в настоящей работе ППК и ПЗ оценки по SOFA, указывающие на высокий риск летального исхода, практически совпали с результатами наиболее современных исследований, посвященных предикторной способности этой шкалы [26].
Гиперлактатемия является общепризнанным показателем тканевой гипоксии в результате гипоперфузии, характерной для сепсиса [27]. Установленное ПЗ оказалось несколько ниже уровня гиперлактаемии, характерного для септического шока [9]. Полагаем, что это вполне закономерно, так как повышенный риск летальности могут иметь и больные без отчетливых проявлений септического шока в первые сутки нахождения в ОРИТ [27, 28]. Принципиально важно, что предикторная способность в отношении летальности в проанализированных клинических наблюдениях становилась более выраженной при сочетании установленной оценки по шкале SOFA и определенного уровня лактатемии. Полагаем, что именно в таких клинических наблюдениях возникают показания к раннему началу ТПТД, так как есть веские основания предполагать наличие миокардиальной дисфункции, вносящей свой вклад в усугубление тканевой гипоксии [29].
Второй этап исследования был посвящен проверке гипотезы о наличии показаний к инвазивному мониторингу ЦГД у больных с высоким риском летальности. Полученные результаты подтвердили предположение о необходимости ранней углубленной оценки состояния системы кровообращения у больных с установленными предикторами летального исхода. В этой группе наблюдений АДср, ЧСС и интенсивность симпатомиметической терапии были такими же, как у остальных больных. Однако практически все параметры ЦГД, отражающие насосную функцию сердца и сократимость миокарда (СИ, ИМС, ПСОП, ИФС, ГФИС) [11], были снижены. Вместе с тем ИГКДО и ИОПСС, изменение которых считают типичным для дистрибутивного септического шока [8], не отличались. Депрессия насосной функции сердца в отсутствие отличий преднагрузки и постнагрузки дает основания считать основной причиной нарушения сократимости миокарда комплекс патологических процессов, характерных для септической кардиомиопатии [30, 31]. Угнетение сократимости, в свою очередь, объективно подтверждает необходимость назначения инотропных препаратов [2].
Отметим, что значимое снижение СИ, дающее основание предположить комбинацию сепсиса с кардиогенным шоком [29] и зарегистрированное в половине наблюдений при сочетании установленных факторов риска летальности, диагностировали хотя и не максимально часто, но в 18,5 раза чаще, чем у больных, не имевших такого сочетания. Полагаем, что это является достаточно веским аргументом в пользу раннего начала инвазивного мониторинга ЦГД для своевременного выявления нарушений насосной функции сердца, еще не приведших к крайне выраженной клинической картине, в частности к стойкой периферической гипоперфузии.
Вместе с тем углубленный анализ предикторной значимости различных параметров ТПТД [7] показал, что дискриминационная способность СИ, ПСОП и ГФИС в отношении высокого риска летальности на фоне корригирующих мер, проводимых в первые несколько суток нахождения больных в ОРИТ, может существенно ухудшаться. При этом нарушение сократимости миокарда может сохраняться у больных с нормальным СИ [6]. Упоминавшийся выше ИФС указывает на сохранение миокардиальной дисфункции, персистирующей в течение нескольких первых суток нахождения больного в ОРИТ, несмотря на стандартные корригирующие меры, при этом ассоциированное с летальностью ПЗ ИФС < 5,8 мин−1 [7]. Сочетание факторов риска оказалось достоверным предиктором уровня ИФС < 5,8 мин−1, который был выявлен у большинства больных соответствующей подгруппы.
Отметим, что определение СИ выполнимо с помощью различных, в том числе неинвазивных, методов, однако оценка ИФС возможна только при ТПТД. Инвазивный мониторинг ЦГД в такой клинической ситуации становится не крайним средством разобраться в причинах прогрессирующего критического состояния больного, а важным диагностическим инструментом, позволяющим выявить признаки миокардиальной дисфункции, еще не проявляющейся клинически, но требующей определенных корригирующих мер.
Отдавая себе отчет в определенной дискуссионности предложения максимально рано начинать инвазивный мониторинг ЦГД у больных с высоким риском летальности, отметим, что в последние годы отчетливо возрос интерес к септической кардиомиопатии и ее патогенетической роли в исходах сепсиса [30, 31]. Заметно повышение интереса к функции сердца и корректности оценки кровообращения в последних клинических рекомендациях [2], в частности, можно отметить акцент на инотропных эффектах и указание на целесообразность инвазивного контроля АД при развитии септическом шока. Можно предположить, что достаточно широкое, но обоснованное применение ТПТД, имеющей не более высокий риск осложнений, чем стандартный инвазивный контроль АД, окажет положительный эффект на качество интенсивного лечения сепсиса. В качестве показаний к раннему началу ТПТД можно рассматривать сочетание оценки по SOFA > 8 баллов и лактатемии > 1,8 ммоль/л.
Полагаем, что у данного исследования имеются ограничения: ретроспективный характер, ограниченное число клинических наблюдений и невозможность включить в анализ данные ЭхоКГ экспертного уровня.
Таким образом, среди клинико-лабораторных показателей, оценка которых доступна в первые 24 ч нахождения больных с сепсисом в ОРИТ, значимыми предикторами летального исхода являются оценка по шкале SOFA > 8 баллов и лактатемия > 1,8 ммоль/л. Для большинства больных с сочетанием этих факторов риска характерно наличие признаков миокардиальной дисфункции (78,6 % наблюдений), а для 50 % — критическое снижение СИ до уровня < 2,5 л/мин/м2, что указывает на целесообразность использования у них инвазивного мониторинга ЦГД, в частности с помощью ТПТД.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Этическое утверждение. Исследование было одобрено локальным этическим комитетом ФУВ ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва, Россия (протокол № 11 от 13.12.2018).
Ethics approval. The present study protocol was approved by the local Ethics Committee of the Moscow Regional Research and Clinical Institute, Moscow, Russia (reference number: 11-13/12/2018).
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.