Несмотря на современные достижения в области профилактики алкоголизма и наркомании, в большинстве стран мира распространенность тяжелых экзогенных интоксикаций остается достаточно высокой. При этом одним из наиболее часто встречающихся и опасных осложнений острых отравлений является рабдомиолиз (РМ). Установлено, что РМ диагностируют у 60 % пациентов с острыми отравлениями, поступающих в стационар [1, 2]. В свою очередь, РМ является наиболее типичной причиной развития острого повреждения почек (ОПП) у данной категории пациентов, выявляемого в 10–55 % случаев при экзогенных интоксикациях [3, 4]. Формирование ОПП существенно отягощает течение токсического РМ и является независимым фактором неблагоприятного прогноза, повышая уровень летальности среди пациентов с острым отравлением до 10 % [5, 6]. Важнейшим звеном патогенеза почечного повреждения при РМ является развитие эндогенной интоксикации в результате попадания в системный кровоток продуктов разрушения миоцитов. При этом ведущее патогенетическое значение для формирования ОПП принадлежит миоглобинемии, что обусловлено осаждением свободного миоглобина в почечных канальцах с их последующим повреждением и обтурацией [7–9].
Потенциальная роль экстракорпоральной детоксикации (ЭКД) в предупреждении развития и прогрессирования ОПП заключается в снижении факторов эндогенной интоксикации и купировании водно-электролитных нарушений за счет своевременного применения данного метода лечения. Большинство современных авторов указывают на то, что наибольшей вероятной детоксикационной эффективностью при лечении тяжелого РМ обладают такие методы ЭКД, как селективная гемосорбция (СГ) и различные виды заместительной почечной терапии (ЗПТ) [7, 10]. При этом среди методик ЗПТ предпочтение в большинстве случаев отдают гемодиафильтрации, указывая на ее наиболее высокий детоксикационный потенциал, обусловленный сочетанием конвекционного и диффузионного механизмов массопереноса [11].
Особого внимания, на наш взгляд, заслуживает исследование эффективности подхода, подразумевающего раннее комбинированное применение СГ и гемодиафильтрации (ГДФ) при токсическом РМ, осложненном ОПП, так как данная методика может позволить существенно улучшить результаты лечения за счет суммации детоксикационного эффекта.
Следует отметить, что в современной отечественной и зарубежной литературе не представлены результаты исследований, которые с высокой степенью достоверности позволили бы судить о наличии или об отсутствии более высокой эффективности подобного подхода по сравнению со стандартной интенсивной терапией токсического РМ, осложненного ОПП.
Цель исследования — улучшить результаты лечения пациентов с токсическим РМ, осложненным ОПП, путем раннего применения селективной гемосорбции и гемодиафильтрации.
В одноцентровое проспективное рандомизированное исследование включены 57 пациентов в возрасте от 18 до 55 лет, находившихся на лечении в отделениях реанимации и интенсивной терапии (ОРИТ) ГБУЗ «Городская клиническая больница № 1 им. Н.И. Пирогова» г. Москвы, в период с 2017 по 2020 г. с диагнозом «токсический рабдомиолиз, осложненный ОПП». Рандомизация пациентов проводилась методом «конвертов».
Исследование было проведено в соответствии с Хельсинкской декларацией после получения разрешения локального этического комитета ГБУЗ «Городская клиническая больница № 1 им. Н.И. Пирогова».
У всех пациентов с токсическим РМ, включенных в исследование, имелись клинические и лабораторные признаки развития ОПП, выраженность которого не снижалась на фоне проведения базового комплекса стандартной интенсивной терапии в течение 12–24 ч от момента поступления в ОРИТ. Стандартная интенсивная терапия, проводимая всем пациентам при поступлении в стационар, включала инфузионную терапию, направленную на коррекцию нарушений кислотно-основного состояния (КОС) и водно-электролитного баланса (ВЭБ); стимуляцию диуреза; предупреждение тромбоэмболических осложнений и стресс-язв желудочно-кишечного тракта; нутриционную поддержку, а также, в случае наличия показаний, респираторную и инотропную/вазопрессорную поддержку.
Критериями включения пациентов в исследование являлись анамнестические, клинические и/или химико-токсикологические данные, свидетельствующие о наличии у пациента острого отравления; развитие РМ (уровень креатинфосфокиназы [КФК] выше 1000 ЕД/л); наличие клинических и лабораторных признаков ОПП. Среди токсических агентов, приведших к развитию РМ, по результатам токсикологической экспертизы следует отметить: прием наркотических препаратов (мефедрон, метадон, амфетамин и др.), употребление спиртов (нашатырный, изопропиловый, муравьиный и салициловый), органических веществ и различных лекарственных препаратов (клонидин, фенобарбитал, доксиламин и др.). Однако следует отметить, что в подавляющем большинстве случаев отравления носили смешанный характер и самостоятельно, кроме наркотических препаратов, практически не встречались.
Критерии исключения из исследования: выявленные хронические заболевания мышц (мышечные дистрофии, воспалительные миопатии и др.), абсолютные противопоказания к применению методов ЭКД (продолжающееся кровотечение, агональное состояние).
Всем пациентам в ходе проведения интенсивной терапии выполняли стандартный мониторинг гемодинамических показателей и клинико-лабораторных показателей. При проведении статистического анализа учитывали худший из зарегистрированных в течение суток параметров.
Диагностику ОПП включенным в исследование пациентам с токсическим РМ осуществляли с учетом рекомендаций KDIGO (Kidney Disease: Improving Global Outcomes — инициатива по улучшению глобальных исходов заболеваний почек), определяли стадию ОПП при поступлении в ОРИТ и далее ежесуточно в ходе динамического наблюдения. С целью оценки скорости клубочковой фильтрации (СКФ) выполняли исследование концентрации цистатина С в крови. Для определения выраженности повреждения почек применяли анализ КIM-1 (kidney injury molecule) в моче.
Пациенты рандомизированы на 2 клинические группы. В состав 1-й группы были включены 28 больных, лечение которых с применением мероприятий стандартной интенсивной терапии в течение первых 24 ч нахождения в ОРИТ не привело к снижению выраженности ОПП. В ходе лечения пациентов 1-й группы придерживались стандартных показаний к началу ЗПТ, заключавшихся в развитии выраженных нарушений функций почек, представляющих непосредственную угрозу жизни, несмотря на базовый комплекс интенсивной терапии, проводимый в полном объеме. Такими показаниями являлись: выраженная уремия с повышением концентрации мочевины крови более 40 ммоль/л; анурия или олигурия, рефрактерная к применению диуретиков, повышение уровня калия в крови более 6,5 ммоль/л; тяжелый метаболический ацидоз с рН < 7,15, рефрактерный к проведению инфузионной коррекции нарушений КОС. Представленные выше показания к неотложному началу ЗПТ были выявлены в процессе лечения 21 пациента из состава 1-й группы. Замещение функции почек проводили в режиме ГДФ.
2-я группа состояла из 29 пациентов, при лечении которых применяли комбинированную методику ЭКД, включавшую одновременное или последовательное проведение СГ и ГДФ. В качестве показаний к началу проведения ЭКД для лечения пациентов 2-й группы принимали неэффективность мероприятий начальной стандартной интенсивной терапии, критериями которой являлось отсутствие положительной динамики в виде снижения сывороточных концентраций креатинина, миоглобина и цистатина С по сравнению с исходными показателями, снижения KIM-1 в моче. Клиническим критерием сохраняющегося ОПП являлось персистирование олигурии или анурии (темп диуреза — менее 0,5 мл/кг/ч) без тенденции к увеличению темпа диуреза.
В рамках реализации алгоритма раннего применения комбинированной ЭКД пациентам 2-й группы проводили ГДФ в режиме постдилюции с помощью аппарата для ЗПТ 5008S (Fresenius Medical Care, ФРГ) с использованием стандартного набора магистралей, кислотного и сухого бикарбонатного концентратов, высокопроницаемых гемофильтров FХ800HDF (B. Braun Avitum AG, ФРГ) с площадью поверхности мембраны 1,8 м2 или FХ1000HDF (B. Braun Avitum AG, ФРГ) с площадью поверхности мембраны 2,0 м2. Интермиттирующую ГДФ выполняли в течение 4–6 ч ежесуточно или через день до восстановления функции почек. При проведении ГДФ использовали следующие параметры: скорость кровотока — 250–300 мл/мин; поток диализата — 500–600 мл/мин; скорость и объем ультрафильтрации рассчитывали с учетом волемического статуса пациента и выраженности гипергидратации. СГ пациентам 2-й группы выполняли с помощью гемопроцессора multiFiltratе (Fresenius Medical Care, ФРГ) с использованием режима гемоперфузии (НР) и стандартного картриджа multiFiltrateCassette (Fresenius Medical Care, ФРГ). При этом в качестве массообменного устройства применяли одну из следующих колонок: Эфферон ЦТ («Эфферон», Россия), Cytosorb (CytoSorbents, США), Десепта («Биотех-М», Россия). При проведении СГ скорость кровотока составляла 100–150 мл/мин, продолжительность выполнения операции — 4–8 ч. В качестве сосудистого доступа для осуществления ЭКД использовали предварительно установленный в одну из центральных вен двухпросветный перфузионный катетер.
Результаты, полученные при проведении исследования, представлены как медиана, 25-й и 75-й процентили. С целью изучения нормальности распределения данных применяли метод Колмогорова—Смирнова. В ходе проверки статистических гипотез использовали непараметрические критерии Манна—Уитни и Краскела—Уоллиса. Сопоставление групп по качественным признакам проводили с применением точного критерия Фишера. Для выявления статистической значимости различий в уровнях показателя при наблюдении в динамике пользовались критерием Уилкоксона. В качестве критического уровня статистической значимости принимали вероятность безошибочного прогноза, равную 95 % (p = 0,05).
Исходные значения клинических показателей в исследуемых группах представлены в табл. 1.
Таблица 1. Исходные значения клинических показателей в исследуемых группах
Table 1. Initial values of clinical indicators in the study groups
| Показатели | 1-я группа (n = 28) Me (Q1–Q3) |
2-я группа (n = 29) Me (Q1–Q3) |
|---|---|---|
| Возраст, лет | 33 (27–37) | 31 (24–35) |
| APACHE II, балл | 18 (16–20) | 22 (18–24) |
| SOFA, балл | 6 (5–7) | 7 (6–8) |
| Среднее АД, мм рт. ст. | 81 (76–83) | 77 (68,5–80,5) |
| ЧСС, ЕД/мин | 106 (104–109) | 109 (106–114) |
| ЦВД, см вод. ст. | 2 (1–3) | 1 (0–2) |
| Индекс оксигенации | 310 (301–324) | 284 (273–307,5) |
| Диурез почасовой, мл | 49 (38–57) | 43 (35–52) |
| Me — медиана; АД — артериальное давление; ЧСС — частота сердечных сокращений; ЦВД — центральное венозное давление. | ||
В табл. 2 представлены основные лабораторные показатели пациентов в исследуемых группах при поступлении в ОРИТ.
Таблица 2. Основные лабораторные показатели в исследуемых группах
Table 2. Main laboratory parameters in the study groups
| Показатели | Единицы измерения | 1-я группа (n = 28) Me (Q1–Q3) |
2-я группа (n = 29) Me (Q1–Q3) |
|---|---|---|---|
| Лейкоциты | ×109/л | 11,5 (8,6–12,2) | 12,3 (9,6–17,7) |
| Эритроциты | ×109/л | 4,6 (4,3–5,3) | 5,4 (4,6–6,3) |
| Гемоглобин | г/л | 150 (138–162) | 158 (143–177) |
| Гематокрит | % | 42,4 (40,9–44,2) | 49 (42,1–53,9) |
| Тромбоциты | ×109/л | 244 (197–297) | 229 (188,5–288,5) |
| Общий белок | г/л | 67 (61,3–71,3) | 67,8 (61,4–78,5) |
| Альбумин | г/л | 32,5 (31–34,7) | 34,3 (31,6–41,1) |
| Мочевина | ммоль/л | 11,6 (9,5–13,1) | 14,3 (11–16,7) |
| Креатинин | мкмоль/л | 212 (187–231) | 247 (214,5–284,9) |
| АлАТ | ЕД/л | 176 (148–215,1) | 220 (152–266) |
| АсАт | ЕД/л | 166,4 (147,1–193,3) | 206,1 (183,2–309) |
| Общий билирубин | мкмоль/л | 11,5 (8,3–15) | 15,5 (8,1–22,9) |
| Щелочная фосфатаза | ммоль/л | 92 (75–112,1) | 138 (98,3–168) |
| ЛДГ | МЕ/л | 105 (84–136,3) | 152 (117–174) |
| Лактат | ммоль/л | 3,1 (1,6–4,1) | 5,0 (1,9–6,9) |
| Калий | ммоль/л | 3,5 (3,2–3,9) | 3,9 (3,1–4,9) |
| Натрий | ммоль/л | 139 (136–142) | 138 (133,5–141,5) |
| Кальций | ммоль/л | 0,85 (0,8–0,92) | 0,61 (0,54–0,71) |
| Хлор | ммоль/л | 102 (98,3–104) | 102 (95–106,5) |
| рН | 7,31 (7,27–7,37) | 7,25 (7,21–7,35) | |
| АЧТВ | с | 29,8 (27,8–33,2) | 30 (23,7–41,6) |
| МНО | 1,06 (1,01–1,19) | 1,24 (0,99–1,55) | |
| Фибриноген | г/л | 3,5 (2,8–4,8) | 4,1 (2,4–4,9) |
| КФК | ЕД/л | 14524 (13315–16231) | 19970 (16793–24309,5) |
| С-реактивный белок | мг/л | 88 (65–109) | 105 (83,1–147,8) |
| Миоглобин | мкг/л | 1025,3 (859–1112,3) | 1316 (1062,1–1405,5) |
| KIM-1 | пг/мл | 0,71 (0,48–0,91) | 0,94 (0,68–1,17) |
| Цистатин С | мг/л | 32,8 (21,2–41,4) | 48,1 (35,3–60) |
| KIM-1 — молекула повреждения почек; Me — медиана; АлАТ — аланинаминотрансфераза; АсАТ — аспартатаминотрансфераза; АЧТВ — активированное частичное тромбопластиновое время; КФК — креатинфосфокиназа; ЛДГ — лактатдегидрогеназа, МНО — международное нормализованное отношение. | |||
В соответствии с представленными значениями пациенты в исследуемых группах на начало проведения комплексной интенсивной терапии в ОРИТ были сопоставимы как по возрасту, тяжести состояния, так и по основным клинико-лабораторным показателям (p > 0,05 для всех параметров).
С целью проведения сравнительного анализа детоксикационной эффективности различных подходов к применению ЭКД выполняли исследование динамики концентрации миоглобина в крови, являющегося не только маркером РМ, но и одним из наиболее значимых факторов патогенеза ОПП у данной категории пациентов. В ходе исследования были выявлены различия в скорости и степени снижения концентрации миоглобина в исследуемых группах в течение 1-й недели лечения в ОРИТ. Так, во 2-й группе было отмечено достоверное снижение данного показателя на 3-и сутки по сравнению с его исходным значением после начала проведения интенсивной терапии, составившее 35,9 % (p = 0,0141). В свою очередь, изменение уровня миоглобина в 1-й группе составило 3,8 %, что не имело статистической значимости (p = 0,1390) (табл. 3).
Таблица 3. Динамика уровня сывороточного миоглобина в период с 1-х по 7-е сутки лечения
Table 3. Dynamics of the level of serum myoglobin in the period from the 1st to the 7th day of treatment
| Группа | Миоглобин, мкг/л Ме (25–75) |
% | р | Миоглобин, мкг/л Ме (25–75) |
% | р | |
|---|---|---|---|---|---|---|---|
| 1-е сутки | 3-и сутки | 7-е сутки | |||||
| 1 (n = 28) |
1025,3 (859–1112,3) | 986,2 (824–1093,6) | 3,8 | 0,1390 | 756 (643,2–861,2) | 26,3 | 0,0312 |
| 2 (n = 29) |
1316 (1062,1–1405,5) | 843 (754,3–1112,9) | 35,9 | 0,0141 | 158,3 (92,4–220) | 88,0 | 0,0061 |
| Ме (25–75) — медиана, 25-й и 75-й процентили. | |||||||
Снижение уровня миоглобина крови в течение первых 7 сут лечения оказалось статистически значимым в обеих группах (р < 0,05). Однако достоверно более выраженный характер данные изменения носили во 2-й группе (р < 0,05).
Выявленные различия в динамике концентрации сывороточного миоглобина в группах в течение 1-й недели проведения интенсивной терапии, на наш взгляд, указывают на более высокий детоксикационный потенциал лечебного подхода, подразумевающего раннее применение ГДФ и СГ.
Достоверные различия между исследуемыми группами также были выявлены в результате проведения сравнительного анализа динамики концентрации KIM-1 в моче. Следует отметить, что KIM-1 является одним из наиболее перспективных для широкого клинического применения биомаркеров ОПП, имеющих высокий уровень чувствительности и специфичности при диагностике почечного повреждения. Ниже представлена динамика снижения уровня KIM-1 в моче в течение 7 сут лечения (табл. 4). Следует отметить, что в течение первых 3 сут проведения интенсивной терапии уровень KIM-1 в моче пациентов 1-й группы увеличился на 15,5 % (р < 0,05). Напротив, во 2-й группе за аналогичный период времени данный показатель достоверно снизился на 39,4 % (р < 0,05).
Таблица 4. Изменение концентрации KIM-1 в моче в период с 1-х по 7-е сутки лечения
Table 4. Change in the concentration of KIM-1 in the urine during the period from the 1st to the 7th day of treatment
|
Группа |
KIM-1 пг/мл Ме (25–75) |
% |
р |
KIM-1 пг/мл Ме (25–75) |
% |
р |
|
|---|---|---|---|---|---|---|---|
|
1-е сутки |
3-и сутки |
7-е сутки |
|||||
|
1 (n = 28) |
0,71 (0,48–0,91) |
0,82 (0,71–0,91) |
+15,5 |
0,0472 |
0,17 (0,1–0,24) |
76,1 |
0,0088 |
|
2 (n = 29) |
0,94 (0,68–1,17) |
0,57 (0,44–0,79) |
−39,4 |
0,0212 |
0,01 (0–0,03) |
99,0 |
0,0019 |
|
Ме (25–75) — медиана, 25-й и 75-й процентили. |
|||||||
Более благоприятное течение ОПП среди пациентов 2-й группы подтверждают результаты исследования динамики уровня KIM-1 в моче в течение 7 сут лечения. Так, несмотря на достоверное снижение данного показателя в обеих группах, во 2-й группе оно было более значимым, чем в 1-й группе.
Мы считаем, что выявленные различия изменений концентрации KIM-1 в моче в исследуемых группах отражают снижение выраженности почечного повреждения, что является следствием высокой детоксикационной и нефропротективной эффективности раннего применения комбинированной методики ЭКД.
Важнейшим показателем изменения детоксикационной функции почек при развитии и течении ОПП является динамика СКФ, для наиболее достоверного определения которой мы применяли исследование уровня цистатина С в крови. Повышение концентрации данного фактора в крови происходит при нарушении функции почек, в том числе при ОПП. Снижение свидетельствует о регрессировании почечной недостаточности и увеличении СКФ. В табл. 5 приведены данные о динамике уровня цистатина С среди пациентов, включенных в исследование, в течение 7 сут лечения в ОРИТ.
Таблица 5. Динамика уровня цистатина С в крови в течение 1-й недели лечения в ОРИТ
Table 5. Dynamics of the level of cystatin C in the blood during the first week of treatment in the ICU
| Группа | Цистатин С, мг/л Ме (25–75) |
Степень снижения, % | р | |
|---|---|---|---|---|
| 1-е сутки | 7-е сутки | |||
| 1 (n = 28) |
32,8 (21,2–41,4) | 30,3 (22–40,9) | 7,6 | 0,0941 |
| 2 (n = 29) |
48,1 (35,3–60) | 13,2 (9,4–19,1) | 72,6 | 0,0087 |
| Ме (25–75) — медиана, 25-й и 75-й процентили. | ||||
В ходе исследования выявлено, что снижение данного показателя за указанный период наблюдалось в обеих исследуемых группах, однако среди пациентов 1-й группы изменения не имели статистической значимости (р < 0,05). При этом во 2-й группе отмечено достоверное снижение уровня цистатина С (р < 0,05). Вероятным объяснением указанных различий является наличие выраженного нефропротективного воздействия комбинированного применения ГДФ и СГ в составе комплексной интенсивной терапии токсического РМ, осложненного ОПП.
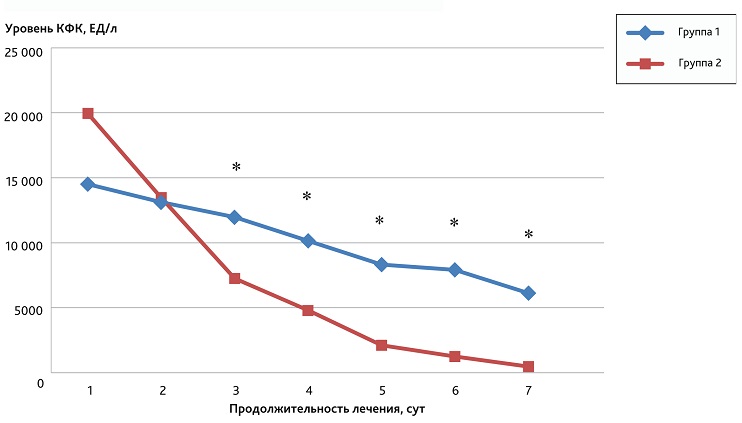
Одним из важнейших лабораторных показателей течения РМ, отражающих динамику выраженности патологического процесса, является изменение уровня КФК крови в ходе проведения лечения. На рис. 1 отображена динамика ежесуточного изменения уровня КФК крови у пациентов в исследуемых группах.
Рис. 1. Результаты исследования динамики уровня КФК крови в исследуемых группах в течение первой недели лечения
* Статистически значимые различия (тест Манна—Уитни, р < 0,05) между уровнями КФК крови в 1-й и во 2-й группах в период с 3-х по 7-е сутки.
Fig. 1. The results of the study of the dynamics of blood CPK levels in the study groups during the first week of treatment
* Statistically significant differences (Mann—Whitney test, р < 0.05) between blood CPK levels in groups 1 and 2 in the period from 3 to 7 days.

Исходя из данных, представленных на рис. 1, следует отметить, что достоверно (р < 0,05) наиболее выраженная динамика снижения уровня КФК была характерна для пациентов 2-й группы по сравнению с 1-й группой, в период с 3-х по 7-е сутки, т. е. уже после проведения первой операции ЭКД. Учитывая, что КФК, являющаяся одним из лабораторных маркеров деструкции миоцитов, обладает значительной молекулярной массой и практически не элиминируется из системного кровотока при проведении ГДФ, можно предположить, что применение комбинированного метода, в составе которого присутствует гемоперфузия, имеет выраженные преимущества в лабораторной динамике процесса и положительно отражается на клиническом течении заболевания.
При анализе данных результатов АлТ (аланинаминотрансфераза), АсТ (аспартатаминотрансфераза), ЛДГ (лактататдегидрогеназа) и ЩФ (щелочная фосфатаза) достоверных различий в группах получено не было (р = 0,11; р = 0,178; р = 0,0941; р = 0,087 соответственно).
Изменение степени выраженности нарушения функции почек, наряду с динамикой лабораторных признаков деструкции миоцитов, являлось одним из основных критериев оценки эффективности проводимой стартовой консервативной интенсивной терапии при принятии решения о необходимости применения методов ЭКД. Важным клиническим параметром, отражающим степень выраженности ОПП, является темп диуреза. Динамика данного показателя в исследуемых группах представлена на рис. 2.
Рис. 2. Темп диуреза в исследуемых группах в течение 1-й недели лечения в ОРИТ
* Статистически значимые различия (тест Манна—Уитни, р < 0,05) между темпом диуреза во 2-й и в 1-й группах в период с 3-х по 7-е сутки.
Fig. 2. Dynamics of the rate of diuresis in the study groups during the first week of treatment in the ICU
* Statistically significant differences (Mann—Whitney test, р < 0.05) between the rate of diuresis in groups 2 and 1 in the period from 3 to 7 days.
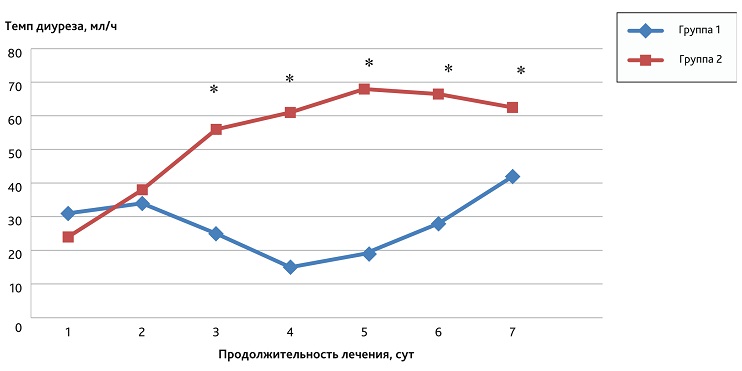
Приведенные данные показывают, что лучшая динамика восстановления темпа диуреза наблюдалась в группе пациентов, в состав лечения которых включали селективную гемоперфузию, по сравнению с пациентами, которые получали консервативную терапию с применением ГДФ по жизненным показаниям (р < 0,05).
В ходе исследования был проведен анализ динамики показателя СКФ, рассчитываемого ежесуточно с помощью формулы CKD-EPI. Изменения расчетного значения СКФ в исследуемых группах в течение первых 7 сут проведения интенсивной терапии отображены на рис. 3.
Рис. 3. Результаты исследования динамики расчетного показателя СКФ (по CKD-EPI) в исследуемых группах в течение первой недели лечения в ОРИТ
* Статистически значимые различия (тест Манна—Уитни, р < 0,05) между расчетным показателем СКФ в 1-й и во 2-й группах в период с 4-х по 7-е сутки.
Fig. 3. The results of the study of the dynamics of the estimated GFR (according to CKD-EPI) in the study groups during the first week of treatment in the ICU
* Statistically significant differences (Mann—Whitney test, р < 0.05) between the estimated GFR in groups 1 and 2 in the period from 4 to 7 days.
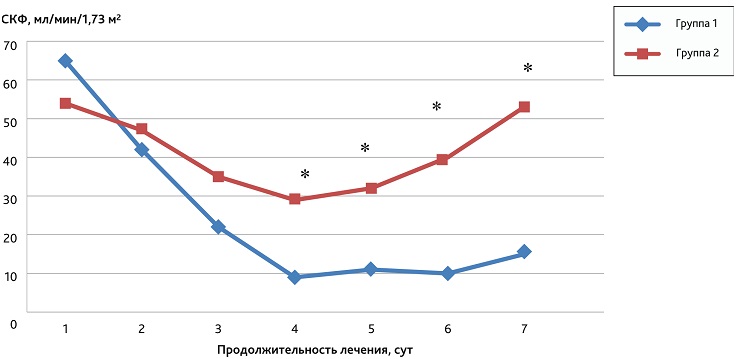
Продемонстрированные результаты выявили значительные отличия с высокой степенью достоверности (р < 0,05) в группах при анализе СКФ уже с 4-х суток на фоне проводимой терапии. Наилучшие показатели отмечены во 2-й группе по сравнению с 1-й группой, показывая, что применение селективной гемоперфузии с переходом на ГДФ, имеет максимальный клинический эффект в работе и восстановлении почечной функции по сравнению с применением ГДФ по жизненным показаниям.
В качестве одного из важных прикладных показателей, отражающих длительность острой дисфункции почек и скорости купирования ОПП, оценивали продолжительность необходимого проведения ЗПТ в исследуемых группах. Медианное значение времени от поступления в ОРИТ до начала выполнения ЗПТ в 1-й группе составило 49 ч, во 2-й группе — 19 ч. В обеих группах выполнение ЗПТ прекращали при появлении устойчивых признаков восстановления функции почек: при повышении темпа диуреза до значений выше 0,5 мл/кг/ч; снижении уровня азотных метаболитов (мочевины и креатинина) вне проведения ЗПТ; отсутствии декомпенсированных нарушений КОС и ВЭБ. Результаты сравнительного анализа продолжительности использования ЗПТ отображены на рис. 4.
Рис. 4. Длительность проведения ЗПТ среди пациентов исследуемых групп
* Статистически значимые различия (тест Манна—Уитни, р < 0,05) между продолжительностью ЗПТ в 1-й и во 2-й группах.
Fig. 4. The figure shows the duration of RRT among patients of the study groups
* Statistically significant differences (Mann—Whitney test, р < 0.05) between the duration of RRT in groups 1 and 2.
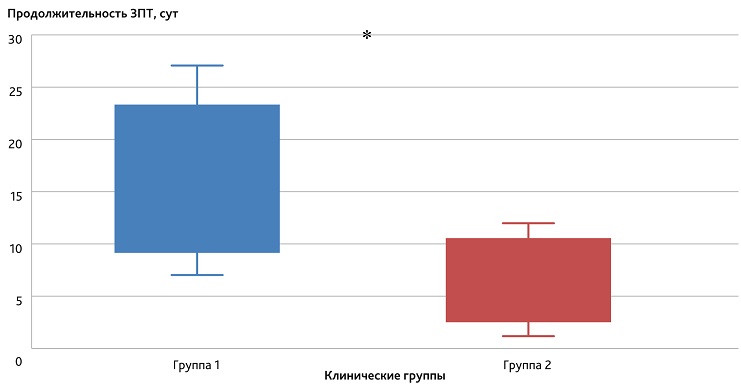
Установлено, что начало ЗПТ по неотложным показаниям в 1-й группе сопровождалось в 2,5 раза большей продолжительностью его необходимого применения, чем во 2-й группе при ранней инициации ЗПТ совместно с СГ (15 сут vs 6 сут соответственно), что свидетельствует о более быстром восстановлении почечной функции при раннем включении комбинированной ЭКД в состав интенсивной терапии ОПП у пациентов с токсическим РМ.
В качестве еще одного важного параметра, связанного не только с клиническими, но и с медико-экономическими аспектами лечения пациентов с токсическим РМ, осложненным ОПП, рассматривали длительность лечения в стационаре, выделяя при этом продолжительность нахождения в ОРИТ. В табл. 6 приведены результаты сравнительного анализа данных показателей в исследуемых группах.
Таблица 6. Продолжительность лечения пациентов в ОРИТ и в стационаре
Table 6. Duration of treatment for patients in the ICU and in the hospital (median, 25th and 75th percentiles)
| Группа 1 Me (25–75) |
Группа 2 Me (25–75) |
|
|---|---|---|
| В ОРИТ, сут. | 11 (9–15) | 4 (3–6)* |
| В стационаре, сут | 19,5 (14–22) | 11 (9,5–15)** |
| * Статистически значимые различия (тест Манна—Уитни, р < 0,05) при сравнении сроков лечения в ОРИТ пациентов группы 1 и группы 2. ** Статистически значимые различия (тест Манна—Уитни, р < 0,05) при сравнении продолжительности лечения в стационаре пациентов группы 1 и группы 2. Ме (25–75) — медиана, 25-й и 75-й процентили; ОРИТ — отделение реанимации и интенсивной терапии. * Statistically significant differences (Mann—Whitney test, р < 0.05) when comparing the duration of treatment in the ICU of patients in group 1 and group 2. ** Statistically significant differences (Mann—Whitney test, р < 0.05) when comparing the duration of hospital treatment in patients in group 1 and group 2. |
||
В ходе проведения исследования было установлено, что при раннем включении в состав интенсивной терапии комбинированной методики ЭКД продолжительность стационарного лечения пациентов с токсическим РМ, осложненным ОПП, снижается в среднем на 8,5 сут, длительность нахождения в ОРИТ — на 7 сут. Данный благоприятный эффект особенно значим для пациентов, поступающих на лечение в тяжелом состоянии, так как среди них наиболее высок риск развития внутригоспитальных инфекционных осложнений.
В результате проведения сравнительного анализа уровня летальности за время стационарного лечения пациентов в исследуемых группах выявлены статистически значимые различия (рис. 5).
Рис. 5. Уровень госпитальной летальности в исследуемых группах
* Статистически значимые различия (точный критерий Фишера, р < 0,05) между показателями госпитальной летальности в 1-й и во 2-й группах.
Fig. 5. The level of hospital mortality in the study groups
* Statistically significant differences (Fisher's exact test, р < 0.05) between hospital mortality rates in groups 1 and 2.
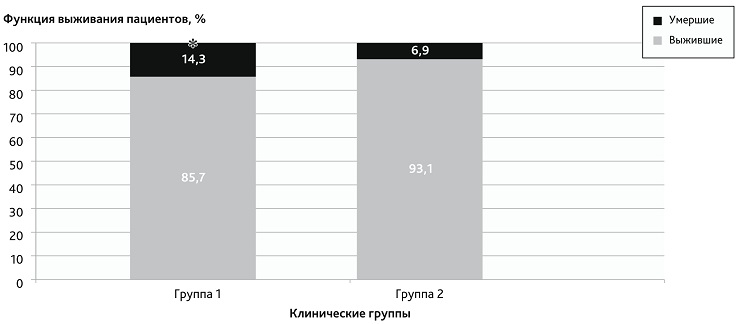
Число умерших пациентов в 1-й группе — 4, во 2-й группе — 2. Структура летальных исходов 1-й группы: прогрессирующий отек головного мозга на фоне перенесенной гипоксии на догоспитальном этапе (n = 2); прогрессирование синдрома полиорганной недостаточности (n = 1); присоединившаяся пневмония на фоне аспирации желудочного содержимого на догоспитальном этапе (n = 1). Во 2-й группе: тромбоэмболия легочной артерии на фоне тяжелого ДВС-синдрома (n = 1); прогрессирование синдрома полиорганной недостаточности (n = 1).
Следует отметить, что полученные достоверные различия между группами выявлены на относительно малом количестве пациентов, и расширение случаев включения пациентов, возможно, приведет к более или менее выраженным различиям, однако уровень летальности во 2-й группе был достоверно ниже, чем среди пациентов 1-й группы, что, по нашему мнению, является наиболее существенным подтверждением эффективности раннего применения комбинированной методики ЭКД, включающей ГДФ и СГ, при лечении токсического РМ, осложненного ОПП.
Результаты, полученные в ходе проведения исследования, в целом подтверждают данные современных отечественных и зарубежных авторов, свидетельствующие об эффективности применения ряда современных методов ЭКД в составе комплексного лечения пациентов с токсическим рабдомиолизом, к наиболее эффективным из которых относят гемодиафильтрацию и гемоперфузию [11–13]. Существенное значение для выявления детоксикационной эффективности применения комбинированного метода ЭКД и сопоставления результата его применения со стандартной консервативной терапией имел сравнительный анализ динамики основных лабораторных показателей РМ, к которым относились миоглобин и КФК. В нашей работе мы отмечаем существенную динамику снижения миоглобина и КФК уже к 3-м суткам терапии на фоне применения экстракорпоральных методов лечения по сравнению с консервативной терапией. Выраженность и динамика данного снижения имели существенные различия среди исследуемых групп, что в дальнейшем нашло свое отражение на показателях продолжительности ЗПТ, сроков лечения в ОРИТ и стационаре. Полученные результаты на фоне раннего применения комбинированного метода ЭКД, по всей видимости, обусловлено быстрой элиминацией токсического агента, как важного патогенетического компонента развития ОПП и системной токсемии. Полученные нами результаты находят свое отражение в немногочисленных работах зарубежных авторов, которые свидетельствуют о том, что скорейшая элиминация токсинов из системного кровотока не только способствует улучшению функционирования основных органов и систем организма, но и приводит к снижению выраженности их прямого миолитического воздействия [14–17].
Важными результатами нашего исследования являются показатели динамики лабораторных маркеров ОПП, отражающие выраженность недостаточности функции почек и характер течения почечного повреждения, к которым относятся цистатин С, KIM-1, темп диуреза и СКФ. Применение комбинированной ЭКД сопровождалось достоверно более существенным снижением уровня цистатина С и KIM-1 в течение 1-й недели лечения в ОРИТ по сравнению с проведением стандартной интенсивной терапии. Вероятно, данный факт может указывать на определенные преимущества раннего применения комбинированных методов ЭКД с целью снижения выраженности ОПП у пациентов с токсическим РМ по сравнению с консервативным подходом к лечению. Однако в мировой литературе данные по данному вопросу практически отсутствуют [18–19]. Значимым компонентом комплексного анализа исходов лечения пациентов с РМ стали результаты исследования степени восстановления функции почек после перенесенного ОПП. В нашей работе показано, что в группе консервативной терапии отмечается достоверно худшие результаты динамики темпа диуреза и СКФ уже с 3-х суток интенсивной терапии по сравнению с группой ЭКД. Уменьшение системного токсикоза в виде редукции миоглобина, КФК, маркеров ОПП и улучшение функции почек нашло свое отражение в достоверном снижении продолжительности ЗПТ с 15 сут в группе консервативной терапии до 6 сут в группе комбинированной ЭКД. Таким образом, полученные результаты нашего исследования, по всей видимости, могут свидетельствовать, что раннее и своевременное применение комбинированного метода экстракорпоральной детоксикации может являться патогенетически обоснованным методом лечения токсического РМ, что в конечном итоге отражается на длительности пребывания пациентов в ОРИТ и стационаре в целом [11–13].
Следует также отметить, что общая летальность в группе комбинированного применения ЭКД по сравнению с группой консервативной терапии существенно ниже, но, несмотря на достоверную разницу, данные выводы могут носить преждевременный характер, и с увеличением количества пациентов результаты могут меняться. Однако результаты некоторых зарубежных коллег также указывают на аналогичные выводы [20–21].
Таким образом, результаты проведенного нами исследования убедительно продемонстрировали более высокую эффективность раннего применения комбинированного метода ЭКД в составе комплексной интенсивной терапии пациентов с токсическим РМ, осложненным ОПП, по сравнению с применением стандартного лечения. Обоснованное и своевременное проведение ЭКД не только сопровождалось значительным улучшением динамики клинических и лабораторных параметров, но и позволило существенно улучшить исходы заболевания. Данные результаты являлись следствием реализации детоксикационного и нефропротективного эффектов применения методов ЭКД, что отражено в некоторых работах зарубежных авторов [3, 9–15, 21].
Включение комбинированной методики ЭКД, основанной на применении гемодиафильтрации и селективной гемоперфузии, в состав лечебных мероприятий при проведении интенсивной терапии пациентов с токсическим РМ на ранней стадии развития ОПП сопровождается существенным улучшением результатов лечения. Преимущества данного подхода по сравнению с базисной консервативной терапией заключаются в значительном увеличении элиминации факторов эндогенной интоксикации, обусловливающих развитие ОПП при РМ, из внутренней среды организма при применении ЭКД, а также в коррекции тяжелых нарушений кислотно-основного состояния и водно-электролитного баланса.
Перечисленные эффекты раннего применения комбинированной ЭКД при лечении токсического РМ, осложненного ОПП, приводят к увеличению темпа восстановления функции почек, что сопровождается значительным снижением уровня летальности, а также сроков пребывания пациентов в стационаре и в ОРИТ. Мы считаем, что необходимо продолжить проведение клинических исследований, направленных на изучение эффективности применения различных методов ЭКД в составе интенсивной терапии ОПП, развившегося вследствие возникновения РМ у пациентов токсикологического профиля.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Этическое утверждение. Исследование было одобрено локальным этическим комитетом ГБУЗ «Городская клиническая больница № 1 им. Н.И. Пирогова», Москва, Россия.
Ethics approval. The present study protocol was approved by the local Ethics Committee of the Pirogov City Clinical Hospital No 1, Moscow, Russia.
Вклад авторов. Д.Н. Проценко, И.Н. Тюрин, М.А. Магомедов, О.А. Мамонтова — методическое руководство, разработка концепции исследования, обоснование научной значимости, разработка концепции статьи, получение и анализ фактических данных, систематизация и статистическая обработка материала, написание и редактирование текста статьи, проверка и утверждение текста статьи; С.В. Масолитин, Т.Г. Ким, А.А. Попов — разработка концепции исследования, обоснование научной значимости, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.
Author contribution. D.N. Protsenko, I.N. Tyurin, M.A. Magomedov, O.A. Mamontova — methodological guidance, development of the research concept, substantiation of scientific significance, development of the concept of the article, obtaining and analyzing factual data, systematization and statistical processing of the material, writing and editing the text of the article, checking and approving the text of the article; S.V. Masolitin, T.G. Kim, A.A. Popov — development of the concept of the study, substantiation of scientific significance, development of the concept of the article, obtaining and analyzing evidence, writing and editing the text of the article, checking and approving the text of the article.