Возбудитель коронавирусной инфекции стал причиной пандемии, охватившей весь мир [1, 2]. Наиболее тяжелой клинической формой коронавирусной инфекции (COVID-19) явилась пневмония с развитием острого респираторного дистресс-синдрома, которая чаще всего становилась причиной летальных исходов [3, 4]. Полимеразная цепная реакция (ПЦР) в реальном времени и анализ антител стали эталонными методами диагностики инфекции, но не дают информации о тяжести заболевания и прогнозе [4]. Компьютерная томография грудной клетки (КТ) является наиболее информативным методом, однако появились данные, что ультразвуковое исследование (УЗИ) легких может быть эффективной альтернативой для диагностики объема и характера поражения легочной ткани [5–7]. Этот способ визуализации по сравнению с КТ является быстрым, экономичным и не требует ионизирующего излучения. Кроме того, УЗИ легких можно повторять столько раз, сколько необходимо для мониторинга прогрессирования заболевания, и проводить непосредственно у постели больного [8, 9].
У пациентов с пневмонией, вызванной COVID-19, выявляемые ультразвуковые признаки были ассоциированы с изменениями КТ органов грудной клетки. В исследовании Nouvenne A. et al. (2020) наиболее типичными ультразвуковыми признаками были различные по площади зоны интерстициального синдрома (сливные или дискретные В-линии) с возможным наличием мелких или крупных субплевральных консолидаций и изменений плевральной линии; плевральный выпот в этом исследовании также обнаруживали редко [10]. В исследовании Ökmen K. et al. (2020) признаки повреждения легких при COVID-19 присутствовали у 72,5 % пациентов при компьютерной томографии и у 78,4 % пациентов при УЗИ. Исследование Chung M. et al. (2019) показало, что в правом легком верхняя доля поражается в 67 %, средняя доля — в 57 %, нижняя доля — в 76 % случаев. В левом легком верхняя доля вовлечена в патологический процесс в 67 % случаев, нижняя доля — в 67 %. Билатеральное поражение легочной паренхимы было выявлено в 76 % случаев, одностороннее (преимущественно справа) наблюдалось в 10 % случаев [11].
В настоящее время появляется все больше работ об использовании УЗИ легких при COVID-19 как в диагностике, так и в прогнозировании заболевания. Одной из первых работ, показывающих корреляцию межу КТ и УЗИ, было исследование Nouvenne A. et al. (2020), которое продемонстрировало значимость использования УЗИ на ранних стадиях заболевания [10]. Последовавшие за ним сравнительные исследования в различных странах отметили разную степень сопоставимости ультразвуковых данных и результатов КТ [12–14]. Soldati G. et al. (2020) в своих исследованиях предложили использовать УЗИ для сортировки пациентов с пневмонией, вызванной СOVID-19 на догоспитальном этапе, что значительно упростит работу в условиях пандемии [15, 16].
Целью нашего исследования стало установление связи между ультразвуковым индексом поражения легких (УИПЛ) 16-зонного модифицированного протокола с выраженностью дыхательной недостаточности, объемом вовлечения легких, определенным с помощью КТ, и исходами заболевания у пациентов с COVID-19.
Проспективное обсервационное когортное клиническое исследование проводили в ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» МО РФ. Проведение исследования было одобрено независимым этическим комитетом ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» МО РФ (протокол № 236 от 21.05. 2020).
Критериями включения в исследование были: возраст пациентов 18–75 лет; развитие внебольничной пневмонии; подтвержденный COVID-19 или подозрение на COVID-19. Критерии невключения: наличие пневмоторакса; травма грудной клетки или операция на легких в анамнезе; фоновые специфические заболевания (туберкулез, саркоидоз).
Всего в исследовании приняло участие 388 пациентов. Общая характеристика пациентов на момент включения в исследование представлена в табл. 1.
Таблица 1. Характеристика пациентов, включенных в исследование
Table 1. Characteristics of patients included in the study
| Показатель | Значение | |
|---|---|---|
| Возраст, лет (М ± SD) | 52,6 ± 10,5 | |
| Пол (мужчины/женщины), n | 267/121 | |
| Рост, см (М ± SD) | 173,4 ± 12,4 | |
| Масса тела, кг (М ± SD) | 94,2 ± 17 | |
| Индекс массы тела, кг/м2 (М ± SD) | 31,2 ± 4,7 | |
| День болезни при поступлении в стационар (М ± SD) | 5,4 ± 2,0 | |
| Средне-тяжелая/тяжелая форма пневмонии, n | 184/204 | |
| Доля пациентов с исходно сниженной (< 94 %) сатурацией при дыхании атмосферным воздухом, n (%) | 252 (64,9) | |
| Объем поражения легких на КТ, % [Ме (Q1–Q3)] | 55 (35–74) | |
| Степень повреждения при КТ | 2, n (%) | 207 (53,4) |
| 3, n (%) | 156 (40,2) | |
| 4, n (%) | 25 (6,4) | |
| Сопутствующие заболевания | Сахарный диабет, n (%) | 78 (20,1) |
| Ожирение, n (%) | 193 (49,7) | |
| Гипертоническая болезнь, n (%) | 252 (64,9) | |
| Ишемическая болезнь сердца, n (%) | 95 (24,5) | |
| Хроническая сердечная недостаточность, n (%) | 20 (24,5) | |
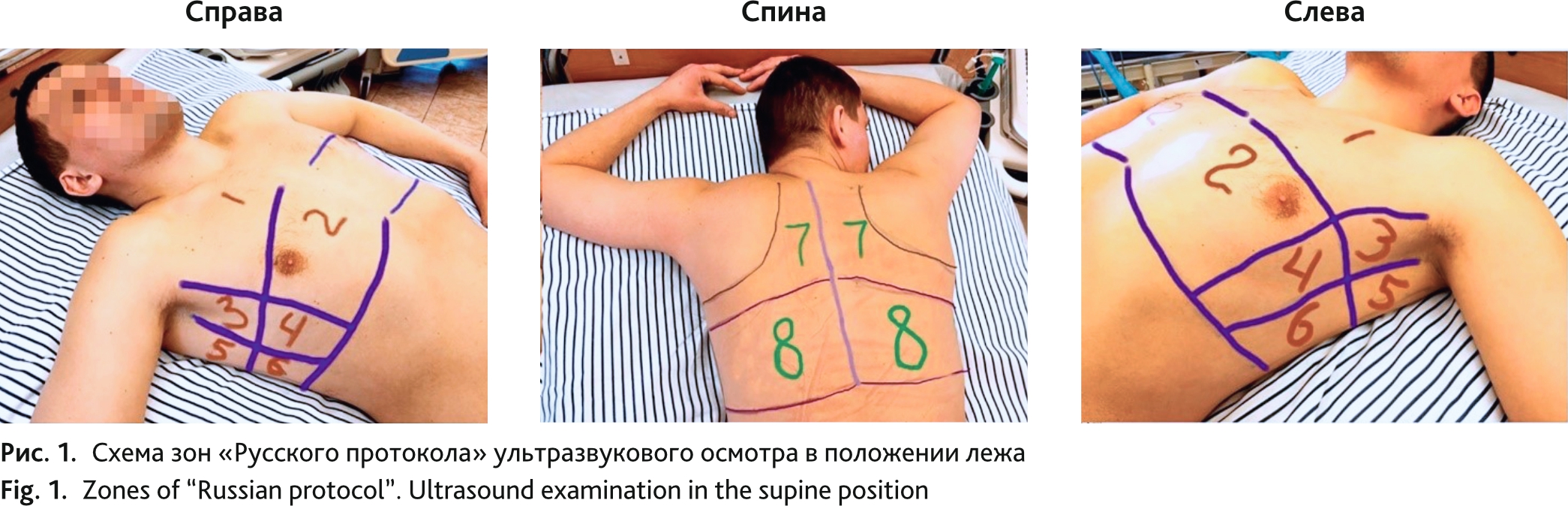
Прикроватное ультразвуковое исследование проводили с помощью портативного ультразвукового аппарата (Mindray M7, Китай), конвексным датчиком C5-2s (2,5–5 МГц). Процедура получения изображения была стандартизирована с использованием преднастройки абдоминального исследования, максимальная глубина — 18 см, фокусировка на плевральной линии. Усиление регулировалось для получения наилучшего изображения плевры, вертикальных артефактов и субплевральных консолидаций с воздушными бронхограммами или без них. Все гармоники и программное обеспечение для снижения артефактов были отключены. Исследование проводили в положении лежа или сидя, в зависимости состояния пациента. Ультразвуковое исследование легких проводили согласно 16-зонному «Русскому протоколу» (восемь зон справа и слева) [рационализаторское предложение № 15165, протокол ВМедА № 4 от 15.12.2020] (рис. 1) [17].

При проведении ультразвукового исследования определяли патологические признаки, признаки инфильтрации и консолидации легких, которые регистрировали по зонам протокола. Обнаруженные в каждой зоне осмотра ультразвуковые признаки инфильтрации и консолидации легкого кодировали по степени в каждой зоне раздельно.
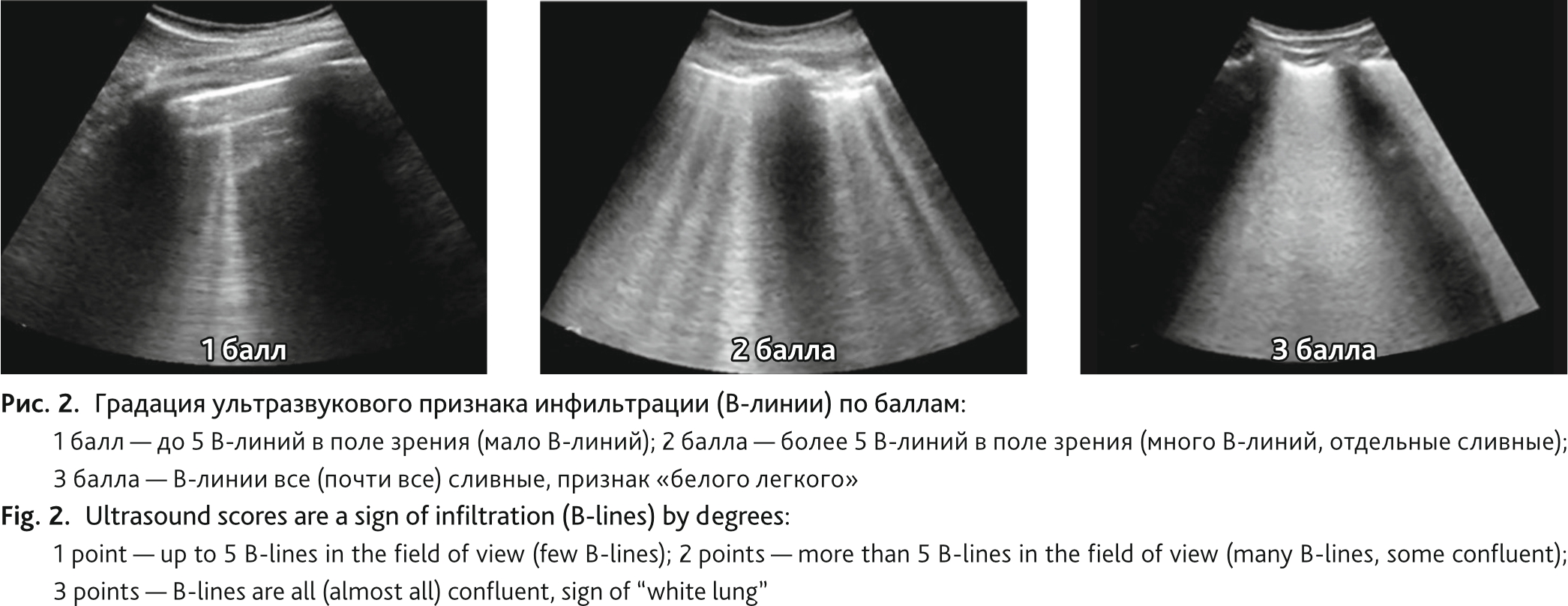
Ультразвуковой признак инфильтрации (В-линии): 1 балл — до 5 В-линий в поле зрения (мало В-линий); 2 балла — более 5 В-линий в поле зрения (много В-линий, отдельные сливные); 3 балла — В-линии все (почти все) сливные, признак «белого легкого» (рис. 2). Ультразвуковой признак консолидации: 1 балл — минимальные субплевральные изменения (безвоздушность небольших участков легкого, примыкающих к плевре (менее 1 см)); 2 балла — кортикальная консолидация (безвоздушность участков легкого, примыкающих к плевре (менее чем 1 сегмент)); 3 балла — консолидация больших объемов ткани легкого (1 сегмент и более) (рис. 3). Балл УИПЛ был рассчитан путем суммирования баллов ультразвуковых признаков инфильтрации и консолидации всех 16 зон исследования.

КТ грудной клетки выполняли по клиническим показаниям (диагноз, ухудшающаяся клиническая картина), оценку результатов проводил рентгенолог, ослепленный к результатам УЗИ легких. КТ проводили на аппарате Philips Ingenuity. При проведении КТ органов грудной клетки определяли патологические признаки, которые регистрировали по сегментам легких. Оценку объема вовлечения легких у пациентов с предполагаемой/известной пневмонией COVID-19 проводили с помощью визуальной оценки.
Анализ данных проводился с помощью программы SPSS-26 для Windows (Statistical Package for Social Science, SPSS Inc. Chicago IL, USA). Переменные были исследованы с помощью визуальных (гистограммы, вероятностный график) и аналитических методов (критерий Колмогорова—Смирнова / Шапиро—Уилка) для определения того, нормально ли они распределены. При нормальном распределении данные были представлены средним значением и стандартным отклонением М (± SD); описание количественных данных, не подчиняющихся закону нормального распределения, представляли в виде медианы и 25-го и 75-го перцентилей — Ме (Q1–Q3). Был проведен анализ для описания и обобщения распределений переменных. Описание частот в исследуемой выборке представлено с обязательным указанием на приводимую характеристику выборки (n (%)). С целью изучения связи УИПЛ с объемом поражения легких и индексом SpO2/FiO2 применяли коэффициент ранговой корреляции Спирмена. Различия считали статистически значимыми при р ˂ 0,05. Оценку чувствительности (Se), специфичности (Sp) ультразвуковых методов проводили на основании ROC-анализа. Выполняли визуальную оценку ROC-кривых, рассчитывали показатели чувствительности и специфичности, а также определяли площадь под ROC-кривой и ее координатные точки. Оптимальную точку отсечения определяли как самый высокий индекс Юдена (чувствительность + специфичность − 1).
Изучение кумулятивной выживаемости и прогнозирование неблагоприятного исхода по УИПЛ проводили методом Каплана—Мейера. Различия между группами проверялись с помощью логарифмического рангового теста (Log Rank (Mantel-Cox)) и теста Бреслоу (Breslow (Generalized Wilcoxon)). Для выявления потенциальных предикторов смерти был проведен многомерный регрессионный анализ Кокса, в качестве предикторов отобраны индекс SpO2/FiO2, объем поражения по данным КТ и УИПЛ. Были построены многомерные модели с использованием метода пошагового исключения. Статистически значимыми считали тесты при р < 0,05.
В исследование были включены 388 пациентов, которым при поступлении и в ходе лечения было выполнено КТ и УЗИ легких (мужчины, n = 267; женщины, n = 121; средний возраст 52,6 ± 10,5 года). Разница по времени между проведением КТ и УЗИ легких составила 8 (2–13) ч. Наиболее частыми симптомами при поступлении были лихорадка (n = 372 [95,9 %]), кашель (n = 114 [80,9 %]) и одышка (n = 147 [37,9 %]). Длительность симптомов перед поступлением в стационар составила в среднем 5,4 ± 2,0 дня. Кислородная терапия требовалась 252 (64,9 %) пациентам (клиническая характеристика пациентов представлена в табл. 1).
По степени повреждения легких, согласно данным КТ, пациенты распределились следующим образом: КТ 2 — 207 (53,4 %); КТ 3 — 156 (40,2 %); КТ 4 — 25 (6,4 %) (см. табл. 1). Медиана объема поражения легких при КТ составила 55 (35–74) %, УИПЛ — 46 (28–60) %. Двустороннее вовлечение было обнаружено в 100 % случаев. При ультразвуковом исследовании легких и плевры выявляемые признаки соответствовали признакам, выявленным на КТ. Если при КТ обнаруживали утолщение плевры, то при УЗИ тоже визуализировали утолщенную плевральную линию. Наиболее часто при КТ встречалось уплотнение легочной паренхимы по типу «матового стекла», которому при УЗИ соответствовали B-линии (мультифокальные, дискретные или сливающиеся). Если ретикулярные уплотнения интерстиция достигали плевры или зоны консолидации, то при УЗИ они определялись как B-линии (чаще дискретные). Признаку консолидации легких при КТ соответствовал ультразвуковой признак консолидации при УЗИ легких.
Насыщение крови кислородом при самостоятельном дыхании воздухом (для расчетов концентрацию кислорода в воздухе определяли как 21 %) составило: SpO2 — 93 (86–97), соотношение SpO2/FiO2 — 443 (390–462).
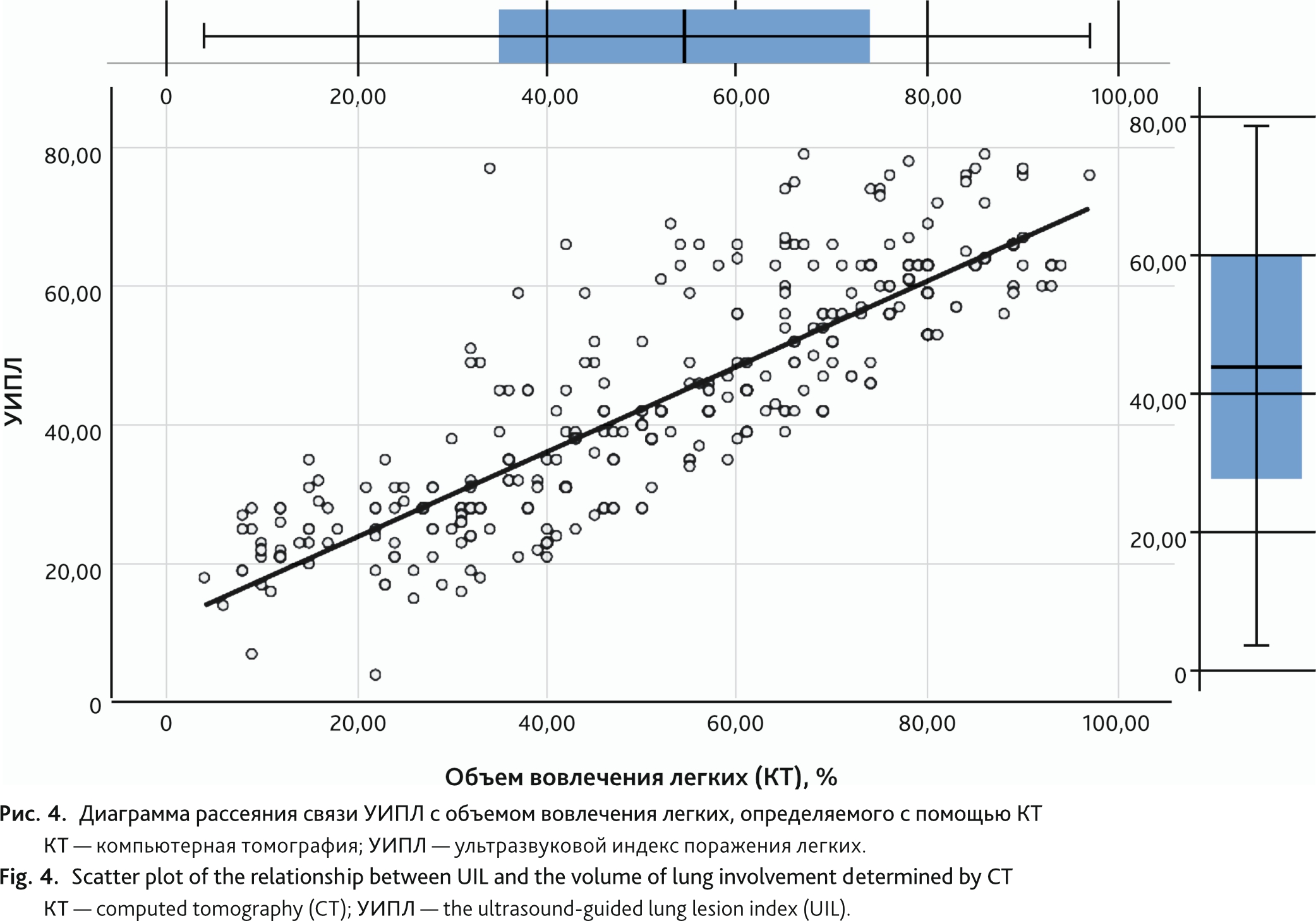
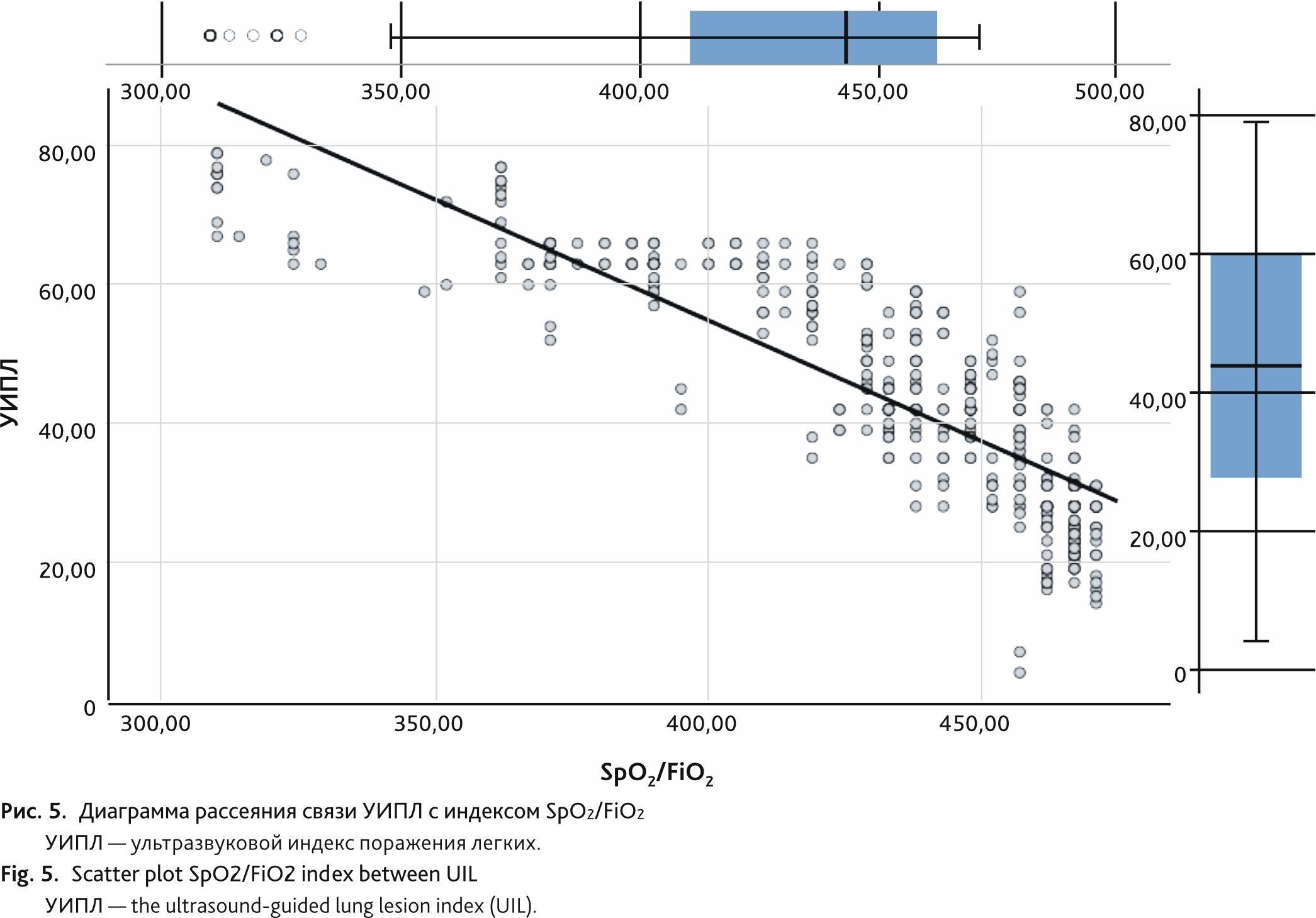
Изменение УИПЛ, определяемого по «Русскому протоколу», имело сильную прямую корреляционную связь 0,873 (95%-й доверительный интервал [95% ДИ] 0,842–0,897, р < 0,01) с изменением объема вовлечения легких, определяемого с помощью КТ (рис. 4). Корреляция УИПЛ с индексом SpO2/FiO2 также была сильной, но носила обратный характер: −0,850 (95% ДИ 0,827–0,871, р < 0,01) (рис. 5).
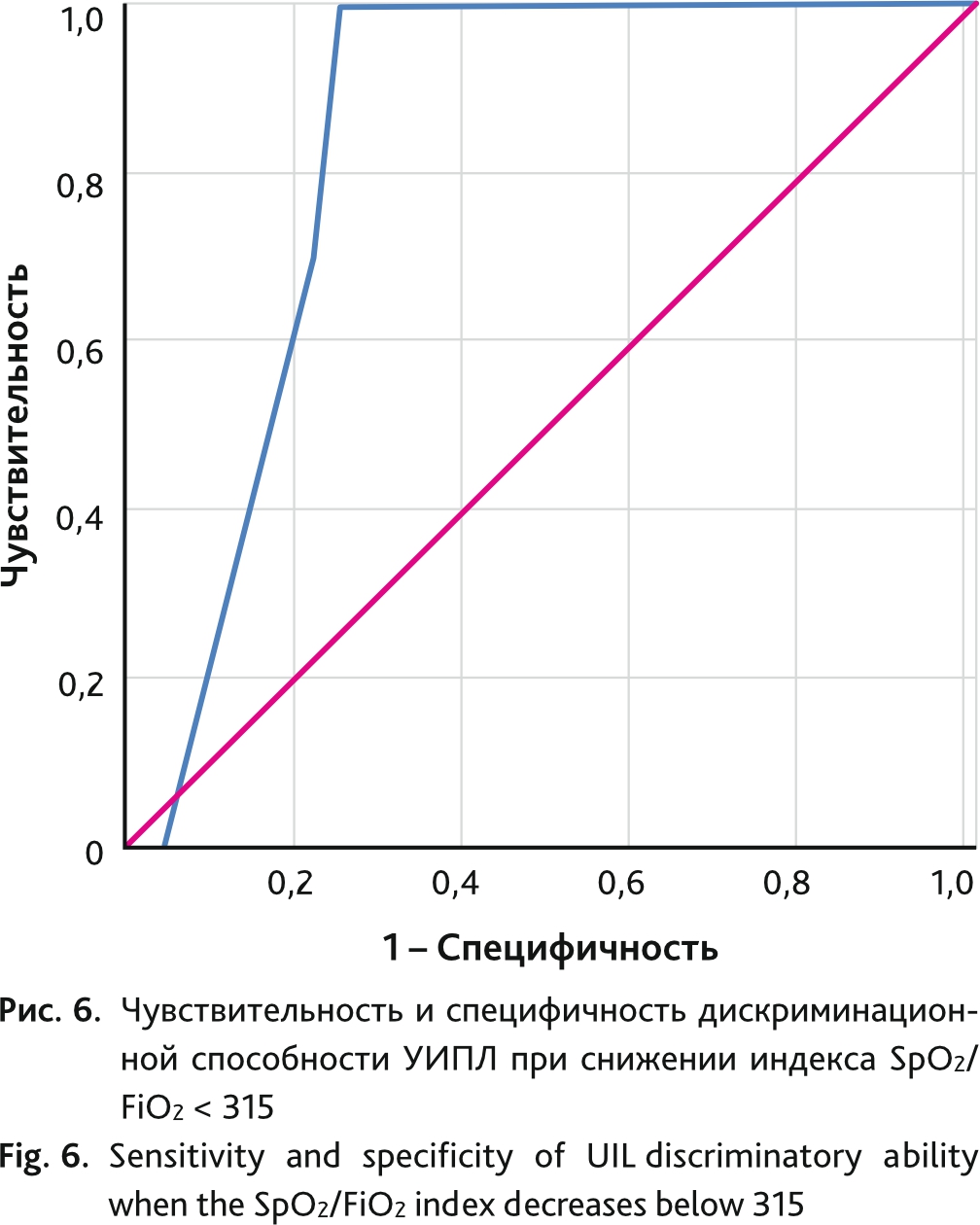
Снижение индекса SpO2/FiO2 < 315 свидетельствует о развитии острого респираторного дистресс-синдрома. Дискриминационную способность УИПЛ и снижения индекса SpO2/FiO2 < 315 оценивали с помощью ROC-анализа с вычислением площади под кривой (AUC ROC) с 95% ДИ и точки отсечения, которой соответствовало наилучшее сочетание чувствительности и специфичности (индекс Юдена) (рис. 6). Дискриминационная способность индекса УЗИ и снижения индекса SpO2/FiO2 < 315 составила 44 балла и выше с площадью под кривой 0,837 (95% ДИ 0,766–0,909; р = 0,03), чувствительностью 96 % и специфичностью 78 %.
Количество летальных исходов в исследуемой группе (n = 388) составило 56 (14,4 %), медиана времени до наступления неблагоприятного исхода у умерших пациентов — 7 (4–14) сут.
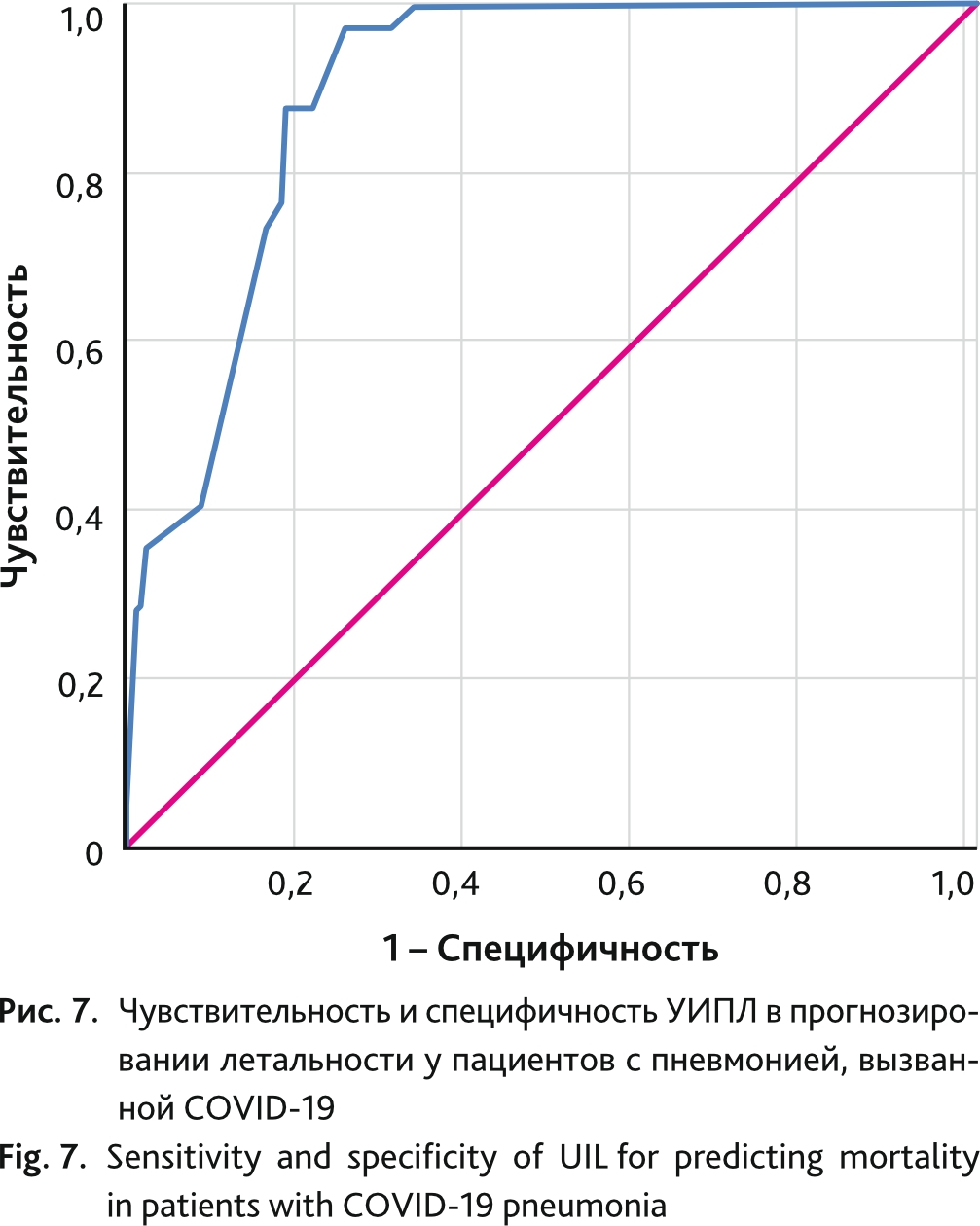
Анализ ROC-кривой УИПЛ для прогнозирования летального исхода показан на рис. 7. Площадь под кривой составила 0,896 (95% ДИ 0,861–0,931), р = 0,018. Оптимальная точка отсечения, определяемая как самый высокий индекс Юдена для УИПЛ при прогнозировании неблагоприятного исхода у пациентов с пневмонией, вызванной COVID-19, составила 55 баллов и имела чувствительность 97,6 % и специфичность 73,9 %.
Исследование по методу Каплана—Мейера проводили на основании полученных в ходе ROC-анализа данных о точке отсечения при прогнозировании летальности. Для введения категориальной переменной были сформированы 2 группы со значениями УИПЛ > 55 баллов и < 55 баллов. Анализ Каплана—Мейера на всем массиве данных (n = 388) продемонстрировал выживаемость 97,6 % (в группе УИПЛ < 55 баллов) и 62 % (в группе УИПЛ > 55 баллов) (рис. 8). Различия между группами были статистически значимы (логранговый тест р < 0,001; тест Бреслоу р < 0,001). При анализе кривых отчетливо видно, что наиболее крутая часть в группе пациентов со значением УИПЛ > 55 баллов длится в течение первых 7 сут, далее начинается пологая часть кривой. Это означает (при снижении УИПЛ > 55 баллов), что основная часть неблагоприятных исходов произошла в течение 1-й недели лечения. В группе со значением УИПЛ < 55 баллов в течение первых 2 нед. пологая линия кривой, затем максимальный наклон в течение 3 сут и далее снова пологая линия. Это подчеркивает характер течения заболевания с развитием осложнений и неблагоприятных исходов в отдаленный период по сравнению с группой пациентов со значением УИПЛ < 55 баллов.

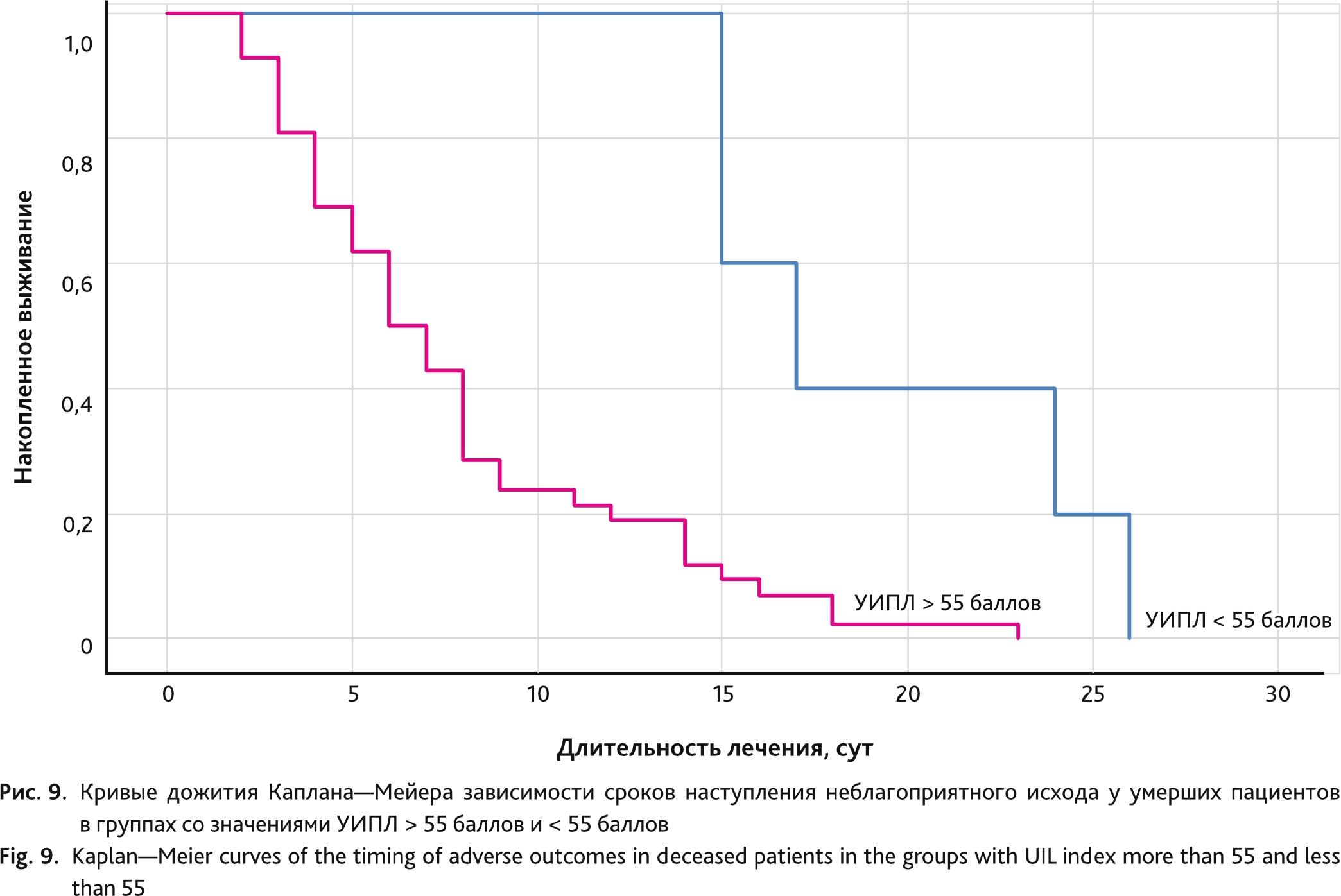
Отдельный анализ данных умерших пациентов (n = 56) показал, что продолжительность жизни в группе со значением УИПЛ < 55 баллов была больше и составила 17 (95% ДИ 12,7–21,3) сут по сравнению с группой со значением УИПЛ > 55 баллов — 7 (95% ДИ 5,4–8,6) сут. Различия между группами были статистически значимы (логранговый тест р = 0,002; тест Бреслоу р = 0,005) (рис. 9).
Для выявления потенциальных предикторов смерти в исследуемые показатели отобраны индекс SpO2/FiO2, объем поражения по данным КТ, УИПЛ. Был проведен многомерный регрессионный анализ Кокса с использованием метода пошагового исключения. С учетом небольшого количества включенных в анализ предикторов регрессионная модель была построена в 3 шага (табл. 2). На первом шаге из модели был исключен индекс SpO2/FiO2 как показатель с наименьшим влиянием на сроки возникновения неблагоприятного исхода и наибольшим уровнем значимости, превышающим 0,05 (Exp (B) = 0,993; р = 0,199). На втором шаге из модели был исключен предиктор объема поражения легких, определенного с помощью КТ (Exp (B) = 1,013; р = 0,246). В результате значимым предиктором неблагоприятного исхода в многомерной модели регрессионного анализа Кокса остался только УИПЛ (р < 0,01).
Таблица 2. Показатели многомерного регрессионного анализа Кокса с использованием метода пошагового исключения
Table 2. Indices of multivariate Cox regression analysis, using the stepwise exclusion method
| Шаг | Предиктор | B | Вальд | Ст. св. | р | Exp (B) | 95% ДИ для Exp (B) | |
|---|---|---|---|---|---|---|---|---|
| нижн. | верхн. | |||||||
| 1 | SpO2/FiO2 | –0,0007 | 1,652 | 1 | 0,199 | 0,993 | 0,983 | 1,004 |
| Объем поражения (КТ) | 0,016 | 2,019 | 1 | 0,155 | 1,017 | 0,994 | 1,040 | |
| УИПЛ | 0,081 | 10,021 | 1 | 0,002 | 1,084 | 1,031 | 1,140 | |
| 2 | Объем поражения (КТ) | 0,013 | 1,344 | 1 | 0,246 | 1,013 | 0,991 | 1,034 |
| УИПЛ | 0,107 | 46,300 | 1 | 0,000 | 1,121 | 1,179 | 1,197 | |
| 3 | УИПЛ | 0,114 | 71,794 | 1 | 0,000 | 1,214 | 1,202 | 1,291 |
| КТ — компьютерная томография; ст. св. — степень свободы; УИПЛ — ультразвуковой индекс поражения легкого; SpO2/FiO2 — соотношение насыщения кислородом к фракции вдыхаемого кислорода; 95% ДИ — 95%-й доверительный интервал. | ||||||||
Стоит отметить тот факт, что это исследование, как и многие другие во время пандемии COVID-19, проводили в варианте прикроватного фокусированного ультразвукового исследования. Типичные ультразвуковые признаки пневмонии были определены и популяризированы в работах основоположника направления D. Lichtenstein, а также в согласительных консенсусах [18–22]. В нашем исследовании, так же как и в других, при УЗИ легких ультразвуковые признаки пневмонического поражения ткани представляли собой утолщение плевры, B-линии различной характеристики (мультифокальные, дискретные или сливающиеся) и признак консолидации.
Определяемый с помощью 16-зонного «Русского протокола» УИПЛ показал сильную прямую корреляцию с объемом вовлечения легких в патологический процесс при коронавирусной инфекции. Чем выше было значение индекса, тем больший процент объема легочной ткани был поражен пневмонией. Ряд публикаций об УЗИ легких при COVID-19 показал наличие корреляции между ультразвуковыми индексами некоторых протоколов исследования со степенью дыхательной недостаточности и различных рисков. Так, в работе Chardoli M. et al. (2021) многомерная логистическая регрессия продемонстрировала возможность УЗИ легких в прогнозировании необходимости механической вентиляции легких (площадь под кривой 0,80) и риска госпитальной смертности (площадь под кривой 0,87) [23]. Lichter Y. et al. (2020) также показали, что УЗИ легких сильно коррелирует с потребностью в инвазивной механической вентиляции легких и является значимым предиктором летальности [24]. В исследовании Secco G. et al. (2021) при использовании 12-зонного протокола ультразвуковой индекс поражения коррелировал с индексом Горовица (P/F) на фоне ингаляции кислородом (R2 0,68; p < 0,0001) и P/F при дыхании атмосферным воздухом (R2 0,59; p < 0,0001) [25]. Примерно такую же корреляцию (R2 −0,697; p < 0,0001) ультразвукового индекса и P/F выявляли Sumbul H. et al. (2021) [26].
Имеющиеся в литературе данные показали, что выжившие пациенты имели более низкий балл оценки при УЗИ легких, чем умершие [27, 28]. При УЗИ легких проводят полуколичественную оценку внесосудистой воды в легких и, косвенно, оксигенации крови [29, 30]. Более низкий балл оценки УЗИ легких означает менее нарушенную аэрацию легких у пациентов с COVID-19 [31, 32]. В опубликованных исследованиях оценка УЗИ легких была связана с летальностью при COVID-19. Была показана связь результатов УЗИ легких с несколькими доказанными предикторами неблагоприятного исхода при COVID-19, включая оценку тяжести КТ, С-реактивный белок, интерлейкин-6 (IL-6), D-димер и индекс РаО2/FiO2. В ряде исследований оценка УЗИ легких достоверно положительно коррелировала с объемом поражений легких [10, 33–35], С-реактивным белком [36], IL-6 [37] и уровнем D-димеров [38]. Корреляция с индексом PaO2/FiO2 была отрицательной [25, 32, 37–39]. Все эти корреляции иллюстрируют, что высокий балл оценки УЗИ легких является потенциальным фактором риска для пациентов с COVID-19.
Величина балльной оценки УЗИ легких была также связана с необходимостью респираторной поддержки, госпитализации или поступления в отделение интенсивной терапии [9, 29, 40], однако для подтверждения этих результатов необходимы дополнительные исследования. Оценка УЗИ легких была связана с тяжестью течения COVID-19. Согласно результатам метаанализа, проведенного Song G. et al. (2021), более высокий балл УЗИ легких означает более тяжелое течение COVID-19 [28]. В ряде исследований уже использовали оценку УЗИ легких в качестве инструмента стратификации рисков осложнений и исходов для пациентов с COVID-19. В нескольких работах было предложено значение точки отсечения балльной оценки УЗИ легких для летальности и тяжести COVID-19 [24, 25, 34, 40–42]. Величины точки отсечения для прогнозирования неблагоприятного исхода в разных исследованиях составили 13 [25], 16 [40], 17 [42], 18 [24], 20 [33], 22,5 [39], 24 [38], 25 [27], 30 [29] сут (в зависимости от использованного протокола УЗИ легких). Значение точки отсечения для прогнозирования тяжелого COVID-19 составило 7, с чувствительностью 80,8 % и специфичностью 95,8 % [34]. В работе Claudio T. (2022), так же как и в нашем исследовании, при многомерном регрессионном анализе Кокса УЗИ легких было единственным независимым предиктором госпитальной летальности — 7,42 (95% ДИ 1,59–34,5) [33].
Таким образом, большинство исследований, в контекст которых встраивается и наша работа, делает вывод о значимости УЗИ легких для оценки состояния и стратификации рисков, в первую очередь неблагоприятного исхода, у пациентов с COVID-19.
УИПЛ, определяемый по 16-зонному «Русскому протоколу», имел сильную прямую корреляционную связь с объемом вовлечения легких, определяемым с помощью КТ, и значительную обратную корреляцию с индексом SpO2/FiO2. Дискриминационная способность индекса УЗИ и снижения индекса SpO2/FiO2 < 315 как показателя развития острого респираторного дистресс-синдрома составила 44 балла и выше, с чувствительностью 96 % и специфичностью 78 %. Показатель летальности в исследуемой группе составил 56 (14,4 %). Оптимальная точка отсечения при ROC-анализе для УИПЛ при прогнозировании неблагоприятного исхода у пациентов с пневмонией, вызванной COVID-19, составила 55 баллов и имела чувствительность 97,6 % и специфичность 73,9 %. Анализ Каплана—Мейера продемонстрировал выживаемость 97,6 % в группе со значением УИПЛ < 55 баллов и 62 % в группе со значением УИПЛ > 55 баллов. В результате многомерного регрессионного анализа Кокса с использованием метода пошагового исключения значимым предиктором неблагоприятного исхода остался только УИПЛ.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Этическое утверждение. Проведение исследования было одобрено локальным этическим комитетом независимым Этическим комитетом (протокол № 236 от 21.05. 2020).
Ethics approval. This study was approved by the independent Ethical Committee (reference number: 236-21.05.2020).