Остеоартроз тазобедренного и коленного суставов является основной причиной инвалидности во всем мире [1]. В Российской Федерации, по данным десятилетней давности, частота остеоартроза тазобедренного и/или коленного сустава у взрослого населения составляла 13 % [2].
В первую очередь пациентов беспокоит боль — основной симптом заболевания, который заставляет людей обращаться за медицинской помощью, формирует функциональные ограничения и снижает качество жизни [3]. Этиология боли при остеоартрозе признана многофакторной, с внутрисуставными и внесуставными компонентами, а единственным лечением при 3–4-й стадии остеоартроза является эндопротезирование сустава. Основной целью операции является повышение качества жизни.
Операции тотального эндопротезирования тазобедренного (ТЭТС) и коленного суставов (ТЭКС) в настоящее время являются рутинными хирургическими вмешательствами. В России потребность в эндопротезировании тазобедренного сустава, по некоторым расчетам, составляет до 300 000 операций в год [4].
Понятно желание пациента избавиться от боли сразу же после операции и никогда большее ее не испытывать. Тем не менее в 1-е сутки после операций ТЭКС и ТЭТС боль средней и даже высокой интенсивности испытывают около половины пациентов [5].
Безусловно, острая послеоперационная боль негативно воспринимается пациентами и затрудняет их реабилитацию в ранний послеоперационный период, однако еще большим злом является хронический послеоперационный болевой синдром (ХПБС), возникновение которого фактически перечеркивает функциональные результаты хирургического лечения в ортопедии. От хронической боли различной степени выраженности страдают до 44 % пациентов, перенесших ТЭКС, и до 27 % пациентов, перенесших ТЭТС. При этом боль отмечают 15 и 6 % пациентов соответственно [6].
В связи с этим целью настоящего исследования явилось улучшение результатов лечения больных ортопедического профиля путем выбора анестезиологической тактики, способствующей снижению частоты развития хронического болевого синдрома после операций ТЭТС и ТЭКС.
Исследование проводилось на базе ГБУЗ ГКБ № 67 им. Л.А. Ворохобова Департамента здравоохранения г. Москвы. Дизайн исследования был одобрен локальным этическим комитетом Первого Московского государственного медицинского университета им. И.М. Сеченова (Сеченовского Университета) (протокол № 06-19 от 15.05.2019).
В исследование были включены взрослые пациенты, которым проводилось плановое первичное эндопротезирование коленного или тазобедренного сустава вследствие коксартроза или гонартроза III–IV стадии. Всего было включено 104 пациента в возрасте от 43 до 87 лет (в среднем 63,85 ± 9,26), в том числе 63 (60,6 %) женщины и 41 (39,4 %) мужчина. В исследование не включались пациенты, у которых были противопоказания к проведению нейроаксиальной анестезии, пациенты с патологией ЦНС в анамнезе, выраженными когнитивными нарушениями и онкологическими заболеваниями.
Из 104 выполненных операций 78 (75 %) составляло ТЭТС и 26 (25 %) — ТЭКС.
Все пациенты были распределены на 2 группы, рандомизация осуществлялась методом конвертов (табл. 1):
Таблица 1. Группы пациентов и методики анестезии/анальгезии
| Этап | Группа | |
|---|---|---|
| КСЭA n = 53 (51 %) |
ОА n = 51 (49 %) |
|
| Премедикация | Вечером накануне операции per os бромдигидрохлорфенилбензодиазепин 1 мг, за 30 мин до операции — в/м бромдигидрохлорфенилбензодиазепин 1 мг, кетопрофен 50 мг | |
| Анестезия | КСЭА. Спинальный компонент: бупивакаин 0,5 % 8–10 мг; эпидуральный компонент (при необходимости) ропивакаин 0,375 % дробно по 7,5–10,75 мг. Седация — пропофол 1,0–1,5 мг/мин под контролем BIS = 80–85 |
Индукция: пропофол 80–150 мг, фентанил 200 мкг, цисатракурия безилат 0,03 мг/кг. Поддержание анестезии: севофлуран 0,8–1,2 МАК, под контролем BIS = 45–60, фентанил 100 мкг каждые 25–30 мин, цисатракурия безилат 0,18 мг/кг/ч |
| Послеоперационная анальгезия | Продленная ЭА. Ропивакаин 0,2 % 8–18 мг/ч, кетопрофен 50 мг в/м 2 раза/сут. Продолжительность ЭА 18–24 ч | Кетопрофен 50 мг 2 раза/сут + парацетамол в/в капельно 1000 мг 2–3 раза/сут, при необходимости — тримеперидин 20 мг в/м |
Коррекцию послеоперационной анальгезии проводили на основе интенсивности болевого синдрома, которую оценивали при помощи 10-балльной визуально-аналоговой шкалы (ВАШ). При значениях ВАШ > 3–4 баллов назначали дополнительное обезболивание (трамадол 100 мг или промедол 20 мг в/м) или же увеличивали скорость инфузии ропивакаина.
Исследуемые группы не имели статистически значимых отличий по полу, возрасту, сопутствующей патологии и характеру оперативного вмешательства, также стоит отметить, что продолжительность и выраженность болевого синдрома (в покое и при движении) до операции и его характер (наличие нейропатического компонента) в группах были схожие.
В дальнейшем проводилась оценка выраженности и характера боли, а также связанных с ней функциональных ограничений через 3, 6 и 12 мес. после операции. Также исследовали влияние интенсивности болевого синдрома до операции и в раннем послеоперационном периоде на формирование ХПБС (табл. 2).
Таблица 2. Этапы и методы исследования
| Методы исследования | Цель | Период оценки | ||
|---|---|---|---|---|
| Перед операцией | 1–2-е сут после операции | 3, 6, 12 мес. после операции | ||
| Шкала ВАШ (10-балльная) | Оценка степени выраженности боли до операции и в раннем послеоперационном периоде, коррекция анальгезии | + | + | − |
| Длительность болевого синдрома до операции (опрос) | Оценка влияния длительности болевого синдрома на риск формирования ХПБС | + | − | − |
| Вопросник WOMAC | Оценка выраженности боли и связанных с ней функциональных ограничений | + | − | + |
| Вопросник DN 4 | Оценка нейропатического компонента боли | + | − | + |
| Определение зон гиперальгезии при помощи волосков Фрея | Оценка влияния выраженности острой послеоперационной боли на формирование ХПБС | − | + | − |
Для оценки динамики боли и функции оперированной конечности использовалась шкала The Western Ontario MacMaster (WOMAC), разработанная специально для пациентов с хронической патологией коленного и тазобедренного суставов. WOMAC состоит из трех блоков вопросов: 17 — оценивающих функции, обеспечивающие повседневную деятельность человека, 5 — связанных непосредственно с болью, и 2 вопроса, оценивающих ограничение подвижности сустава.
Для выявления нейропатического компонента боли использовалась шкала Douleur Neuropathique 4 Questions (DN4), состоящая из 4 вопросов. Если количество положительных ответов составляет 4 и более (из 10 возможных), это указывает на наличие нейропатического компонента боли.
С целью оценки площади вторичной гиперальгезии вокруг операционной боли (прямая зависимость между площадью боли и интенсивностью острого болевого синдрома) использовали волоски Фрея (набор BIOSERB, Франция).
Статистическая обработка результатов исследования проводилась с помощью программ StatSoft Statistika 10.0, Microsoft Excel 2016, онлайн калькуляторами http://medstatistic.ru. Для оценки статистической значимости различий использовались точный критерий Фишера, t-критерий Стьюдента, U-критерий Манна—Уитни.
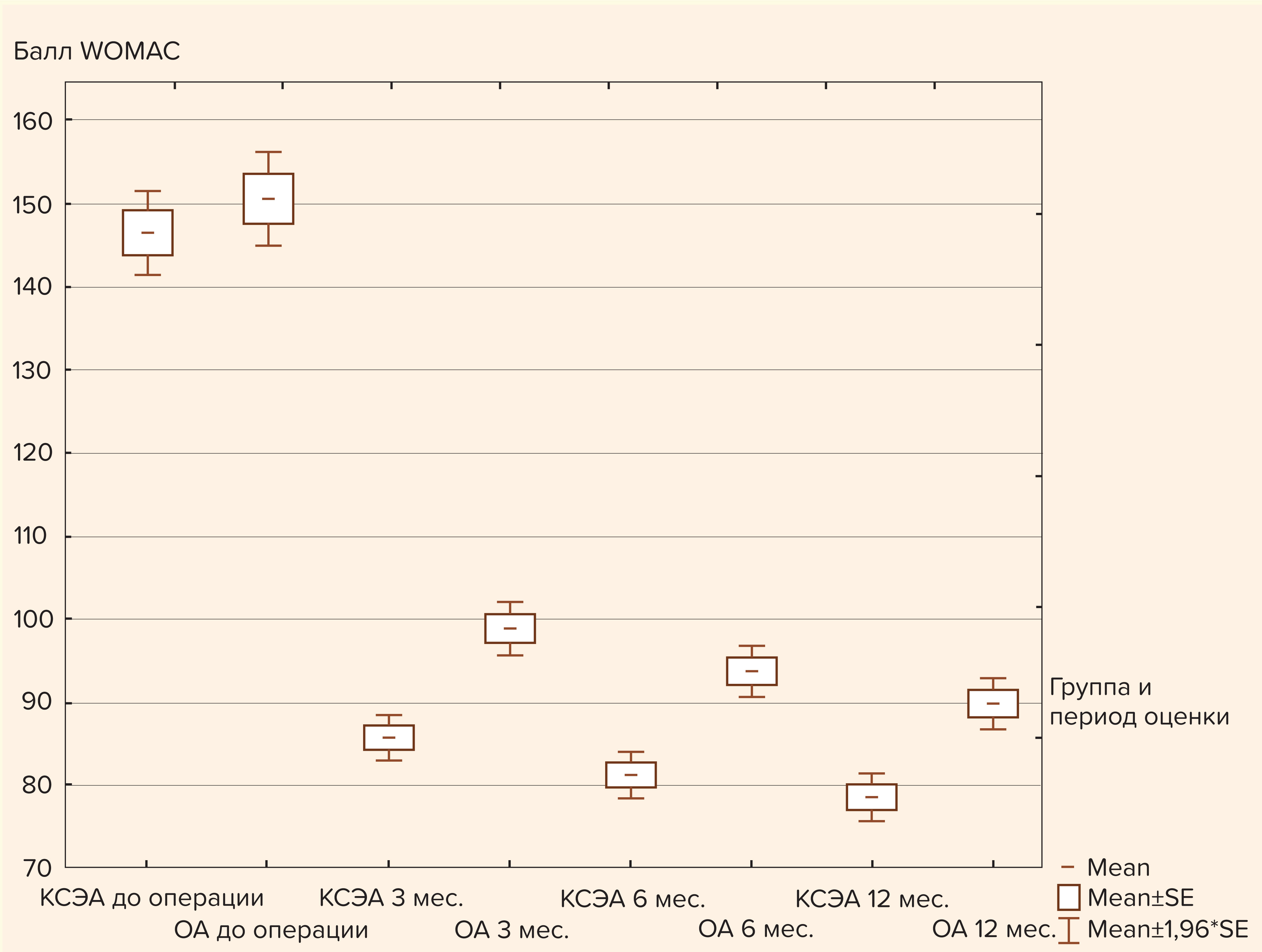
Основным критерием улучшения качества жизни пациентов в нашем исследовании явилась динамика оценки по шкале WOMAC за 3, 6 и 12 мес. после операции. Сумма баллов по шкале, оценивающей характер боли и связанных с ней функциональных ограничений, до операции составила 150,4 ± 20,6 и 146,4 ± 8,7 в группах ОА и КСЭА соответственно (p = 0,279). В динамике после операции отмечалось значимое улучшение в обеих группах по всем параметрам опроса WOMAC (боль, ограничение и функция сустава), при этом результаты лечения в группе КСЭА были существенно лучше. Оценки по WOMAC составили 85,7 ± 9,99 балла vs 99,0 ± 11,68 в группе ОА спустя 3 мес. после операции (p < 0,01), 81,3 ± 10,19 vs 93,8 ± 11,31 спустя 6 мес. (p < 0,01) и 78,7 ± 10,48 vs 89,9 ± 10,77 спустя год после операции (p < 0,01) (рис. 1).

Рис. 1. Сравнение результатов оценки по шкале WOMAC в группах исследования в динамике (до операции, через 3, 6 и 12 месяцев после операции)
КСЭА — группа комбинированной спинально-эпидуральной анестезии с продленной эпидуральной анальгезией; ОА — группа общей анестезии с послеоперационной мультимодальной анальгезией; до операции — оценка проведена до оперативного лечения; 3 мес. — оценка спустя 3 месяца после операции; 6 мес. — оценка спустя 6 месяцев после операции; 12 мес. — оценка спустя 12 месяцев после операции.
Значительное снижение интенсивности боли через 3 мес. после операции отметило большинство пациентов обеих группах. В то же время наличие хронического болевого синдрома отмечалось у 18 (17,3 %) пациентов при оценке спустя 3 мес. после операции и у 16 (15,4 %) пациентов при оценке спустя 6 и 12 мес. (табл. 3). При этом наличие боли и потребность в приеме анальгетиков через полгода-год после операции существенно реже отмечались у пациентов группы КСЭА.
Таблица 3. Частота хронического послеоперационного болевого синдрома в группах исследования
| Группы | Пациенты с ХПБС спустя 3 мес. после операции | Пациенты с ХПБС спустя 6 мес. после операции | Пациенты с ХПБС спустя 12 мес. после операции |
|---|---|---|---|
| КСЭА (n = 53) | 6 (11,32 %) | 4 (7,5 %) | 4 (7,5 %) |
| ОА (n = 51) | 13 (25,49 %) | 12 (23,53 %) | 12 (23,53 %) |
| p = 0,07763* | p = 0,03034* | p = 0,03034* |
* Расчет по точному критерию Фишера.
Для оценки наличия нейропатического компонента боли пациенты с ХПБС были оценены по шкале DN4 (оценка проводилась через 6 мес. после эндопротезирования). У 10 (62,5 %) пациентов отмечались признаки нейропатической боли, несколько чаще в группе ОА, хотя разница была незначимая — 8 (66 %) в группе ОА vs 2 (50 %) в группе КСЭА (p > 0,05).
При анализе результатов опроса на дооперационном этапе выявлено, что у большинства пациентов длительность болевого синдрома до операции превышала 6 мес. Длительное ожидание операции значительно повлияло на формирование ХПБС (табл. 4).
Таблица 4. Влияние длительности болевого синдрома до операции на формирование хронического послеоперационного болевого синдрома*
| Период от появления интенсивной боли до выполнения операции замены сустава | Количество пациентов (%) | Пациенты с ХПБС |
|---|---|---|
| Менее 6 мес. | 18 (17,3 %) | 0 (0 %) |
| От 6 до 12 мес. | 21 (20,2 %) | 2 (9,5 %) |
| От 12 до 24 мес. | 47 (45,2 %) | 8 (17,2 %) |
| Более 24 мес. | 18 (17,3 %) | 6 (33,3 %) |
| Всего | 104 | 16 (15,4 %) |
*Анализ произвольных таблиц сопряженности с использованием критерия χ2, p = 0,039.
В первые двое суток после операции всем пациентам была проведена оценка площади гиперальгезии вокруг послеоперационной раны с помощью волосков Фрея. В группе КСЭА площадь гиперальгезии была значимо меньше (табл. 5).
Таблица 5. Площадь гиперальгезии в 1-е и 2-е послеоперационные сутки в группах исследования (см2)
| Измерение | КСЭА (n = 53) | ОА (n = 51) | p* |
|---|---|---|---|
| Площадь гиперальгезии в 1-е сут после операции (см2): | |||
— тонкий волосок |
14,89 ± 4,17 | 17,07 ± 4,20 | 0,00944 |
— средний волосок |
15,86 ± 4,25 | 19,81 ± 5,41 | 0,00007 |
— толстый волосок |
18,46 ± 4,91 | 22,41 ± 5,10 | 0,00011 |
| Площадь гиперальгезии во 2-е сут после операции (см2): | |||
— тонкий волосок |
11,33 ± 4,57 | 13,54 ± 3,26 | 0,00550 |
— средний волосок |
13,56 ± 4,68 | 15,44 ± 4,53 | 0,03858 |
— толстый волосок |
15,10 ± 4,69 | 19,14 ± 5,86 | 0,00019 |
* Расчет с использованием U-критерия Манна—Уитни.
При ретроспективной оценке пациентов с развившимся ХПБС было отмечено, что площадь зоны вторичной гиперальгезии в первые двое суток после операции у них была значительно больше в сравнении с пациентами без ХПБС (табл. 6).
Таблица 6. Влияние площади зоны вторичной гиперальгезии в первые двое суток после операции на формирование хронического послеоперационного болевого синдрома
| Измерение | Нет ХПБС (n = 88) | Есть ХПБС (n = 16) | p* |
|---|---|---|---|
| Площадь гиперальгезии в 1-е сут после операции (см2): | |||
— тонкий волосок |
15,33 ± 4,27 | 19,41 ± 2,55 | 0,00008 |
— средний волосок |
16,99 ± 5,12 | 22,28 ± 3,21 | 0,00003 |
— толстый волосок |
19,56 ± 5,29 | 25,03 ± 2,81 | 0,00007 |
| Площадь гиперальгезии во 2-е сут после операции (см2): | |||
— тонкий волосок |
11,85 ± 4,10 | 15,59 ± 2,58 | 0,00027 |
— средний волосок |
13,82 ± 4,66 | 18,13 ± 2,56 | 0,00041 |
— толстый волосок |
16,19 ± 5,49 | 21,93 ± 3,97 | 0,00010 |
* Расчет с использованием U-критерия Манна—Уитни.
Основным осложнением, приводящим к неполной функциональной реабилитации и неудовлетворенности пациентов после операций эндопротезирования крупных суставов нижних конечностей, является формирование ХПБС, частота которого значительно выше в сравнении с другими областями хирургии и в среднем составляет 7–23 % после ТЭТС и 10–34 % после ТЭКС [7]. В нашем случае болевой синдром через год после операции сохранялся у 16 (15,4 %) пациентов. В большинстве случаев (62,5 %) эта боль имела нейропатический характер, что усугубляло психоэмоциональный дискомфорт пациентов.
Имеются убедительные данные о том, что длительность предоперационного болевого синдрома у пациентов с остеоартрозом находится в прямой связи с интенсивностью последующего болевого синдрома и степенью функциональных нарушений. В частности, полагают, что срок > 1 года между появлением показаний к хирургическому лечению и выполнением эндопротезирования ухудшает результат с точки зрения полноценной реабилитации [8, 9]. В нашем исследовании средний срок ожидания операции и, соответственно, период интенсивной боли до хирургического лечения составил более года. Нами была выявлена прямая зависимость формирования ХПБС от длительности ожидания операции.
В современной литературе до сих пор нет убедительных данных о преимущественном влиянии той или иной анестезиологической тактики на формирование ХПБС после ТЭТС или ТЭКС. Однако существуют данные о способности регионарной анестезии/анальгезии снижать риск формирования ХПБС в целом. В частности, Кокрейновский обзор 2012 г. (метаанализ 23 контролируемых рандомизированных исследований) показал, что послеоперационная ЭА снижает частоту развития ХПБС после торакотомии, а паравертебральная блокада — частоту постмастэктомического болевого синдрома [10]. Известны данные о способности продленной ЭА снижать частоту развития хронического постторакотомического болевого синдрома [11].
В 2015 г. был представлен анализ восьми контролируемых рандомизированных исследований, оценивавших влияние различных вариантов регионарной анестезии/анальгезии на отдаленные (> 3 мес.) функциональные результаты эндопротезирования суставов нижних конечностей [12]. Авторы анализа отметили, что функциональные результаты достоверно не отличались от групп сравнения, получавших системную анальгезию. Данный факт объяснили разнородностью применявшихся методик, а также малым количеством выборки в исследованиях.
В нашем исследовании использование методики КСЭА с пролонгированием ЭА в ранний послеоперационный период значительно повлияло на отдаленные результаты формирования ХПБС и улучшило функциональные возможности пациентов. В группе КСЭА частота ХПБС составила 7,5 %, в группе общей анестезии — 23,5 %.
Схожие результаты отмечались и при оценке по шкале WOMAC, отражающей функциональные возможности оперированного сустава. Сумма баллов по шкале в группе КСЭА была значительно ниже в сравнении с группой ОА на всех этапах оценки спустя 3, 6 и 12 мес.
Лучшие результаты лечения в отношении формирования ХПБС и, как следствие, лучшая функциональная реабилитация в группе СЭА обусловлены влиянием регионарной анестезии на звенья патогенеза развития хронической боли. Прерывая трансмиссию боли, то есть блокируя боль на этапе афферентной иннервации, регионарные методики анальгезии препятствуют сенситизации нейронов задних рогов спинного мозга, выраженность которой влияет на формирование вторичной гиперальгезии.
Применение КСЭА в нашем исследовании сопровождалось значимым уменьшением площадей зон вторичной гиперальгезии вокруг операционной раны. Ограничение зон вторичной гиперальгезии сопровождалось снижением интенсивности боли в ранний послеоперационный период. Интенсивность боли в 1–2-е сут после операции является одним из основных факторов риска ХПБС [13].
Формирование ХПБС после операций тотального эндопротезирования крупных суставов нижних конечностей является одним из основных факторов, ухудшающих функциональные результаты хирургического лечения. Основными факторами риска можно считать: а) наличие интенсивного болевого синдрома до операции; б) его длительность, превышающую 6 мес.; в) наличие интенсивного болевого синдрома в 1-е сут после операции.
Выполнение операций эндопротезирования коленного и тазобедренного суставов в условиях КСЭА с продленной ЭА в течение 18–24 ч снижает риск формирования ХПБС в три раза в сравнении с пациентами, которые были оперированы в условиях общей анестезии с системным введением анальгетиков в послеоперационный период.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Политов М.Е., Овечкин А.М., Сокологорский С.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи, обоснование научной значимости; Панов Н.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, обоснование научной значимости.