Термин «вентилятор-ассоциированная диафрагмальная дисфункция» введен в клиническую практику в 2004 г. Vassilakopoulos T. [1] при обсуждении проблем с отлучением ряда пациентов от респираторной поддержки. Частота встречаемости этого осложнения послеоперационного периода среди пациентов, получающих искусственную вентиляцию легких, достигает 20 % [2]. Среди возможных причин развития данного состояния можно в первую очередь выделить несостоятельность аппарата внешнего дыхания.
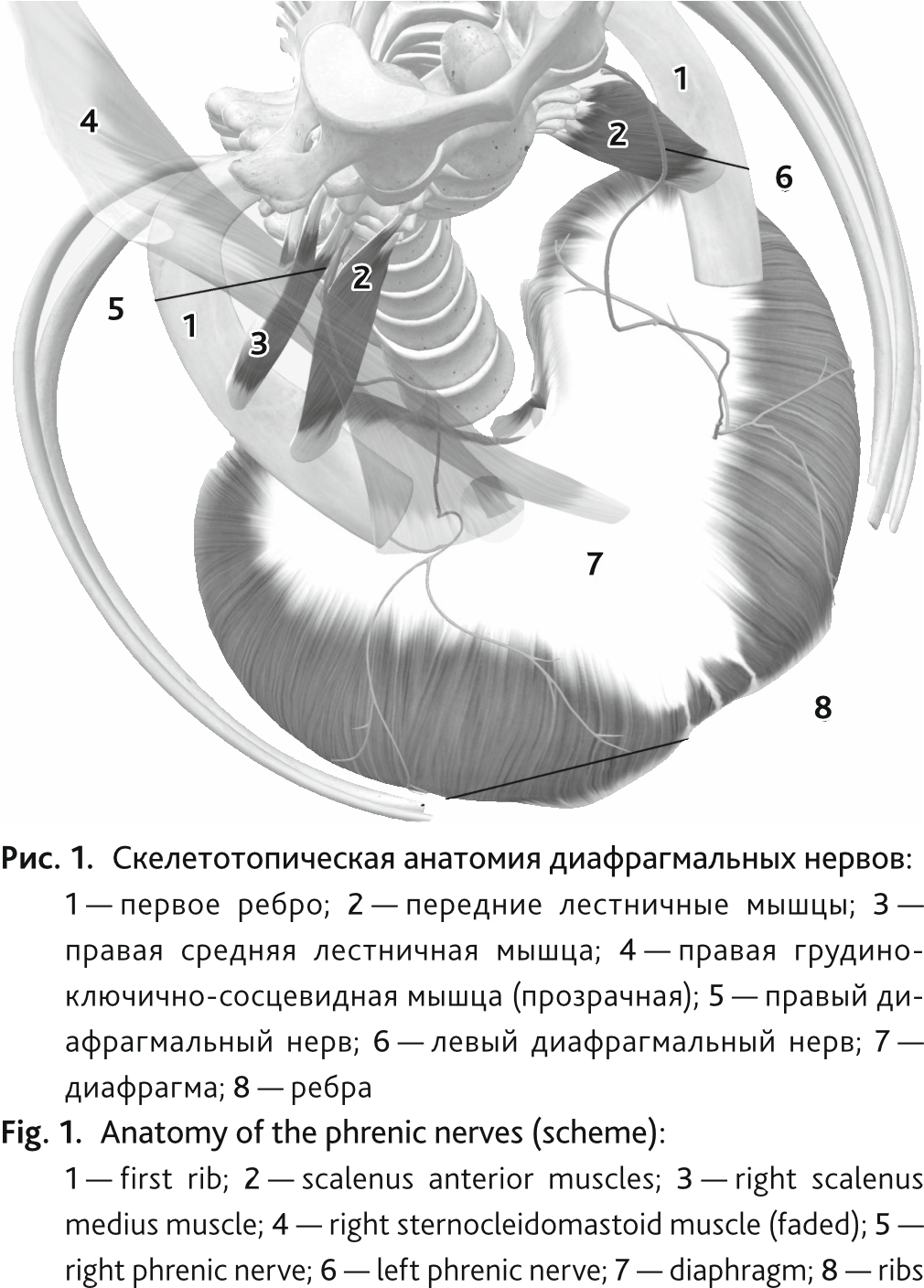
Как известно, диафрагма представляет собой мышцу, работа которой обеспечивает 2/3 инспираторного усилия, и, если одностороннее повреждение часто остается бессимптомным, двусторонняя дисфункция значительно нарушает работу внешнего дыхания. Диафрагма иннервируется передними ветвями 3, 4 и 5-го шейных спинномозговых нервов, которые формируют диафрагмальные нервы. Сформированный нерв проходит в нейрофасциальном пространстве между средней и передней лестничными мышцами. Далее, прикрытый спереди грудино-ключично-сосцевидной мышцей, он кранио-каудально следует по передней поверхности передней лестничной мышцы к верхней апертуре, через которую проникает в грудную клетку. В средостении, проходя по боковой поверхности перикарда кпереди от корня легкого, нерв достигает диафрагмы, формируя дистальные двигательные ветви (рис. 1). Кроме диафрагмы, к основным дыхательным мышцам относят наружные межреберные и зубчатые мышцы, а также мышцы, поднимающие ребра. Вспомогательная дыхательная мускулатура представлена мышцами шеи, груди и спины. Все они получают эфферентную стимуляцию из различных сегментов спинномозговых нервов.

Среди причин снижения сократимости диафрагмы, т. е. непосредственно миопатической причины ее дисфункции, рассматривают оксидативный стресс и митохондриальные изменения в миофибриллах. Возникающие на этом фоне нарушения белкового синтеза приводят к атрофии диафрагмы, снижению ее функциональности и усугублению дыхательной недостаточности [3]. Степень выраженности дисфункции и скорость ее прогрессирования очень индивидуальны.
Есть данные, что уже через 12 ч после начала искусственной вентиляции легких в диафрагме обнаруживаются атрофические изменения, а значимое снижение ее функции может возникать через 48 ч респираторной поддержки с потенциалом для дальнейшего прогрессирования [3].
В кардиохирургической практике стоит помнить о возможном нейропатическом генезе диафрагмальной дисфункции при непосредственном интраоперационном повреждении [4]. Так, после неосложненных кардиохирургических вмешательств односторонняя дисфункция диафрагмы отмечается в 10 % случаев, что зачастую не оказывает влияния на исход. Двусторонняя дисфункция отмечена в 2,3 % случаев [5]. Один из последних ретроспективных обзоров указывает, что диафрагмальная дисфункция в кардиохирургии встречается преимущественно у пациентов после коронарного шунтирования, у которых среди сопутствующей патологии диагностирована артериальная гипертензия и повышение массы тела [6]. Функциональная неполноценность аппарата внешнего дыхания в кардиохирургии приводит к удлинению времени респираторной поддержки, повышению частоты реинтубаций, трахеостомий и неинвазивной вентиляции, а также к удлинению сроков госпитализации. При этом есть доказательства обратимости повреждения диафрагмального нерва, подтвержденного электрофизиологическим исследованием, и восстановления его функции в течение года наблюдения [7]. С учетом длительности периода восстановления проведения по поврежденному диафрагмальному нерву и невозможности полноценной реабилитации при несостоятельности аппарата внешнего дыхания очень важны своевременная диагностика и терапия этого состояния. Это особенно актуально на фоне продленной вентиляторной поддержки, которая повышает риск инфекционных осложнений и легочного фиброза, что ассоциируется с госпитальной летальностью и увеличением расходов системы здравоохранения в послеоперационном периоде [8].
Среди методов диагностики дисфункции диафрагмы по-прежнему целесообразно рентгенографическое исследование, хотя в последнее время особый интерес представляют такие ультразвук-ассистированные методики, как определение толщины и экскурсии диафрагмы, а также индекса ее утолщения во время дыхательного цикла (рис. 2); тем не менее нормативы этих показателей остаются предметом дискуссий [2]. Считается, что экскурсия диафрагмы < 10–14 мм и ее утолщение < 20–36 % во время дыхательного цикла указывают на диафрагмальную дисфункцию и являются предикторами несостоятельности отлучения от респиратора и экстубации [9]. Несмотря на различия в измеряемой при ультразвуковом исследовании толщине диафрагмы между мужчинами и женщинами, этот показатель признан простым и воспроизводимым в общей популяции [10].

Для оценки степени функциональной несостоятельности диафрагмы могут быть полезны определение максимального инспираторного давления, трансдиафрагмального давления, а также сомнография с оценкой качества сна и бодиплетизмография. Если первые два показателя доступны для мониторирования на респираторах экспертного класса, то последние (сомнография и бодиплетизмография) малоинформативны в интенсивной терапии и используются в основном в терапевтической практике для оценки прогноза или определения показаний к имплантации стимулятора диафрагмы или ее пликации.
Терапевтические опции диафрагмальной дисфункции в раннем послеоперационном периоде ограничены купированием основной патологии, протективной респираторной поддержкой с сохранением паттерна спонтанного дыхания, стабилизацией нутритивного статуса и реабилитационными мероприятиями [11]. К профилактическим мерам, предупреждающим дисфункцию диафрагмы, относят купирование электролитных нарушений и гипоальбуминемии, в том числе при неконтролируемой почечной недостаточности и гипотиреозе. Кроме этого, следует избегать необоснованного использования пролонгированной седации, миорелаксантов и кортикостероидов, которые также могут усугубить это состояние [12]. В экспериментальных исследованиях на животных применение высоких доз витамина Е, ацетилцистеина и ряда других антиоксидантов способствовало купированию оксидативного стресса и уменьшению степени атрофии диафрагмы при продленной искусственной вентиляции легких [13, 14], но в клинической практике эффективность их применения не доказана. Приемлемым профилем риска и пользы в терапии диафрагмальной дисфункции обладает осторожное использование малых доз теофиллина, поскольку кроме реологических эффектов, оказываемых на кровоснабжение диафрагмы, оно способствует улучшению бронхиальной проводимости, блокирует транслокацию провоспалительных молекул и сокращает выделение свободных радикалов [3]. На основании теоретической способности кальциевого сенситайзера левосимендана усиливать сократимость диафрагмы за счет увеличения аффинности сократительных белков и кальция, а также результатов небольшого рандомизированного исследования на здоровых добровольцах, показавшего улучшение функции диафрагмы [15], для купирования дисфункции диафрагмы рассматривалось и назначение данного препарата. Однако отрицательные результаты ряда экспериментальных исследований [16] и недоказанная клиническая эффективность не позволяют внести это показание в инструкцию к препарату, что ограничивает его применение для улучшения сократимости диафрагмы. В настоящее время нарастает интерес к использованию стволовых клеток в качестве стресс-лимитирующей терапевтической стратегии при оксидативном стрессе различной этиологии, но их применение при вентилятор-ассоциированной диафрагмальной дисфункции остается предметом будущих исследований [3].
К доступным хирургическим методам купирования диафрагмальной дисфункции как причины дыхательной недостаточности относят пликацию диафрагмы, что приводит к увеличению альвеолярной вентиляции за счет опускания релаксированного купола диафрагмы [11]. Данный метод эффективен преимущественно при одностороннем поражении и не используется в сроке до 12 мес. от события, вызвавшего нарушения дыхания.
К перспективным методам терапии диафрагмальной дисфункции относят миостимуляцию имплантированными электродами и инвазивную стимуляцию диафрагмальных нервов [17], о которых речь пойдет ниже.
Изучение и улучшение нейрональной проводимости особенно актуально у пациентов со спинальной травмой, которая внезапно нарушает или полностью прерывает нейромышечную проводимость. Исследования показывают, что при мультимодальном подходе к терапии можно улучшить регенерацию поврежденных аксонов, повысить мощность оставшихся нейрональных контактов и способствовать формированию новых связей; эти процессы называются нейропластичностью [18]. Для ускорения этих процессов и оптимизации нейрональной активности применяют методики нейромодуляции. Кроме фармакологических препаратов, для восстановления утраченных двигательных функций при спинальной травме с успехом применяются оптогенетическая модификация и периферическая электростимуляция, в том числе с синхронизацией по электроэнцефалограмме (ЭЭГ) и машинным интерфейсом. Периферическая электростимуляция в арсенале методик нейромодуляции является наиболее доступным и безопасным методом реабилитации, используемым и в домашних условиях [19]. Альтернативу транскутанным воздействиям составляют инвазивные методики электрической нейромодуляции.
Интерес к электрической нейромодуляции проявляли в прошлом для лечения электричеством головных болей и артритов. Научную основу электростимуляции заложил в XIX в. М. Фарадей. В последующие два столетия ее с успехом внедрили в разные медицинские специальности — от анестезиологии и неврологии до психиатрии, офтальмологии и нейрохирургии [20, 21]. В современной медицине электрическое воздействие на ткани и структуры относится к физиотерапевтическим вмешательствам, актуальность которых в век доказательной медицины подвергается критике. Ренессанс использования электростимуляции основан на положительных эффектах комплексной нейромодуляции у пациентов после травмы спинного мозга со стойкой утратой моторной и сенсорной функции [19] и доступности прикроватной визуализации нервов с помощью ультразвука. Диагностические исследования нервной проводимости возможны при транскутанном расположении активных электродов [12], но лечебное воздействие, особенно на миелинизированные нервные волокна, возможно лишь при близком контакте с нервом. С другой стороны, интимное расположение кончика иглы может вызвать повреждение периневрия у половины пациентов, поэтому непосредственный контакт с нервом нежелателен [23], а терапевтический эффект может быть достигнут за счет различных режимов электрического воздействия. Эти свойства возбудимости основаны на электрофизиологических характеристиках стимула, в частности реобазы, хронаксии и длительности воздействия. Так, реобаза для исключения повреждения структуры нерва не должна превышать 0,5 мА, хронаксия для крупных миелинизированных (Аα) нервных стволов, к которым относится диафрагмальный нерв, должна быть не более 0,05–0,1 мс, а длительность воздействия зависит от желаемого эффекта [24].
Электростимуляция нервных стволов оказывает модуляторное и трофическое действие на структуру нерва, что обеспечивает терапевтические эффекты купирования хронического болевого синдрома и нейропатической боли, однако частотные и амплитудные характеристики электростимуляции, а также ее оптимальная длительность до сих пор не определены [25].
Различают методы для постоянной и временной стимуляции диафрагмы. Имплантация диафрагмального миостимулятора на постоянной основе имеет экономические преимущества перед инвазивной вентиляцией легких лишь через 3–4 года использования [26], поэтому имплантируемые устройства с целью облегчения отлучения от механической вентиляции практически не применяются.
Для ускорения реабилитации после длительной искусственной вентиляции легких (ИВЛ) предложены временные трансвенозные системы для стимуляции диафрагмальных нервов. С учетом простоты их имплантации данная методика выглядит достаточно многообещающей, однако для рекомендаций к ее рутинному внедрению в клиническую практику пока недостаточно данных об эффективности [27]. Ряд авторов предлагает имплантировать интраоперационно к диафрагме электроды для временной электрокардиостимуляции, традиционно используемые при кардиохирургических вмешательствах. Предложенная методика имплантации электродов и ежедневная стимуляция диафрагмы увеличивают дыхательный объем в среднем на 37 %, что уменьшает ателектазирование легочной ткани и атрофию диафрагмы, нивелирует гиповентиляцию и способствует сокращению сроков респираторной поддержки у ряда пациентов [28], однако выбор таких больных остается предметом для дискуссии. Еще один из возможных методов — шейный доступ к диафрагмальным нервам для их электрической стимуляции, также показал свою безопасность и возможность применения [29, 30]. В целом физиотерапевтические воздействия, в частности электростимуляция диафрагмы, доказали свою эффективность, но клинический опыт использования этих методик ограничен единичными публикациями и небольшим количеством наблюдений.
Целью представления клинического случая является описание новой опции в арсенале анестезиолога-реаниматолога, а именно инвазивной нейромодуляции диафрагмального нерва методом непосредственной электростимуляции и его роли в ведении пациента с послеоперационной диафрагмальной дисфункцией.
Пациентка (82 года, масса тела — 65 кг, рост — 155 см) поступила в кардиохирургическое отделение ГБУЗ АО «Первая ГКБ им. Е.Е. Волосевич» (Архангельск) для плановой коррекции аортального порока сердца — стеноза аортального клапана тяжелой степени. Значимой коморбидности, кроме артериальной гипертензии II степени, риска 4 и хронической болезни почек (скорость клубочковой фильтрации [СКФ] — 41 мл/мин), не отмечено. Аллергический анамнез благоприятный. Среди принимаемых препаратов пациентка указывает бета-блокаторы в малой дозе, дезагреганты — ацетилсалициловую кислоту и эпизодически — ингибиторы ангиотензин-превращающего фермента (иАПФ) под контролем артериального давления. Эпизодов диспноэ, одышки, мышечной слабости ранее не отмечала. Наследуемые заболевания у близких родственников отрицает.
16.11.2021 через срединную стернотомию выполнено плановое протезирование аортального клапана (биопротез Epic № 23) в условиях искусственного кровообращения и фармакохолодовой кардиоплегии, наружное охлаждение сердца не использовалось. Явные интраоперационные предпосылки для холодового, ишемического и травматического повреждения нервов отсутствовали. Операция проведена в условиях анестезии севофлураном и фентанилом, ее продолжительность составила 180 мин, длительность искусственного кровообращения — 90 мин. Течение первых суток послеоперационного периода было неосложненным, после прохождения теста на спонтанное дыхание выполнена экстубация трахеи спустя 6 ч после завершения операции. В течение 1-х суток послеоперационного периода на фоне инсуффляции кислорода через носовые катетеры оксигенация не страдала, при контроле газового состава артериальной крови показатель парциального давления кислорода (РаО2) составлял 160–180 мм рт. ст. при гиперкапнии 46,8–50,5 мм рт. ст. При этом объективно и субъективно дыхательная недостаточность была компенсирована, уровень лактата составлял 1,5 ммоль/л, метаболических нарушений не было. При рентгенологическом исследовании органов грудной клетки очаговых и инфильтративных изменений в легких не выявлено, отмечены косвенные признаки гиповентиляции в нижнем отделе левого легкого. Латеральные синусы свободны, релаксации диафрагмы не отмечено.
Вместе с тем к концу 1-х суток нарастание усталости, гиповентиляции, гипоксемии и десатурации до 88 % потребовали подключения неинвазивной вентиляции легких c поддержкой давлением 10 см вод. ст. и положительным давлением в конце выдоха (ПДКВ) 5 см вод. ст. Толерантность к предложенному режиму респираторной поддержки в течение 40 ч постепенно уменьшалась. На 4-е сутки после операции (20.11.2021) пациентка была переведена на инвазивную искусственную вентиляцию через оротрахеальную трубку, а на 7-е сутки (23.11.2021) ей была выполнена трахеостомия в связи с отсутствием адекватного спонтанного дыхания и прогнозируемыми сложностями при отлучении от респираторной поддержки. Вентиляция легких при этом осуществлялась в режиме поддержки давлением (+8… +12 см вод. ст.) со средним давлением в дыхательных путях 13 см вод. ст. и ПДКВ 4 см вод. ст., при этом дыхательный объем достигал 350–430 мл. Стабильные показатели газообмена и дыхательный комфорт обеспечивались при фракции кислорода 30 %. При попытке перевода на спонтанное дыхание отмечено парадоксальное дыхание — разнонаправленное движение грудной стенки и брюшной стенки во время дыхательного цикла, активное участие вспомогательной дыхательной мускулатуры.
При осмотре пациентка в сознании, контактна, комплаентна к проводимой терапии. Режим расширенный постельный, ортостатических реакций нет. На фоне ИВЛ в режиме спонтанного дыхания при поддержке давлением +12 см вод. ст. и ПДКВ 4 см вод. ст. при фракции кислорода 30 % дыхание равномерно проводится во все отделы легких, частота дыхательных движений (ЧДД) — 18/мин. Хрипов нет. Дыхательный объем — 340–400 мл, субъективно отмечает состояние дыхательного комфорта, но при тесте на спонтанное дыхание (уменьшении поддержки давлением) в течение 45–60 мин ЧДД нарастает до 30/мин, дыхательный объем уменьшается до 280–300 мл, при этом сатурация — 90–92 %, тахикардия — 110/мин, что сопровождается эмоциональным негативизмом и ажитацией.
Предварительный диагноз: 7-е сутки послеоперационного периода протезирования аортального клапана. Миопатия неуточненная. Острая вентиляционная дыхательная недостаточность.
Рентгенологические исследования органов грудной клетки в прямой проекции от 17.11, 18.11 и 22.11.2021 не выявили очаговых инфильтративных изменений в паренхиме легких и релаксации диафрагмы.
Компьютерная томография органов грудной клетки 17.11 (рис. 3) и 30.11.2021 также не выявила инфильтративных изменений в легочной ткани или гидроторакса, как и смещения куполов диафрагмы краниально.
22.11, 23.11, 02.12.2021 выполнены бронхоскопические санации, получено незначительное количество слизистой мокроты, деформации бронхиального дерева или признаков бронхообструкции не выявлено. Посевы мокроты трехкратно оказались без роста патологической микрофлоры.
Уровень маркеров воспаления в крови регрессировал, отмечен регресс лейкоцитоза с 19,1 до 8,2 × 109/л и С-реактивного белка с 63 до 2 мг/л к 14-м суткам послеоперационного периода. Показатели газового состава артериальной крови в динамике представлены в табл. 1.
Таблица 1. Динамика показателей артериальных газов в период реабилитации
Table 1. Arterial blood gases during rehabilitation in Intensive Care unit
| Параметр | Дата | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 16.11 | 22.11 | 30.11 | 02.12 | 04.12 | 06.12 | 08.12 | 11.12 | 14.12 | 16.12 | 19.12 | |
| PaO2, мм рт. ст. | 178 | 87 | 71 | 85 | 105 | 86 | 111 | 78 | 98 | 111 | 96 |
| PaCO2, мм рт. ст. | 46,8 | 45,9 | 46,9 | 43,3 | 42,0 | 40,9 | 35,9 | 39,9 | 36,9 | 40,4 | 42,2 |
| AB, моль/л | 18,0 | 28,1 | 26,7 | 26,2 | 23,6 | 22,4 | 22,3 | 23,5 | 22,2 | 23,2 | 24,0 |
| pH | 7,23 | 7,41 | 7,39 | 7,4 | 7,37 | 7,36 | 7,39 | 7,38 | 7,38 | 7,37 | 7,38 |
| Лактат, моль/л | 2,3 | 1,0 | 1,8 | 1,3 | 1,1 | 1,0 | 1,3 | 0,7 | 2,0 | 1,4 | 1,1 |
| FiO2, % | 50 | 30 | 30 | 30 | 30 | 30 | 30 | 30 | 30 | СД | СД |
| AB — концентрация бикарбоната; FiO2 — фракция кислорода в кислородно-воздушной смеси на вдохе; PaCO2 — парциальное напряжение углекислого газа в артериальной крови; PaO2 — парциальное напряжение кислорода в артериальной крови; pH — водородный показатель; СД — спонтанное дыхание. | |||||||||||
Неоднократные исследования соскоба со слизистой носоглотки и бронхоальвеолярного лаважа (тест на основе полимеразной цепной реакции (ПЦР) — 5580 РеаБест РНК SARS-CoV-2) на новую коронавирусную инфекцию 19.11, 23.11, 2.12.2021 отрицательные.
При ультразвуковом исследовании диафрагмы 30.11.2021 (линейный датчик L12-5, фазированный датчик S5-1, аппарат Philips CX-50) толщина диафрагмы составила 10 мм, экскурсия правого купола — 5 мм, индекс утолщения — 0 %.
Уровень альбумина на фоне восстановления энтерального питания повысился с 26 (17.11.2021) г/л до 35 (3.12.2021) г/л, показатели электролитного состава крови, а также маркеры печеночной и почечной дисфункции находились в пределах референсных значений.
Пациентка проконсультирована неврологом, выполненная проба с неостигмином для исключения манифестации миастении оказалась отрицательной. Сила и тонус мышц конечностей симметричны, движения в конечностях в полном объеме, признаков очаговой неврологической симптоматики не выявлено. Нейромиографическое исследование и биопсия мышц оказались недоступными по техническим причинам.
По результатам консультации торакального хирурга данных о релаксации диафрагмы не выявлено, показаний к пликации диафрагмы нет.
Выполнение спирографии оказалось невозможным в силу тяжести дыхательной недостаточности, измерение трансдиафрагмального давления недоступно.
Основное заболевание: склеродегенеративный аортальный порок сердца с формированием аортального стеноза тяжелой степени; 15-е сутки послеоперационного периода протезирования аортального клапана (биопротез Epic № 23).
Осложнения: послеоперационная двусторонняя диафрагмальная дисфункция; острая вентиляционная дыхательная недостаточность.
Сопутствующие заболевания: артериальная гипертензия II степени, риск 4; хроническая анемия легкой степени; хроническая болезнь почек IIIА степени.
В данном случае ведущим этиологическим фактором в развитии послеоперационной дыхательной недостаточности явилась диафрагмальная дисфункция. Описанная клиническая картина может возникать в результате дефекта любого участка нейромышечной оси: спинного мозга (С3–4–5) — диафрагмального нерва — нейромышечного соединения — диафрагмы [31]. Поражение спинного мозга исключено ввиду дисфункции исключительно в зоне иннервации диафрагмального нерва; парестезий, нарушения двигательных функций в зоне иннервации нервов, формирующих плечевое сплетение, не отмечено. Миастенические симптомы и проявления наследуемых заболеваний маловероятны ввиду хотя и двустороннего, но мононеврального поражения и изолированности нейропатии. Нейропатия диафрагмального нерва или его интраоперационное повреждение рассматривались как основные факторы патогенеза дисфункции, но уровень повреждения требовал дополнительного подтверждения.
Дальнейшая неспецифическая терапия была направлена на реабилитацию, поддержание трофического статуса и профилактику инфекционных осложнений. В течение следующих 5–7 сут пациентка находилась в ясном сознании, была толерантна к расширению режима, смогла вертикализироваться, занималась с инструктором по лечебной физкультуре и восстановила пероральный прием пищи. Тем не менее попытки перевода на спонтанное дыхание и отлучения от аппарата в течение часа приводили к диспноэ и эмоциональному истощению. Со слов пациентки, с учетом отсутствия положительной динамики и субъективного восприятия бесперспективности лечения, стали появляться суицидальные мысли, и актуализировалось астено-депрессивное состояние.
После получения добровольного информированного согласия на 20-е сутки послеоперационного периода, с целью определения уровня поражения и состоятельности нервно-мышечной передачи, проведена билатеральная ультразвук-ассистированная инвазивная электростимуляция диафрагмальных нервов (рис. 4).
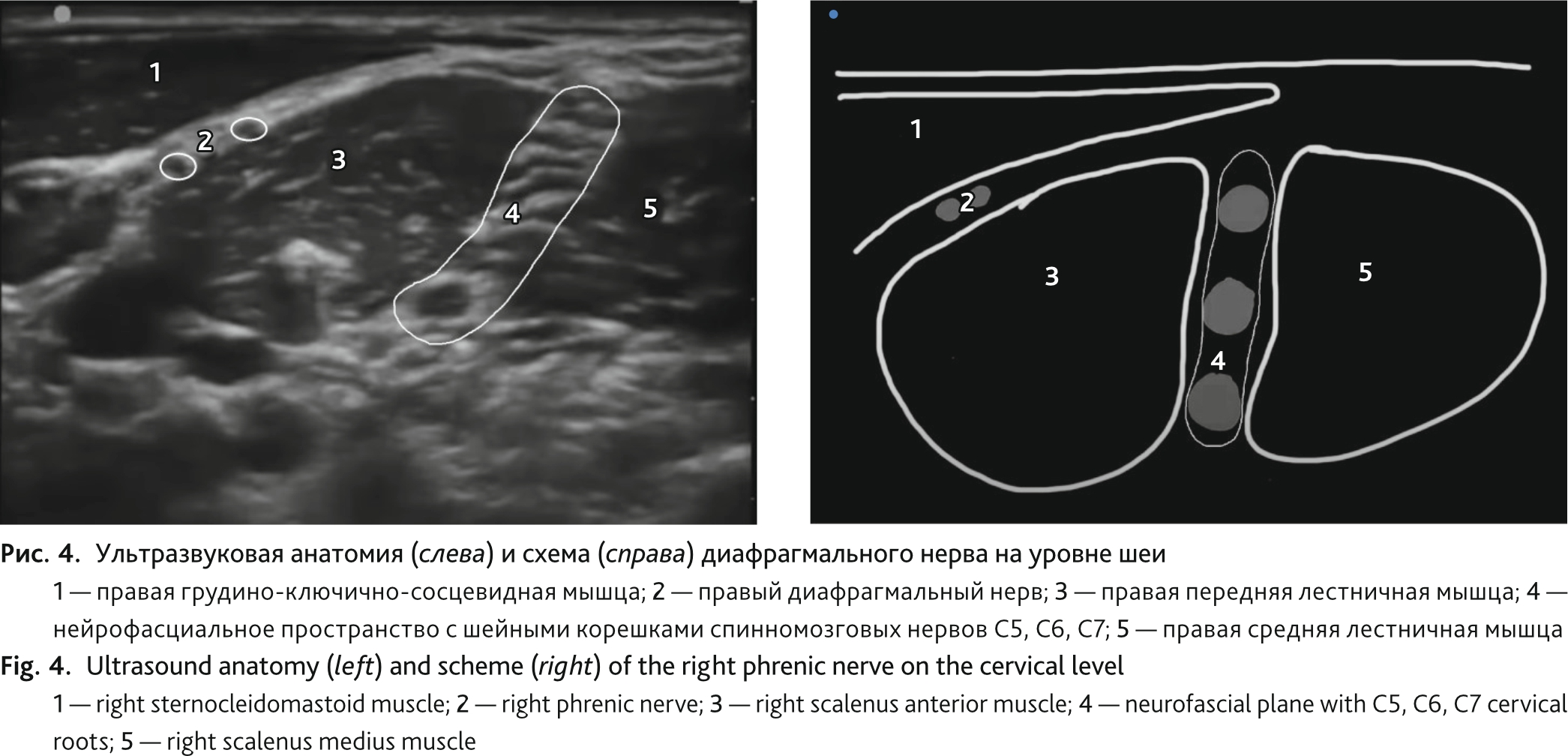
В условиях ультразвуковой навигации (аппарат Philips CX-50) верифицирован левый диафрагмальный нерв, между грудино-ключично-сосцевидной мышцей спереди и передней лестничной мышцей сзади. После предварительной обработки операционного поля спиртовым раствором хлоргексидина и местной анестезии места пункции 1 % лидокаином 2,0 мл игла Stimuplex D 22G — 50 мм подведена к диафрагмальному нерву на фоне ультразвукового мониторинга. Игла заблаговременно подключена к катоду генератора импульсов Stimuplex, а анод размещен в проекции диафрагмы на передней грудной стенке. При базовой силе тока 1 мА и частоте 1 Гц на основании парестезий и ультразвукового контроля верифицировали левый диафрагмальный нерв. При первичной стимуляции диафрагмального нерва помимо эмоционального эффекта отмечен прирост дыхательного объема, доставленного респиратором (Drager Savina), с 430 до 600 мл при прежней поддержке давлением (10 см вод. ст.). В последующем пациентка отмечала, что в тот момент впервые с момента операции получилось сделать глубокий вдох. Измерение времени проведения импульса по диафрагмальному нерву было недоступно по техническим причинам. С учетом хорошего клинического эффекта от пробной стимуляции после гидродиссекции нерва и фиксации иглы в непосредственной близости от нерва в течение 10 мин выполнено нейромодуляторное воздействие на диафрагмальный нерв под контролем парестезий и субъективных ощущений токами с частотой 0,5–4 Гц и силой тока 1–4 мА. Такое же воздействие после предварительной укладки и обработки операционного поля проведено с контралатеральной стороны. Интервал между нейромодуляторными воздействиями слева и справа не превышал 5–7 мин. Экскурсия правого купола диафрагмы через 10 мин после воздействия составила 8 мм, левого — 10 мм, утолщения мышечной части диафрагмы при ультразвуковом мониторинге не отмечено. Клинический эффект от проведенной процедуры оказался временным — прирост дыхательного объема отмечен лишь во время стимуляции, при ее прекращении нивелировался, и параметры вентиляции возвращались к исходным. Тем не менее эмоциональный эффект от проведенной процедуры оказался более стойким, как и парестезии в области диафрагмы.
С учетом состоятельности нервно-мышечной передачи и положительного эффекта нейромодуляции решено продолжить процедуры в курсовом режиме. После повторения сеансов электрической нейростимуляции диафрагмальных нервов на 22, 24 и 26-е сут послеоперационного периода продолжительность эпизодов спонтанного дыхания достигла 12 ч/сут, улучшились сон и комплаентность к терапии. Субъективно пациентка отмечает повышение эмоционального фона и уменьшение одышки. Уже после деканюляции ввиду снижения качества и продолжительности сна, вынужденного положения ортопноэ на 32-е сутки послеоперационного периода решено провести пятый сеанс билатеральной нейростимуляции диафрагмальных нервов; клинический эффект процедуры положительный.
На фоне комплекса проводимой терапии на 30-е сутки послеоперационного периода выполнена деканюляция трахеи, а на 33-е сутки пациентка была переведена в кардиохирургическое отделение, откуда выписана в стабильном состоянии, без клиники дыхательной недостаточности.
С учетом восстановления нервно-мышечной проводимости до уровня, достаточного для обеспечения адекватного спонтанного дыхания, рецидив диафрагмальной дисфункции без дополнительного повреждающего фактора маловероятен. Через 1 мес. после выписки проведен телефонный опрос. Пациентка не испытывает одышки в состоянии покоя, способна совершать повседневную работу по дому и выходить на прогулки. Рекомендовано в дальнейшем выполнить контрольную спирографию или бодиплетизмографию для оценки функции внешнего дыхания и определения прогноза.
При беседе с пациенткой перед выпиской из стационара получен положительный отзыв о выполненном вмешательстве. По ее мнению, улучшение респираторной функции связано с сеансами нейростимуляции, поскольку при хорошей переносимости процедуры и отсутствии осложнений пациентка отмечала стойкий положительный эффект в виде субъективного ощущениями «воздушного вдоха, как на улице, с запахом леса» и «прилива сил».
Последние 20 лет возрастает интерес к диафрагмальной дисфункции в качестве причины дыхательной недостаточности и несостоятельности попыток отлучения от респираторной поддержки, однако в Международной классификации болезней актуального 10-го пересмотра (МКБ-10) это состояние не отражено. Согласно действующим профессиональным стандартам, не установлены компетенции специалистов, которые должны заниматься этой проблемой с точки зрения и диагностики, и лечения. Кроме того, нет однозначного мнения по объективизации степеней диафрагмальной дисфункции посредством ультразвуковой диагностики.
В своей практике мы столкнулись с невозможностью качественно оценить подвижность левого купола диафрагмы у конкретного пациента, особенно в раннюю фазу пищеварения, когда воздух в желудке ограничивает ультразвуковое окно. Оценка кинетики диафрагмы в динамике несколько субъективна и оператор-зависима, поскольку угол сканирования и точка установки датчика не всегда постоянны.
В случаях, когда в терапевтической практике встречается проблема диафрагмальной дисфункции и при этом отсутствует возможность этиотропного лечения, как, например, при герпетическом поражении диафрагмального нерва [32], основной опцией остается симптоматическое использование неинвазивной вентиляции легких в декомпенсированных случаях или ожидание спонтанного восстановления функции внешнего дыхания [33]. Многие авторы указывают на низкий терапевтический потенциал медикаментозной терапии диафрагмальной дисфункции. Действительно, в описанном случае стандартная терапия в течение 2 нед. не принесла какого-либо существенного улучшения. Ввиду неэффективной послеоперационной реабилитации и потенциальной необратимости состояния нами было предложено экспериментальное нейромодулирующее воздействие, однако в связи с ограниченностью публикаций по этой проблеме и отсутствием единого подхода к нейростимуляции диафрагмы мы столкнулись с рядом проблем при проведении этой методики.
Электростимуляция нервно-мышечного проведения за счет плейотропных эффектов в отношении кровотока, метаболизма и функционирования диафрагмы является доступным средством профилактики ее дисфункции и коррекции контрактильного дефицита. В настоящее время нет данных о безопасном и эффективном режиме воздействия. Подбор комфортного режима стимуляции диафрагмы подразумевает «тренировку» нервно-мышечного проведения с постепенным изменением силы тока и частоты стимуляции для обеспечения максимального ответа при хорошей переносимости воздействия, что требует времени и опыта. При избыточном электрическом воздействии на нерв можно вызвать его «оглушение», а порог стимуляции для достижения этого эффекта неясен, поэтому период адаптации может быть увеличен.
Большинство обзоров и серий случаев, доступных для поиска, указывают на эффективность стимуляции диафрагмы в качестве дополнения или в альтернативы искусственной вентиляции легких после необратимой спинальной травмы со стойким неврологическим дефицитом. С учетом актуальности проблемы диафрагмальной дисфункции после искусственной вентиляции легких у пациентов с трудностями при отлучении от респираторной поддержки целесообразно оценить возможность применения доступных методик с доказанной эффективностью у этой категории больных.
Терапия диафрагмальной дисфункции после даже непродолжительной вынужденной искусственной вентиляции легких может значительно улучшить качество послеоперационной реабилитации, но требует междисциплинарного подхода при ее ведении [17].
Несмотря на описанные выше ограничения, положительный клинический эффект от вмешательства позволяет надеяться, что наш опыт является дополнительным аргументом для включения инвазивной электростимуляции диафрагмальных нервов в арсенал методик, используемых анестезиологом-реаниматологом при терапии диафрагмальной дисфункции у пациентов со сложностями при отлучении от респираторной поддержки.
Представленный клинический случай описывает применение билатеральной инвазивной электростимуляции диафрагмальных нервов в комплексе терапии пациентки с диафрагмальной дисфункцией после планового протезирования аортального клапана. Несмотря на недостаточную стандартизацию, методика хорошо переносится пациентом, безопасна и эффективна. Таким образом, курсовое нейромодулирующее воздействие токами малой частоты и интенсивности на фоне дисфункции диафрагмы может уменьшать выраженность дыхательных нарушений, что способствует отлучению пациента от респираторной поддержки и ускорению послеоперационной реабилитации.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Информированное согласие на публикацию. Авторы получили письменное согласие пациента на анализ и публикацию медицинских данных и фотографий.
Consent for publication. Written informed consent for publication was obtained from the patient.