Обезболивание в педиатрии является основной составляющей восстановления ребенка после перенесенного хирургического лечения [1]. Регионарная анестезия, согласно рекомендациям 2016 г., является компонентом, улучшающим послеоперационное обезболивание [2]. Регионарные методики обезболивания в офтальмологии имеют определенные риски, такие как развитие гематомы при ретро- и перибульбарных блокадах [3, 4], перфорация глаза [5]. Субтеноновая блокада относится к менее инвазивным вмешательствам, обладающим достаточно высоким анальгетическим профилем, что послужило обоснованием для ее интраоперационного применения при хирургии катаракты и некоторых операциях на задних отделах глаза [6–8]. Все чаще субтеноновая блокада применяется у детей при хирургии косоглазия с целью интраоперационного обезболивания [9].
Известно, что послеоперационной период для данного вида хирургического вмешательства характеризуется наличием болевого синдрома разной интенсивности и послеоперационной тошнотой и рвотой (ПОТР), что негативно сказывается на реабилитации детей [10]. Послеоперационное обезболивание у детей имеет определенные ограничения, связанные с использованием препаратов в раннем возрасте [11]. Вместе с этим превентивное или упреждающее обезболивание за счет выполнения в конце оперативного вмешательства субтеноновой блокады с анестетиком продленного действия создает длительный анальгетический эффект в качестве альтернативы парентеральному лечению болевого синдрома.
Цель данного исследования — оценить эффективность субтеноновой блокады для послеоперационного обезболивания у детей при операциях по поводу косоглазия.
Проведено одноцентровое открытое рандомизированное контролируемое проспективное продольное исследование в параллельных группах. Исследование проведено в соответствии с Хельсинкской декларацией и одобрено Комитетом по этике Иркутского филиала ФГАУ «НМИЦ «Межотраслевой научно-технический комплекс «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России (протокол № 4-В от 04.02.2020).
В исследование в период с января 2020 г. по январь 2021 г. были включены 74 ребенка. Пациентов распределили на две группы, сопоставимые по объему оперативного вмешательства: 1-я группа (n = 36), 2-я группа (n = 38). Хирургический метод лечения включал рецессию одной или двух мышц на одном глазу. Распределение больных по полу и возрасту, массе тела и статусу по American Society of Anesthesiologists (ASA) не имело статистически значимых различий (p > 0,05) (табл. 1).
Таблица 1. Общая характеристика пациентов (М ± sd)
Table 1. General patients’ characteristics (M ± sd)
| Показатели | 1-я группа, n = 36 | 2-я группа, n = 38 | р |
|---|---|---|---|
| Возраст, лет | 12,07 ± 6,14 | 10,6 ± 7,9 | 0,989* |
| Масса, кг | 30,73 ± 10,4 | 31,78 ± 6,36 | 0,650* |
| Пол муж./жен., n | 20/16 | 23/15 | 0,112** |
| Статус по ASA, I/II/III/IV класс, n | 26/9/1/0 | 22/14/2/0 | 0,870** |
| * Критерий Манна—Уитни. ** Критерий χ². |
|||
Критериями включения были:
Критериями исключения были:
Всем пациентам выполнялась операция по поводу косоглазия с рецессией и резекцией мышц. Все операции осуществлялись одним хирургом. В зависимости от метода обезболивания в конце операции пациенты были разделены на две группы: в 1-й группе обезболивание проводили ацетаминофеном 15 мг/кг внутривенно (в/в), во 2-й группе — субтеноновую блокаду ропивакаином 0,5 % — 0,6 мг/кг.
Случайная последовательность распределения была последовательно пронумерована для участников, и непрозрачные запечатанные конверты, определяющие контрольную группу или группу сравнения, были сгенерированы компьютером.
Демографические данные пациентов, включая возраст, массу тела, пол, были задокументированы до операции. Во время оперативного вмешательства у всех пациентов проводилась пульсоксиметрия с измерением сатурации (SpO2), гемодинамических показателей. Общая анестезия всем пациентам выполнялась по единой методике и включала премедикацию мидазоламом 0,1–0,25 мг/кг в/в. Всем пациентам проводили общую ингаляционную анестезию по методике Volatile Induction and Maintenance of Anesthesi (VIMA), индукцию осуществляли севофлураном с установкой ларингеальной маски соответствующего размера. Поддержание анестезии обеспечивали ингаляцией севофлураном в дозе 2,2–2,5 об % (минимальная альвеолярная концентрация [МAК] 1,0–1,2) при сохраненном спонтанном дыхании. Всем пациентам после индукции выполняли субтеноновую анестезию лидокаином 2 % — 2,0 мл (рис. 1, а).
Методика субтеноновой блокады включала хирургический доступ к субтеноновому пространству и введение тупой канюли в нижний назальный квадрант с последующим введением местного анестетика. Пациентам, составлявшим 1-ю группу (n = 36), по окончании оперативного вмешательства вводили в/в ацетаминофен 15 мг/кг, пациентам 2-й группы (n = 38) субтеноновую блокаду повторно выполняли 0,5 % раствором ропивакаина — 3,0 мл (0,57 ± 0,03 мг/кг) (рис. 1, б).

Во время исследования неинвазивный мониторинг показателей гемодинамики осуществляли с помощью монитора Infinity Vista XL Dräger, регистрировались функциональные параметры сердечно-сосудистой системы: артериальное давление (систолическое артериальное давление (АДс), диастолическое артериальное давление (АДд), среднее артериальное давление (АДср)), частота сердечных сокращений (ЧСС), пульсоксиметрия.
Значения фиксировались на следующих этапах анестезии:
С целью оценки стресс-ответа определяли концентрацию кортизола крови. Кортизол в сыворотке крови определяли иммуноферментным методом на аппарате Bio Tek Instruments Inc. EL×800 (США), за норму был принят уровень 101,2–535,7 нмоль/л. Оценка окислительного стресса (тест Free Oxigen Radicals Testing [FORT], ммоль/л; норма — до 2,31 ммоль/л) и общей антиоксидантной способности (тест Free Oxigen Radical Defens [FORD], ммоль/л; норма — 1,07–1,53 ммоль/л) в образцах цельной крови проводилась с помощью анализатора FORM Plus CR 3000 (Сallegary, Италия), после чего рассчитывали интегральный показатель в виде окислительно-восстановительного коэффициента (FORD/FORT). Забор крови проводили на следующих этапах:
Оценку интенсивности боли осуществляли по 4-балльной шкале вербальных оценок (ШВО), где 1 балл — боли нет; 2 балла — слабая боль; 3 балла — умеренная боль; 4 балла — сильная боль. ШВО более удобна для пациентов с ослабленным зрением, имеющих трудности с графическими инструментами. Оценка боли проводилась в палате интенсивной терапии (через 2 ч после операции, когда пациент просыпался и мог отвечать на вопросы), через 4 ч после операции. Фиксировали частоту и степень ПОТР в баллах: 0 баллов — отсутствие тошноты и рвоты; 1 балл — наличие тошноты; 2 балла — тошнота с позывами на рвоту; 3 балла — однократная рвота; 4 балла — неоднократная рвота.
Оценка степени воспалительной реакции в первые сутки после операции проводилась врачом-офтальмологом на следующие сутки после операции. Для составления отчета о результатах была использована блок-схема исследования согласно стандартам отчетности CONSORT (рис. 2) [12].

Статистический анализ проводился с использованием пакета программ Statistica 6.0. Соответствие полученных данных нормальному распределению проверялось по критерию Шапиро—Уилка. Данные были представлены в виде среднего (M), стандартного отклонения (sd) и в виде медианы (Me), первого (Q1) и третьего квартиля (Q3). Для оценки различия средних в несвязанных выборках применяли критерий Манна—Уитни, в связанных выборках — критерий Уилкоксона, для оценки долей использовали критерий χ².
Результаты исследования гемодинамики во время операции показали, что, несмотря на применение различных методик послеоперационного обезболивания, функциональное состояние сердечно-сосудистой системы на различных этапах исследования не выходило за пределы допустимых значений и не имело достоверных различий в группах (рис. 3). Оценка через 2 ч после операции показала наличие болевого синдрома: в 1-й группе у 5 (10 %) пациентов величина боли по шкале ШВО составила 2 балла, что потребовало назначения анальгетиков. Во 2-й группе боли зафиксировано не было.
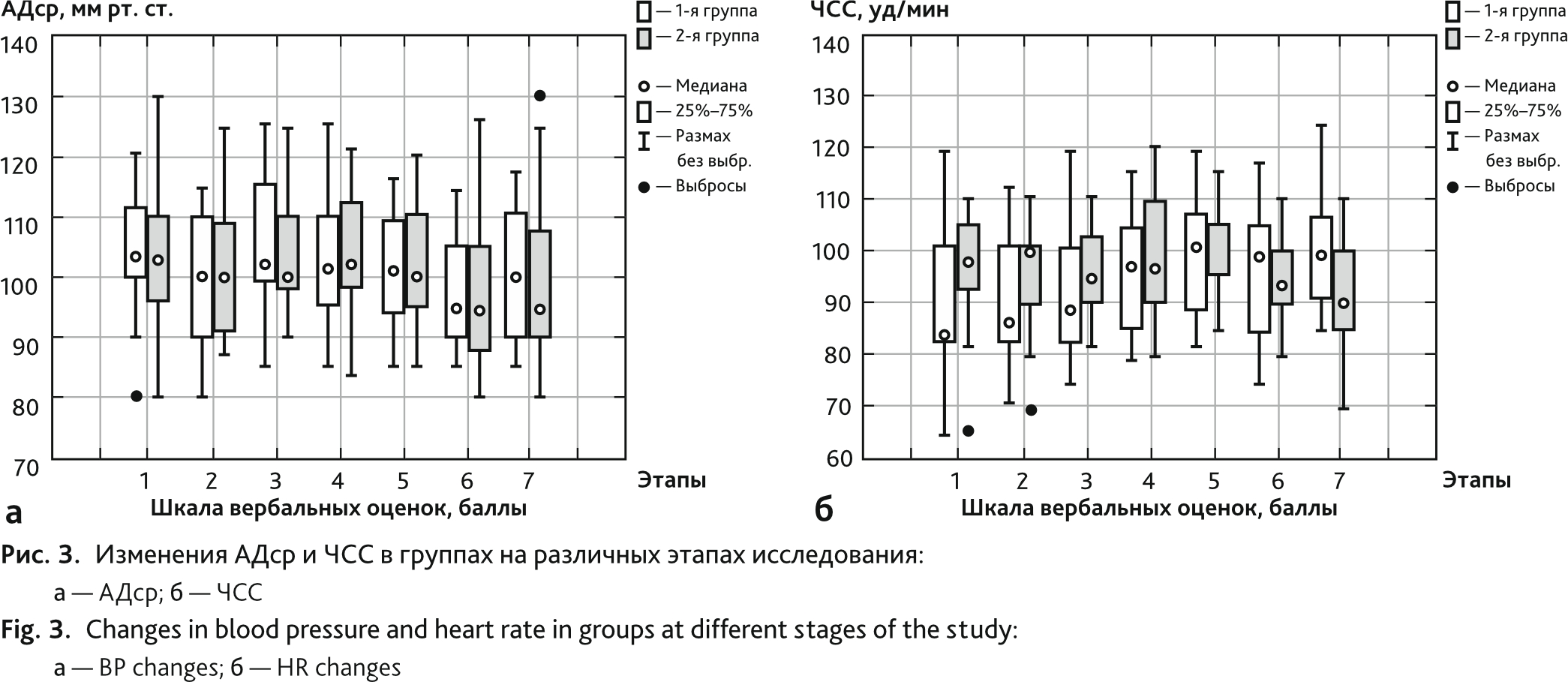
Через 4 ч после операции в стационаре у 9 (18 %) пациентов 1-й группы был зарегистрирован болевой синдром умеренной выраженности, у 15 (30 %) пациентов боль была оценена как слабая, 26 (52 %) пациентов жалоб на боль не предъявляли. В соответствии с этим произошло распределение пациентов, нуждающихся в дополнительном обезболивании. На этом этапе во 2-й группе только 2 (5,2 %) пациента предъявили жалобы на слабую боль (ШВО — 2 балла) в области оперативного вмешательства.
При оценке ПОТР у 6 (16,6 %) пациентов 1-й группы отмечался синдром ПОТР 1-й степени, он сопровождался умеренным болевым синдромом и был купирован после назначения анальгетиков. Во 2-й группе ПОТР не было. У больных 1-й группы с момента окончания операции уровень кортизола достоверно снизился с 784,52 ± 185,14 нмоль/л до 672,66 ± 159,63 нмоль/л, через 4 ч после операции — на 23 % (p ˂ 0,05). Во 2-й группе со времени окончания операции уровень кортизола в сыворотке крови достоверно снизился с 787,97 ± 231,65 нмоль/л до 347,59 ± 138,43 нмоль/л, через 4 ч после операции — на 55 % (p ˂ 0,05)]. То есть уровень кортизола после оперативного вмешательства при сравнении в группах имел достоверные отличия: в группе больных с субтеноновой блокадой в конце операции уровень кортизола через 4 ч в стационаре был на 32 % меньше (p ˂ 0,05), чем у пациентов 1-й группы.
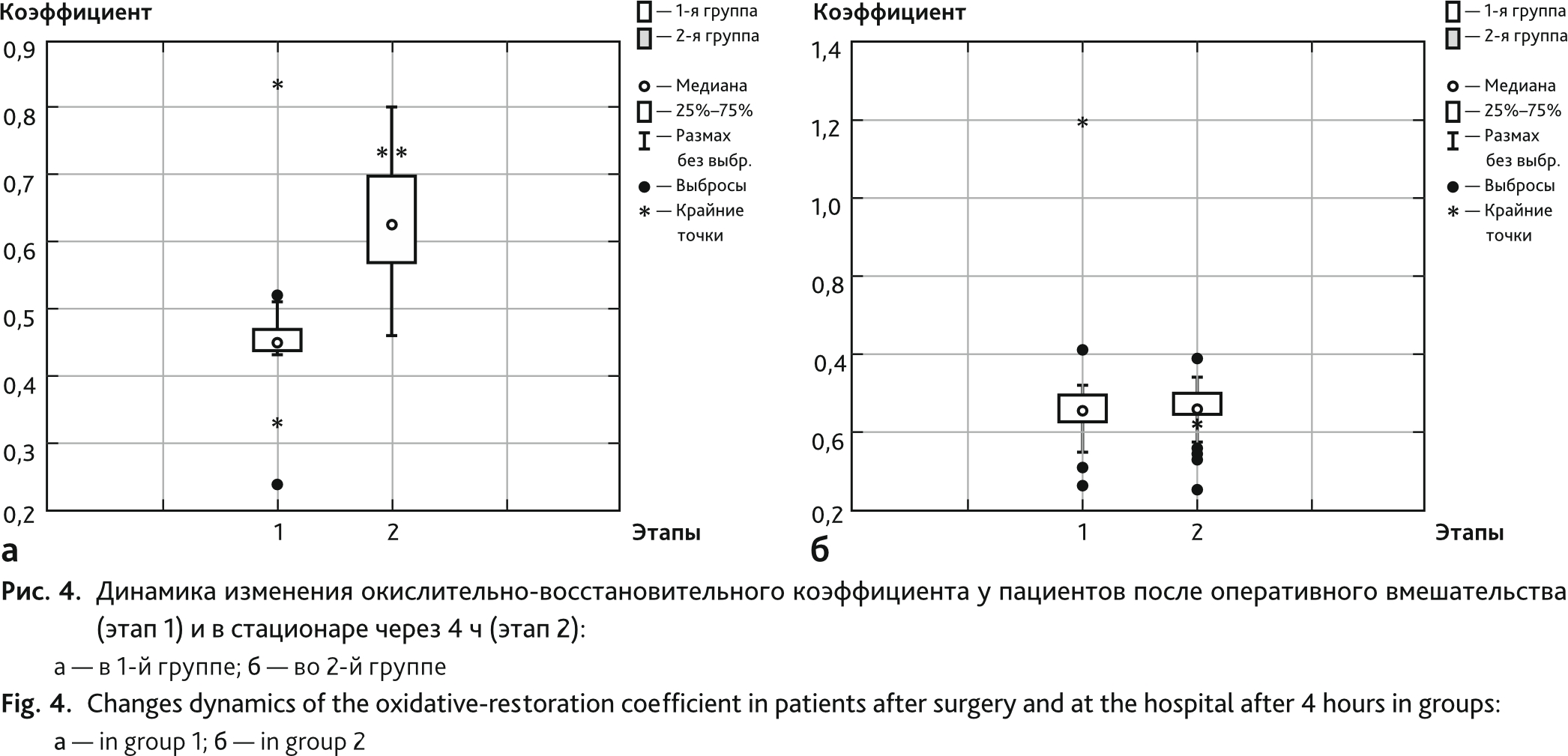
У пациентов 2-й группы коэффициент соотношения суммарной концентрации свободных радикалов к суммарной концентрации антиоксидантов достоверно увеличился через 4 ч после операции с 0,45 ± 0,5 до 0,62 ± 0,2 (p ˂ 0,005) по сравнению с показателями в конце операции, и это увеличение составило 37 %. В то же время у пациентов 1-й группы изменение данного показателя проявлялось его снижением на 2,6 % (p ˃ 0,05) — с 0,47 ± 0,15 до 0,46 ± 0,06 (рис. 4).
Исследование корреляций между окислительно-восстановительным коэффициентом и уровнем боли в стационаре продемонстрировало ожидаемую отрицательную взаимосвязь между этими показателями, более тесную у пациентов 1-й группы (r = −0,75, р = 0,000) (рис. 5).

На 1-е сутки после операции воспалительная реакция легкой степени в 1-й группе отмечалась у 10 (27,7 %) пациентов, во 2-й группе — у 7 (19,4 %) пациентов (р < 0,05).
Применение субтеноновой блокады в конце оперативного лечения при хирургии косоглазия у детей позволяет создать оптимальные условия течения раннего операционного периода за счет продленного обезболивания, снижения частоты и выраженности ПОТР. Регионарная блокада более полно защищает организм от хирургической агрессии в сравнении с парентеральным послеоперационным обезболиванием, приводя к менее выраженному эндокринно-метаболическим ответу, являющемуся основой возникновения воспалительной реакции глаза.
Применение регионарных блокад в хирургии позволяет снизить медикаментозную анальгетическую нагрузку в послеоперационном периоде как в общей хирургии, так и в офтальмохирургии [13, 14]. Субтеноновая блокада широко используется в педиатрии и является одной из малоинвазивных регионарных методик [15]. Использование в субтеноновых блокадах ропивакаина как анестетика продленного действия при лечении косоглазия отражено в работе Walters G. [16].
Применение субтеноновой блокады для обезболивания хирургии косоглазия у детей, согласно исследованиям Tuzcu K. [9], имеет анальгетический эффект только в первые 2 ч после операции. В связи с этим болевой синдром в послеоперационном периоде требует лечения, которое иногда вызывает возникновение ПОТР [17].
Известно, что помимо опиоидного обезболивания при оперативном лечении косоглазия фактором, инициирующим ПОТР, является тракция экстраокулярных мышц, которая индуцирует окулогастральный и окулокардиальный рефлексы [18].
Механизм возникновения этих патологических рефлексов основан на наличии многочисленных периферических коллатералей и анастомозов нервов, смежной локализации ядер тройничного, языкоглоточного и блуждающих нервов в продолговатом мозге и ретикулярной формации [19]. Большинство опубликованных статей посвящены применению антиэметиков для купирования ПОТР [20]. Регионарная анестезия снижает риски возникновения патологических рефлексов за счет блокады афферентной импульсации из области операционного вмешательства.
Полученные данные указывают на адекватную антиоксидантную защиту пациентов с применением субтеноновой блокады в конце хирургического вмешательства, поскольку коэффициент соотношения суммарной концентрации антиоксидантов к суммарной концентрации свободных радикалов продемонстрировал достоверное увеличение после операции. Была установлена сильная отрицательная корреляционная связь с показателями уровня боли по ШВО и уровня окислительного стресса после операции у пациентов 1-й группы (r = −0,75, p = 0,000). Известно, что боль является одним из патогенетических факторов окислительного стресса, а анестезия достаточного уровня обладает антиоксидантным эффектом [21]. Регулирование окислительно-восстановительного баланса посредством модуляции уровней активных форм кислорода и антиоксидантов на нетоксичном уровне в тканях раны может улучшать заживление [22]. Результаты представленного исследования продемонстрировали снижение уровня воспалительной реакции глаза на 1-е сутки после операции в группе с субтеноновой блокадой.
Применение субтеноновой блокады при хирургии косоглазия по окончании операции позволяет достигнуть выраженной и продленной анальгезии, ограничить проявления ПОТР в послеоперационном периоде, а также снизить уровень хирургического стресса в целом, что, в свою очередь, снижает степень воспалительной реакции глаза.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Этическое утверждение. Проведение исследования было одобрено Комитетом по этике Иркутского филиала ФГАУ «НМИЦ «Межотраслевой научно-технический комплекс «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России (протокол № 4-В от 04.02.2020).
Ethics approval. This study was approved by the Ethical Committee of Ethics Committee of the Irkutsk branch S.N. Fyodorov Eye Microsurgery State Institution, Irkutsk, Russia (reference number: 4-B-04.02.2020).