Дыхательная недостаточность (ДН) — состояние организма, при котором не обеспечивается поддержание нормального газового состава артериальной крови, либо оно достигается за счет повышенной работы внешнего дыхания, приводящей к снижению функциональных резервов организма, либо поддерживается искусственным путем.
Хроническое обструктивное заболевание легких — собирательное понятие, которое объединяет группу хронических болезней дыхательной системы: хронический обструктивный бронхит, эмфизему легких, бронхиальную астму тяжелого течения, облитерирующий бронхиолит и бронхоэктатическую болезнь.
Встречаемость периоперационной ДН разнится от исследования к исследованию в значительных пределах и зависит от того, что авторы подразумевали под таковой (табл. 1).
Таблица 1. Эпидемиология периоперационной дыхательной недостаточности
Table 1. Epidemiology of perioperative respiratory failure
| Проявления дыхательной недостаточности | Частота проявлений, % |
|---|---|
| ИВЛ в течение 48 ч после операции или реинтубация в течение 30 дней | 3,1 |
| ИВЛ в течение 48 ч после операции или реинтубация вследствие острой дыхательной или сердечно-сосудистой недостаточности | 3,0 |
| Острый респираторный дистресс-синдром | 2,6 |
| Эпизоды умеренной гипоксемии (SpO2 86–90 %) (70 % остаются нераспознанными анестезиологом) | 53 |
| Эпизоды тяжелой гипоксемии (SpO2 < 81 %) (продолжительность в среднем 2,3 мин) | 20 |
| Развитие гипоксемии в течение 5 дней после операции | 4,2 |
| ИВЛ — искусственная вентиляция легких. | |
Патогенетически ДН можно разделить на несколько видов (табл. 2).
Таблица 2. Патогенез периоперационной дыхательной недостаточности
Table 2. The pathogenesis of perioperative respiratory failure
| Тип острой дыхательной недостаточности | Причина | Доминирующий газовый дисбаланс | Время формирования |
|---|---|---|---|
| Центрогенная | Дисфункция регуляции дыхания | Гиперкапния, респираторный ацидоз, гипоксемия | Премедикация, индукция, поддержание, выход из анестезии |
| Нейромышечная | Дисфункция респираторной мускулатуры | ||
| Торако-диафрагмальная | Пневмоторакс | Гипоксемия | Индукция, поддержание |
| Легочная обструктивная | Бронхо-обструктивный (обструктивный) синдром | Гиперкапния с умеренной или выраженной гипоксемией, респираторный ацидоз | Индукция, поддержание, выход из анестезии |
| Бронхоспазм | |||
| Легочная рестриктивная | Ателектаз | Гипоксемия | Поддержание анестезии, послеоперационный период |
| Пневмония | Гипоксемия | Послеоперационный период | |
| Аспирационный пневмонит | Гипоксемия | Индукция, выход из анестезии | |
| Острый респираторный дистресс-синдром | Гипоксемия | Послеоперационный период | |
| Нарушение кровообращения по малому кругу | Тромбоэмболия легочной артерии | Гипоксемия и гиперкапния | Поддержание анестезии, послеоперационный период |
Для каждой рекомендации приведены уровень достоверности доказательств (УДД) и уровень убедительности рекомендации (УУР).
Рекомендация 1. У всех пациентов в предоперационный период рекомендуется выявлять жалобы, характерные для патологии респираторной системы [1–3] (УДД — 5, УУР — С).
Комментарий. Наиболее характерные жалобы при респираторной патологии: 1) кашель (сухой или с мокротой); 2) кровохарканье; 3) одышка разной степени выраженности; 4) приступы удушья; 5) боли в груди; 6) различные проявления нарушений общего состояния (например, слабость, потливость, лихорадка).
Рекомендация 2. У всех пациентов в предоперационный период рекомендуется оценка выраженности одышки по шкале mMRC [1–5] (УДД — 5, УУР — С).
Комментарий. Одышка [5]:
Таблица 3. Степени тяжести одышки
Table 3. Degrees of dyspnea severity
| Степень | Тяжесть | Описание |
|---|---|---|
| 0 | Нет | Одышка не беспокоит, за исключением очень тяжелой нагрузки |
| 1 | Легкая | Одышка возникает при быстрой ходьбе или подъеме на возвышение |
| 2 | Средняя | Одышка приводит к более медленной ходьбе по сравнению с другими людьми того же возраста, или появляется необходимость делать остановки при ходьбе в своем темпе по ровной поверхности |
| 3 | Тяжелая | Одышка заставляет делать остановки при ходьбе на расстояние около 100 м или через несколько минут ходьбы по ровной поверхности |
| 4 | Крайне тяжелая | Одышка не позволяет выходить из дома или появляется при одевании и раздевании |
Рекомендация 3. У пациентов с признаками нарушений дыхания в предоперационный период рекомендуется проведение рентгенографического исследования органов грудной клетки [1–3, 6] (УДД — 5, УУР — С).
Комментарий. К рентгенографическим признакам респираторных нарушений относят [6]: 1) повышение воздушности легких; 2) буллы; 3) низко и высоко расположенная диафрагма; 4) распространение воздушных участков ретростернально; 5) ателектазы; 6) увеличение размеров сердца; 7) инфильтраты; 8) выпоты; 9) опухоли; 10) пневмоторакс.
Рекомендация 4. У пациентов с подозрением на респираторную патологию в предоперационный период рекомендуется проводить оценку функции внешнего дыхания (ФВД) [7, 8] (УДД — 5, УУР — С).
Комментарий. Показания к исследованию ФВД: 1) гипоксемия при дыхании комнатным воздухом; 2) напряжение углекислого газа в артериальной крови (РаСО2) > 50 мм рт. ст. при наличии легочного заболевания, если ФВД ранее не оценивалась; 3) ДН в анамнезе при сохраняющейся ее причине; 4) выраженная одышка (3-й и 4-й степени); 5) планируемая пневмонэктомия; 6) дифференциальная диагностика ДН; 7) оценка ответа на бронходилататоры; 8) признаки легочной гипертензии.
При курении и нарушениях дыхания в анамнезе проведение легочных функциональных тестов у вышеописанных категорий пациентов должно проводиться обязательно (табл. 4) [9]. Хотя легочные функциональные тесты (спирометрия с определением диффузионной емкости легких или без такового) четко определяют пациентов, у которых неблагоприятен исход резекционной торакальной хирургии, и пациентов с низкой выживаемостью после операций, уменьшающих легочные объемы, их роль в оценке легочной функции при других операциях остается неясной.
Таблица 4. Клиническое значение величин легочных функциональных тестов
Table 4. Clinical significance of pulmonary function test values
| Легочные функциональные тесты | Клиническое значение отклонений |
|---|---|
| ЖЕЛ | ↓ ЖЕЛ (пневмония, ателектаз, легочный фиброз, болевой синдром, метеоризм); < 15 мл/кг — риск легочных осложнений |
| ОФВ1 | 1,5–2,5 л — умеренная обструкция; менее 1 л — средняя обструкция; 0,8 — тяжелая обструкция; < 1 л — риск легочных осложнений |
| Тест Тиффно | ОФВ1/ФЖЕЛ отражает степень обструкции бронхов; < 50 % — высокий риск легочных осложнений |
| Максимальное статическое инспираторное давление (Pimax) | < 25 см вод. ст. — неспособность глубоко вдохнуть |
| СФВ 25–75 % | Чувствительный показатель ранней обструкции мелких бронхов; < 50 % — риск легочных осложнений |
| Максимальное статическое экспираторное давление (PEmax) | < +40 см вод. ст. — снижение способности кашлять |
| Скорость пикового потока | < 3 л/с в предоперационном периоде — снижение эффективности кашля |
| ЖЕЛ — жизненная емкость легких; ОФВ1 — объем форсированного выдоха за первую секунду; СФВ — средняя скорость форсированного выдоха; ФЖЕЛ — форсированная жизненная емкость легких. | |
Для определения обратимости бронхиальной обструкции проводится проба с бронхолитиками. Пациент должен воздержаться от приема β2-агонистов короткого действия не менее 6 ч, пролонгированных β2-агонистов — не менее 12 ч, холинолитиков длительного действия — не менее 36 ч до спирометрии. Необходимо воздержаться от курения не менее чем за 1 ч перед исследованием.
Методика теста: 1) измерение исходного объема форсированного выдоха за первую секунду (ОФВ1); 2) пациент вдыхает бронхолитик; через 15–30–45 мин — повторение исследования; 3) увеличение ОФВ1 на 200 мл или 12 % означает, что проба с бронхолитиком положительная. Однако при ОФВ1 < 1 л тест теряет свою достоверность.
При проведении теста на обратимость бронхообструкции применяют следующие препараты: 1) β2-агонисты короткого действия (начиная с минимальной дозы до максимально допустимой: сальбутамол — 200–400 мкг, фенотерол — 100–800 мкг) с измерением бронходилатационного ответа через 10–15 мин; 2) холинолитик ипратропия бромид (начиная с минимальных доз — 40 мкг до максимально возможных — 160 мкг) с измерением бронходилатационного ответа через 30 мин.
Возможно проведение бронходилатационных тестов с назначением более высоких доз препаратов, которые ингалируют через небулайзеры. Повторные исследования ОФВ1 в этом случае следует проводить после ингаляции максимально допустимых доз: через 15 мин после ингаляции 2,5–5 мг сальбутамола или 0,5–1,5 мг фенотерола или через 30 мин после ингаляции 500 мкг ипратропия бромида.
Рекомендация 5. У всех пациентов рекомендуется проводить оценку факторов риска периоперационной ДН [10] (УДД — 3, УУР — В).
Комментарий. Факторами риска, связанными с оперативным вмешательством, являются его длительность более 3 ч, экстренный характер операции, локализация в области верхнего этажа брюшной полости и грудной клетки, позиционирование на операционном столе, высокая травматичность операции. Изменения механических свойств легких, связанные с интраоперационными факторами и анестезией, заключаются в снижении функциональной остаточной емкости (ФОЕ) на всех этапах анестезии, увеличении фракции шунта, снижении податливости, снижении легочных объемов. Факторами риска развития легочных осложнений, связанными с состоянием пациента, являются ожирение, возраст, курение, повышение внутрибрюшного давления (ВБД), сопутствующая респираторная патология [10].
Факторы риска, связанные с исходным состоянием пациента:
Факторы риска, связанные с оперативным вмешательством:
Таблица 5. Влияние положения на операционном столе на респираторную систему
Table 5. Effect of operating patient position on the respiratory system
| Положение | Влияние на дыхание |
|---|---|
| Горизонтальное | Смещение диафрагмы в краниальном направлении. Снижение ФОЕ. Возникновение зависимых зон на фоне искусственной вентиляции легких. Повышение сопротивления дыхательных путей |
| Тренделенбурга | Значительное снижение легочных объемов. Повышенный риск регургитации. Высокий риск образования ателектазов |
| Приподнятая головная часть | Повышение ФОЕ. Снижение работы дыхания при спонтанной вентиляции |
| ФОЕ — функциональная остаточная емкость легких. | |
Техника оперативного вмешательства:
Рекомендация 6. У всех пациентов рекомендуется оценивать респираторный риск с помощью шкалы риска послеоперационной ДН [30] (УДД — 3, УУР — В).
Комментарий. Оценка риска должна производиться с помощью шкалы риска послеоперационной ДН (табл. 6) [30]. Шкала обладает хорошей прогностической ценностью (AUROC = 0,82; Hosmer—Lemeshow χ2 = 7,080; p = 0,253) [30].
Таблица 6. Шкала оценки риска послеоперационной дыхательной недостаточности
Table 6. Postoperative respiratory failure risk scale
| Факторы риска | Баллы |
|---|---|
| Связанные с состоянием пациента | |
| Предоперационная сатурация кислорода в крови (SpO2) | |
| > 96 % | 0 |
| 91–95 % | 7 |
| ≤ 90 % | 10 |
| Симптомы респираторного заболевания (по крайней мере один) | 10 |
| Застойная сердечная недостаточность по классификации NYHA | |
| Нет | 0 |
| I класс | 3 |
| ≥ II класс | 8 |
| Хроническое заболевание печени | 7 |
| Экстренная операция | 12 |
| Локализация | |
| Периферические операции | 0 |
| Лапаро-/торакоскопические операции | 3 |
| Лапаротомия | 7 |
| Торакотомия | 12 |
| Длительность | |
| ≤ 2 ч | 0 |
| 2–3 ч | 5 |
| > 3 ч | 10 |
| Результаты: < 12 баллов — низкий риск развития дыхательной недостаточности (1,1 %); 12–22 балла — средний риск (4,6 %); ≥ 23 баллов — высокий (18,8 %). | |
| NYHA — New-York Heart Association. | |
Рекомендация 7. При острой патологии верхних дыхательных путей и легких рекомендуется отмена планового оперативного вмешательства на срок не менее 4 недель [31] (УДД — 5, УУР — С).
Рекомендация 8. После перенесенной НКИ COVID-19 рекомендуется отмена планового оперативного вмешательства на срок не менее 7 недель [32] (УДД — 3, УУР — В).
Рекомендация 9. Рекомендуется отказаться от курения за 4 недели до оперативного вмешательства [33] (УДД — 1, УУР — А).
Комментарий. У пациентов с высоким риском необходим отказ от курения (табл. 7) [34, 35].
Таблица 7. Профилактика осложнений у курильщиков
Table 7. Prevention of complications in smokers
| Длительность | Положительные эффекты | Отрицательные эффекты |
|---|---|---|
| 2–3 дня | Нормализация уровней угарного газа (карбоксигемоглобина) и никотина. Снижение частоты интраоперационной ишемии миокарда. Улучшение дренажной функции бронхов | Повышение реактивности дыхательных путей: риск развития интра- и послеоперационного бронхоспазма, ларингоспазма. Возможно появление или обострение реактивных респираторных заболеваний. Увеличение продукции мокроты. Повышение риска ТГВ. Раздражительность, беспокойство |
| 1–2 недели | Нормализация продукции мокроты. Снижение реактивности дыхательных путей. Снижение риска ТГВ | |
| 4–8 недель | Уменьшение частоты раневой инфекции, дыхательных осложнений | |
| 2 года | «Нормализация» ОФВ1 | |
| ОФВ1 — объем форсированного выдоха за первую секунду; ТГВ — тромбоз глубоких вен. | ||
Рекомендация 10. У пациентов с ХОБЛ в кардиохирургии в предоперационный период рекомендуется терапия кортикостероидами [36, 37] (УДД — 2, УУР — А).
Комментарий. 20 мг перорального преднизолона в течение 5 дней в предоперационный период снижает частоту повторной интубации трахеи и продолжительность пребывания в стационаре по сравнению с плацебо. Однократное применение метилпреднизолона в дозе 30 мг в предоперационный период снижает длительность пребывания в ОРИТ и стационаре.
Рекомендация 11. У пациентов с впервые установленным диагнозом ХОБЛ в предоперационный период рекомендуется терапия ингаляционными бронходилататорами [38–40] (УДД — 2, УУР — А).
Рекомендация 12. У всех пациентов во время индукции анестезии при плановых операциях рекомендуется применение фракции вдыхаемого кислорода не более 0,8 [41–43] (УДД — 3, УУР — В).
Комментарий. Снижение фракции вдыхаемого кислорода до 80 % позволяет уменьшить объем абсорбционных ателектазов, не сокращая при этом длительность безопасного апноэ.
Рекомендация 13. У всех пациентов рекомендуется проводить профилактику аспирации для снижения риска послеоперационных легочных осложнений [44] (УДД — 5, УУР — C).
Комментарий. Профилактика аспирационного синдрома включает следующие направления [44]: 1) контроль желудочного содержимого (предоперационное голодание; снижение объема и кислотности желудочного содержимого; опорожнение желудка с помощью зонда); 2) защиту дыхательных путей; 3) выбор оптимального способа анестезии.
Рекомендация 14. У пациентов с гиперреактивностью дыхательных путей рекомендуется применение анестетиков, обладающих бронходилатирующими свойствами, и не рекомендуются барбитураты [53, 54] (УДД — 5, УУР — C).
Комментарий. При риске развития бронхоспазма препаратом выбора является пропофол. Все ингаляционные и неингаляционные анестетики (кроме тиопентала натрия) оказывают бронхолитический эффект.
Тиопентал натрия: 1) слабо подавляет рефлекторную активность дыхательных путей; 2) отмечается дозозависимое снижение чувствительности дыхательного центра к гиперкапнии; 3) может стимулировать секрецию бронхиальных желез за счет стимуляции блуждающего нерва; 4) может приводить к бронхоконстрикции за счет усиления ваготонии.
Рекомендация 15. При интраоперационной вентиляции легких рекомендуется применять ДО 6–8 мл/кг должной массы тела и уровень конечно-экспираторного давления 5 см вод. ст. и более [55–57] (УДД — 1, УУР — А).
Комментарий. Протективная ИВЛ и периоперационная поддержка целевых параметров гемодинамики у пациентов некардиохирургического профиля — наиболее важные предикторы снижения риска послеоперационных легочных осложнений [15, 56–59].
Данные одноцентрового рандомизированного клинического исследования (РКИ) Karalapillai et al. [60] показали, что у взрослых пациентов общехирургического профиля интраоперационная ИВЛ с низким ДО (6–8 мл/кг идеальной массы тела), по сравнению с обычным ДО, при одинаковом уровне положительного давления в конце выдоха (ПДКВ) существенно не снижала риск легочных осложнений в первые 7 суток послеоперационного периода. Исследование Levin et al. [61] показало, что применение одних малых ДО без конечно-экспираторного давления приводит к увеличению 30-дневной летальности, что свидетельствует о необходимости применять все элементы протективной вентиляции для профилактики осложнений.
Уровень ПДКВ может варьировать в пределах 5–10 см вод. ст. В случае необходимости возможно увеличение ПДКВ. У пациентов с ожирением ПДКВ поддерживается на уровне > 10 см вод. ст. При проведении лапароскопических операций уровень ПДКВ также должен составлять ≥ 10 см вод. ст. У пациентов с ожирением в лапароскопической хирургии при отсутствии эффекта от ПДКВ необходимо сочетать его с рекрутментом и позиционированием. Метаанализ Deng et al. [55] показал, что ИВЛ с низким ДО и умеренным либо высоким ПДКВ (≥ 5 см вод. ст.) во время общей анестезии уменьшает количество послеоперационных легочных осложнений у хирургических пациентов. Cho et al. [62] получили данные, что в абдоминальной хирургии использование ИВЛ с низким ДО (6–8 мл/кг) в сочетании с ПДКВ 5 см вод. ст. не увеличивает риск ателектазов по сравнению с ИВЛ с высоким ДО. Оценку состояния легких исследователи проводили с помощью прикроватной УЗ-визуализации.
Применение маневра рекрутмента входит в понятие протективной вентиляции, однако его использование требует осторожности ввиду высокого риска гемодинамических осложнений. Основным условием являются нормоволемия и сохранная сократительная способность миокарда. Существуют различные схемы проведения рекрутмента. Эффективным способом улучшения оксигенации является следующий метод: в течение вентиляции с контролем по давлению с ДО 6–8 мл/кг должной массы тела и ПДКВ, 6–8 см вод. ст. каждые 30 минут увеличивают ПДКВ до 30 см вод. ст. на 10–30 секунд. Данная схема позволяет улучшить оксигенацию, уменьшить частоту респираторных осложнений, послеоперационной ДН и сепсиса. У пожилых пациентов с высоким риском гемодинамических нарушений возможно проведение пошагового маневра рекрутмента, зарекомендовавшего себя как безопасный метод улучшения оксигенации: увеличивают ПДКВ с исходных 4 до 10 см вод. ст. на 3 вдоха, затем с 10 до 15 см вод. ст. на 3 вдоха и с 15 до 20 см вод. ст. на 10 вдохов со снижением ПДКВ до 12 см вод. ст. Кратность применения: через 1 ч после интубации трахеи и далее каждый час анестезии. Liu et al. [57] провели РКИ, которое показало, что протективная ИВЛ с более низким ДО, умеренным ПДКВ и регулярными рекрутмент-маневрами во время анестезии значительно улучшает легочную оксигенацию и снижает частоту послеоперационных легочных осложнений у пациентов, находящихся на ИВЛ > 6 ч. Метаанализ 12 РКИ (2856 пациентов) Cui et al. [63] показал, что протективная ИВЛ в сочетании с рекрутмент-маневрами во время общей анестезии снижает риск послеоперационных легочных осложнений у пациентов без ожирения. У пациентов с ожирением, перенесших операцию под общей анестезией, ИВЛ с более высоким ПДКВ в сочетании с рекрутмент-маневрами, по сравнению с более низким ПДКВ, не показала снижения риска послеоперационных легочных осложнений [64].
Рандомизированное исследование Schmidt et al. [65] показало, что в группе пациентов, перенесших хирургическое шунтирование периферических сосудов, вентиляция легких с низким ДО и умеренным уровнем ПДКВ, по сравнению с высоким ДО и низким ПДКВ, не уменьшала частоту послеоперационных легочных осложнений. Также наблюдалось увеличение частоты интраоперационной гемодинамической нестабильности и потребности в вазопрессорах у пациентов с протективной ИВЛ, что, возможно, связано с более высоким уровнем ПДКВ. В то же время другие исследования показали положительное влияние протективной ИВЛ у критических пациентов и хирургических пациентов группы абдоминальной хирургии [56].
Метаанализ 8 исследований разного дизайна Zhao et al. [66] показал, что при проведении аортокоронарного шунтирования пациенты с сопутствующей ХОБЛ имели более высокий риск послеоперационных осложнений (таких, как пневмония, ДН, инсульт, почечная недостаточность и раневая инфекция); в то же время наличие ХОБЛ не увеличивало риск летальности у данной категории пациентов.
Рекомендация 16. Во время общей анестезии не рекомендуется применение высокой фракции вдыхаемого кислорода [67–70] (УДД — 1, УУР — A).
Комментарий. В большинстве случаев фракцию вдыхаемого кислорода (FiO2) устанавливают в пределах 0,35–0,4. Существует мнение, что высокая фракция может снижать риск инфекционных осложнений, однако данные противоречивы. Ferrando et al. [67] показали, что стратегия оксигенации с использованием высокого FiO2 по сравнению с обычным FiO2 не уменьшала частоту послеоперационных инфекционных осложнений в области хирургического вмешательства у пациентов группы абдоминальной хирургии. Никаких различий во вторичных исходах или побочных эффектах также не было обнаружено. Li et al. [71] установили, что у пациентов, перенесших абдоминальные операции под общей анестезией, интраоперационная протективная ИВЛ с FiO2 30 % по сравнению с FiO2 80 % не снизила частоту послеоперационных легочных осложнений, но тяжесть данных осложнений при FiO2 30 % была меньше. Несколько крупных метаанализов показали, что высокая фракция вдыхаемого кислорода не снижает частоту инфекционных осложнений в колоректальной хирургии и даже может увеличивать частоту нежелательных явлений и оксидативный стресс [68–70].
Рекомендация 17. У пациентов, подвергающихся общей анестезии, в интраоперационный период рекомендуется внутривенное введение лидокаина (1,0–1,5 мг/кг) для профилактики постэкстубационного кашля и боли в горле [72]. Назначение лидокаина внутривенно как компонента анестезии или мультимодальной анальгезии является назначением «off-label» (УДД — 1, УУР — А).
Комментарий. Метаанализ 16 РКИ (1516 пациентов) показал, что внутривенное введение лидокаина в периоперационном периоде в дозе 1–1,5 мг/кг снижает риск длительного послеэкстубационного кашля и болезненности в горле без нежелательных побочных явлений [72].
Рекомендация 18. У пациентов с высоким риском респираторных осложнений в абдоминальной и торакальной хирургии рекомендуется послеоперационное обезболивание с помощью продленной эпидуральной анальгезии [73–76] (УДД — 2, УУР — А).
Комментарий. Продленная эпидуральная анальгезия [74–76]: 1) снижает частоту послеоперационных легочных осложнений после операций на печени и поджелудочной железе; 2) снижает частоту послеоперационных легочных осложнений в кардиохирургии; 3) обеспечивает более быструю экстубацию и снижение частоты послеоперационной ДН после операций на пищеводе.
Рекомендация 19. У пациентов с высоким респираторным риском рекомендуется проведение экстубации после восстановления нейромышечной проводимости на основании TOF-мониторинга [77–80] (УДД — 2, УУР — А).
Комментарий. Применение объективного мониторинга нейромышечной проводимости позволяет снизить частоту послеоперационного остаточного нейромышечного блока и послеоперационных легочных осложнений.
Рекомендация 20. У пациентов с высоким риском и пациентов с ожирением в послеоперационный период рекомендуется применение высокопоточной оксигенотерапии [81, 82] (УДД — 1, УУР — А).
Комментарий. Метаанализ 11 РКИ (2201 пациент) Chaudhuri et al. [81] показал, что профилактическое применение высокопоточной оксигенации через назальные канюли снижает риск реинтубации и потребности в более сложном методе респираторной поддержки по сравнению со стандартной оксигенотерапией в раннем послеоперационном периоде после кардиоторакальных операций, в особенности у пациентов с высоким риском и пациентов с ожирением. В двух РКИ высокий риск определялся как сумма баллов по шкале ARISCAT, равная 26 или более. В одном исследовании к высокому риску относили любого пациента, у которого присутствовал по крайней мере один фактор риска послеоперационных легочных осложнений, в том числе ХОБЛ в анамнезе, астма, инфекция нижних дыхательных путей в предшествующие 4 недели, ИМТ ≥ 35 кг/м2 или текущий (в течение последних 6 недель) статус курильщика (> 10 пачко-лет). Четвертое исследование включало только пациентов после кардиохирургических операций, которые считались подверженными риску необходимости послеоперационной кислородной терапии на основе заранее определенных факторов риска, включая ИМТ > 30 кг/м2, фракцию выброса левого желудочка (ФВЛЖ) < 40 % и предыдущую неудачную экстубацию.
Рекомендация 21. У пациентов после абдоминальных операций в послеоперационный период рекомендуется применение постоянного положительного давления в дыхательных путях (СРАР) для профилактики послеоперационных легочных осложнений [83, 84] (УДД — 1, УУР — А).
Комментарий. Два метаанализа показали, что в абдоминальной хирургии применение CPAP позволяет снизить частоту респираторных осложнений. Первый метаанализ 4 РКИ (в трех из них исследовались обширные абдоминальные операции, в одном — открытые холецистэктомии) показал, что применение CPAP после абдоминальных операций значительно снижает риск послеоперационных легочных осложнений (относительный риск [ОР] 0,66; 95%-й доверительный интервал [95% ДИ] 0,52–0,85), ателектазов (ОР 0,75; 95% ДИ 0,58–0,97), пневмонии (ОР 0,33; 95% ДИ 0,14–0,75) [83]. Второй метаанализ 9 РКИ продемонстрировал, что применение СРАР после открытых абдоминальных операций позволяет снизить частоту послеоперационных легочных осложнений ОШ 0,34 (95% ДИ 0,13–0,88, p = 0,03) [84].
Рекомендация 22. У пациентов с ожирением в течение периоперационного периода рекомендуется рассмотреть применение СРАР для профилактики острой ДН [85] (УДД — 2, УУР — А).
Комментарий. В одном метаанализе 2 РКИ и одного ретроспективного исследования применение СРАР было связано с меньшим риском послеоперационных легочных осложнений у пациентов с ожирением (ИМТ > 35 кг/м2) (ОР 0,33; 95% ДИ 0,16–0,66; p = 0,002) [85].
Рекомендация 23. Не рекомендуется рутинное применение неинвазивных методов респираторной поддержки в послеоперационный период для профилактики послеоперационных легочных осложнений и пневмонии [86] (УДД — 1, УУР — А).
Комментарий. Метаанализ РКИ показал, что профилактическое применение неинвазивной ИВЛ, СРАР и ВПО в послеоперационный период не снижает риск послеоперационных осложнений.
Критерии оценки качества медицинской помощи представлены в табл. 8.
Таблица 8. Критерии оценки качества медицинской помощи
Table 8. Criteria for assessing the medical care quality
| № | Критерии качества | УДД | УУР |
|---|---|---|---|
| 1 | Выполнена рентгенография органов грудной клетки | 5 | C |
| 2 | Определен риск респираторных осложнений | 3 | В |
| 3 | Произведена спирометрия у пациентов с хроническим заболеванием легких | 5 | C |
| 4 | Проведена профилактика аспирации | 5 | С |
| 5 | Проводилась протективная искусственная вентиляция легких | 1 | А |
| 6 | При острой патологии респираторной системы плановое оперативное вмешательство было отложено на срок не менее 4 недель | 5 | С |
| 7 | После перенесенной НКИ COVID-19 плановое оперативное вмешательство было отложено на срок не менее 7 недель | 3 | В |
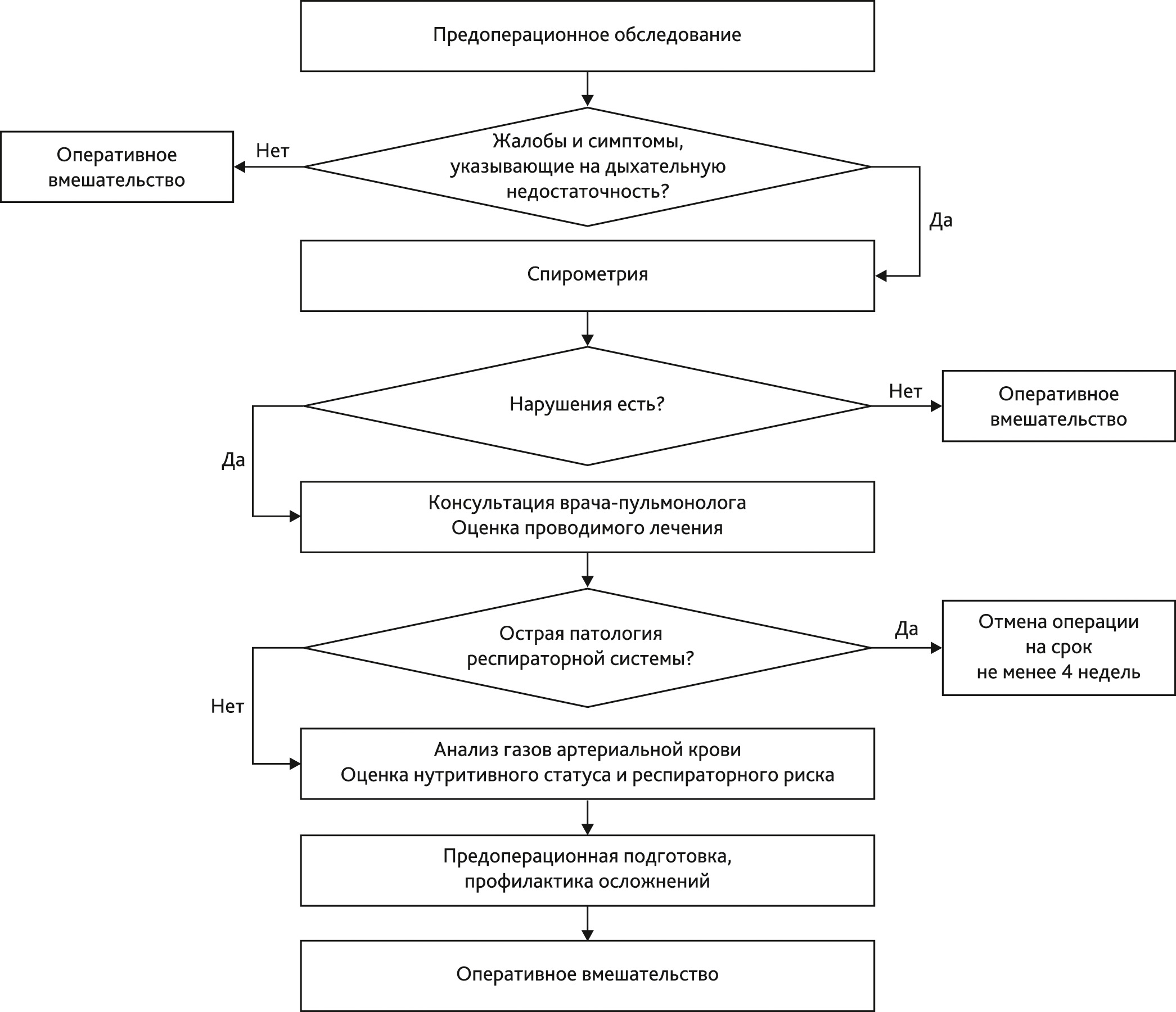
Алгоритм ведения пациента с ДН представлен на рис. 1.

Рис. 1. Алгоритм ведения пациента с дыхательной недостаточностью
Fig. 1. Algorithm for managing a patient with respiratory insufficiency
Рекомендации разработаны в соответствии с Приказом Министерства здравоохранения России от 28.02.2019 № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации» (зарегистрировано в Минюсте России 08.05.2019 № 54588), а также с Приказом Министерства здравоохранения России от 23.06.2020 № 617н «О внесении изменений в приложения № 1, 2 и 3 к Приказу Министерства здравоохранения Российской Федерации от 28 февраля 2019 г. № 103н «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации».
Конфликт интересов. И.Б. Заболотских — первый вице-президент общероссийской общественной организации «Федерация анестезиологов и реаниматологов»; А.И. Грицан — вице-президент общероссийской общественной организации «Федерация анестезиологов и реаниматологов»; А.Н. Кузовлев — заместитель директора — руководитель НИИ общей реаниматологии им. В.А. Неговского Федерального научно-клинического центра реаниматологии и реабилитологии (ФНКЦ РР); К.М. Лебединский — президент общероссийской общественной организации «Федерация анестезиологов и реаниматологов»; А.И. Ярошецкий — председатель комитета по респираторной и метаболической поддержке общероссийской общественной организации «Федерация анестезиологов и реаниматологов». Остальные авторы заявляют об отсутствии конфликта интересов.
Disclosure. I.B. Zabolotskikh is the First Vice-President of the all-Russian public organization “Federation of anesthesiologists and reanimatologists”; A.I. Gritsan is the Vice-President of the all-Russian public organization “Federation of anesthesiologists and reanimatologists”; A.N. Kuzovlev is the Deputy Director of Federal Research and Clinical Center of Intensive Care Medicine and Rehabilitology; K.M. Lebedinskii is the President of the all-Russian public organization “Federation of anesthesiologists and reanimatologists” and A.I. Yaroshetskiy is the Chairman of the Committee for Respiratory and Metabolic Support of the all-Russian public organization “Federation of anesthesiologists and reanimatologists”. Other authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.