Конечно-экспираторное давление (в частности, положительное давление конца выдоха, ПДКВ) сегодня остается одним из немногих параметров, значения которых пока регламентированы наименее жестко [1], хотя роль ПДКВ в профилактике и лечении нарушений легочной функции сложно переоценить.
История поиска универсальной методики оптимизации ПДКВ длится уже более пятидесяти лет [2]. Но несмотря на то что еще в 1970-х годах было известно о многофакторном влиянии ПДКВ, в последние десятилетия фокус внимания был сконцентрирован в основном на биомеханике легких, когда наибольшую популярность получили кривые давление–объем с их точками перегиба, стресс-индекс, движущее давление (англ. driving pressure), анализ динамики конечно-экспираторного объема легких, а также многочисленные попытки визуализации посредством компьютерной томографии, ультразвука и биоимпеданса [1, 3–8]. К сожалению, несмотря на всесторонние поиски через биомеханические характеристики, до сих пор не существует единого «золотого стандарта», хотя необходимость индивидуального и регулярного подбора ПДКВ не вызывает сомнений [9], особенно после пандемии COVID-19 [10, 11]. Наиболее практичным алгоритмом на сегодняшний день остаются таблицы взаимно-сопряженных соотношений ПДКВ и фракции вдыхаемого кислорода (FiO2), согласно которым сопряженное титрование этих двух параметров осуществляется до достижения целевых значений парциального давления кислорода артериальной крови (PaO2) [12–14]. Регулярная жесткая критика этого подхода на протяжении двух десятков лет, в свою очередь, свидетельствует об отсутствии общей приемлемой альтернативы. Такая методика титрования отражает уже не биомеханику вентиляции, а эффективность газообменных процессов в легких на фоне оптимизации вентиляционно-перфузионных отношений, но требует многократного взятия проб артериальной крови.
В последние годы для оптимизации ПДКВ все бóльшее внимание привлекает волюметрическая капнография [15–19], где динамический анализ кривой используют именно для оптимизации соотношения вентиляции и перфузии (V/Q). Показатель объемного выделения углекислого газа (VCO2) можно получить и посредством метаболографа, в котором его наряду с волюметрической оксиметрией (VO2) применяют для непрямой калориметрии. В метаболографе, однако, используется принципиально иной — трендовый — характер отображения данных (рис. 1), который позволяет по-новому взглянуть на динамические процессы газообмена, а также потенциально способен стать новым инструментом для настройки параметров искусственной вентиляции легких (ИВЛ), в частности уровня конечно-экспираторного давления, на основе оптимизации вентиляционно-перфузионных отношений [20].
Цель исследования — сравнение изменений парциального давления кислорода в артериальной крови с динамическими сдвигами VСO2 и VO2 при стандартном изменении уровня ПДКВ.

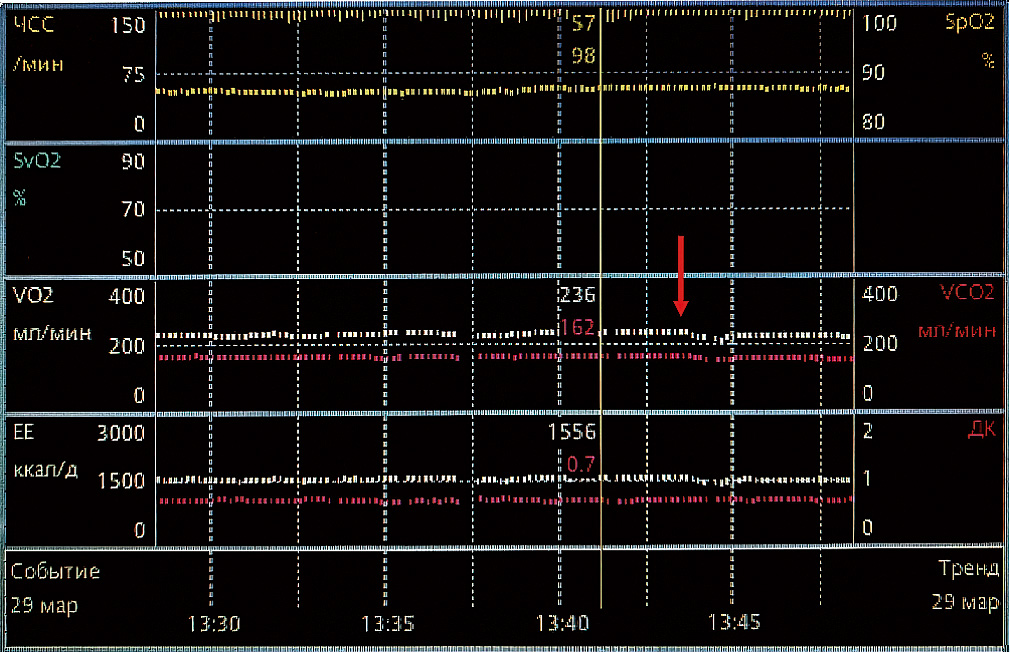
Рис. 1. Отображение временнóго ряда данных метаболографа M-COVX в виде графических трендов на мониторе CareScape B650 (GE HealthCare, США)
Демонстрация периода стабилизации показателей VO2 и VСO2 после индукции общей анестезии в течение 10–15 мин (до сплошной вертикальной полосы курсора). После стабилизации проведено изменение уровня ПДКВ (указано стрелкой) с 2 до 5 см вод. ст., далее наблюдается кратковременное снижение показателей VO2 и VСO2 с их последующим возвратом к стабильным исходным значениям.
Fig. 1. Displaying a time series of M-COVX metabolographer data in the form of graphic trends on the CareScape B650 monitor screen (GE HealthCare, USA)
Demonstration of the period of stabilization of VO2 and VCO2 indicators after general anesthesia induction for 10–15 minutes (up to a solid vertical cursor line). After stabilization, an increase of PEEP level was performed (indicated by vertical arrow) from 2 to 5 mbar and then short-time decrease of VO2 and VCO2 values were observed, followed by returning to stable initial levels.
В одноцентровое проспективное исследование включили 41 пациента, подвергшегося общей анестезии для планового оперативного лечения в хирургическом отделении № 1 клиники Петра Великого СЗГМУ им. И.И. Мечникова (г. Санкт-Петербург). Проведение исследования одобрено Локальным этическим комитетом ФГБОУ ВО СЗГМУ им. И.И. Мечникова, протокол № 10 от 30.10.2019.
Критерии включения:
Критерии исключения:
По вышеприведенным критериям включения в исследование исходно было набрано 48 пациентов, в ходе исследования исключено 7 наблюдений. В итоге в исследование вошли 24 женщины и 17 мужчин, возраст участников составил 52 (46–62) года, индекс массы тела — 29,2 (26,1–33,9) кг·м−2, ASA II — n = 12, ASA III — n = 29. Ни у одного из пациентов ранее не были диагностированы заболевания легких (бронхиальная астма, хроническая обструктивная болезнь легких). Оперативные вмешательства включали: пластику грыж передней брюшной стенки (n = 17), резекцию щитовидной железы (n = 12), холецистэктомию из мини-доступа (n = 5), геморроидэктомию (n = 6) и резекцию печени (n = 1).
Перед началом исследования всем пациентам проводили индукцию общей анестезии тиопенталом натрия (4 мг ∙ кг−1 внутривенно) с дальнейшим переходом на галогенсодержащие анестетики (севофлуран или изофлуран), анальгезию осуществляли фентанилом, миорелаксацию — рокурония бромидом в начальной дозе 0,5 мг ∙ кг−1. Интубировали эндотрахеальной трубкой и проводили искусственную вентиляцию легких в полностью принудительном режиме с управлением по объему (CMV-VC), с дыхательным объемом (VT) 7 мл ∙ кг−1 предсказанной массы тела (ПМТ), частотой дыхания до достижения парциального давления углекислого газа в конце выдоха (PETCO2) 32–35 мм рт. ст. и FiO2 < 0,85 до достижения сатурации (SpO2) > 97 %.
После индукции ожидали стабилизации параметров VO2 и VCO2, полученных с помощью метаболического модуля M-COVX многофункционального монитора CareScape B650 в составе наркозного аппарата Datex-Ohmeda Avance (GE HealthCare, США). По достижении стабильных (колебания менее 3 % по амплитуде) параметров на протяжении 3 мин фиксировали начальные значения VO2(start) и VCO2(start) и производили взятие пробы артериальной крови для анализа и фиксации исходной величины PaO2(start).
Не меняя никаких других исходно заданных установок, увеличивали ПДКВ с 2 см вод. ст. до 5 см вод. ст. и в течение 5–10 мин наблюдали изменения VСO2 и VO2 по данным метаболографа. При изменении данных параметров фиксировали максимальное отклонение VСO2(max) и VO2(max), а затем ожидали их дальнейшей стабилизации (VСO2(end) и VO2(end)) — отсутствия колебаний > 3 % в течение 3 мин, после чего повторно брали пробу артериальной крови и фиксировали конечное значение PaO2(end).
Статистическую обработку проводили в программе R-Studio (R Foundation for Statistical Computing) с пакетом визуализации ggplot2. Количественные данные представлены значением медианы и интерквартильным интервалом.
Корреляционный анализ проводили с помощью коэффициента корреляции Спирмена (rh). Нулевую гипотезу отклоняли при р < 0,05. Объем минимальной необходимой выборки определяли по формуле расчета (1) для корреляционного анализа [21] после статистической обработки данных первых 15 пациентов:
\( N = [(Z_α + Z_β)/C]^2 + 3 \), (1)
где N — минимальное необходимое число наблюдений; Zα — стандартное нормальное отклонение для α-ошибки (Zα = 1,645 при α = 0,05); Zβ — стандартное нормальное отклонение для β-ошибки (Zβ = 1,282 при β = 0,10); С = 0,5 × ln[(l + rh)/(l − rh)], где rh — наименьшее значение коэффициента, полученное в результате статистического анализа первых 15 пациентов.
Для снижения влияния большого разброса исходных значений, отчасти вызванного разбросом значений FiO2, абсолютные величины сдвигов параметров переводили в соответствующие процентные эквиваленты:
\( \Delta PaO_2 (\text{%}) = (PaO_2(\text{end}) − PaO_2(\text{start})) / PaO_2(\text{start}) * 100 \text{%} \) (2)
\( \Delta VCO_2 (\text{%}) = (VCO_2(\text{max}]) − VCO_2(\text{start})) / VCO_2(\text{start}) * 100 \text{%} \) (3)
\( \Delta VO_2 (\text{%}) = (VO_2(\text{max}) − VO_2(\text{start})) / VCO_2(\text{start}) * 100 \text{%} \) (4)
Критерием значимости отклонения ΔPaO2 считали величину > 5 % по модулю.
После статистического анализа данных первых 15 пациентов для пары ΔVCO2 и ΔPaO2 и пары ΔVO2 и ΔPaO2 из двух корреляционных коэффициентов был выбран наименьший (rh = 0,72) для использования в расчете объема выборки. Для α = 0,05 и мощности исследования в 90 % (β = 0,1) необходимый минимальный объем выборки, согласно формуле (1), составил 17 наблюдений.
На момент включения в исследование характеристики пациентов и режима вентиляции были следующими: среднее АД — 83 (76–95) мм рт. ст., коэффициент минимальной альвеолярной концентрации анестетика — 1,0 (0,9–1,05), VT — 450 (445–455) мл (7 мл ∙ кг−1 ПМТ), частота дыхания — 12 (11,8–12,1) мин−1, ПДКВ — 2 см вод. ст., Ppeak — 18 (16–21) см вод. ст., FiO2 — 0,35 (0,3–0,4), PaO2/FiO2 — 466 (246–540) мм рт. ст., PaO2(start) — 128 (94–161) мм рт. ст., VCO2(start) — 165 (130–180) мл ∙ мин−1, VO2(start) — 192 (150–200) мл ∙ мин−1.
На одинаковый подъем ПДКВ на 3 см вод. ст. было получено три варианта реакций.
Значимое увеличение PaO2: 15 наблюдений c ΔPaO2 12,57 % (10,11–16,21), ΔVCO2 — 3,27 % (2,8–7,54), ΔVO2 — 7,96 % (6,43–11,54).
Без значимых изменений: 14 наблюдений с ΔPaO2 0,33 % (−1,15 … 0), ΔVCO2 — –0,28 % (−3,07 … 0), ΔVO2 — 0,07 % (−2,07 … 0).
Значимое уменьшение PaO2: 12 наблюдений с ΔPaO2 –10,75 % (−12,21 … −7,37), ΔVCO2 — –3,6 % (−2,53 … −1,12), ΔVO2 — –8,8 % (−10,12 … −6,04).
Длительность отклонений с формированием характерных «горок» и «ямок» составила от 1 до 6 мин (в среднем около 2 мин).
Коэффициент корреляции Спирмена между VCO2 и PaO2 составил 0,77 (при р = 3,75 × 10−9), что достоверно отражает выраженную корреляционную зависимость. Для пары VO2 и PaO2 такая зависимость оказалась еще сильнее, и коэффициент корреляции составил уже 0,92 (при p = 2,2 × 10−16) (рис. 2).
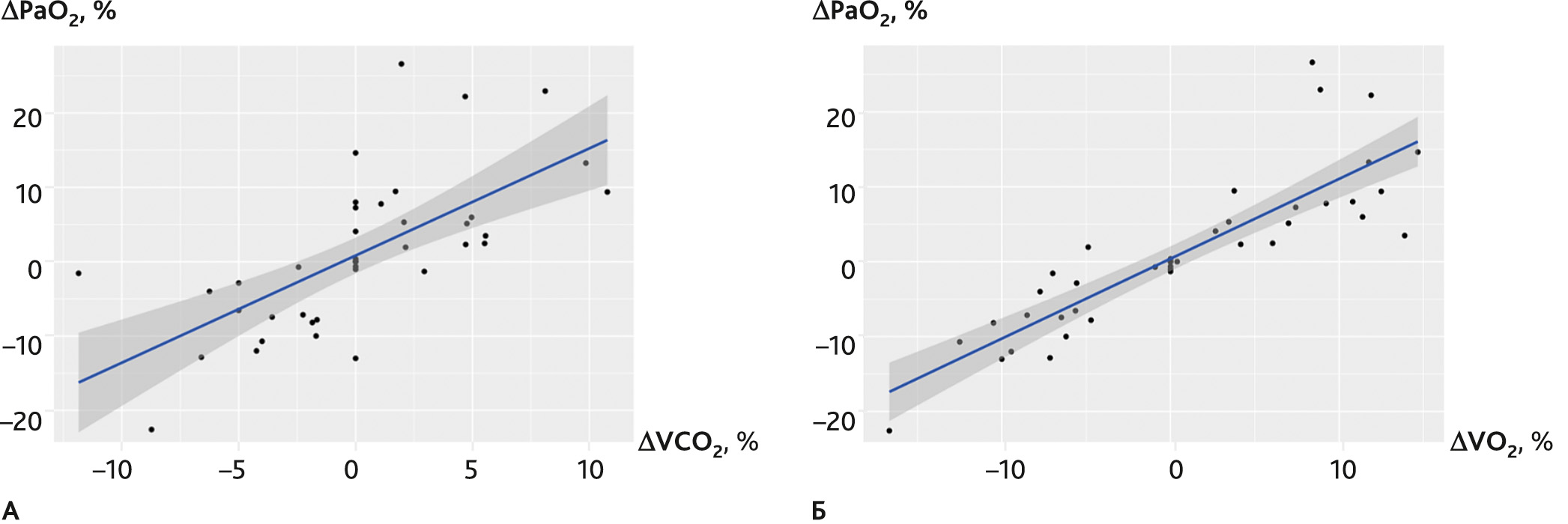
Рис. 2. Корреляционные графики для ΔVCO2/ΔPaO2 (A) и ΔVO2/ΔPaO2 (Б)
Fig. 2. Correlation plots for ΔVCO2/ΔPaO2 (A) and ΔVO2/ΔPaO2 (Б)
Остановимся вначале на разнонаправленных сдвигах VO2 и VCO2, которые в данном исследовании мы наблюдали у разных пациентов в ответ на однонаправленное изменение ПДКВ. Очевидно, что VO2 и VCO2 отражают динамику газообменной производительности легких, биофизическим эквивалентом которой является объемная скорость диффузии газов. Объемная скорость диффузии (Vx, мл ∙ мин−1), согласно модифицированной формуле Адольфа Фика, равна:
\( V_x=\Delta P \frac{S}{d}D_x \) (5)
где ΔP — градиент давления, S — площадь контакта, d — толщина мембраны и Dx — коэффициент диффузии [22].
Коэффициент диффузии, зависящий от физико-химических свойств молекул газа и диффузионной мембраны, не мог меняться во время данного исследования. Градиент давления очевидным образом меняется однонаправленно, то же самое можно сказать и о возможных изменениях толщины мембраны за счет степени растяжения альвеол и капилляров. Откуда же тогда разнонаправленные изменения VO2 и VCO2?
Единственным компонентом формулы (5), который при однонаправленном изменении ПДКВ может меняться разнонаправленно, остается площадь S поверхности контакта крови и альвеолярного газа. Ничего нового в таком представлении на самом деле нет: еще классическая схема зон John West (1963) [23] продемонстрировала значимость конкуренции вентиляции и кровотока за ограниченный внутренний объем легочного газообменника. Поэтому и влияние увеличения ПДКВ на газообменную производительность легких зависит от того, будут ли перфузироваться капилляры вновь раскрытых альвеол и в каких фазах дыхательного цикла эта перфузия будет возможна (вспомним «феномен водопада» у Дж. Веста!). Аналогично влияние на газообменную производительность снижения ПДКВ будет зависеть от того, какой пул альвеол будет преобладать после такого маневра — дерекрутированных или таких, вокруг которых при сохранении вентиляции восстановилась перфузия капилляров малого круга [24].
Насколько значим тот или иной сдвиг ПДКВ? В первом приближении выбранное нами повышение ПДКВ всего лишь на 3 см вод. ст. расширит первую зону Веста вниз на те же 3 см, что в горизонтальном положении пациента совсем не мало.
Отдельный важный вопрос — причина и механизм быстро обратимого характера сдвигов VO2 и VCO2, наступающих в результате изменения уровня ПДКВ. С одной стороны, понятно, что манипуляции с вентиляционно-перфузионными соотношениями в легких неспособны изменить величины потребления кислорода и продукции углекислого газа тканями организма. С другой стороны, очень важно понимать, каким образом происходит возврат величин VO2 и VCO2 к исходным значениям при изменившейся величине эффективной поверхности контакта между кровью и альвеолярным газом. Поскольку все остальные параметры уравнений диффузии фиксированы, единственный возможный путь образования «горок» и «ямок» на трендах VO2 и VCO2 (т.е. возврата величины Vx к исходному стабильному значению) — изменение градиента давления ΔP за счет изменения состава смешанной венозной крови: при увеличении поверхности контакта градиенты снижаются, при снижении S они должны повышаться. Если, однако, не видеть динамику VO2 и VCO2 в предоставляемом метаболографом высоком временнóм разрешении, можно посчитать, что ничего не изменилось. Но развитие методов физиологического исследования вообще и мониторинга в частности всегда побуждают нас видеть предметы интереса (i) с меньшей инерционностью средств измерения и (ii) с частотой отсчетов, позволяющей получать без потерь все полезные компоненты сигнала. В строгой математической трактовке это отражают предел Г. Найквиста (1928) и теорема В.А. Котельникова (1933), а интересующее нас биофизическое явление описывается совсем не как повышение или снижение VO2 или VCO2, а как быстрая смена знака производных dVO2/dt и dVCO2/dt с плюса на минус («горка») или, напротив, с минуса на плюс («ямка»).
В нашем исследовании возврат к исходным значениям VO2 происходил всегда, в то время как возвращения VCO2(end) к точным величинам значения VCO2(start) мы не отметили в пяти наблюдениях, хотя общий рисунок «горок» или «ямок» и при этом был сохранен. Такая особенность может быть связана с бóльшей химической емкостью поглощения для углекислого газа, «демпфирующей» колебания его продукции и выделения [25].
Тот факт, что у 12 из 41 пациента в ответ на повышение ПДКВ с 2 до «минимально-протективных» 5 см вод. ст. [26] происходило преходящее снижение VO2 и VCO2, побуждает нас задуматься о том, насколько легочно-протективная вентиляция в действительности эффективна с точки зрения газообменной производительности легких.
Такие выводы могут оказаться справедливыми не только для настройки уровня ПДКВ, но и для других параметров, исходно регламентированных более жестко [27].
Стоит сказать и об ограничениях данного метода, к которым относятся: невозможность анализа VO2 при FiO2 > 85 % (технический максимум прибора [28]), необходимость исходной стабилизации параметров VO2 и VCO2, что требует как стабильного уровня метаболизма, так и стабильных объемов и частоты дыхания. Эти условия в целом достигаются у релаксированных и седатированных пациентов в полностью принудительном режиме с управлением по объему.
В данное исследование были включены пациенты, проходящие плановое оперативное вмешательство, у которых индекс PaO2/FiO2 не соответствовал критериям острого респираторного дистресс-синдрома (ОРДС), поэтому методика, несомненно, требует дополнительного анализа на соответствующей группе пациентов. Хотя у ряда пациентов отмечался индекс PaO2/FiO2 < 300, эта особенность связана не с развитием ОРДС, а характерна для ИВЛ во время общей анестезии без применения ПДКВ [29]; в нашем же случае мы имели дело еще и с пациентами, «официально» и «неофициально» перенесшими COVID-19.
Авторы понимают, что оптимизация диффузионного потенциала легких не означает в то же время оптимизации, например, биомеханических параметров их вентиляции. Однако определенная зацикленность коллег на протяжении нескольких десятилетий исключительно на вентиляционной стороне легочной функции, логически вытекающая из многолетней (до появления рутинно доступной экстракорпоральной мембранной оксигенации) безальтернативности ИВЛ при тяжелой дыхательной недостаточности, мотивировала нас изолированно изучить другой критерий оптимизации — диффузионный. Ведь наша конечная цель — не оптимальная вентиляция, а максимальный газообмен.
Данные VCO2 и VO2, полученные с помощью метаболографа, имеют высокодостоверную корреляционную связь со сдвигами PaO2 при изменениях ПДКВ, что делает перечисленные данные функционально взаимозаменяемыми критериями настройки оптимальных значений конечно-экспираторного давления. VO2 по сравнению с VСO2 в нашем исследовании имел более сильную корреляционную связь и предсказательную способность. Более глубокий анализ данной методики, включая разработку на ее основе алгоритма оптимизации ПДКВ, требует дальнейших исследований, в том числе и у пациентов с ОРДС. Обращает на себя внимание тот факт, что в 12 из 41 наблюдения уровень ПДКВ 5 см вод. ст. является избыточным с точки зрения газообменной производительности легких.
Конфликт интересов. К.М. Лебединский — президент Общероссийской общественной организации «Федерация анестезиологов и реаниматологов». Р.Ю. Овсянников заявляет об отсутствии конфликта интересов.
Disclosure. K.M. Lebedinskii is the President of the all-Russian public organization «Federation of anesthesiologists and reanimatologists». R.Iu. Ovsiannikov declares that he have no competing interests.
Вклад авторов. Оба автора в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. Both authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Этическое утверждение. Проведение исследования одобрено Локальным этическим комитетом ФГБОУ ВО СЗГМУ им. И.И. Мечникова, протокол № 10 от 30.10.2019. Все пациенты подписали информированное согласие на проведение исследования.
Ethics approval. The study was approved by the local Ethical Committee of North-Western State Medical University named after I.I. Mechnikov (reference number: 10-30.10.2019). All the patients have undersigned standard informed consent paper.