Ежегодно в мире около 250 млн человек подвергаются некардиальным хирургическим операциям. В Европе при выполнении 5,7 млн некардиальных операций у больных с сопутствующими сердечно-сосудистыми заболеваниями развивается более 167 000 кардиальных осложнений, причем в 19 000 наблюдений — с летальными исходами [1].
Второй важный момент — это то, что с каждым годом возрастает количество операций, выполняемых лицам пожилого и старческого возраста, пациентам с сопутствующей сердечно-сосудистой патологией. Доля таких больных в развитых странах постоянно увеличивается. Соответственно, увеличивается и необходимость в хирургическом лечении у таких пациентов, которая возрастает в четыре раза по сравнению с общей популяцией [1, 2].
Именно у этой категории пациентов риск осложнений со стороны сердечно-сосудистой системы многократно увеличивается. Так, частота кардиальных осложнений у больных старше 50 лет после плановых некардиальных операций составляет 1,4 % [3] и может доходить до 26,6 % у больных старше 85 лет после экстренных абдоминальных вмешательств [4]. Эти осложнения приводят не только к удлинению пребывания больного в стационаре и росту стоимости лечения, но и увеличивают летальность. По данным ряда исследований, у взрослых больных более 40 % летальности при некардиальных оперативных вмешательствах обусловлено кардиальными осложнениями, среди которых наиболее частыми являются различные варианты повреждения миокарда и сердечная недостаточность (СН) [5–7].
В связи с этим эффективная профилактика и своевременное лечение таких осложнений в периоперационном периоде является одним из самых важных факторов по снижению госпитальной летальности пациентов при проведении хирургических операций [1, 8–10].
Одним из главных развиваемых направлений в этом отношении является разработка так называемых риск-снижающих технологий [11, 12]. Последние подразумевают под собой комплекс, который сочетает в себе совокупность методик оценки риска пациента, фармакологической подготовки пациента к оперативному вмешательству, методов анестезиологического обеспечения, включая современный мониторинг, а также адъювантную кардиопротекцию, под которой понимают периоперационное использование различных лекарственных агентов, обладающих защитными свойствами в отношении сердечно-сосудистой системы. К ним относятся такие фармакологические группы, как бета-блокаторы, сартаны, α2-агонисты, нитраты, кальциевые сенситайзеры, блокаторы кальциевых каналов, антиагреганты, статины, галогеносодержащие анестетики. Но на настоящий момент некоторые препараты не подтвердили ожидаемой кардиопротективной эффективности (нитраты, блокаторы кальциевых каналов). Более того, использование нифедипина у больных при сосудистых операциях повышает периоперационную летальность [13].
При периоперационном применении бета-блокаторов повышается риск гемодинамически значимой брадикардии. Возможны и другие побочные эффекты: гипотензия, бронхоспазм, декомпенсация СН. Кроме того, пероральные бета-блокаторы требуют довольно длительной предоперационной подготовки [14]. Это относится и к пероральным статинам, которые нужно назначать минимум за 5–7 дней до операции, чтобы они проявили свою протективную активность.
Большинство препаратов с антикоагулянтной активностью повышают риск периоперационных кровотечений, что ограничивает их активное профилактическое назначение. Предоперационное использование сартанов значимо повышает риск выраженной артериальной гипотензии после индукции общей анестезии, особенно у больных, получающих β-адреноблокаторы; следует подчеркнуть трудность в коррекции такой гипотензии [11].
При применении левосимендана возможны побочные эффекты (артериальная гипотензия и тахикардия), препарат противопоказан больным с аортальным стенозом — самым распространенным клапанным пороком у больных пожилого и старческого возраста, а это заболевание является доказанным фактором риска периоперационного инфаркта миокарда и летальности, особенно при выполнении экстренных оперативных вмешательств [1]. В последнее десятилетие большое внимание уделяется прекондиционирующему эффекту галогеносодержащих анестетиков [11, 15]. Но несомненная эффективность анестетического прекондиционирования кардиомиоцитов, показанная в эксперименте, не нашла пока однозначного подтверждения в клинической практике. Возможно, потому что для реализации кардиопротективного эффекта требуются высокие концентрации галогеносодержащего анестетика, что клинически не всегда достижимо [16].
Среди всех перечисленных лекарственных средств особое место занимает фармакологический агент метаболической (биоэнергетической) направленности — экзогенный фосфокреатин (ФК), препарат с более чем 30-летней историей. Первая работа, обосновывающая его возможное практическое применение и включенная в данный обзор, датируется 1979 г. [17]. Новый виток интереса к нему обусловлен появлением убедительных доказательств высокого уровня, подтверждающих его кардиопротективную эффективность в различных клинических ситуациях. Так, Landoni G. с соавт. и Mingxing F. с соавт. [18, 19] показали, что в общей популяции больных с заболеваниями сердца (более 3000 клинических наблюдений) ФК обеспечивает снижение общей летальности в 3 раза (отношение шансов (ОШ) 0,71; 95%-й доверительный интервал (95% ДИ); р = 0,04); снижение частоты тяжелых аритмий (ОШ 0,42; 95% ДИ 0,27–0,66; р < 0,001); уменьшение потребности в назначении симпатомиметических препаратов (ОШ 0,39; 95% ДИ 0,25–0,61; р < 0,001). Использование ФК было ассоциировано с более высокой фракцией изгнания (ФИ) левого желудочка (ЛЖ) (95% ДИ 1,18–6,46; р = 0,005) и снижением уровня MB-фракции креатинфосфокиназы (МВ-КФК) (95% ДИ –8,01 … – 4,15; р < 0,001) [18].
У кардиохирургических больных (более 1900 клинических наблюдений) при использовании ФК подтвердились меньшая (в 1,75 раза) частота серьезных аритмий (ОШ 0,44; 95% ДИ 0,27–0,69; p < 0,001), снижение (в 1,6 раза) частоты назначения инотропных препаратов (ОШ 0,47; 95% ДИ 0,35–0,61; p < 0,001), больший уровень ФИЛЖ в ранний послеоперационный период (95% ДИ 2,07–4,29; р < 0,001) и меньший (р < 0,001) послеоперационный уровень МB-КФК [19].
В 2018 г. был опубликован обзор применения экзогенного ФК в кардиохирургической практике [20]. Данный же обзор посвящен опыту его использования как агента, обеспечивающего профилактику периоперационных кардиальных осложнений при общехирургических операциях. Опыт применения экзогенного ФК у больных высокого риска, которым выполняют экстракардиальные оперативные вмешательства, относительно ограничен, хотя актуальность проблемы адъювантной кардиопротекции в этой клинической ситуации не вызывает сомнений [1, 21].
Поиск исследований проводился в базах PubMed/Medline, Embase, e-library, China National Knowledge Infrastructure, WANGFANG DATA. В поиске использовали следующие термины: «фосфокреатин», «креатинфосфат», а также «хирургия». Поиск велся на русском, английском и китайском языках. Профессиональные переводчики переводили текст с китайского на русский. Были исключены исследования при операциях на сердце и отобраны исследования с применением экзогенного ФК в некардиальной хирургии. Дата последнего поискового запроса — 31 декабря 2019 г.
Основу ФК составляет креатин, или метилгуанидинуксусная кислота, — природное соединение аргинина, глицина и метионина. У человека он синтезируется в печени и поджелудочной железе [17].
Этот агент играет важнейшую роль в тканях с высокой метаболической активностью, например, миокарде, скелетных мышцах и головном мозге, поскольку является, с одной стороны, основным источником пополнения энергии, а с другой — переносчиком энергии [22, 23].
В клетках креатин содержится в свободной форме, а также в виде ФК (другое название — креатинфосфат). Креатинфосфат играет фундаментальную роль в энергетическом механизме сокращения миокарда. Это вещество является резервом химической энергии в миокарде и используется для повторного синтеза АТФ, при гидролизе которой образуется готовая к использованию энергия в процессе сокращения актиномиозинового комплекса.
Использование с целью кардиопротекции экзогенного ФК весьма логично, поскольку при ишемии-реперфузии (а именно этот синдром в основном является причиной повреждения миокарда) происходит существенное снижение содержания ФК и, как следствие этого, уменьшение АТФ. Это приводит к гиподинамическому состоянию миокарда. А введение экзогенного ФК и проникновение его в клетку, обеспечивая ресинтез АТФ, поддерживает внутриклеточную концентрацию аденозинтрифосфорной кислоты, необходимую для нормальной функциональной деятельности миокарда.
Возможность проникновения экзогенного ФК в кадиомиоцит доказали в своих работах Down с соавт., Breccia с соавт. и Preobrazhensky с соавт., которые в экспериментах in vitro установили, что 32Р-ФК, или дважды меченный ФК, существенно повышает содержание в ткани АТФ и что меченый фосфат встраивается в АТФ, несмотря на то что скорость поглощения тканью была невысокой. Проникая внутрь клетки, экзогенный ФК может внести значительный вклад в поддержание содержания ФК и ресинтеза АТФ [24–26]. В миокарде ФК является не только субстратом ресинтеза АТФ (креатинкиназная реакция), но и обеспечивает главный путь передачи внутриклеточной энергии (фосфокреатиновый путь) от митохондрий ко всем местам ее использования [27].
Макроэргические фосфаты переносятся из мест образования (митохондрии) к местам утилизации посредством ряда метаболических изменений в виде фосфотрансферазных реакций, катализируемых креатинкиназой «фосфокреатинового челнока». Если эндогенный ФК работает внутри кадиомиоцита, то фармакологические и биоэнергетические эффекты экзогенного ФК могут реализовываться и без проникновения в клетку. Экзогенный ФК способен с помощью сарколеммальной креатинкиназной реакции поддерживать пул АТФ около сарколеммы, восполняя энергию, необходимую для кальциевых каналов, работающих с затратами энергии. В результате в кардиомиоцитах поддерживается медленный входящий кальциевый ток, необходимый для сократительной функции [28].
Кроме того, ряд экспериментальных исследований показал, что помимо поддержания уровня аденозинтрифосфата ФК обеспечивает, за счет цвиттер-ионного взаимодействия между заряженными центрами молекулы ФК и заряженными головками фосфолипидов мембран, сохранность ее фосфолипидного слоя и снижает образование лизофосфоглицеридов в ишемизированном миокарде. Это защищает сарколемму кардиомиоцитов от ишемического повреждения, снижает частоту аритмий и повышает постишемическое восстановление сократительной функции.
Резюмируя вышеизложенное, можно заключить:
Наиболее частым кардиальным осложнением при общехирургических операциях является возникновение ишемии и развитие инфаркта миокарда (ИМ). Среди 100 млн взрослых в возрасте 45 лет и старше, подвергающихся экстракардиальным оперативным вмешательствам, периоперационный ИМ переносят около 3 млн человек. Периоперационные кардиальные осложнения в виде ишемии, инфаркта миокарда и сердечной недостаточности (СН) являются ведущей причиной летальных исходов у больных с высоким кардиальным риском, оперируемых по самым различным показаниям. Именно на профилактику ишемии-реперфузии и декомпенсации исходной сердечной недостаточности должны быть направлены действия анестезиолога в рамках кардиопротективного обеспечения общехирургических операций. При этом экзогенный ФК может сыграть ведущую кардиопротективную роль. Чем обосновано такое заключение? Экспериментальные исследования биохимических процессов при ишемии-реперфузии убедительно показывают, что этот патофизиологический процесс сопровождается быстрым истощением высокоэнергетических фосфатов, таких как ФК и АТФ, необходимых для поддержания метаболической активности кардиомиоцитов. Снижение уровня макроэргов приводит к структурным изменения в самой клетке, что представляет собой картину ишемического повреждения миокарда. В связи с этим ключевым механизмом, позволяющим уменьшить ишемическо-реперфузионные последствия, является адекватное энергообепечение клеток перед ишемией, во время ишемии и после нее. Как показали исследования, ключевую роль в реализации этого механизма играет экзогенный ФК.
Группа авторов из ФГБУ «Медицинский радиологический научный центр» Минздрава России (г. Обнинск) опубликовали результаты своей работы относительно кардопротективной эффективности экзогенного ФК у пациентов старшей возрастной группы [31].
Именно у пожилых пациентов с особой остротой встает проблема безопасности операции и раннего послеоперационного периода.
Включенные в исследование пациенты старше 65 лет (41 больной) составили две группы — контрольную (21 пациент) и основную (20 пациентов). Пациентам основной группы за 5 дней до операции назначали ФК по 2 г в сутки, далее — 4 грамма (2 г во время операции и 2 г в ОРИТ) в день операции и по 2 грамма в 1-е — 3-и сутки в ОРИТ. Авторы показали, что применение ФК в схеме предоперационной кардиотропной терапии позволило достоверно снизить количество послеоперационных осложнений, и в частности острого коронарного синдрома, сократить сроки пребывания больных в ОРИТ.
Недавно опубликованы результаты исследования, показавшего, что периоперационное использование экзогенного ФК у онкологических больных старшей возрастной группы с высоким риском кардиальных осложнений обеспечивает комплекс благоприятных эффектов [32].
Авторы сравнили 80 пациентов с обычным ведением периоперационного периода (1-я группа) и 56 пациентов, у которых обычное ведение было дополнено назначением экзогенного ФК (2-я группа). Препарат назначали в течение 5 суток до операции и 3 суток после операции по 2 г, а в день операции — в дозе 4 г. Частота послеоперационных осложнений была ниже во второй группе — 7,2 vs 35 % (p = 0,001; OШ = 0,18; 95% ДИ 0,07–0,49), преимущественно за счет уменьшения числа случаев острого коронарного синдрома и снижения частоты фибрилляции предсердий. Авторы доказали, что использование ФК позволило предотвратить какое-либо осложнение у каждого четвертого больного. Длительность госпитализации после операции также была ниже во 2-й группе.
Еще одна ниша использования экзогенного ФК — это септический шок. Как известно, у больных с септическим шоком довольно часто развивается гипокинетический тип кровообращения.
В комплексе мер по коррекции такого состояния было предложено использовать в качестве адъювантной терапии ФК [33]. Исследования были проведены у 49 пациентов с послеоперационным абдоминальным сепсисом. Пациентам одной из групп в программу интенсивной терапии включали введение ФК: 6 г внутривенно болюсно, а затем препарат инфузировали в дозе 1 г на 10 кг массы тела пациента в течение суток. Полученные результаты данного исследования показали, что такая терапия позволила улучшить параметры гемодинамики, уменьшает степень гипоксии и снизить дозы норадреналина в 4 раза.
Как известно, операции по эндопротезированию тазобедренного сустава характерны для пациентов пожилого и старческого возраста, у которых наиболее частой сопутствующей патологией является ишемическая болезнь. Именно такой неблагоприятный фон обусловливает риск возникновения периоперационного инфаркта миокарда и нарушений сердечного ритма [34, 35].
Исследователи из Китая Wen-Long Z. и Meng-Fei Y., применив ФК у этой категории пациентов, показали, что у больных, получавших ФК, частота возникновения ишемии и серьезных нарушений сердечного ритма во время проведения анестезии была значительно ниже (в 3 раза), чем у пациентов контрольной группы. Различия статистически значимы (p < 0,05) [36].
Повреждение миокарда после трансплантации печени является одним из грозных осложнений, повышающих риск неблагоприятного исхода. В связи с этим адъювантная кардиопротективная терапия является одним из значимых факторов уменьшения этого риска и улучшения результатов оперативного вмешательства. Исследования Xiao-Guang Y., Xia-Guang D., Yu-Ging K. показали, что применяемый с целью защиты миокарда экзогенный ФК повышает степень его защиты, о чем свидетельствует достоверно более низкий уровень тропонина I и MB фракции КФК в группе ФК по сравнению с группой контроля — 0,363 ± 0,119 и 0,551 ± 0,161 соответственно (р < 0,05). Следует отметить, что экзогенный ФК вводился превентивно во время индукции в анестезию в дозе 30 мг/кг [37].
Еще один большой раздел хирургии высокого риска — это торакальная хирургия, и в частности онкохирургия. Она характеризуется высокой степенью травматичности и обширностью оперативных вмешательств, связанных с манипуляциями на жизненно важных органах, обеспечивающих дыхание и кровообращение [38]. В то же время функциональные резервы большинства онкологических больных в той или иной степени снижены из-за возраста, сопутствующей патологии, осложнений основного заболевания, адъювантной химио- и/или лучевой терапии [39].
К основным видам кардиальных осложнений после торакальных операций следует отнести возникновение аритмий от 10 до 20 % при проведении лобэктомии и до 40 % и более после пневмонэктомии, ишемические изменения (3,8 %) или инфаркт миокарда (1,2 %), сердечную недостаточность, отек легких, тромбоэмболию легочной артерии (ТЭЛА) [40, 41].
Не вызывает сомнений, что эти больные требуют применения адъювантной интраоперационной терапии, повышающей степень протекции сердечно-сосудистой системы. Исследования показали, что патогенетическим препаратом в этом отношении может быть экзогенный ФК [29, 39, 42].
Как уже отмечалось, при проведении больших общехирургических операций у пациентов высокого риска одним из самых грозных осложнений является периоперационный инфаркт миокарда. Так, C. Herrington с соавт. сообщают, что частота инфаркта миокарда в торакальной хирургии колеблется от 2,1 % и может достигать 21 % [43]. В связи с этим очень ценен с практической точки зрения проведенный метаанализ [44], включающий 1474 взрослых пациента с ишемической болезнью сердца и сердечной недостаточностью, т. е. пациентов с большой степенью вероятности развития кардиальных осложнений. Было показано, что при применении ФК отмечается снижение частоты возникновения нарушений ритма, снижение пиковых значений креатинфосфокиназы и уровня тропонина. Более того, использование ФК было связано с улучшением фракции выброса у пациентов, подвергнутых хирургическому лечению при наличии у них хронической сердечной недостаточности.
Хотелось бы остановиться еще на очень важном аспекте применения экзогенного ФК. В связи с совершенствованием хирургических технологий, методов анестезиологического обеспечения и послеоперационного ведения пациентов оперативному лечению подвергаются все более тяжелые больные с множеством сопутствующих патологий, и в частности с хронической сердечной недостаточностью. Частота встречаемости ХСН в возрасте более 80 лет составляет 10 %. Именно у таких пациентов риск периоперационных осложнений со стороны ССС резко повышается, и именно эти пациенты нуждаются в первую очередь в кардиопротективной защите. Исследования показывают, что сердечная недостаточность у больных старше 65 лет увеличивает риск периоперационной летальности при общехирургических операциях в 1,63 раза. По данным разных авторов, в структуре послеоперационных кардиальных осложнений острая левожелудочковая недостаточность с отеком легких занимает от 30 до 92 % [45].
Проведенные исследования свидетельствуют, что одним из возможных вариантов протективной защиты у этой категории больных является использование экзогенного ФК. Так, Smilari с соавт. провели открытое эхокардиографическое исследование для оценки влияния быстрой инфузии ФК (1 г) на функцию левого желудочка у 20 пациентов с застойной кардиомиопатией, ишемической кардиомиопатией и легочным сердцем. Через 3 ч после окончания инфузии ФК наблюдалось достоверное снижение конечного диастолического и конечного систолического размеров в сочетании с существенным повышением фракции укорочения (+30 %), увеличением фракции выброса (+18 %) и сердечного выброса (+17 %). [46]. Ferraro с соавт. изучили эффекты ФК у пациентов с хронической сердечной недостаточностью, компенсированной благодаря медикаментозной терапии. ЭхоКГ выполняли до инфузии, сразу после нее. В группе плацебо существенных изменений не было, а в группе ФК наблюдалось достоверное увеличение фракции выброса и фракции укорочения наряду с уменьшением конечно-систолического размера и системного сосудистого сопротивления [47]. Cafiero с соавт. отметили, что струйное введение 5 г ФК в/в достоверно улучшало все показатели сократимости миокарда (напряжение стенки, фракция выброса, фракция укорочения) [48].
Недавно были получены новые подтверждения того, что ФК может применяться в качестве адъювантной терапии хронической сердечной недостаточности и улучшать функцию сердца, в частности систолическую функцию левого желудочка [49]. Авторы изучали влияние ФК на функцию левого желудочка и уровень мозгового натрийуретического пептида у пациентов с сердечной недостаточностью. В группе ФК наблюдалось достоверное улучшение фракции выброса левого желудочка, ударного объема и сердечного выброса по сравнению с контрольной группой, а также значительное снижение уровня натрийуретического пептида В-типа.
Многие авторы придают большое значение использованию экзогенного ФК для подготовки больных с ХСН к хирургической операции. В этой клинической ситуации рекомендуют введение 1–2 г препарата 2 раза в сутки в течение нескольких недель. Учитывая хорошую переносимость препарата, в первые дни лечения могут использоваться высокие дозы ФК (до 10 г/сутки).
Применение ФК у больных застойной сердечной недостаточностью сопровождается улучшением клинико-функционального состояния, снижением функционального класса, уменьшением нарушений ритма сердца и улучшением эхокардиографических показателей (увеличение регионарной фракции изгнания гипокинетичных отделов левого желудочка, повышение ударного объема и минутного объема сердца) и толерантности к физической нагрузке, причем подчеркивается, что препарат предотвращает прогрессирование сердечной недостаточности [50, 51].
Помимо защиты миокарда представляют особый интерес возможности ФК в более быстром восстановлении сознания после общей анестезии, обусловленные нейропротективными свойствами ФК. В 2018 г. Wei Wang с соавт. опубликовали результаты рандомизированного двойного слепого плацебо-контролируемого исследования с участием пожилых пациентов от 65 до 80 лет, которым выполнялась трансабдоминальная холецистэктомия под общим наркозом [52]. 120 пациентов были случайным образом распределены либо в группу терапии ФК (1,0 г растворенного в 100 мл 0,9 % физиологического раствора), либо в группу контроля, в которой пациенты получали 100 мл 0,9 % физиологического раствора без ФК. Оценивались динамика биспектрального индекса, время пробуждения, время экстубации, время восстановления сознания, продолжительность пребывания в ОРИТ. Было показано, что по сравнению с группой контроля применение ФК обеспечивало более быстрое восстановление сознания, уменьшало время ИВЛ и нахождения пациента в ОРИТ.
Актуальность задачи снижения частоты кардиальных осложнений у больных с сопутствующими заболеваниями сердца, которым выполняют некардиальные операции, не вызывает сомнений. Одним из путей решения этой задачи может быть применение препаратов, направленных на поддержание и улучшение метаболизма сердечной мышцы. Быстрое истощение высокоэнергетических фосфатов, таких как ФК и АТФ, во время ишемии-реперфузии диктует необходимость адекватного энергообеспечения клеток перед ишемией, во время ишемии и после нее. Как показали вышеприведенные исследования, ключевую роль в реализации защиты миокарда от ишемического-реперфузионного повреждения играет экзогенный ФК.
Проведенные исследования позволили доказать, что препарат снижает частоту послеоперационных осложнений у больных, имеющих сопутствующую сердечно-сосудистую патологию, при некардиальных вмешательствах высокого хирургического риска, влияя, таким образом, на общую результативность лечения.
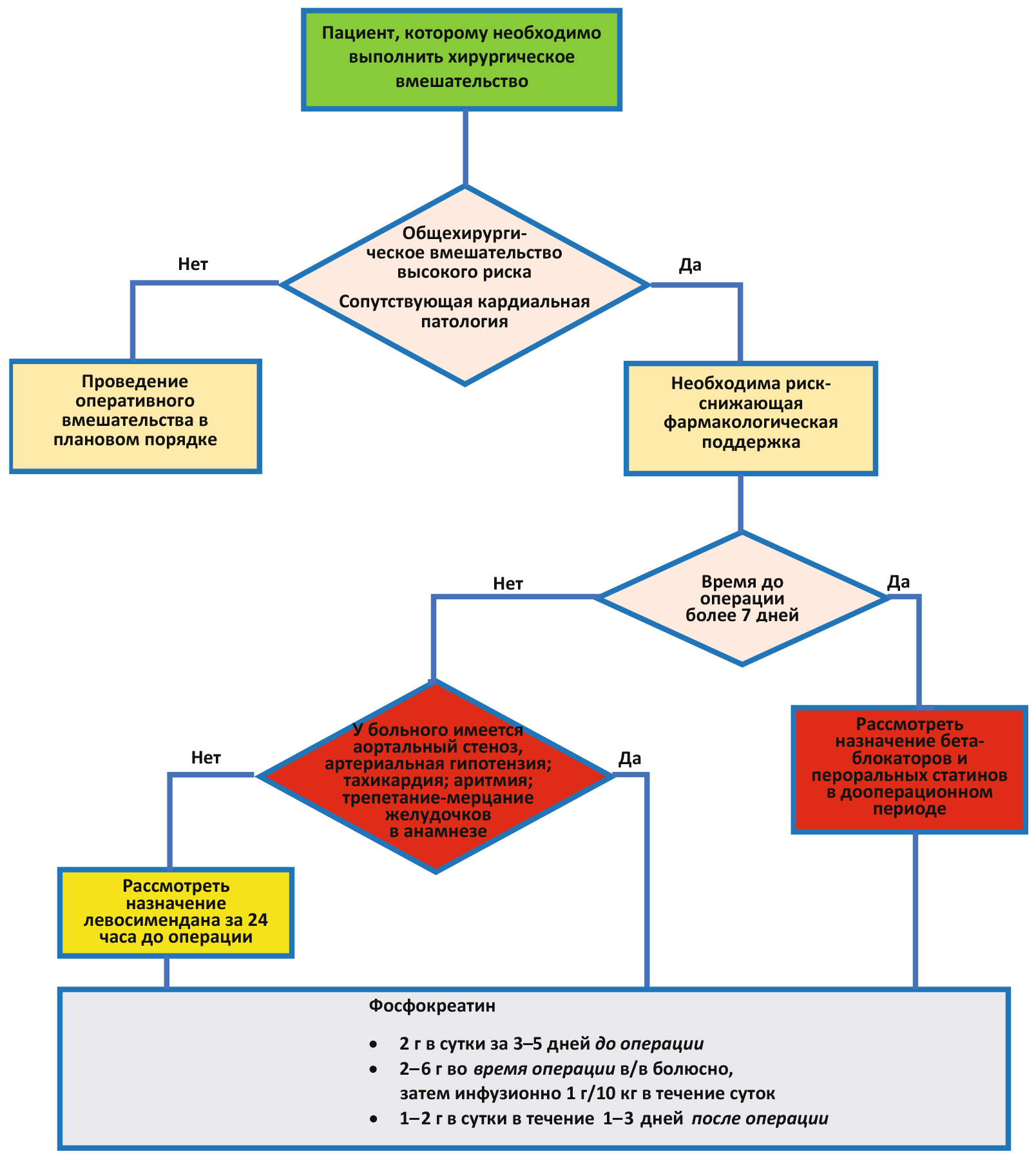
Учитывая вышеизложенные данные о положительном кардиопротективном эффекте экзогенного ФК при различных хирургических операциях, данную протективную методику можно рекомендовать для более широкого применения в клинической практике у больных с высоким кардиальным риском (рис. 1).
Рис. 1. Алгоритм фармакологической поддержки при общехирургических вмешательствах у пациентов с сопутствующей кардиальной патологией
Fig. 1. Algorithm of pharmacological support during general surgical interventions in patients with concomitant cardiac pathology

Конфликт интересов. А.Г. Яворовский является научным консультантом компании «Альфасигма Рус». Остальные авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Яворовский А.Г. — разработка концепции статьи, написание и редактирование текста статьи, получение и анализ фактических данных, проверка и утверждение текста статьи; обоснование научной значимости; Попов А.М., Ногтев П.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.