Острый респираторный дистресс-синдром (ОРДС) и кардиогенный шок являются частыми причинами смерти пациентов отделений реанимации и интенсивной терапии (ОРИТ), несмотря на существенные достижения в медицине критических состояний [1, 2]. В то же время значительно увеличилось использование метода экстракорпоральной мембранной оксигенации (ЭКМО) у пациентов с тяжелой дыхательной или сердечной недостаточностью, рефрактерной к традиционным методам лечения: по данным Всемирной организации экстракорпоральной поддержки жизни, в 2021 г. зарегистрировано 20 317 случаев ЭКМО в 577 центрах [1, 3, 4].
ЭКМО — это медицинская технология, которая может обеспечить как гемодинамическую, так и респираторную поддержку. Пациентов с тяжелой сердечной недостаточностью, как правило, переводят на вено-артериальную (ВА) ЭКМО, а пациентов с тяжелой дыхательной недостаточностью — на вено-венозную (ВВ) [3, 5]. Наряду с ростом применения ЭКМО стала более очевидной ее роль в лечении ОРДС в период пандемии COVID-19 [6]. В метаанализе из двух рандомизированных контролируемых исследований (РКИ) было показано значимое снижение 90-дневной летальности пациентов с ОРДС, которые находились на ВВ-ЭКМО в сравнении с традиционной механической вентиляцией легких [7]. Что касается ВА-ЭКМО, сообщается об увеличении долгосрочной выживаемости в кардиохирургии и при потенциально обратимой сердечной недостаточности [8, 9].
Нутритивная поддержка является важным элементом интенсивной терапии тяжелых пациентов. В состоянии гиперметаболизма-гиперкатаболизма адекватное питание поддерживает мышечную массу и баланс необходимых макро- и микроэлементов в организме больного [12, 13]. В целом пациенты, которые находятся в ОРИТ в критических состояниях, нередко не получают достаточное количество питательных веществ. По данным различных исследований, целевые показатели энергии и белка составляют 50–70 % от должных у пациентов в критическом состоянии [10, 11]. Результаты ряда обсервационных исследований демонстрируют связь между недостаточным питанием и худшими клиническими исходами [14] в течение первой недели пребывания в ОРИТ [15].
Нутритивная поддержка имеет большое значение во время ЭКМО, учитывая тот факт, что эта популяция пациентов обычно относится к когорте наиболее тяжелых, им требуется комплексное интенсивное лечение, сопровождающееся длительным пребыванием в ОРИТ и длительной реабилитацией, а также высоким уровнем смертности [16, 18]. При этом потребности в питании могут увеличиваться из-за повышенного катаболизма белка, вторичного по отношению к системным воспалительным процессам [17].
Несмотря на рост частоты использования ЭКМО в ОРИТ за последнее десятилетие, информативные клинические данные, касающиеся оптимального управления питанием и контролем метаболизма, встречаются редко [18, 19]. Существующий недостаток доказательной базы в сочетании с отсутствием клинических рекомендаций приводит к гетерогенности клинической практики в отношении оптимального времени, типа и объема питания пациентов, нуждающихся в ЭКМО [21, 22]. Вместе с этим тяжелые нарушения кровообращения и системное воспаление, наряду с высоким уровнем вазопрессорной поддержки и необходимостью антикоагулянтной терапии во время экстракорпорального кровообращения, создают высокий риск нарушения целостности кишечника и гипоперфузии внутренних органов, ишемических или геморрагических осложнений со стороны желудочно-кишечного тракта (ЖКТ). Само по себе применение ЭКМО с различными биосовместимыми материалами, применяемыми для экстракорпорального газообмена, может не только индуцировать или усугублять системное воспаление и окислительный стресс [23], но и сопровождаться усиленной потерей эндогенных и экзогенных макронутриентов и микроэлементов [24].
Ранее энтеральное питание (ЭП) во время ЭКМО считалось достаточно рискованным из-за опасений, что введение питательных веществ в кишечник увеличивает потребность энтероцитов в кислороде, которое превышает его доставку вследствие возможного нарушения микроциркуляторного кровотока [25]. Осложнения со стороны ЖКТ, такие как задержка опорожнения желудка, диарея и ишемия кишечника, были зафиксированы у пациентов с нестабильной гемодинамикой на фоне ЭП, возможно, вследствие имеющей место гипоперфузии внутренних органов [26]. С другой стороны, сообщается, что начало ЭКМО, вероятно, способствует достижению адекватного статуса кровообращения и, следовательно, снижает риск желудочно-кишечной гипоперфузии и связанных с ней осложнений [27]. После купирования шока с помощью механической поддержки наряду с инфузионной и вазопрессорной терапией предлагается как можно скорее начать малообъемное (трофическое) ЭП [12, 28].
Для предотвращения кумулятивного дефицита энергии и белка в течение первой недели ЭКМО, когда нутритивная поддержка начинается с раннего трофического ЭП и целевые показатели питания еще не достигнуты, дополнительное парентеральное питание (ПП) является еще одной стратегией, которую следует рассмотреть. При выраженной непереносимости ЭП назначение ПП является необходимым [29, 30]. При этом использование ПП у пациентов на ЭКМО остается спорным из-за возможности инфильтрации липидов жировой эмульсии в оксигенатор, что может вызывать нарушение его функционирования [12]. Кроме того, полиметилпентеновые волокна оксигенатора и магистрали из поливинилхлорида системы ЭКМО могут связывать различные лекарственные средства и, возможно, макронутриенты и микроэлементы, снижая биодоступность этих веществ [31].
Оптимальные целевые показатели нутритивной поддержки на различных стадиях критического заболевания остаются спорными [32]. Непрямая калориметрия считается «золотым стандартом» измерения расхода энергии у тяжелых пациентов в ОРИТ [12, 13]. Однако на практике часто используются различные прогностические уравнения для оценки целевых показателей энергии и белка, что сопряжено с ограничениями и рисками значительной гипоалиментации или, напротив, перекармливания пациентов [32, 33]. Также неясно, подходят ли расчетные методы для использования в особых группах пациентов, таких как пациенты на ЭКМО. Кроме того, метод непрямой калориметрии основан на измерении потребления кислорода, выделения углекислого газа и минутного объема дыхания. А при ЭКМО газообмен частично или полностью происходит через мембранный оксигенатор, и определение уровня удаленного углекислого газа и поглощенного кислорода технически ограничено [17].
Таким образом, не существует конкретных рекомендаций по нутритивной поддержке для взрослых пациентов на экстракорпоральном жизнеобеспечении. В актуальных клинических рекомендациях «Организация экстракорпорального жизнеобеспечения» авторы отмечают: «Как и для всех тяжелобольных пациентов, необходима полноценная калорическая и белковая нутритивная поддержка» [1]. Исключением являются клинические рекомендации по нутритивной поддержке новорожденных на ЭКМО Американского общества парентерального и энтерального питания (ASPEN) [20].
Некоторые исследования подтверждают, что адекватное обеспечение энергией и белком может улучшить мышечную силу и физическую функцию пациентов ОРИТ [34–36]. И наоборот, дальнейшие обсервационные исследования показали, что достижение целевых уровней энергии и белка на ранних стадиях критического состояния может даже усугубить атрофию мышц и способствовать развитию приобретенной в ОРИТ общей мышечной слабости из-за потенциального подавления аутофагии [17, 37].
Цель и задачи систематического обзора — анализ и обобщение результатов современных исследований, посвященных НП взрослых пациентов в критическом состоянии, находящихся на ЭКМО. Для этого сформулированы следующие вопросы:
Систематический поиск и отбор публикаций был выполнен в январе-феврале 2022 г. При поиске литературы была использована библиографическая база данных PubMed для выявления соответствующих исследований, опубликованных за 10 лет (2012–2021 гг.), и изучения подхода к нутритивной поддержке пациентов на ЭКМО. Использовались следующие ключевые слова: «extracorporeal membrane oxygenation», «nutrition support», «enteral nutrition», «parenteral nutrition». Выявленные исследования включались в обзор, если они отвечали следующим критериям:
Релевантные исследования в дальнейшем были ограничены рандомизированными контролируемыми исследованиями, проспективными обсервационными исследованиями, ретроспективными исследованиями и клиническими испытаниями. Из публикаций исключались: обзоры, описания клинических случаев, исследования на животных и редакционные письма.
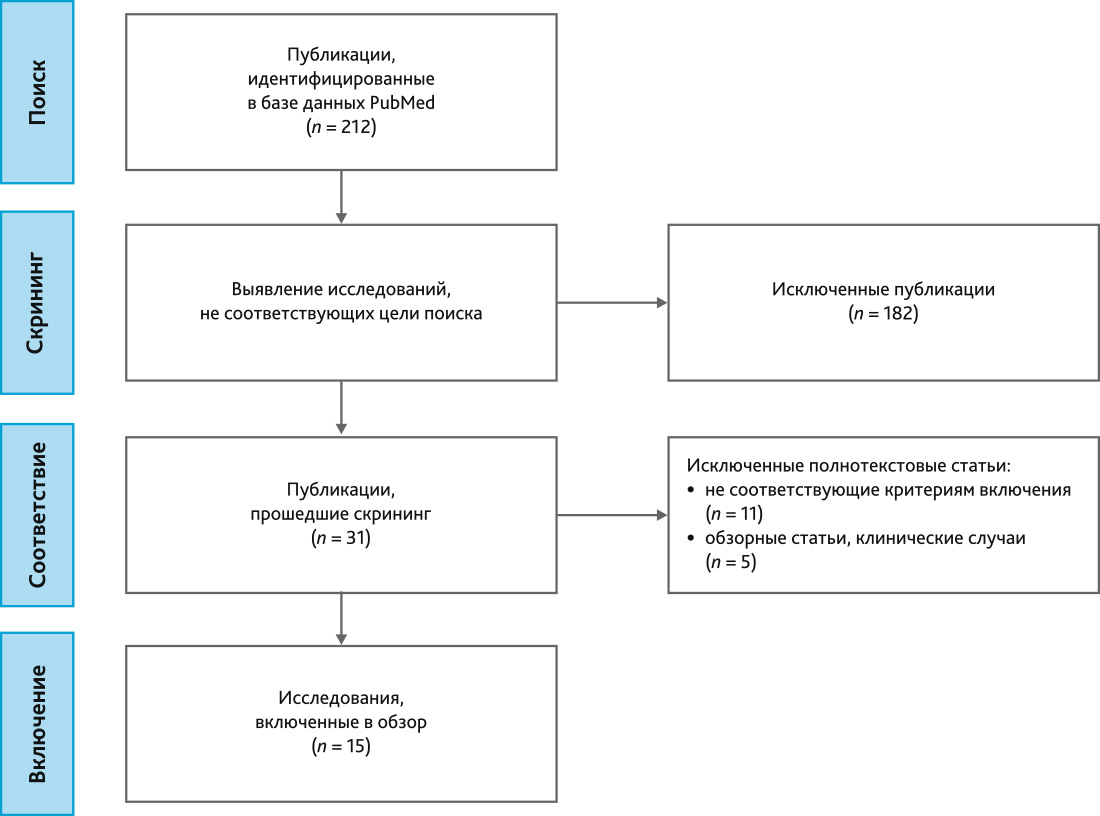
Первоначальный поиск в электронной базе данных выявил 212 статей. После изучения аннотаций поставленной цели соответствовала 31 публикация. Затем были исключены обзоры, клинические случаи, исследования в детской когорте, рецензии на проведенные исследования. После оценки полнотекстовых статей и применения критериев включения отобрано 15 исследований [31, 38–51], среди которых 8 ретроспективных и 6 проспективных обсервационных, 1 эксперимент ex vivo. Алгоритм отбора представлен на рис. 1.

Рис. 1. Блок-схема отбора литературы
Fig. 1. Flowchart of papers selection
В 11 исследованиях (8 ретроспективных и 3 проспективных) описывается практика НП и ее взаимосвязь с клиническими исходами [38–48]. В 3 проспективных исследованиях оцениваются индивидуальные потребности в энергии и белке, которые сравниваются со стандартизированными значениями энергопотребления. В эксперименте ex vivo анализировалась биодоступность различных макро- и микронутриентов. Включенные в обзор исследования опубликованы в период с 2013 по 2021 г. Краткая характеристика исследований и основные результаты представлены в табл. 1.
Таблица 1. Включенные в обзор исследования, их дизайн и основные результаты
Table 1. The studies included in the review, their design and main results
| Авторы | Дизайн | Популяция и тип ЭКМО, n (%) | Начало и метод НП | ЦП питания | Клинические результаты |
|---|---|---|---|---|---|
| Gutierrez et al. [38] | Ретроспективное, одноцентровое | ВА-ЭКМО: 142 пациента с внегоспитальной остановкой сердца | Не получили ЭП, n = 52 Раннее ЭП (< 48 ч), n = 34 Отсроченное ЭП (> 48 ч), n = 56 |
Потребление калорий: 27,5 ккал/кг/сут (p = 0,66) Достижение ЦП через 75 ч от начала ЭП (p = 0,97) |
Выживаемость с благоприятным неврологическим исходом: 29,4 % — раннее ЭП, 53,6 % — отсроченное ЭП (p = 0,04) |
| Kim et al. [39] | Ретроспективное, одноцентровое | 60 пациентов с ОКС, декомпенсацией ХСН, миокардитом, ОРДС ВА: 44 (73,3 %) ВВ: 16 (26,7 %) |
ПП с 1-го дня ЭКМО, ЭП при СрАД ≥ 65 мм рт. ст., снижение ПП по мере повышения ЭП Не получили ЭП, n = 15 Раннее ЭП, n = 29 |
7-е сутки ЭКМО: ЦП < 80 %, n = 18 ЦП 80–120 %, n = 20 ЦП > 120 %, n = 11 |
Отлученные от ЭКМО и выжившие не показали существенных различий в зависимости от адекватности НП. Раннее ЭП связано с успешным отлучением от ЭКМО (p = 0,042) и выживаемостью (p = 0,038). НП с преобладанием ЭП на 7-е сутки ЭКМО не была связана с госпитальной летальностью. Прерывание ЭП (n = 21) не было связано с его ранним началом |
| Renaudier et al. [40] | Ретроспективное, одноцентровое | ВА-ЭКМО: 150 пациентов (65 — посткардиотомный шок, 85 — острый кардиогенный шок) | ЭП в первые 5 сут, n = 128 ПП в первые 5 сут, n = 7 |
Нет данных | Острая мезентериальная ишемия была подтверждена у 14 больных (100 % летальность). Раннее ЭП было отрицательно связано с мезентериальной ишемией (ОШ 0,15; 95 % ДИ 0,03–0,69) |
| Hunt et al. [41] | Проспективное, одноцентровое | 50 пациентов с посткардиотомным шоком ВА: n = 36 (72 %) ВВ: n = 14 (28 %) |
Нет данных о начале НП ЭП, n = 49 ПП, n = 3 |
ЦП от должного: 29,4 % (энергия), 33,5 % (белок). Средняя скорость введения ЭП в зонд 26 мл/ч (~8,25 ч/сут). К 20-м суткам от начала ЭКМО достигнуты целевые уровни по белку — 60 % калорийности от должного | Общая смертность на ЭКМО 70 % vs 20 % без ЭКМО (p = 0,001). Статистически значимой разницы по продолжительности НП, частоте ЭП и ПП не было зафиксировано. Достижение ЦП у пациентов без ЭКМО достоверно выше: энергия (p = 0,017), белок (p = 0,001). Осложнения со стороны ЖКТ не были значимо связаны с ЭКМО, количеством потребляемых калорий и белка, продолжительностью ЭП через зонд |
| MacGowan et al. [42] | Ретроспективное, одноцентровое | ВВ-ЭКМО: 203 пациента с острой дыхательной недостаточностью | ЭП, n = 193. Среднее время начала НП — 13,5 ч. 96,6 % получили ЭП в течение 48 ч. ПП, n = 10 |
Среднее время достижения ЦП: 54,5 ч (энергия), 59,5 ч (белок) ЦП < 80 %: n = 48 (энергия), n = 78 (белок) ЦП 80–110 %: n = 150 (энергия), n = 111 (белок) Медиана ЦП от должного: 89,8 % (энергия), 84,7 % (белок) |
Достоверной связи между адекватностью НП и смертностью не выявлено. Осложнения со стороны ЖКТ n = 42 (22,8 %). 52 % нуждались в прокинетиках. О случаях острой мезентериальной ишемии не сообщалось |
| Park et al. [43] | Ретроспективное, одноцентровое | ВА-ЭКМО: 41 пациент (посткардиотомный шок, ОКС, экстракорпоральная сердечно-легочная реанимация) | Медиана 1-го дня ЭП — 9-е сутки от начала ЭКМО. ПП рассматривалось на 3–5-е сутки непереносимости ЭП | ЦП на 1-й неделе: 33,9 % (энергия), 0,24 г/кг/сут (белок) ЦП на 2-й неделе: 77,7 % (энергия), 0,74 г/кг/сут (белок) Медиана продолжительности достижения 70 % целевого уровня — 8 сут |
Энергия, получаемая ежедневно в течение второй недели ЭКМО, была связана с 90-дневной смертностью (ОР 0,82; 95 % ДИ 0,69–0,97). Мезентериальная ишемия или перфорация ЖКТ через 2 нед. (n = 4), из которых 3 начали ЭП в течение 14 сут после подключения ВА-ЭКМО |
| Lu et al. [44] | Ретроспективное, одноцентровое | 102 пациента с сердечной и дыхательной недостаточностью ВА: n = 77 (75,5 %) ВВ: n = 25 (24,5 %) |
ЭП, n = 102. Начало: выжившие 1,6 ± 2 сут; невыжившие 0,8 ± 1,5 сут. 78 % выживших переносили полимерную формулу ЭП, 22 % назначили олиго- и мономерные смеси. ПП — нет данных |
Достижение ЦП в среднем на 7-е сутки от начала ЭКМО Выжившие: потребление 97 % (энергия) и 113 % (белок) от ЦП Невыжившие: 88 % (энергия) и 121 % (белок) от ЦП (p = 0,037) |
Переносимость ЭП — 80 %. Общая смертность — 59,8 %. Летальность у пациентов, получивших < 80 % ЦП по сравнению с теми, кто получил ≥ 80 % ЦП — 66 % vs 39 % (p = 0,01). Об осложнениях со стороны ЖКТ нет данных |
| Ohbe et al. [45] | Ретроспективное, многоцентровое | 1769 пациентов на ВА-ЭКМО с кардиогенным или обструктивным шоком | Раннее ЭП (< 48 ч): n = 220 (12,4 %) Отсроченное ЭП (> 48 ч): n = 1549 (87,6 %) |
Нет данных | Раннее ЭП было связано с более низкой госпитальной смертностью (скорректированное ОР 0,78; 95 % ДИ 0,62–0,98) и более низкой 28-дневной летальностью (скорректированное ОР 0,74; 95 % ДИ 0,56–0,97). Острая мезентериальная ишемия: ни одного в группе раннего ЭП и 9 (1 %) в группе позднего ЭП |
| Ridley et al. [46] | Проспективное, многоцентровое | 107 пациентов, ВА: n = 65 (60,7 %) ВВ: n = 42 (39,3 %) |
Среднее время начала НП — 13 ч Длительность НП всех пациентов 1602: ЭП — 1342 (1207 —желудочный зонд, 135 — постпилорический доступ) сут (84 %), ПП — 111 сут (7 %), пероральное питание — 155 сут (10 %), отсутствие питания 83 сут (5 %), ЭП + ПП — 52 сут (3 %) |
Медиана доставки энергии — 20 ккал/кг/сут (82 % от целевого) и белка 0,9 г/кг/сут (76 % от целевого) Пропофол вводили в течение 495 сут исследования (в среднем 266 ккал/сут) Более 80 % пациентов получали ЭП, содержащее 1,25–2 ккал/мл |
ЭП прерывалось (диагностические процедуры, высокий остаточный объем желудка) суммарно 629 дней (53 %): средняя продолжительность 8 ч на эпизод. Высокий остаточный объем желудка: 22 %. Медиана общего суточного остаточного объема: 80 мл. Прокинетики назначены 71 пациенту (66 %) в течение 554 сут исследования. Слабительные средства вводились в течение 1009 сут. ПП назначалось по причине «непереносимости ЭП» (остаточный объем желудка), ЖКК. ЖКК: 27 (24 %). Острая мезентериальная ишемия: 5 (4,5 %) |
| Ferrie et al. [47] | Ретроспективное, одноцентровое | 86 пациентов ВА: 31 (36 %) ВВ: 55 (64 %) |
Среднее время начала ЭП: 13,1 ч n = 20 — успешно применены прокинетики. ПП (полное/дополнительное) n = 18 (20,9 %). n = 10 переведены на ЭП в течение 4 сут |
Достижение ЦП на 2,6 сут. ЦП в первые 14 сут: энергия — 79,7 %, белок — 73 % Пропофол обеспечивал более 400 ккал/сут у 32 пациентов. Эти пациенты в среднем получали на 11 % меньше белка |
Летальность в группе с ЦП < 80 % была выше: 56 % vs 15 % (p = 0,017). Также высокий положительный баланс ассоциировался с более высокой смертностью (p = 0,002) и более низкими ЦП (p = 0,007). Непереносимость ЭП в первые 5 сут n = 33(38 %). О случаях острой мезентериальной ишемии не сообщалось |
| Umezawa Makikado et al. [48] | Проспективное, одноцентровое | 7 пациентов на ВА-ЭКМО | ЭП, n = 7 ПП, n = 0 Начало ЭП в течение 48 ч от начала ЭКМО во всех случаях (из них n = 2 в течение 24 ч) |
В первые 7 сут достигнуто > 70 % ЦП калорий во всех случаях. ЦП белка — нет данных | Летальность 14 % (n = 1). Нежелательные явления со стороны ЖКТ не были выявлены. Расчетный энергетический баланс к концу 1-й недели составил в среднем −246 ккал/сут. Средний кумулятивный дефицит к концу исследования был равен −3265 ккал (при среднем продолжительности ЭКМО 12 сут) |
| Pelekhaty et al. [49] | Ретроспективное, одноцентровое | 29 пациентов на ВВ-ЭКМО | ЭП n = 29, ПП n = 0 Начало НП — нет данных |
Пациенты с ожирением получили 97,3 % ЦП энергии и 83 % белка; без ожирения — 97,9 % энергии и 90,8 % белка | Анализ суточной экскреции азота с мочой для оценки азотистого баланса у пациентов с ожирением (−0,8 г/сут) и без ожирения (−7,89 г/сут). Обе группы получали ~2 г/кг/сут белка |
| De Waele et al. [50] | Ретроспективное, одноцентровое | 7 пациентов ВА: n = 4 ВВ: n = 3 |
Нет данных | Нет данных | Двухуровневая (ИВЛ и ЭКМО) оценка основного обмена (REE) с помощью непрямой калориметрии. Медиана расхода энергии: 21 ккал/кг/сут (12–33 ккал/кг/сут) |
| Wollersheim et al. [51] | Ретроспективное, одноцентровое | 20 пациентов на ВВ-ЭКМО с ОРДС | Нет данных | Нет данных | Оценка потребления O2 (VO2) и продукции CO2 (VCO2) с помощью метаболографа на ИВЛ и анализа газов крови до и после оксигенатора ЭКМО. Медиана расхода энергии составила 2013 ккал/сут (медиана массы тела −78 кг). При сравнении с различными формулами по расчету REE в 48 % случаев выявлена неприемлемая разница (> 500 ккал). При сравнении с группой без ЭКМО измеренные значения не выявили достоверной разницы, как и 8 пациентов после удаления ЭКМО |
| Lindberg et al. [31] | Эксперимент ex vivo | 6 контуров ЭКМО, заполненных донорской кровью с гепарином | − | − | Не было выявлено достоверных различий концентрации макронутриентов, микронутриентов, различных витаминов в контуре ЭКМО с контрольными образцами |
| 95 % ДИ — 95%-й доверительный интервал; REE — реальная энергопотребность; ВА — вено-артериальный; ВВ — вено-венозный; ЖКК — желудочно-кишечное кровотечение; ЖКТ — желудочно-кишечный тракт; ИВЛ — искусственная вентиляция легких; НП — нутритивная поддержка; ОКС — острый коронарный синдром; ОР — отношение рисков; ОРДС — острый респираторный дистресс-синдром; ОШ — отношение шансов; ПП — парентеральное питание; ХСН — хроническая сердечная недостаточность; ЦП — целевой показатель; ЭКМО — экстракорпоральная мембранная оксигенация; ЭП — энтеральное питание. | |||||
Нами было найдено 10 обсервационных исследований, в которых сообщалось о сроках начала НП у пациентов на ЭКМО [38–40, 42–48]. В одном исследовании [39] ПП назначалось с 1-го дня, а ЭП начиналось со 2-го дня. В остальных случаях ЭП было первой линией НП. При этом раннее ЭП (в первые 24–48 ч) назначалось в 8 исследованиях [38, 39, 42, 44–48], если не было противопоказаний, а в трех из них медиана времени начала НП составила около 13 ч [42, 44, 46].
В трех исследованиях сравниваются раннее (< 48 ч) и отсроченное (> 48 ч) начало ЭП у пациентов на ЭКМО [38, 39, 45]. Gutierrez et al. [38] в ретроспективном исследовании, куда были включены пациенты с рефрактерной внегоспитальной остановкой сердечной деятельности, которым проводилась имплантация ВА-ЭКМО, анализировали связь выживаемости с благоприятным неврологическим исходом с ранним или отсроченным началом ЭП. В скорректированном анализе, включающем пациентов, получавших НП, отсроченное ЭП было связано с повышенными шансами выживаемости с благоприятным неврологическим исходом (29 % vs 54 %, 95% ДИ 1,04 ± 7,25, р = 0,04). Оценивали также частоту развития кишечной непроходимости, желудочно-кишечных кровотечений (ЖКК), ишемии кишечника, аспирационную пневмонию и необходимость трахеостомии как вторичных исходов, где не было выявлено достоверных различий между группами раннего и отсроченного ЭП. Похожие результаты получили Lu et al. [44]: показано более отсроченное время начала ЭП у выживших пациентов по сравнению с умершими (1,6 сут vs 0,8 сут, p < 0,05), вместе с тем обе группы получили ЭП до 48 ч. Однако на момент начала ЭКМО группа умерших пациентов имела более высокую степень тяжести по APACHE II (средний балл: 26 vs 22, p < 0,05), что может объяснить более высокую летальность. Напротив, в двух исследованиях [39, 45] достоверно показано преимущество раннего начала ЭП. Так, Kim et al. [39] в ретроспективном исследовании с 60 пациентами (ВА-ЭКМО: n = 44; ВВ-ЭКМО: n = 16) продемонстрировали связь между ранним ЭП и госпитальной летальностью. Отлучение от ЭКМО (20 vs 13; p = 0,042) и выживаемость до выписки (19 vs 11; p = 0,038) чаще встречались у участников, которые получили раннее ЭП.
Результаты регрессионного анализа пропорциональных рисков Кокса также выявили взаимосвязь раннего ЭП со снижением внутрибольничной смертности. Следует отметить, что тяжесть состояния по шкале APACHE II в группе с ранним ЭП была значительно ниже, чем в группе с отсроченным ЭП (29,3 ± 7,6 vs 35,6 ± 7,7; р = 0,004). Также важным моментом является отсутствие разделения ВА-ЭКМО и ВВ-ЭКМО, так как такие пациенты могут различаться с точки зрения метаболических последствий основных заболеваний и изменением пульсирующего кровотока в случае с ВА-ЭКМО, который потенциально может уменьшить поток крови в микроциркуляторном русле и впоследствии снизить перфузию органов-мишеней. В ретроспективном исследовании Ohbe et al. [45], куда были включены 1769 пациентов на ВА-ЭКМО с кардиогенным или обструктивным шоком, сообщается, что начало ЭП в течение 48 ч после имплантации системы ЭКМО было связано с более низкими госпитальной (ОР 0,78; 95 % ДИ 0,62–0,98, p = 0,032) и 28-дневной смертностью (ОР 0,74; 95 % ДИ 0,56–0,97, p = 0,031). В этом исследовании только 12 % пациентов получили раннее ЭП, что могло отразиться на результатах.
Противоречивые результаты приведенных выше исследований можно объяснить следующими аспектами, которые в той или иной степени влияют на исход: отсутствие рандомизации, особенности характера и тяжести основного заболевания, приведшего к использованию ЭКМО, исходный метаболический статус пациентов к моменту поступления в ОРИТ.
Международный опрос центров ЭКМО для взрослых [21] показал, что 22 из 36 (61 %) респондентов начинали НП в течение 24 ч после начала ЭКМО (ВВ), 12 (33 %) — в течение 48 ч, 1(3 %) — в течение 72 ч, что в общем соответствует текущим рекомендациям [13]. В свою очередь, данные о практике НП пациентов на ВА-ЭКМО не опубликованы. Влияние времени начала НП на смертность и дальнейшие исходы у пациентов с ЭКМО требует подтверждения в более крупных проспективных РКИ.
Кроме одного [43], в остальных рассматриваемых исследованиях [38–42, 44–49] наиболее распространенным методом НП является ЭП через назогастральный зонд. В нескольких исследованиях [38, 41, 42, 46] имеются указания о применении назоинтестинального зонда, тогда как остальные авторы либо указывают, что такую методику не применяли [47, 48], либо вовсе не упоминают об энтеральном доступе. Отказ от процедуры, когда интестинальный зонд заводится за связку Трейца под эндоскопическим контролем, объясняется инвазивностью манипуляции и, соответственно, увеличением риска кровотечения у пациентов на ЭКМО из-за повышенной кровоточивости тканей вследствие гепаринизации. Однако имеются данные об альтернативном, менее инвазивном и более безопасном методе установки зонда у пациентов на ИВЛ с помощью электромагнитного устройства [52, 42]. Наиболее детализировано об использовании постпилорического доступа указывают Ridley et al. [46] и MacGowan et al. [42]. В проспективном многоцентровом исследовании [46], куда вошли 107 пациентов (60 % ВА-ЭКМО, 40 % ВВ-ЭКМО), назоинтестинальный зонд использовался 135 сут исследования (10 % от времени использования ЭП). Во втором исследовании [42] постпилорическое питание применяли у 35 % пациентов. Наиболее частой причиной применения данного метода является высокий остаточный объем желудка, когда прокинетическая терапия не приводила к значимой эвакуации содержимого желудка.
Об использовании прокинетиков без значимых побочных эффектов сообщает ряд авторов [40, 42, 43, 46, 47]. Частота применения в некоторых исследованиях превышает 50 % [42, 46]. Такой комплексный подход может способствовать меньшему добавлению к терапии ПП, по поводу применения которого ведутся споры у больных на ЭКМО из-за риска инфильтрации липидов в оксигенатор, что может потенциально привести к его отказу [53]. Lindberg et al. провели эксперимент ex vivo с целью выявления любого значительного снижения циркулирующих концентраций макро- или микронутриентов. Не было обнаружено никаких изменений в концентрации питательных веществ в контуре ЭКМО ex vivo по сравнению с контрольными образцами. Это, в свою очередь, указывает на то, что компоненты ПП не адсорбируются мембраной или контуром ЭКМО [31]. Неопределенность в отношении дисфункции оксигенаторов на фоне использования внутривенных липидов связано с микропористой структурой мембраны в более ранних образцах, что, по-видимому, не является выраженной проблемой для новых типов диффузных (полиметилпентеновых) мембранных оксигенаторов [47].
Что касается ПП, пятеро авторов [38, 44, 45, 48, 49] не использовали или не привели данные о его применении. Kim et al. [39] указывают, что обычной практикой было назначение ПП с 1-го дня имплантации ЭКМО. ЭП начиналось при стабильном уровне среднего АД ≥ 65 мм рт. ст., в том числе с помощью механической и медикаментозной поддержки, и без повышения уровня лактата крови. По мере увеличения объема ЭП постепенно уменьшалось количество ПП. Park et al. [43] в своем исследовании сообщают, что после достижения гемодинамической стабильности предпочтение отдавалось ЭП. Но за 14 сут ЭКМО больше 50 % энергии пациенты получали парентерально. В исследовании Ridley et al. [46] полное ПП было использовано в течение 111 сут (7 %) и 52 сут (3 %) — как дополнение к ЭП. Ferrie et al. [47] указывают, что ПП получили 18 (20,9 %) пациентов — в виде как полного, так и дополнительного питания. В течение 4 сут на ЭП успешно переведены 10 пациентов. В остальных случаях [40–42] количество пациентов, получивших ПП, не превышало 6 %. Следует отметить, что только 4 автора [41, 42, 46, 47] учитывают вклад пропофола в общую доставку липидов и энергии в целом. У некоторых пациентов седация пропофолом обеспечивала до 400 ккал/сутки, что требовало изменения схемы НП. Более того, соевое масло, содержащееся в эмульсии пропофола, не является выбором первой линии в качестве источника липидов при критических состояниях [54]. В случае, когда нет альтернатив по другим вариантам седации, пациентов с ПП можно перевести на двухкомпонентные (аминокислоты + глюкоза) растворы для ПП, что является еще одной из стратегий НП.
В международном опросе центров ЭКМО [21], который упоминался ранее, показано, что наиболее распространено определение основных потребностей пациента из расчета 20–25 ккал/кг/сут и 1,5 г/кг/сут белка. 6 исследований [38–42, 48] из настоящего обзора также рассчитывали энергопотребность от 20 до 30 ккал/кг/сут, 4 исследования использовали расчетные уравнения (Harris—Benedict [43, 44], Schofield [46, 47]) с использованием дополнительного коэффициента фактора стресса. Что касается потребности в белках, расчет целевого уровня варьировал от 1,2 до 1,5, редко — до 2 г/кг/сут. MacGowan et al. [42] сообщают об увеличении целевых показателей у пациентов, получающих заместительную почечную терапию. Pelekhaty et al. [49] определяли потребность в белке в зависимости от индекса массы тела (ИМТ): 1,5–2 г/кг/сут фактической массы тела у пациентов без ожирения, > 2 г/кг/сут и > 2,5 г/кг/сут для пациентов с ИМТ 30–39,9 кг/м2 и < 40 кг/м2 соответственно при расчете на идеальную массу тела.
Энергетические потребности во время ЭКМО остаются неясными. Следует отметить, что в приведенных в обзоре исследованиях, где проводится анализ НП, не использовался метод непрямой калориметрии, который считается «золотым стандартом» для измерения расхода энергии у тяжелых пациентов [12, 13]. Отчасти это связано с наличием двух точек газообмена, что делает использование непрямой калориметрии технически сложной задачей. Тем не менее в проспективном обсервационном исследовании [55] было показано несоответствие энергопотребности, рассчитанной прогностическими формулами, в частности Harris—Benedict, данным, полученным с помощью непрямой калориметрии у пациентов в послеоперационном периоде в кардиохирургии, как с использованием искусственного кровообращения, так и при операциях на работающем сердце.
В обзоре приводится два обсервационных исследования, описывающих альтернативные методы измерения расхода энергии с помощью непрямой калориметрии у пациентов на ЭКМО. De Waele et al. [50] представили метод, при котором измерение сначала производится в нативном легком через аппарат ИВЛ, затем метаболограф подключают к оксигенатору. Полученные результаты складываются и подставляются в уравнение Weir для расчета расхода энергии. Авторы указывают на использование адаптера для подключения метаболографа к контуру ЭКМО, который был изготовлен специально для данного исследования, что еще больше усложняет применение данной процедуры. Тем не менее полученные результаты подтверждают необходимость индивидуального подхода к каждому пациенту. Расход энергии варьировал у 7 включенных в исследование пациентов от 12 до 33 ккал/кг. При этом самые высокие показатели зарегистрированы у одного пациента на 7-е сутки поддержки ЭКМО, тогда как у остальных измерение производилось на 2–3-и сутки от начала имплантации ЭКМО. Эти данные указывают, что расход энергии может меняться в зависимости от продолжительности ЭКМО, скорости потока крови и газа через оксигенатор.
С другой стороны, Wollersheim et al. [51] сообщили, что рекомендуемое значение 25 ккал/кг/сутки значительно меньше полученных показателей и в 48 % случаев разница > 500 ккал. В данном случае использовали другой метод определения основного обмена. По-прежнему использовался метаболограф, подключенный к контуру ИВЛ, но вместо подключения к оксигенатору производился забор крови до и после оксигенатора, далее измеряли содержание кислорода и углекислого газа [56]. В дальнейшем расчет производился также с использованием уравнения Weir. Отличие полученных результатов можно объяснить как разными методами, которые авторы использовали, так и различными когортами пациентов: Wollersheim et al. [51] включали только пациентов на ВВ-ЭКМО, а De Waele et al. [50] — как с ВВ-ЭКМО, так и на ВА-ЭКМО. Оба протокола дают возможность измерить энергопотребность у пациентов, получающих ЭКМО, но требуют проспективной валидации, особенно в разные моменты времени во время выполнения ЭКМО, поскольку расход энергии не статичен и на измерение могут влиять разные скорости кровотока. Тем не менее эти методы, безусловно, позволят провести дальнейшие исследования оптимальных энергетических целей для пациентов, получающих ВА-ЭКМО и ВВ-ЭКМО.
Предполагаемая польза от обеспечения достаточным количеством белка заключается в снижении атрофии скелетных мышц, что может привести к улучшению физической функции после пребывания в ОРИТ. В случае с пациентами на ЭКМО это представляется еще более важным, учитывая результаты исследования Hayes et al. [57], где с помощью УЗИ оценивали степень атрофии мышц. Площадь поперечного сечения прямой мышцы бедра пациентов на ВВ-ЭКМО и ВА-ЭКМО уменьшилась на 19 % на 10-е сутки и на 30 % на 20-е сутки. Более того, меньший размер мышц был связан с более низкой оценкой силы и подвижности.
Найдено одно проспективное одноцентровое исследование [49], направленное на изучение оптимального потребления белка у пациентов на ЭКМО. Pelekhaty et al. изучали азотистый баланс у взрослых пациентов на ВВ-ЭКМО с ожирением и без него. 29 пациентов получили около 2 г/кг/сут фактической (пациенты без ожирения) или идеальной массы тела (с ожирением). У пациентов с ожирением выявлен более выраженный отрицательный азотистый баланс (−7,89 г/сут [−12,57 ... −3,3]) в сравнении с пациентами без ожирения (−0,8 г/сут [−5,71 ... 3,02]). Хотя измерение потерь азота у пациентов в критическом состоянии имеет ограничения из-за повышенного количества неощутимых потерь, результаты данного исследования свидетельствуют о более высоких потребностях в белке этой когорты пациентов. Это может быть связано с тяжелым течением заболевания и длительным катаболизмом. Отсутствуют исследования для получения точных прогностических уравнений для определения потребностей в питании у пациентов с ЭКМО.
В отсутствие руководств по НП, предназначенных для пациентов на ЭКМО, кажется разумным следовать имеющимся в настоящее время клиническим рекомендациям по НП для пациентов в критическом состоянии, где при отсутствии возможности непрямой калориметрии рекомендуется использование формул, основанных на фактической или идеальной массе тела [12, 13].
Как показывают обсервационные исследования из данного обзора, достижение адекватного питания у пациентов на ЭКМО в критическом состоянии является сложной, но достижимой задачей. Два исследования [40, 45] не предоставили данных о достижении целевых показателей НП. В проспективном одноцентровом исследовании Hunt et al. [41] сообщается, что пациенты в среднем получили 29,4 и 33,5 % от целевых показателей по калорийности и белку соответственно. К 20-м суткам терапии на ЭКМО было достигнуто 60 % энергетических целей и 100 % по белку. При этом в сравниваемой группе без ЭКМО достижение целевых показателей достоверно выше как по энергии, так и по белку. Это было связано с более частым прекращением ЭП для проведения диагностических или терапевтических процедур в когорте пациентов на ЭКМО (60 % пациентов). Park et al. [43] сообщают, что в течение первой недели в среднем достигнуто 33,9 % целевых калорий и 0,24 г/кг/сут белка, а в течение второй недели — 77,7 % энергии и 0,74 г/кг/сут белка.
В остальных исследованиях, где представлены данные об адекватности НП, было достигнуто в среднем 70–80 % от целевых показателей. В исследовании Kim et al. [39] на 7-е сутки в среднем доставлено 99 % калорий и 110 % белков от должного. При этом 37 % пациентов получили недостаточное количество питания, а 22 % — избыточное. Также MacGowan et al. [42] сообщают о достижении 90 и 85 % целевых показателей по энергии и белку соответственно, но отмечают, что в 25 % случаев пациенты получали НП меньше 80 % от должного. 24 % пациентов получили недостаточное количество энергии, 13 % — избыточное, 27 % доставлено меньше белка от назначенного, а в 23 % случаев — избыточное. Ridley et al. [46] в своем проспективном многоцентровом исследовании сообщают, что пациенты получили в среднем 20 ккал/кг/сут энергии и 0,9 г/кг/сут белка. Таким образом, средний дефицит энергии и белка составил −416 ккал/сут и −18 г/сут соответственно, а за весь период исследования это кумулятивно составило −5924 ккал (IQR, −10 581 ... −3619) и −325 г белка (IQR, −525 ... −188).
Имеется недостаточно данных, анализирующих связь целевых и доставленных калорий с клиническим исходом у взрослых пациентов на ЭКМО. Park et al. [43] показали в своем ретроспективном исследовании снижение 90-дневной летальности с достижением среднесуточных целевых показателей питания в течение 2-й недели терапии на ЭКМО. В работах Lu et al. [44] и Ferrie et al. [47] продемонстрировано снижение госпитальной смертности при получении пациентами > 80 % целевых показателей НП. В дополнение Lu et al. [44] отмечают, что выжившие пациенты получили до 97 % от объема назначенных макронутриентов. В других исследованиях, где представлены данные об адекватности НП, достоверных связей между летальностью и целевыми показателями питания не выявлено или такая корреляция не анализировалась.
Время достижения среднесуточных адекватных целевых показателей варьировало от 2,5 до 8 сут. Наиболее частыми причинами прерывания НП или ее неадекватной доставки являлись высокая частота исследований с перерывом кормления, непереносимость ЭП, проявляющаяся регургитацией или высоким остаточным объемом желудка, гемодинамическая нестабильность.
В 8 исследованиях описана частота встречаемости желудочно-кишечных осложнений, связанных с ЭП. Три группы авторов [38, 39, 42] отмечают, что частота прерывания ЭП превышала 40 %. Больше трети случаев паузы НП в исследовании MacGowan et al. [42] связаны с различными диагностическими процедурами и оперативными вмешательствами, а Gutierrez et al. [38] сообщают о 23,3 % хирургических вмешательств. В ряде исследований [38, 41, 43, 45, 46] также сообщают об осложнениях в виде ишемии кишечника, ЖКК, перфораций кишечника, частота которых не превышает 5 %. В исследовании Ridley et al. [46] суммарно полное ПП проводили 111 сут, из которых 27 (24 %) сут — по причине ЖКК. Выявлена одна работа [40], в которой острая мезентериальная ишемия у пациентов на ВА-ЭКМО верифицирована в 9 % случаев. Авторы отмечают, что острая мезентериальная ишемия отрицательно связана с ранним началом ЭП (ОШ 0,15, 95 % ДИ 0,03–0,69, p = 0,02). Hunt et al. [41] обращают внимание, что желудочно-кишечные осложнения не были связаны с процедурой ЭКМО, применением катехоламинов, количеством потребляемых калорий и белков, количеством часов кормления через назогастральный зонд при сравнении с пациентами без ЭКМО. При этом отмечается, что вероятность желудочно-кишечных осложнений увеличивают применение элементарных формул для ЭП и смесей с низким содержанием жира.
Задержка эвакуации из желудка часто упоминается как осложнение, связанное с ЭП [39, 42, 43, 46] у пациентов на ЭКМО. Высокий остаточный объем желудка встречается до 5,5 % случаев. При этом критерии высокого остаточного объема варьируют в диапазоне 150–300 мл. В настоящее время неизвестно, каков идеальный порог остаточного объема желудка и следует ли его измерять. Данные некоторых исследований [58] и руководства по клиническому питанию [12, 13] подтверждают, что принятие более высокого целевого значения остаточного объема желудка или даже отсутствие его измерения не имеет значительных неблагоприятных последствий для пациентов ОРИТ общего профиля. Однако неясно, применимо ли это к тяжелым пациентам на ЭКМО, учитывая серьезные нарушения гемодинамики, которые часто встречаются у них. Также в настоящем обзоре описано применение постпилорического доступа как одного из способов доставки ЭП при высоком остаточном объеме желудка, когда назначение прокинетиков не имеет положительного эффекта.
Двумя группами авторов [39, 43] указана нестабильность гемодинамики как одна из причин прекращения НП, частота которой достигает 11 %. Высокий вазоактивный инотропный индекс, как один из признаков нестабильности гемодинамики, также может быть причиной остановки питания пациентов. У больных в критическом состоянии, получающих высокие дозы адренергических препаратов, страдает перфузия органов, в частности ЖКТ [32]. Тем не менее в европейской рекомендации [28] на основании мнений экспертов сказано о безопасности раннего ЭП. При этом в исследовании [26], которое сравнивало ЭП и ПП у пациентов в критическом состоянии, получающих вазопрессорную поддержку, не было выявлено различий в 28-дневной смертности. Однако в группе ЭП чаще регистрировались нежелательные явления со стороны ЖКТ, в том числе ишемия кишечника. Эти потенциальные последствия требуют дальнейших исследований в особенно сложной когорте пациентов на ЭКМО.
Не обнаружено метаанализов и проспективных рандомизированных контролируемых исследований, изучающих оптимальный путь, сроки, состав формул для ЭП и ПП или адекватность нутритивной поддержки у пациентов, получающих ЭКМО. Поскольку пациенты с ВА-ЭКМО и ВВ-ЭКМО могут различаться с точки зрения их метаболических особенностей и потребностей, методологически более правильно анализировать результаты исследований в субпопуляциях пациентов с ВА-ЭКМО и ВВ-ЭКМО раздельно.
Проанализированные в обзоре данные демонстрируют сложности и нерешенные проблемы с определением реальной потребности пациентов на ЭКМО в энергии и белке и, соответственно, определенные затруднения в осуществлении целевой НП.
На основании имеющихся в настоящее время данных можно утверждать, что раннее ЭП является безопасным для этой группы пациентов. Следует прилагать определенные усилия для достижения адекватного обеспечения пациента на ЭКМО в объеме более 80 % от расчетных целевых показателей.
Сочетание ЭП и вспомогательного ПП можно рассматривать в качестве дополнительной стратегии при проведении НП, учитывая, что в представленных работах регистрировались трудности с доставкой целевых объемов ЭП, в том числе частые эпизоды прерывания ЭП. Также возможно применение постпилорического доступа при высоком остаточном объеме желудка.
Имеется ограниченное количество положений, отражающих особенности проведения НП у пациентов на ЭКМО, с достаточной доказательной базой.
Необходимы дальнейшие исследования, изучающие особенности белкового и энергетического обмена, методы определения потребности пациентов в макро- и микронутриентов, влияние различных методов НП на показатели клинического исхода у пациентов на ЭКМО.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Информация о финансировании. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.