Современная кардиохирургия и кардиоанестезиология достигла настолько высокого уровня развития, что при любом оперативном вмешательстве должен рассматриваться вопрос не только сохранения жизни и здоровья пациента, но и качества его жизни. Когнитивные способности ребенка напрямую относятся к данной тенденции, и необходимо принимать все усилия по их сохранению на дооперационном уровне, в том числе и у пациентов при коррекции врожденных пороков сердца (ВПС). Однако, по результатам многочисленных исследований, кардиохирургические операции у детей сопровождаются высокой частотой послеоперационных когнитивных расстройств. Так, послеоперационный делирий (ПОД) встречается в 40–57 % случаев [1–3]. При этом ПОД в большой степени пролонгирует длительность пребывания пациента в отделении реанимации за счет повышенной потребности в искусственной вентиляции легких, седативных препаратах и других манипуляциях [1, 4]. Но перечисленными эффектами не ограничивается негативное воздействие ПОД, так как доказано его долгосрочное влияние и способность к снижению когнитивных способностей ребенка на многие месяцы после операции [5]. Аналогичные долговременные исходы могут быть следствием не только ПОД, но и любого церебрального повреждения в интраоперационном периоде [6]. Это влечет за собой трудности в использовании как уже освоенных ребенком навыков, так и трудности с его обучением новым знаниям, что особенно актуально для детей первых лет жизни [7, 8].
Если говорить о причинах высокой частоты когнитивных нарушений при коррекции ВПС у детей, то стоит отметить, что кардиохирургические операции обладают наиболее широким спектром факторов патологического влияния на головной мозг и соответствующего церебрального повреждения. Влияние анестетиков, эпизоды гипоксии и нестабильной гемодинамики, использование симпатомиметических препаратов и длительность операции — все это характерно для вмешательств по коррекции ВПС, но не полностью обусловливает всю тяжесть их влияния на организм больного [9–11]. Отличительной чертой кардиохирургических операций и главным патологическим фактором является искусственное кровообращение (ИК), в условиях которого проходит большинство вмешательств. Его эффектами, опасными в плане развития церебрального повреждения, являются микроэмболия, ламинарный характер тока крови, возможные эпизоды гипотермии и циркуляторный арест [12–14]. Кроме того, при любой процедуре ИК происходит контакт крови пациента с поверхностью контура аппарата ИК, что в сочетании с вышеперечисленными факторами вызывает инициацию и усиление системного воспалительного ответа [14]. При этом обоснованным и доказанным является механизм участия СВО в церебральном повреждении посредством поддержания нейровоспаления [15, 16] с соответствующими клиническими исходами в виде послеоперационных когнитивных нарушений.
В данном аспекте у детей при коррекции ВПС интерес представляют любые методики по ограничению СВО. На такую роль может претендовать ограничение использования компонентов донорской крови в интра- и послеоперационном периоде. Для пациентов детского возраста вопрос трансфузии стоит особенно остро, так как ее применение в кардиохирургии зачастую носит превентивный характер, позволяя избежать излишней гемодиллюции [17] из-за несоответствия объема циркулирующей крови ребенка и объема первичного заполнения аппарата ИК. При этом компоненты донорской крови, по данным исследований, сами по себе являются источником СВО [18]. Тем не менее, несмотря на сложность проблемы, применение компонентов донорской крови в составе ИК никак не регламентируется и остается на усмотрение анестезиолога. По этой причине актуальным является исследование влияния трансфузии на церебральное повреждение и выраженность СВО у пациентов детского возраста, а также выявление связи между ними.
Цель исследования — изучить влияние трансфузии на развитие церебрального повреждения при оперативной коррекции врожденных пороков сердца у детей.
Проспективное исследование проведено на базе ФГБНУ «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний», Кемерово. Критерии включения пациентов в исследование были следующие: планируемое хирургическое вмешательство по коррекции врожденного порока сердца (дефекта межпредсердной или межжелудочковой перегородки) в условиях ИК, наличие информированного согласия об участии в исследовании, подписанного законным представителем ребенка, возраст ребенка от 6 мес.; масса тела менее 25 кг. Критерии исключения: отсутствие информированного согласия пациента и родителей на участие в исследовании, экстренные и срочные оперативные вмешательства; наличие клинически выраженной анемии, гипотермический режим ИК, эпизоды десатурации в периоперационном периоде; наличие иных ВПС кроме дефекта межпредсердной или межжелудочковой перегородки, а также их сочетание, заболевания центральной нервной системы в анамнезе, установленный электрокардиостимулятор, нестабильность гемодинамики, требующая предоперационной фармакологической и/или механической поддержки, любые эпизоды нарушения мозгового кровообращения в анамнезе или периоперационном периоде, наличие у пациента тяжелых сопутствующих заболеваний, ухудшающих психический и соматический статус, острая инфекция и обострение хронической инфекции в периоперационном периоде, сопутствующие аутоиммунные заболевания, наличие злокачественных новообразований, хирургические осложнения в послеоперационном периоде.
После учета критериев включения и исключения в исследование было включено 78 пациентов в возрасте от 1 до 78 мес. (13 [9-23] мес.), с массой тела от 3,3 до 21,5 кг (8,7 [6,9-11,0] кг).
Анализ объема выборки был проведен по формуле:
\( n =\frac{t^2 \times P \times Q}{\Delta^2} \),
где t — критическое значение критерия Стьюдента при соответствующем уровне значимости, в данном исследовании — 0,05; ∆ — предельно допустимая ошибка (%); P — доля случаев, в которых встречается изучаемый признак (%); Q — доля случаев, в которых не встречается изучаемый признак (10 − P).
Согласно расчету, мощность выборки должна была составить 196 пациентов, по этой причине данное исследование является пилотным. Исследование было одобрено локальным этическим комитетом НИИ КПССЗ (протокол № 20 от 20.11.2018). Все пациенты по факту интраоперационного использования эритроцитсодержащих компонентов донорской крови были отнесены в одну из двух групп: 1-я группа без применения трансфузии (n = 30) и 2-я группа — с ее применением (n = 48).
Всем детям анестезиологическое обеспечение проводили по одинаковой схеме. После поступления пациента в операционную под местной анестезией проводили катетеризацию периферической вены. Индукцию анестезии осуществляли посредством внутривенного введения пропофола в дозе 2–3 мг/кг и фентанила 5 мкг/кг. С целью миорелаксации использовали пипекурония бромид в дозе 0,1 мг/кг. Далее осуществляли интубацию трахеи, катетеризацию центральной вены, лучевой артерии и мочевого пузыря. Непосредственно перед началом оперативного вмешательства применяли болюсное введение фентанила 5 мкг/кг. Поддерживающая анестезия включала в себя постоянную инфузию пропофола в дозе 2–4 мг/кг/час и фентанила 5 мкг/кг/час, а также ингаляцию севофлурана 1,0–1,5 минимальной альвеолярной концентрации. Искусственную вентиляцию легких проводили аппаратом General Electric Datex-Ohmeda Avans по полузакрытому контуру в режиме SIMV (Synchronized intermittent mechanical ventilation) с параметрами: фракция кислорода во вдыхаемой смеси — 0,25–0,3; дыхательный объем — 6–8 мл/кг; пиковое давление вдоха — 10–15 см вод. ст.; положительное давление в конце выдоха — 5–8 см вод. ст; соотношение вдоха и выдоха — 1:2.
Оценка соответствия доставки и потребления кислорода тканями проводилась с помощью сатурации венозной крови (SvO2), уровня лактата крови и показателей церебральной оксиметрии (Near-infrared spectroscopy — NIRS), кроме того, оценивались данные пульсоксиметрии (SpO2), а также уровень гемоглобина и гематокрита. Кроме того, оценивались газовый состав крови и ее кислотно-основное состояние.
Для ИК использовали аппарат Maquet HL 20. В качестве оксигенатора применяли мембранные оксигенаторы: Terumo Baby Fx-05, Sorin Dideco D101, Maquet QUADROX-i Pediatric. Выбор оксигенатора зависел от расчетной объемной скорости перфузии на ИК. Объем первичного заполнения составлял 300–500 мл. В объем первичного заполнения всем пациентам добавлялся маннит, натрия бикарбонат и гепарин в расчетных дозировках. В роли коллоидного раствора 10 % раствор альбумина из расчета 1 г/килограмм массы тела. Кристаллоидным раствором был полиионный раствор (Стерофундин). В качестве эритроцитсодержащего компонента донорской крови во всех случаях была использована эритроцитарная взвесь, лейкоредуцированная. При массе тела пациента ниже 7,5 кг эритроцитарную взвесь добавляли в объем первичного заполнения до начала ИК из расчета по 10–15 мл/кг. При массе свыше 7,5 кг в объем первичного заполнения входили только описанные выше растворы без применения компонентов донорской крови. В ходе ИК при снижении уровня гематокрита ниже 25 % или сатурации венозной крови ниже 70 % проводили добавление эритроцитарной взвеси в контур ИК из расчета 5–10 мл/кг, при необходимости процедуру повторяли. После завершения ИК и до окончания операции трансфузия потребовалась 14 пациентам и была выполнена в дозе 5–10 мл/кг. В послеоперационном периоде ни одному пациенту трансфузия не проводилась. Случаев, когда первичный объем заполнения не включал компоненты донорской крови, но затем потребовалось их применение в процессе ИК, не наблюдалось. Однако у 3 пациентов потребовалась трансфузия эритроцитарной взвеси в периоде после окончания ИК. Данные случаи также были отнесены во 2-ю группу.
До начала ИК все пациенты получали гепарин из расчета 300 ЕД на килограмм массы тела с обязательным последующим контролем активированного времени свертывания крови. ИК проводилось с перфузионным индексом 2,5–3,0 л/мин/м2 в нормотермическом режиме (температура по назофарингеальному датчику — 37 °С), без использования режима пульсации. Поток газовой смеси в оксигенатор составлял в среднем 0,5 от объемной скорости перфузии. Фракция кислорода в газовой смеси регулировалась согласно данным кислотно-щелочного состояния крови и составляла 0,4–0,6 %. Уровень углекислого газа в крови контролировался по анализу кислотно-щелочного состояния артериальной крови и регулировался объемом газовой смеси.
С целью кардиоплегии применялся охлажденный раствор «Кустодиол» в дозировке 50 мл/кг, экспозиция — не менее 8 мин. Доставка кардиоплегического раствора осуществлялась антеградно, в корень аорты. Для подачи раствора использовали специальные приставки с теплообменником фирмы Medtronic. Отработанный кардиоплегический раствор аспирировали в кардиотомный резервуар оксигенатора.
Во время ИК проводилась ультрафильтрация с целью элиминации избыточного количества жидкой части перфузата и предотвращения гемодилюции. Использовалась ультрафильтрационная колонка Maquet BC 20 plus или Maquet BC 60 plus, в зависимости от веса пациента.
В группе с добавлением эритроцитарной взвеси в первичный объем заполнения до начала ИК проводилась модифицированная ультрафильтрация нулевого баланса. После окончания ИК всем пациентам проводилась модифицированная ультрафильтрация по описанным в литературе методикам с забором крови из артериальной канюли и возвратом концентрированной крови в канюлю нижней полой вены. После завершения модифицированной ультрафильтрации проводилась вакуумная ультрафильтрация оставшегося в кардиотоме перфузата по запатентованной нами технологии [19]. После чего концентрированная кровь из колонки ультрафильтрации вводилась пациенту.
При необходимости применялась инотропная поддержка в виде инфузии эпинефрина в дозе 0,05 мкг/кг/мин.
В исследовании применен ряд специфических маркеров — интерлейкин 1 бета (interleukin-1β [IL-1β]), интерлейкин-6 (interleukin-6 [IL-6]), интерлейкин-10 (interleukin-10 [IL-10]) и фактор некроза опухоли альфа (tumor necrosis factor alpha — TNF-α), по концентрации которых в сыворотке крови, согласно данным многочисленных исследований, объективно можно оценить степень выраженности СВО [20, 21]. Для диагностики церебрального повреждения в сыворотке крови определялся уровень специфических маркеров: белка S-100-β, нейронспецифической енолазы (neuron-specific enolase — NSE) и глиального фибриллярного кислого белка (glial fibrillary acidic protein — GFAP) [22–24]. Анализ крови для измерений проводили в трех контрольных точках: 1 — до начала операции, после катетеризации магистральной вены; 2 — в течение 5 мин после окончания ИК; 3 — спустя 16 ч после окончания операции. Забор крови проводился из центрального венозного катетера во внутренней яремной вене.
Статистическая обработка данных осуществлялась c помощью программы BioStat Pro 5.9.8. Ввиду того, что большинство данных не соответствовало закону о нормальном распределении (критерий Шапиро—Уилка, р < 0,05), применялись непараметрические методы анализа. Данные представлены в виде медианы (Me), верхнего (Q1) и нижнего квартилей (Q3). Сравнительный анализ количественных переменных проводили с использованием критерия Манна—Уитни [25]. Для связанных выборок использовался критерий Уилкоксона. Корреляционный анализ проводили с использованием коэффициента корреляции Спирмена (Rho). Статистически значимыми считали различия при р < 0,05.
В табл. 1 представлена динамика маркеров, использованных в исследовании пациентов обеих групп на различных контрольных точках. Кроме того, на рис. 1, 2 и 3 продемонстрирована динамика маркеров церебрального повреждения. Для всех маркеров, за исключением белка S-100-β и TNF-α, характерно, что наименьшая их концентрация отмечалась до начала оперативного вмешательства. Однако уже во 2-й контрольной точке, после завершения ИК, концентрация всех маркеров была статистически значимо выше начального уровня. Через 16 ч после оперативного вмешательства сывороточная концентрация белка S-100-β была статистически значимо ниже (р = 0,0053) начального уровня. Концентрация маркера TNF-α в 1-й и 3-й контрольных точках значимо не отличалась, как и IL-10, а также GFAP. Все остальные маркеры через 16 ч после окончания оперативного вмешательства отличались от начального уровня с должным уровнем статистической значимости.
Таблица 1. Динамика маркеров по контрольным точкам
Table 1. Dynamics of markers by control points
| Маркер | Контрольная точка исследования | ||
|---|---|---|---|
| До операции | Конец ИК | Через 16 ч после операции | |
| S-100-β, нг/мл | 226,10 [145,00–376,10] | 682,00 [453,50–965,65] (р < 0,000001) |
171,40 [110,12–314,91] (р = 0,0053) |
| NSE, нг/мл | 11,42 [4,33–17,10] | 23,30 [11,19–39,64] (р < 0,000001) |
19,67 [9,15–31,94] (р = 0,00008) |
| GFAP, нг/мл | 0,1121 [0,1061–0,1212] | 0,1215 [0,1135–0,1433] (р < 0,000001) |
0,1181 [0,1095–0,1231] (р = 0,062) |
| IL-1β, пг/мл | 3,11 [2,55–3,67] | 3,50 [3,01–4,40] (р = 0,00026) |
3,17 [2,66–4,01] (р = 0,01689) |
| IL-6, пг/мл | 2,10 [0,93–2,55] | 10,75 [3,38–23,61] (р < 0,000001) |
16,18 [3,10–27,18] (р < 0,000001) |
| IL-10, пг/мл | 0,79 [0,62–1,28] | 7,65 [3,03–13,60] (р < 0,000001) |
0,94 [0,70–1,79] (р = 0,713) |
| TNF-α, пг/мл | 1,14 [0,86–1,29] | 1,33 [1,10– 2,10] (р = 0,00012) |
1,13 [0,97–1,45] (р = 0,438) |
| GFAP — глиальный фибриллярный кислый белок; IL — интерлейкин; NSE — нейронспецифическая енолаза; TNF-α — фактор некроза опухоли альфа; ИК — искусственное кровообращение. Для концентрации маркеров во 2-й и 3-й контрольных точках указана статистическая значимость отличия от концентрации в 1-й контрольной точке согласно критерию Уилкоксона. |
|||

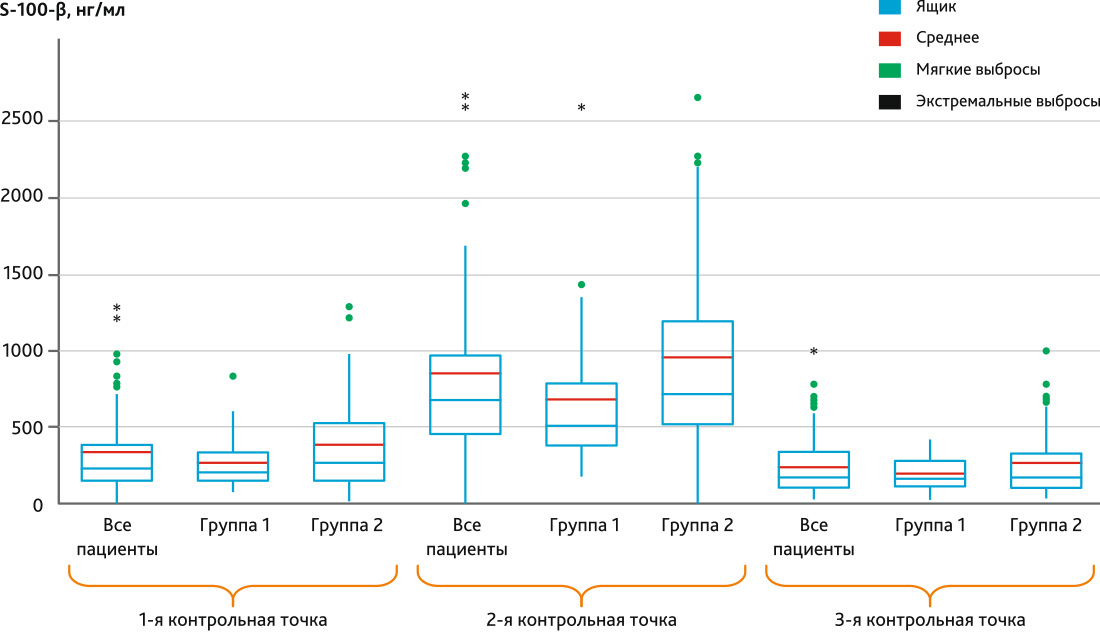
Рис. 1. Диаграмма box plot динамики белка S-100-β по контрольным точкам в группе 1 и группе 2
Примечание. Ящик — это межквартильный размах. Мягкие выбросы — значения, выходящие за пределы 1,5 межквартильного размаха. Экстремальные выбросы — это значения, выходящие за пределы 3 межквартильных размахов.
Fig. 1. Box plot diagram of protein S-100-β dynamics by control points in group 1 and group 2
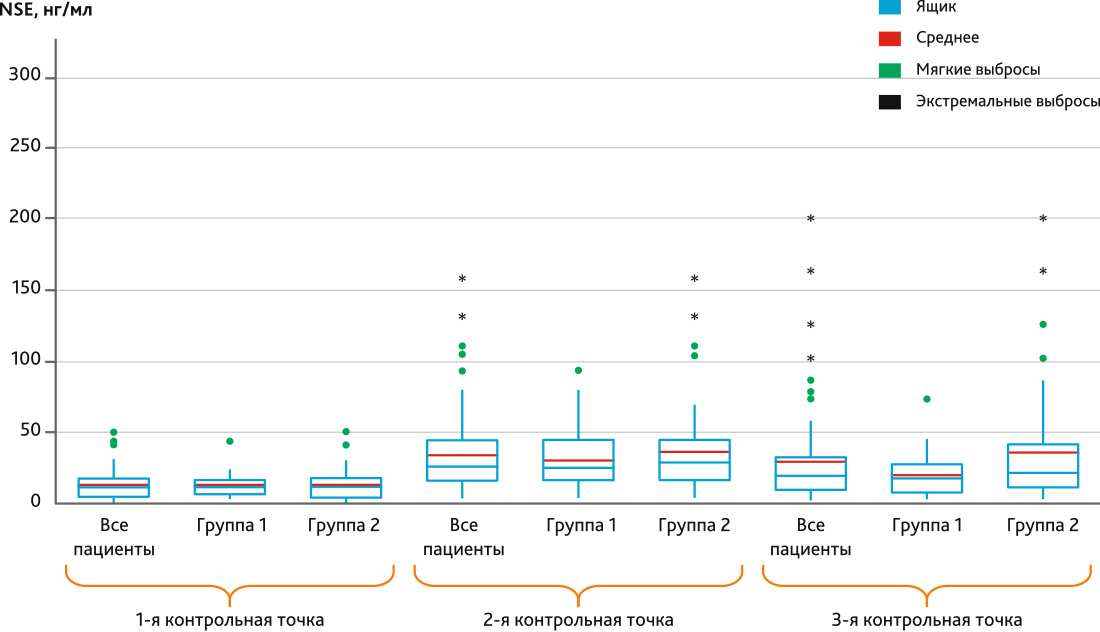
Рис. 2. Диаграмма box plot динамики NSE по контрольным точкам в группе 1 и группе 2
Примечание. Ящик — это межквартильный размах. Мягкие выбросы — значения, выходящие за пределы 1,5 межквартильного размаха. Экстремальные выбросы — это значения, выходящие за пределы 3 межквартильных размахов.
Fig. 2. Box plot diagram of NSE dynamics by control points in group 1 and group 2
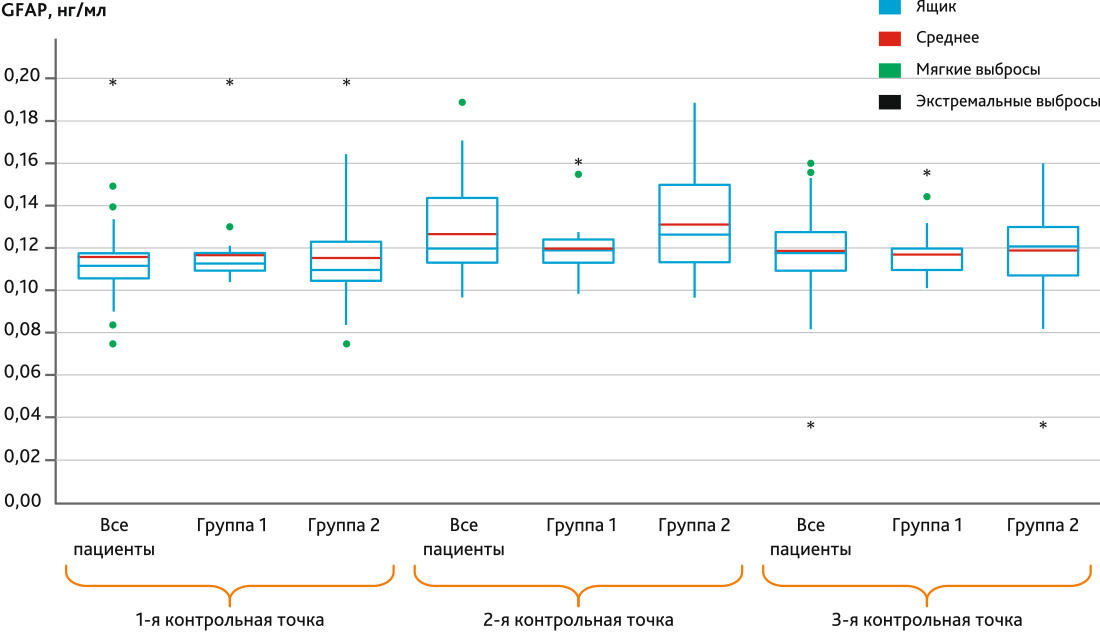
Рис. 3. Диаграмма box plot динамики белка GFAP по контрольным точкам в группе 1 и группе 2
Примечание. Ящик — это межквартильный размах. Мягкие выбросы — значения, выходящие за пределы 1,5 межквартильного размаха. Экстремальные выбросы — это значения, выходящие за пределы 3 межквартильных размахов.
Fig. 3. Box plot diagram of protein GFAP dynamics by control points in group 1 and group 2
В табл. 2 представлена характеристика исследуемых групп 1 и 2, которые образовались после разделения пациентов по факту применения трансфузии. Пациенты обеих групп были сопоставимы по соотношению пациентов мужского и женского пола, виду ВПС, типу хирургического доступа и времени пережатия аорты. При этом группы статистически значимо отличались между собой по возрасту, росту и массе тела пациентов, а также по длительности ИК. Помимо этого, пациенты отличались по уровню гемоглобина на всех этапах операции: выше его концентрация была до начала операции в группе 1, но во время ИК и в конце операции соотношение изменилось в пользу группы 2. При этом по показателям кислородного транспорта, таким как сатурация венозной крови, уровень лактата и церебральная оксиметрия, группы статистически значимо не отличались, так же как и по числу пациентов с инотропной поддержкой.
Таблица 2. Характеристика пациентов группы 1 и группы 2
Table 2. Сharacteristics of patients in group 1 and group 2
| Признак | Группа 1 (n = 30) | Группа 2 (n = 48) | р |
|---|---|---|---|
| Мужской пол, n | 11 | 20 | 0,6607 |
| Женский пол, n | 19 | 28 | |
| Возраст, мес. | 15 (12-28) | 11 (8-18) | 0,0064 |
| Масса тела, кг | 10,3 (8-12) | 8 (5,5-9,6) | 0,0008 |
| Рост, см | 81 (75,75-90,5) | 71 (60,75-78,5) | 0,0002 |
| Диагнозы, n (%) | |||
| ДМПП | 20 | 23 | 0,1053 |
| ДМЖП | 10 | 25 | |
| Хирургический доступ, n (%) | |||
| Срединная стернотомия | 19 | 35 | 0,3723 |
| Боковой доступ | 11 | 13 | |
| Время ИК, мин | 43 (38-50) | 50 (40-63) | 0,0450 |
| Время пережатия аорты, мин | 27 (21-33) | 31 (25,5-42,5) | 0,0640 |
| Лабораторные показатели | |||
| Hb до операции, г/л | 123 (115-128) | 113 (108,5-117,5) | 0,00003 |
| Hb во время ИК операции, г/л | 87 (81-91,5) | 89 (85-98,5) | 0,0528 |
| Hb в конце операции, г/л | 105 (100-110,5) | 123 (112-134) | 0,00001 |
| Венозная сатурация крови во время ИК, % | 71 (67-73,25) | 69,5 (65-73,5) | 0,1990 |
| Венозная сатурация крови в конце операции, % | 71 (68,5-75) | 70 (65-77) | 0,1891 |
| Лактат крови во время ИК, ммоль/л | 1,3 (1,1-1,55) | 1,3 (1,15-1,4) | 0,3459 |
| Лактат крови в конце операции, ммоль/л | 1,3 (1,15-1,5) | 1,3 (1,0-1,5) | 0,2602 |
| Показатели мониторинга | |||
| Показатели NIRS перед операцией, % | 77 (72-80) | 75 (70-78) | 0,0568 |
| Показатели NIRS во время ИК, % | 79 (77-81,25) | 77 (74-82) | 0,0835 |
| Показатели NIRS в конце операции, % | 78 (75-82,5) | 77 (74-80) | 0,0894 |
| Инотропные препараты | |||
| Пациенты с применением инотропных препаратов | 11 | 27 | 0,0923 |
| NIRS — церебральная оксиметрия; ИК — искусственное кровообращение; ДМЖП — дефект межжелудочковой перегородки; ДМПП — дефект межпредсердной перегородки. | |||
При разделении всех исследованных пациентов на 2 группы по факту применения трансфузии в интраоперационном периоде можно наблюдать общую тенденцию к более высокому уровню всех маркеров в группе с применением эритроцитарной взвеси. Стоит отметить, что на начальном этапе значения между группами не отличались для всех маркеров.
При изучении маркеров церебрального повреждения установлено, что белок S-100-β имел более высокую концентрацию во 2-й контрольной точке — после завершения ИК, среди пациентов 2-й группы, что подтверждено должным уровнем статистической значимости (р = 0,024). NSE был выше среди пациентов с трансфузией во 2-й контрольной точке (р = 0,023), но, кроме того, показал отличия и в 3-й точке исследования (р = 0,044). Аналогично белку S-100-β демонстрировал картину повышения GFAP после ИК (р = 0,035), однако нельзя не заметить и его большие значения в группе 2 через 16 ч после операции, которые, тем не менее, формально нельзя считать значимыми, поскольку р = 0,062. Все описанные значения представлены в табл. 3.
При анализе маркеров СВО были получены следующие данные. Сывороточная концентрация IL-1β была значимо выше в группе с трансфузией (р = 0,011) после ИК и имела тенденцию к таковой разнице на следующие сутки (через 16 ч) после операции, без достаточных значений уровня статистической значимости, но близкие к таковым — р = 0,060. Маркер СВО IL-6 демонстрировал различия в значениях только на послеоперационном этапе в 3-й контрольной точке (р = 0,021). Аналогичная картина концентрации отмечена у IL-10, значения которого были выше в группе с трансфузией в 3-й контрольной точке (р = 0,018). Маркер TNF-α имел значения выше среди пациентов в группе 2 только при измерении сразу же после окончания ИК (р = 0,011).
Таблица 3. Динамика маркеров по контрольным точкам в группах
Table 3. Dynamics of markers by control points in groups
| Маркер | Контрольная точка | Группа 1 | Группа 2 | р |
|---|---|---|---|---|
| S-100-β, нг/мл | До операции | 186,90 (141,70–336,00) | 260,80 (154,85–459,71) | 0,084 |
| Конец ИК | 509,90 (379,30–871,70) | 717,10 (517,90–1195,33) | 0,024 | |
| Через 16 ч после операции | 165,40 (141,00–271,90) | 183,45 (106,06–347,65) | 0,247 | |
| NSE, нг/мл | До операции | 11,89 (5,90–16,31) | 10,36 (4,03–17,34) | 0,247 |
| Конец ИК | 17,55 (11,19–26,41) | 34,05 (17,06–44,90) | 0,023 | |
| Через 16 ч после операции | 17,63 (7,43–21,66) | 22,23 (10,60–41,17) | 0,044 | |
| GFAP, нг/мл | До операции | 0,1128 (0,1101–0,1178) | 0,1102 (0,1052–0,1232) | 0,134 |
| Конец ИК | 0,1190 (0,1135–0,1245) | 0,1231 (0,1138–0,1493) | 0,035 | |
| Через 16 ч после операции | 0,1156 (0,1099–0,1193) | 0,1211 (0,1083–0,1299) | 0,062 | |
| IL-1β, пг/мл | До операции | 2,97 (2,52–3,66) | 3,17 (2,56–3,70) | 0,436 |
| Конец ИК | 3,13 (2,88–3,71) | 3,88 (3,23–4,63) | 0,011 | |
| Через 16 ч после операции | 3,04 (2,64–3,49) | 3,3 (2,71–4,06) | 0,060 | |
| IL-6, пг/мл | До операции | 2,14 (1,08–2,47) | 2,11 (0,89–2,63) | 0,451 |
| Конец ИК | 12,28 (3,06–17,41) | 9,07 (3,43–27,16) | 0,231 | |
| Через 16 ч после операции | 11,92 (2,21–18,88) | 18,97 (4,45–38,25) | 0,021 | |
| IL-10, пг/мл | До операции | 0,66 (0,59–1,04) | 0,88 (0,62–1,29) | 0,11 |
| Конец ИК | 6,32 (2,71–12,20) | 8,29 (3,55–15,95) | 0,123 | |
| Через 16 ч после операции | 0,82 (0,62–1,46) | 1,03 (0,45–1,89) | 0,018 | |
| TNF-α, пг/мл | До операции | 1,19 (0,93–1,28) | 1,04 (0,83–1,28) | 0,126 |
| Конец ИК | 1,26 (1,04–1,34) | 1,52 (1,15–12,22) | 0,011 | |
| Через 16 ч после операции | 1,11 (0,98–1,24) | 1,18 (1,01–1,95) | 0,104 | |
| GFAP — глиальный фибриллярный кислый белок; IL — интерлейкин; NSE — нейронспецифическая енолаза; TNF-α — фактор некроза опухоли альфа; ИК — искусственное кровообращение. | ||||
Если говорить о нейровоспалении как о реализации системного воспаления, то следует ожидать связи маркеров церебрального повреждения с маркерами СВО. Анализ выявил следующие статистически значимые корреляции (см. табл. 4). В интраоперационном периоде: после завершения ИК концентрация белка S-100-β коррелировала с TNF-α. NSE коррелировал с умеренной силой с TNF-α, а также имелась корреляция и с IL-6. В точке наблюдения через 16 ч после оперативного вмешательства концентрация белка S-100-β имела умеренную корреляцию с IL-1β и слабую с TNF-α. В то же время NSE имел умеренной силы взаимосвязь с TNF-α и заметную связь с концентрацией в крови IL-6.
Таблица 4. Корреляция маркеров церебрального повреждения и маркеров СВО
Table 4. Correlation of markers of cerebral damage and markers of SIRS
| Белок S-100-β | NSE | GFAP | |
|---|---|---|---|
| Корреляция маркеров во 2-й контрольной точке | |||
| IL-1β | 0,14176 (р = 0,21569) | −0,14474 (р = 0,20611) | 0,03819 (р = 0,73990) |
| IL-6 | 0,09605 (р = 0,40284) | 0,35 (p = 0,00206)* | −0,04037 (р = 0,72566) |
| IL-10 | −0,00108 (р = 0,99250) | 0,05147 (р = 0,65450) | 0,02675 (р = 0,81616) |
| TNF-α | 0,23 (p = 0,04762)* | 0,30 (p = 0,0071)* | 0,06155 (р = 0,59244) |
| Корреляция маркеров в 3-й контрольной точке | |||
| IL-1β | 0,32 (p = 0,00474)* | −0,15412 (р = 0,17789) | 0,15316 (р = 0,18066) |
| IL-6 | 0,03485 (р = 0,76193) | 0,50 (p = 0,00001)* | 0,11572 (р = 0,31302) |
| IL-10 | 0,12187 (р = 0,28782) | −0,04421 (р = 0,70072) | 0,10806 (р = 0,34632) |
| TNF-α | 0,28 (p = 0,00474)* | 0,43 (p = 0,00010)* | 0,21933 (р = 0,05530) |
| *Статистически значимые корреляции (р < 0,05). GFAP — глиальный фибриллярный кислый белок; IL — интерлейкин; NSE — нейронспецифическая енолаза; TNF-α — фактор некроза опухоли альфа. |
|||
Для выявления взаимосвязи факта использования компонентов донорской крови в интраоперационном периоде с концентрацией маркеров СВО был проведен корреляционный анализ, который во 2-й контрольной точке выявил следующие статистически значимые закономерности: IL-1β — Rho = 0,27 (p = 0,01913); TNF-α — Rho = 0,27 (p = 0,01599). В 3-й точке определения концентрации маркеров СВО взаимосвязь их с трансфузией отмечена у IL-6 — Rho = 0,24 (p = 0,03951) и IL-10 — Rho = 0,25 (p = 0,02626). По шкале оценки силы связи Чеддока все выявленные корреляции оцениваются как слабые, так как имеют значения Rho, не превышающие 0,3.
Касательно маркеров церебрального повреждения можно отметить только тенденции к наличию статистически значимой корреляции. Так, белок S-100-β показал коэффициент Спирмена, равный 0,22 c p = 0,05651 в точке после завершения ИК. По NSE в этот же временной отрезок отмечено Rho = 0,22 при р = 0,06386. Аналогичная картина наблюдалась и при анализе GFAP с Rho = 0,22 и р = 0,05716.
Для диагностики влияния объема всей примененной интраоперационно трансфузии во 2-й группе пациентов необходимо проанализировать, сколько эритроцитарной взвеси приходилось на килограмм тела пациента. Медианное значение равнялось 22,73 [14,40–29,82] мл/кг. При анализе корреляции исследованных маркеров с объемом суммарно трансфузии на килограмм массы тела пациента выявлено, что IL-1β, согласно шкале оценки корреляционной связи Чеддока, имел умеренную корреляцию как во второй контрольной точке (Rho = 0,37, p = 0,010), так и в третьей (Rho = 0,33, p = 0,023). TNF-α также имел умеренную корреляцию с объемом трансфузии, но только в точке после завершения ИК (Rho = 0,31, p = 0,034). Анализ для других маркеров СВО — IL-6 и IL-10 не выявил статистически значимой корреляции. Среди маркеров церебрального повреждения белок S-100-β показал умеренную корреляцию с трансфузией во второй (Rho = 0,48, p = 0,00065) и третьей контрольных точках (Rho = 0,36, p = 0,01330). Нейронспецифическая енолаза демонстрировала аналогичную картину: Rho = 0,41, p = 0,00421 — после завершения ИК и Rho = 0,35, p = 0,01667 — через 16 ч после оперативного вмешательства. Глиальный фибриллярный кислый белок статистически значимой связи с объемом трансфузии не имел. Таким образом, выявлена связь, демонстрирующая увеличение концентрации большинства маркеров с увеличением дозы трансфузии на килограмм массы тела.
Из данных табл. 1 можно видеть, что наивысшие концентрации для большинства исследованных маркеров отмечались во 2-й контрольной точке, что является логичным, исходя из механизма их появления в крови. Так, белок S-100-β является специфичным для головного мозга, находится в астроцитах и появляется в крови только при повреждении гематоэнцефалического барьера, при этом его сывороточная концентрация коррелирует с объемом поражения нейронов [22, 23]. Согласно литературным данным, его максимальная концентрация достигается к концу ИК и затем резко снижается, при отсутствии деструктивных для головного мозга факторов [26], что соответствует полученным нами данным. Учитывая, что период полураспада белка S-100-β равен 2 ч [26], понятным является снижение его уровня в крови пациентов через 16 ч даже ниже дооперационного уровня. Второй маркер церебрального повреждения также является строго тканеспецифичным для нейронов, поскольку представляет собой внутриклеточный фермент и повышение его уровня свидетельствует о наличии церебрального повреждения [24, 27]. По данным исследований известно, что пика концентрации NSE достигает в конце ИК и через 6 ч после его завершения [26], после чего постепенно снижается. В нашем исследовании была зафиксирована максимальная концентрация данного маркер как раз после завершения ИК. Второй пик его концентрации наблюдать не представлялось возможным, поскольку следующая точка забора сыворотки крови была через 16 ч после завершения оперативного вмешательства, в которой возможно увидеть конечную фазу снижения NSE от его максимального уровня. Тем не менее в этой контрольной точке он все еще был выше, чем на дооперационном уровне, что соотносится с результатами других исследований данного маркера в кардиохирургии [26]. Последним маркером повреждения головного мозга выступал GFAP, являющийся специфичным для астроцитов, повышение уровня которого в крови пациента говорит о нарушении структуры ГЭБ [28], также ассоциировано с послеоперационными когнитивными нарушениями [29]. По результатам нашего анализа пик концентрации из всех контрольных точек был на момент после завершения, т. е. в период максимальной нагрузки патологических факторов на головной мозг пациента. Однако такие показатели не соотносятся с данными других похожих исследований, в которых пик концентрации GFAP отмечался через 24 ч [30] и даже через 72 ч [31] от начала операции. Вероятно, в последующих исследованиях по данной тематике перспективным будет расширение нами временного интервала изучения маркеров для получения максимальной информации об изменении их концентрации.
В исследовании было изучено 4 маркера СВО. Первый из них — IL-1, семейство которого включает IL-1α, IL-1β и IL-1RN. Мы в своем исследовании использовали IL-1β, обладающий провоспалительными эффектами и коротким периодом полураспада [32]. Описанными характеристиками и обусловлена та его динамика, которую можно наблюдать из наших данных — пик концентрации маркера отмечался после завершения ИК, т. е. после наибольшего среди всей операции патологического воздействия. В дальнейшем наблюдалось снижение концентрации и возращение к дооперационному уровню, что соотносится с результатами других аналогичных исследований [33]. IL-6 является маркером СВО c двойным — про- и противовоспалительным действием и отличается разнообразием клеток, продуцирующих его (кардиомиоциты, фибробласты, эндотелиоциты) [34, 35]. При анализе IL-6 наблюдалась картина его повышения в период ИК с дальнейшим его повышением на следующие сутки. Исходя из данных литературы, согласно которым пик концентрации маркера достигает через 24 ч от начала операции [36], в нашем исследовании значения IL-6 должны быть таковыми в 3-й контрольной точке, что и было отмечено при анализе. IL-10 представляет собой противовоспалительный цитокин и известно, что повышенные его концентрации в послеоперационном периоде ассоциированы с иммуносупрессией и повышенным риском развития инфекционных осложнений [37]. Наивысшей точкой концентрации данного маркера, по нашим данным, служит окончание ИК, что согласуется с результатами других похожих исследований [38], с дальнейшим быстрым ее снижением через 16 ч почти до начального дооперационного уровня. Таким образом, для исследованной группы пациентов риск описанных осложнений и иммуносупрессии был минимален, что обусловлено малым временем ИК, с которым у IL-10 наблюдается корреляция по результатам Gorjipour F. et al. [39]. Динамика TNF-α, полученная нами, была сходна с другими работами по изучению данного маркера в детской кардиохирургии [40]. Пиковая концентрация, как и у IL-1β и IL-10, наблюдалась во 2-й контрольной точке со снижением до начального уровня в 3-й точке, что логично, учитывая его непродолжительный период полувыведения и прямую связь с повреждающими факторами операции, главным из которых выступает ИК. Учитывая благоприятный исход для всех пациентов в исследовании, неосложненный и непродолжительный реанимационный период для них, можно говорить о том, что подтверждаются данные, полученные Gorjipour F. и de Fontnouvelle [39, 40]. По их данным, у пациентов с оперативной коррекцией ВПС была обнаружена корреляция высоких концентраций TNF-α и более продолжительного периода нахождения в реанимации искусственной вентиляции легких, чего не наблюдалось для пациентов нашего исследования, у которых значения маркера через 16 ч после вмешательства находились на дооперационном уровне.
Если говорить о значении трансфузии в развитии церебрального повреждения, то стоит акцентировать внимание на данных, описанных в табл. 3. Исходя из них, выраженность повреждения нейроваскулярной единицы была значимо выше в группе с применением эритроцитарной взвеси, учитывая более высокие значения всех трех специфических маркеров (белка S-100-β, NSE и GFAP). Однако нельзя не отметить определенные ограничения нашего исследования, которые наглядно представлены в табл. 2. Во-первых, группы отличались между собой по антропометрическим данным и возрасту пациентов, и именно этим чаще всего и было обусловлено применение трансфузии, так как в нашей клинике удалось пока достичь проведения ИК детям без компонентов донорской крови только начиная с массы тела 7,5 кг. Группы также отличались по уровню гемоглобина в большую сторону в группе 2, что на этапе ИК и в конце оперативного вмешательства обусловлено применением трансфузии в этой группе. Однако по показателям кислородного транспорта группы значимо не отличались, поэтому можно исключить факт влияния гипоксии на головной мозг. Стоит отметить и то, что группы 1 и 2 хоть и незначительно, но отличались между собой по времени ИК. По длительности пережатия аорты такой разницы не отмечено. Указанные аспекты могли бы теоретически потенцировать больший выброс маркеров СВО в группе 2, как и отмечалось по нашим результатам. Тем не менее, если рассматривать теорию о том, что источником нейровоспаления являются как прямые повреждающие факторы, так и СВО [16, 41], то должна существовать корреляция между маркерами СВО и маркерами церебрального повреждения. Данная корреляция, по полученным нами данным, отмечалась как на стадии после ИК, так и через 16 ч после операции. Таким образом, подтверждается, что у исследованных пациентов главным фактором, потенцирующим развитие нейровоспаления, выступает СВО. Доказательством того, что именно трансфузия стала его причиной, служит наличие корреляционной связи между фактом трансфузии и исследованными маркерами. Еще выше был коэффициент корреляции между маркерами и дозой интраоперационной трансфузии на килограмм массы тела пациента. Такие результаты полностью соотносятся с другими исследованиями, доказавшими влияние трансфузии на развитие церебрального повреждения и делирия в детской кардиохирургии [42, 43]. Учитывая все негативные последствия трансфузии [44], в том числе доказанные и в нашем исследовании, представляются перспективными исследования, направленные на минимизацию использования компонентов донорской крови [45] и изучение различных аспектов их влияния на организм пациента [46].
Пик концентрации маркеров церебрального повреждения (S-100-β, NSE, GFAP) и СВО (IL-1β, IL-6, IL-10, TNF-α) приходился на этап после завершения ИК для всех исследованных маркеров, кроме IL-6, у которого максимальная концентрация наблюдалась через 16 ч после операции.
В ходе сравнения группы с использованием трансфузии и с отказом от нее были выявлены статистически более высокие показатели маркеров церебрального повреждения на этапе после завершения ИК для S-100-β, NSE и GFAP и через 16 ч после операции для GFAP. Маркеры СВО — IL-1β TNF-α были значимо выше после завершения ИК, а IL-6 и IL-10 — через 16 ч после оперативного вмешательства.
Наблюдалась слабая и умеренная корреляция степени выраженности церебрального повреждения и СВО с фактом применения эритроцитарной взвеси и ее дозой на килограмм массы тела пациента. Приведенные данные являются подтверждением того, что интраоперационная трансфузия выступает источником повышенного уровня СВО и нейровоспаления с дальнейшим церебральным повреждением у детей при оперативной коррекции септальных ВПС.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Этическое утверждение. Проведение исследования было одобрено локальным этическим комитетом НИИ КПССЗ (протокол № 20 от 20.11.18).
Ethics approval. This study was approved by the local Ethical Committee Research Institute for Complex Issues of Cardiovascular Diseases (Reference number 20-20.11.18).
Информация о финансировании. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.