Термин «хроническое критическое состояние» (ХКС) впервые был предложен в 1985 г. [1]. Тем не менее данное состояние до настоящего времени не имеет стандартного определения [2, 3]. Одной из причин отсутствия стандартного определения является невозможность объективной оценки перехода острой фазы критического состояния в хроническую фазу [2, 4]. Отсутствие возможности объективизации критериев начала хронической фазы критического состояния в настоящее время отражается в наличии множества различных определений ХКС, которые апеллируют к длительности госпитализации или искусственной вентиляции легких [5–17].
В настоящее время наблюдается увеличение количества пациентов, которые классифицируются как пациенты с ХКС [18]. Основной причиной данного явления представляется то, что среди пациентов с сепсисом в результате внедрения более современных подходов лечения пациентов снизилась госпитальная летальность [19–21], и часть выживших пациентов переходит в категорию пациентов с ХКС [22, 23].
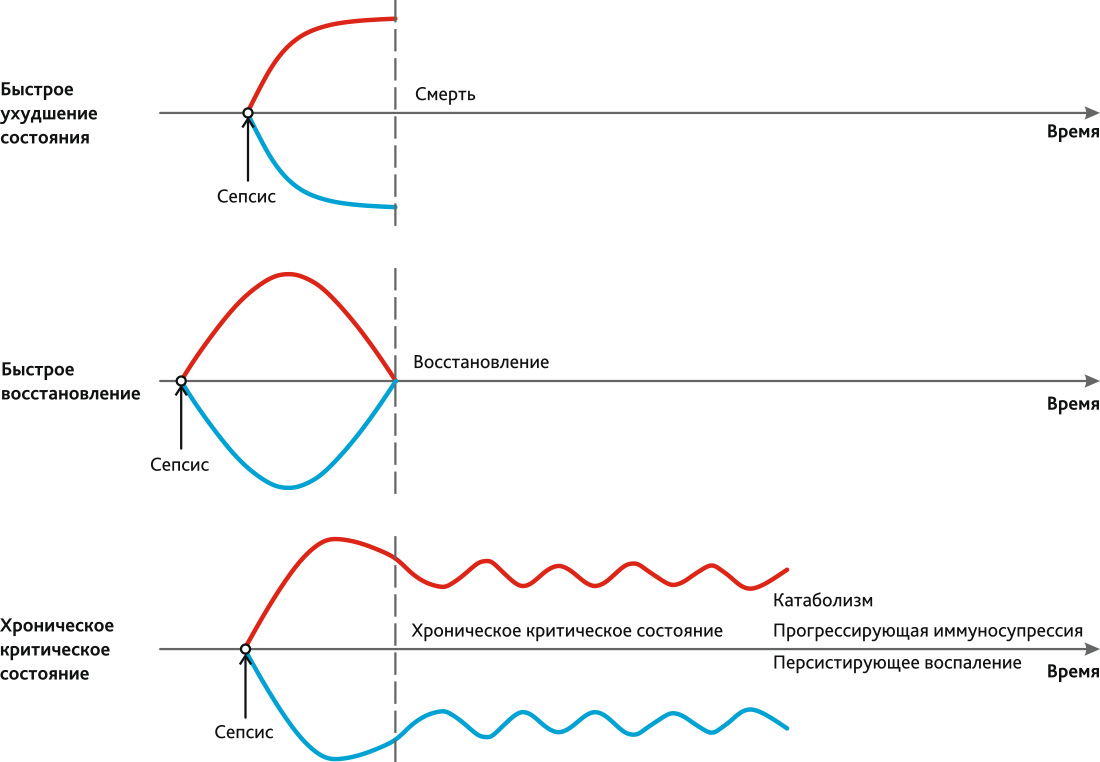
Относительно недавно начали появляться данные о том, что эти пациенты имеют неблагоприятные исходы лечения. В частности, было показано, что ХКС является фактором риска летального исхода в течение 1 года после постановки диагноза [24, 25]. Более того, начали появляться работы о патофизиологических изменениях, которые происходят у пациентов с ХКС. Данные изменения описываются как синдром персистирующего воспаления, иммуносупрессии и катаболизма (ПИКС). Современные представления о патогенезе ПИКС и ХКС представлены на рис. 1.

Рис. 1. Современные представления о патогенезе ПИКС и ХКС
Красная линия — уровень прововоспалительных факторов; голубая линия — уровень противовоспалительных факторов.
Fig. 1. Current concepts in the pathogenesis of PICS and CCI
Red line — the level of proinflammatory factors; blue line — the level of antiinflammatory factors.
Цель исследования — оценка влияния хронического критического состояния на показатели иммунного статуса пациентов.
Первичной и единственной конечной точкой исследования является ответ на вопрос, имеются ли статистически значимые различия показателей иммунного статуса пациентов с ХКС в сравнении с пациентами с быстрым восстановлением.
Для поиска статей были использованы международные базы данных PubMed и Google Scholar. Поисковые запросы были сформированы 10.08.2022. Для поиска использовались следующие запросы: «chronically critically ill patients AND immune», «chronic critical illness AND immune», «persistent inflammation, immunosuppression, and catabolism syndrome AND immune». Поиск был ограничен статьями, опубликованными в период с 2012 г. по август 2022 г. С целью увеличения точности поиска использовался фильтр «adults». Также для поиска статей был применен метод поиска по литературным ссылкам.
Критерии соответствия были сформированы с использованием стратегии PICOS (табл. 1).
Таблица 1. Критерии соответствия согласно стратегии PICOS
Table 1. Eligibility criteria according to PICOS
| Параметры | Критерии включения |
|---|---|
| Популяция | Пациенты старше 18 лет с ХКС/ПИКС |
| Исследовательские стратегии | Развитие критического состояния |
| Группы сравнения | Пациенты с быстрым восстановлением, здоровые добровольцы |
| Исходы | Показатели иммунного статуса, воспаления и катаболизма |
| Дизайн исследований | Оригинальные статьи |
| ПИКС — синдром персистирующего воспаления, иммуносупрессии и катаболизма; ХКС — хроническое критическое состояние. | |
Таким образом, в систематический обзор включались статьи, удовлетворяющие следующим критериям включения:
Сформированные поисковые запросы были отправлены трем независимым исследователям, которые провели обзор статей по абстрактам. Статьи, которые вероятно удовлетворяли критериям соответствия, были отобраны в качестве статей для полнотекстового ознакомления. Данные статьи были изучены двумя независимыми исследователями. По итогам полнотекстового ознакомления со статьями были выбраны статьи, полностью удовлетворяющие критериям соответствия и включенные в обзор литературы. Любые разногласия решались путем консенсуса с привлечением дополнительного специалиста.
Для оценки достоверности результатов, представленных в статьях, включенных в анализ, была проведена оценка риска систематической ошибки для исследований, включенных в анализ. Инструментом оценки систематической ошибки был выбран ROBINS-E (The Risk Of Bias In Non-randomized Studies — of Exposure) [26].
Оценка систематической ошибки проводилась по методу Delphi в 2 этапа тремя исследователями.
Delphi, этап 1. На первом этапе все участники независимо оценили статьи на наличие систематической ошибки c помощью ROBINS-E. Результаты были собраны руководителем исследования. Руководителем исследования были выявлены блоки, в которых не было согласия между всеми участниками исследования. Каждому из трех исследователей было предложено анонимно обосновать в письменной форме свое мнение относительно каждого из спорных блоков. Данные разъяснения были отправлены руководителю исследования.
Delphi, этап 2. Перед вторым раундом каждый исследователь получил от руководителя исследования результаты оценки риска систематической ошибки и обоснования относительно несогласованных доменов, которые были составлены двумя другими исследователями. При этом анонимность работ была сохранена.
На втором этапе исследователям предлагалось оценить несогласованные блоки повторно, принимая во внимание письменно изложенное мнение двух других исследователей. Каждый исследователь мог как согласиться, так и не согласиться с мнением коллег, оставаясь при этом анонимным. После повторной оценки риска систематической ошибки с помощью ROBINS-E результаты были вновь отправлены руководителю исследования для окончательного заключения.
На основании поисковых запросов была обнаружена 491 статья. При анализе абстрактов для полнотекстового анализа было отобрано 25 статей. Из 25 отобранных статей для 2 статей не был получен доступ к полнотекстовому варианту. Следовательно, для полнотекстового ознакомления подходили 23 статьи. После прочтения из 23 статей только 5 статей удовлетворяли критериям соответствия и были включены в обзор литературы (рис. 2). Среди исследований 3 были проспективными обсервационными, 2 — post hoc анализом проспективных исследований.
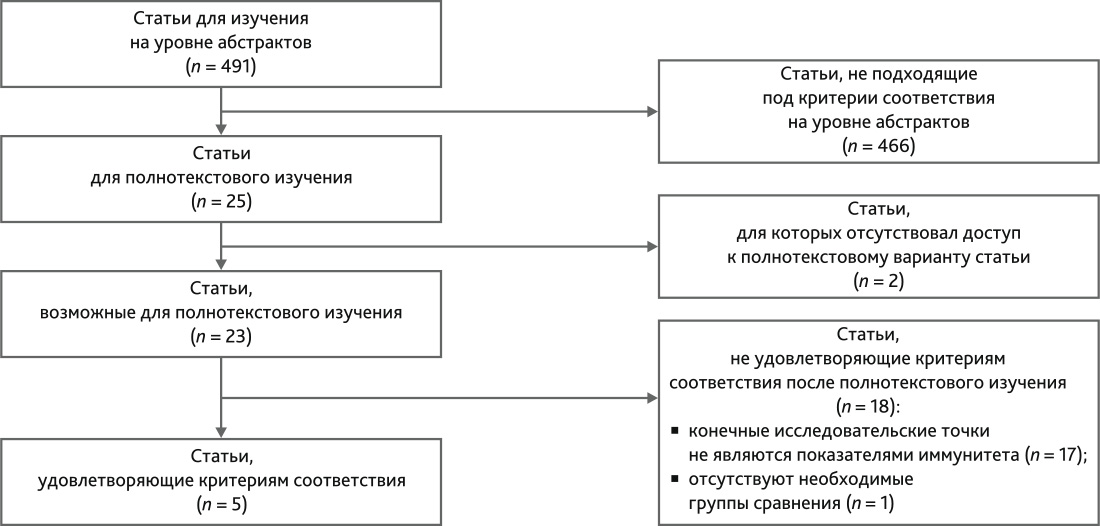
Рис. 2. Схема отбора статей
Fig. 2. Selection scheme for the articles reviewed in this study
Оценка риска систематической ошибки была проведена для всех 5 исследований, включенных в обзор литературы (табл. 2). На основании анализа риска систематической ошибки было показано, что 2 из 5 статей имеют средний риск систематической ошибки, 3 из 5 статей — высокий.
Таблица 2. Оценка риска систематической ошибки с использование ROBINS-E
Table 2. Bias risk assessment using ROBINS-E
| Исследование | Виды систематических ошибок | Общий риск | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Первые авторы | Год | Связанные с конфаундерами | Связанные с определением воздействия | Отбор пациентов | Связанный с интервенциями после воздействия | Отсутствие данных | Оценка исходов | Выборочная публикация результатов | Низкий/Средний/Высокий/Очень высокий |
| Brakenridge S.C. [27] | 2019 | Высокий | Средний | Низкий | Низкий | Низкий | Низкий | Средний | Высокий |
| Stortz J.A., Murphy T.J. [29] | 2018 | Средний | Средний | Низкий | Низкий | Низкий | Низкий | Низкий | Средний |
| Cox M.C. [28] | 2020 | Высокий | Средний | Низкий | Низкий | Низкий | Низкий | Средний | Высокий |
| Stortz J.A., Mira J.C. [30] | 2018 | Высокий | Средний | Низкий | Низкий | Низкий | Низкий | Низкий | Высокий |
| Mankowski R.T. [31] | 2022 | Низкий | Средний | Низкий | Низкий | Низкий | Низкий | Низкий | Средний |
Информация о статьях, включенных в обзор литературы, представлена в табл. 3.
Таблица 3. Информация о статьях
Table 3. Article Information
| Автор | Дизайн | Когорта пациентов | Группы сравнения | Определения | Основные результаты оценки биомаркеров |
|---|---|---|---|---|---|
| Brakenridge S.C. [27] | Post hoc анализ, n = 157 | Сепсис | Пациенты с ХКС и пациенты с быстрым восстановлением | ХКС: длительность нахождения в ОРИТ ≥ 14 сут + наличие органной дисфункции (SOFA ≥ 2 баллов) Быстрое восстановление: длительность нахождения в ОРИТ < 14 сут |
|
| Stortz J.A., Murphy T.J. [29] | Проспективное обсервационное исследование, n = 88 (+20 добровольцев) | Сепсис | Здоровые волонтеры, пациенты с ХКС и пациенты с быстрым восстановлением | ХКС: длительность нахождения в ОРИТ ≥ 14 сут + наличие органной дисфункции (SOFA ≥ 2 баллов). Быстрое восстановление: длительность нахождения в ОРИТ < 14 сут |
|
| Cox M.C. [28] | Post hoc анализ, n = 144 (+27 добровольцев) | Сепсис | Здоровые волонтеры, пациенты с ХКС и пациенты с быстрым восстановлением | ХКС: длительность нахождения в ОРИТ ≥ 14 сут + наличие органной дисфункции (SOFA ≥ 2 баллов) Быстрое восстановление: длительность нахождения в ОРИТ < 14 сут |
|
| Stortz J.A., Mira J.C. [30] | Проспективное обсервационное исследование, n = 145 | Сепсис | Пациенты с ХКС и пациенты с быстрым восстановлением | ХКС: длительность нахождения в ОРИТ ≥ 14 сут + наличие органной дисфункции (SOFA ≥ 2 баллов) Быстрое восстановление: длительность нахождения в ОРИТ < 14 сут |
|
| Mankowski R.T. [31] | Проспективное обсервационное исследование, n = 363 (+37 добровольцев) | Сепсис | Здоровые волонтеры, пациенты с ХКС и пациенты с быстрым восстановлением | ХКС: длительность нахождения в ОРИТ ≥ 14 сут + наличие органной дисфункции (SOFA ≥ 2 баллов) Быстрое восстановление: длительность нахождения в ОРИТ < 14 сут |
|
| 3MHIS — 3-метилгистидин; ALC — абсолютное количество лейкоцитов; ANC — абсолютное количество нейтрофилов; CRP — С-реактивный белок; GLP-1 — глюкагон-подобный пептид-1; HLA-DR — человеческие лейкоцитарные антигены тип DR; IGF1 — инсулиноподобный фактор роста 1; IGFBP3 — белок, связывающий инсулиноподобный фактор роста 3; IL-10 — интерлейкин-10; IL-6 — интерлейкин-6; IL-8 — интерлейкин-8; MCP-1 — моноцитарный хемотаксический белок-1; SOFA — шкала оценки органной недостаточности; sPD-L1 — растворимая форма лиганда белка программируемой клеточной гибели-1; ОРИТ — отделение реанимации и интенсивной терапии; ХКС — хроническое критическое состояние. | |||||
Показатели иммунитета: sPD-L1. В ряде работ было показано, что у пациентов группы ХКС в сравнении с пациентами с быстрым восстановлением во всех временных точках оценки обнаруживались более высокие концентрации sPD-L1 (р < 0,05) [28, 30, 31] в плазме крови. Stortz, Murphy et al. [29], изучив в своей работе динамику изменения концентрации sPD-L1, продемонстрировали, что для группы быстрого восстановления характерно постепенное снижение sPD-L1 до уровня нормальных значений, в то время как для группы ХКС характерно прогрессирующее увеличение sPD-L1 (р < 0,05).
Показатели иммунитета: IL-10. По результатам двух опубликованных работ [30, 31] было показано, что пациенты с ХКС в сравнении с группой быстрого восстановления в течение всего периода госпитализации имели более высокие значение IL-10 в плазме крови пациентов (р < 0,05).
Показатели иммунитета: ALC. В работе Stortz, Mira et al. [30] было показано, что только на 14-е сутки от момента постановки диагноза «сепсис» абсолютное количество лейкоцитов статистически значимо ниже в группе пациентов с ХКС в сравнении с группой быстрого восстановления. При этом в другой работе (Stortz, Murphy et al. [29]) было продемонстрировано, что динамика изменения параметра ALC различна между изучаемыми группами: для группы быстрого восстановления характерно быстрое повышение ALC до уровня нормальных значений, в то время как для группы ХКС характерно медленное увеличение ALC (р = 0,036).
Показатели иммунитета: HLA-DR. В работе Stortz, Murphy et al. [29] было показано, что пациенты с ХКС и пациенты с быстрым восстановлением в период постановки диагноза сепсис имеют сниженные показатели HLA-DR в сравнении с группой здоровых добровольцев. При этом относительно динамики HLA-DR наблюдается схожая картина с динамикой ALC: для группы быстрого восстановления характерно быстрое повышение HLA-DR до уровня нормальных значений, в то время как для группы ХКС характерно медленное увеличение HLA-DR (р < 0,05).
Показатели персистирующего воспаления: IL-6 и IL-8. По результатам опубликованных работ показано, что пациенты с ХКС в сравнении с группой быстрого восстановления имели более высокие значения IL-6 [27, 28, 30, 31] и IL-8 [28, 30, 31] в крови во всех временных точках оценки от момента постановки диагноза «сепсис» в сравнении с группой быстрого восстановления (p < 0,05).
Показатели персистирующего воспаления: MCP-1, CRP, ANC. В одной работе изучались дополнительные маркеры воспаления [31], и было показано, что пациенты с ХКС в сравнении с пациентами с быстрым восстановлением имели более высокие показатели значения MCP-1, CRP и ANC в плазме крови в течение 14 суток от момента постановки диагноза «сепсис» (p < 0,05).
Показатели катаболизма: GLP-1. В трех исследованиях было показано, что во всех временных точках оценки вплоть до 28 сут от момента постановки диагноза «сепсис» пациенты с ХКС в сравнении с пациентами с быстрым восстановлением имели более высокие значения концентрации GLP-1 в плазме крови (p < 0,05) [27, 28, 31].
Показатели катаболизма: IGFBP3. В двух исследованиях было показано, что во всех временных точках оценки в течение 14 сут от момента постановки диагноза «сепсис» пациенты с ХКС в сравнении с пациентами с быстрым восстановлением имели более высокие значения концентрации IGFBP3 в плазме крови (p < 0,05) [30, 31].
Показатели катаболизма: IGF1. В работе Mankowski R.T. et al. [31] было показано, что концентрация в крови IGF1 у пациентов с ХКС выше в течение 14 суток от момента постановки диагноза «сепсис» в сравнении с группой быстрого восстановления (p < 0,05).
Показатели катаболизма: 3MHIS. В работе Stortz, Mira et al. [30] была продемонстрирована повышенная экскреция 3-метилгистидина (3MHIS) у пациентов с ХКС в сравнении с группой быстрого восстановления через 7 и 14 сут от момента постановки диагноза «сепсис» (p < 0,05).
В нескольких работах также изучалась летальность пациентов с ХКС и быстрым восстановлением. Так, в своей работе Cox M.C. et al. [28] оценили 30-дневную и годовую летальность у пациентов группы ХКС и группы быстрого восстановления. В группе пациентов с ХКС 30-дневная летальность составила 19%, а годовая — 42%, в то время как в группе с быстрым восстановление 30-дневная летальность — 1%, а годовая — 7% (p < 0,001 для обоих исходов). Stortz, Murphy et al. [29] также обнаружили, что летальность в течение 30 сут и 6 мес. от момента постановки диагноза «сепсис» значимо различается между изучаемыми группами: в группе пациентов с ХКС 30-дневная летальность составила 11%, а 6-месячная — 26%, в то время как в группе с быстрым восстановлением 30-дневная летальность — 0%, а 6-месячная — всего 4% (р = 0,015 и р = 0,002 соответственно). Схожая тенденция продемонстрирована и в работе Stortz, Mira et al. [30]: в группе пациентов с ХКС 6-месячная летальность составила 37%, а в группе с быстрым восстановлением — 2% (p < 0,001).
Данный обзор литературы суммирует результаты исследования различных биомаркеров у пациентов с ХКС. Группами сравнения в данной работе выступали пациенты с ХКС и пациенты с быстрым восстановлением. Важно отметить, что во всех исследованиях использовались единые критерии диагностики ХКС, что повышает качество синтеза результатов отдельных исследований по причине низкой гетерогенности изучаемых явлений в условиях отсутствия стандартизованного определения.
Относительно полученных результатов можно сказать, что различия между группами, полученные в каждом из исследований, однонаправленные. В каждом из исследований получены доказательства наличия персистирующего воспаления, иммуносупрессии и катаболизма, объем которых значимо отличается для пациентов с ХКС в сравнении с группой быстрого восстановления (рис. 3).
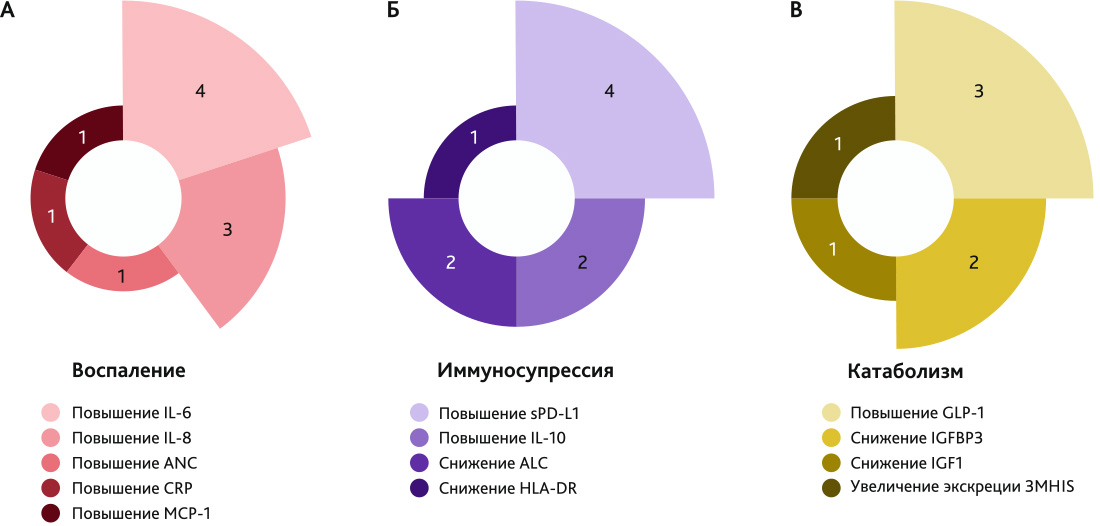
Рис. 3. Оценка биомаркеров хронического критического состояния в анализируемых исследованиях
Примечание. Каждый сегмент соответствует одному биомаркеру, направленность биомаркера указана под круговой диаграммой; величина сегмента в круговой диаграмме, как и цифры рядом с каждым сегментом, указывает на количество исследований, в которых обнаружены статистически значимые различия между группой с ХКС и группой быстрого восстановления относительно биомаркера.
Fig. 3. Evaluation of biomarkers of chronic critical illness in the selected studies
Note. Each slice corresponds to one biomarker, biomarker orientation is indicated below the pie chart; the size of each slice, as well as the numbers next to each slice, indicate the number of studies that found a statistically significant difference in the biomarker level between the CCI group and the rapid recovery group.
Было показано, что у пациентов с ХКС снижены уровни HLA-DR и ALC на фоне более высоких значений sPD-L1 и IL-10 [27–31] (рис. 3, б). Все эти показатели отражают персистирующее иммуносупрессивное состояние пациентов. В частности, в ряде работ авторы обнаружили более высокую частоту вторичных инфекций у пациентов с ХКС и связали именно с иммуносупрессивным статусом пациентов [28, 29, 31], что может приводить к дополнительному увеличению длительности госпитализации пациентов.
Одновременно с этим у пациентов поддерживается персистирующее воспаление. В проанализированных статьях было показано, что пациенты с ХКС имеют значимо более высокие уровни IL-6, IL-8, MCP-1, CRP, ANC [27–31] (рис. 3, а). Данные результаты свидетельствуют о персистирующей системной воспалительной реакции.
Также у пациентов с ХКС продемонстрировано катаболическое состояние. Данное состояние обусловлено как снижением факторов роста (IGF1 и IGFBP3) [30, 31], так и увеличением разрушения мышечной ткани (повышенная экскреция 3-метилгистидина) [30]. Также для пациентов с ХКС характерна повышенная концентрация GLP-1 [27, 28, 31] (рис. 3, в).
Тем не менее, несмотря на значимость полученных результатов, 3 из 5 исследований имеют высокий риск систематической ошибки по причине того, что проводили сравнение групп, которые были несопоставимы по исходным параметрам, а также не использовали статистические методы корректировки данных различий между группами сравнения [27, 28, 30]. Только 2 из 5 исследований имеют средний риск систематической ошибки [29, 31]. Исследований иммунного статуса пациентов с ХКС, имеющих низкий риск предвзятости, не обнаружено. Данный результат говорит о том, что качество полученных результатов должно рассматривать как низкое и требующее дальнейшего проведения новых исследований. Важно отметить, что все исследования имеют определенный риск предвзятости также по причине того, что на данный момент не существует стандартизированного определения ХКС, а потому существуют вероятность того, что полученные сейчас результаты не смогут быть экстраполированы на пациентов, которые будут удовлетворять стандартизованному определению ХКС в будущем.
Таким образом, в настоящее время существует очень мало работ, в которых изучался иммунный статус пациентов с ХКС. Более того, в существующих работах иммунный статус пациентов с ХКС исследован недостаточно. В частности, требуется более глубокое изучение состояния клеточного и гуморального иммунитета для того, чтобы понять особенности пациентов с ХКС и выработать стратегии по снижению летальности, длительности ИВЛ и длительности госпитализации у пациентов с ХКС.
Основным ограничением в работе является дизайн данного исследования — обзор литературы, исключающий статистический анализ. Данный дизайн исследования выбран по причине того, что методы представления результатов в изучаемых статьях не позволяют сравнить полученные результаты между собой.
Пациенты с ХКС имеют иммуносупрессивный статус, который отражается в сниженном уровне HLA-DR и ALC, на фоне более высоких значений sPD-L1 и IL-10. Результаты изучения иммунного статуса пациентов в настоящее время имеют высокий и средний риск систематической ошибки, а потому должны рассматриваться как результаты низкого качества, отражены недостаточно, вследствие чего дальнейшее проведение проспективных обсервационных исследований.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Disclosure. The authors declare that they have no competing interests.
Вклад авторов. Все авторы в равной степени участвовали в разработке концепции статьи, получении и анализе фактических данных, написании и редактировании текста статьи, проверке и утверждении текста статьи.
Author contribution. All authors according to the ICMJE criteria participated in the development of the concept of the article, obtaining and analyzing factual data, writing and editing the text of the article, checking and approving the text of the article.
Информация о финансировании. Авторы заявляют об отсутствии внешнего финансирования при проведении исследования.
Funding source. This study was not supported by any external sources of funding.