Сепсис является гетерогенным синдромом, вызванным разбалансированным ответом организма-хозяина на инфекцию, приводящим к органной дисфункции [1]. Патогенез коагулопатии, развивающейся на фоне сепсиса, включает несколько механизмов.
Снижение уровня антитромбина выявляется у половины пациентов с сепсисом, а дефицит протеина C — у подавляющего большинства. В физиологических условиях антитромбин ингибирует тромбин и другие факторы свертывания (VII, IX, X и XI), а протеин С, активированный комплексом тромбин–тромбомодулин на поверхности эндотелиоцитов, инактивирует факторы Vа и VIIIа, разрывая петли положительной обратной связи и выступая естественным антикоагулянтом. Состояние повышенной прокоагулянтной активности и нарушенного фибринолиза приводит к образованию фибриновых сгустков в микроциркуляторном русле и, как следствие, органной недостаточности [2, 3]. Коагулопатия имеет различную степень выраженности, при этом частота развития явного синдрома диссеминированного внутрисосудистого свертывания крови (ДВС) достигает 30 % при оценке по критериям International Society on Thrombosis and Haemostasis (ISTH) и около 60 % — по критериям Japanese Association for Acute Medicine (JAAM) [4]. Спорным остается вопрос, является ли тяжесть ДВС независимым от количества баллов Acute Physiology and Chronic Health Evaluation (APACHE) II score и Sequential Organ Failure Assessment (SOFA) score предиктором летального исхода, или же прогноз определяется тяжестью общего состояния. Первое утверждение доминировало в литературе с момента опубликования в 2004 г. результатов исследования PROWESS. Альтернативное мнение высказано в 2018 г. по результатам крупного эпидемиологического исследования ДВС в Японии, где авторы показали преимущественное прогностическое значение шкал APACHE и SOFA перед существующими шкалами ДВС (ISTH и JAAM) [4]. Хотя диагностика явного синдрома ДВС по критериям ISTH основана на общедоступных маркерах и обычно не представляет сложности, констатация данной (запущенной) стадии септической коагулопатии не только не открывает новых терапевтических возможностей, но и резко сокращает эффективность имеющихся. Экспериментальные исследования эндотоксемии подтверждают наличие фазы гиперкоагуляции, предшествующей развитию гипокоагуляции [5]. Выявление более ранней (гиперкоагуляционной) стадии синдрома ДВС в клинических условиях представляет собой диагностическую проблему, поскольку распространенные скрининговые тесты коагуляции в этом отношении либо нечувствительны, либо неспецифичны. Это, в свою очередь, препятствует развитию целенаправленной превентивной терапии на ранней стадии ДВС.
В настоящее время принято разделение методов диагностики гемостаза на интегральные (оценивают работу системы в целом) и локальные (оценивают отдельные звенья или отдельные факторы). В свою очередь, локальные тесты подразделяют на скрининговые и специализированные. Наиболее популярные скрининговые тесты — это протромбиновое время и активированное парциальное тромбопластиновое время. Показано, что отдельные коагуляционные маркеры (далее будем упоминать их как специализированные тесты) высоко коррелируют с наличием гиперкоагуляционных сдвигов в системе гемостаза на фоне сепсиса, но их использование в клинической практике не является рутинным. Наиболее часто в контексте диагностики гиперкоагуляции упоминаются D-димер, протеин C, протеин S, антитромбин, фактор VIII, фактор фон Виллебранда.
Интегральные тесты коагуляции, такие как тромбоэластография (ТЭГ), тромбоэластометрия (ТЭМ), получили широкое распространение как методы мониторинга коагулопатий, связанных с операцией и травмой. Одно из преимуществ глобальных тестов — их способность к выявлению гиперкоагуляции. Известно, что ТЭГ и ТЭМ пригодны для выявления гиперкоагуляции и прогнозирования тромботических осложнений у отдельных групп пациентов [6, 7], однако использование их в условиях сепсиса противоречиво [8]. Поскольку методики ТЭГ/ТЭМ максимально приближены к пациенту (так называемый point of care testing), они являются очевидными кандидатами для скрининга глобального статуса системы коагуляции и первичной стратификации рисков. На выборе ТЭГ/ТЭМ критериев гиперкоагуляции необходимо остановиться отдельно. При сравнении ТЭМ-параметров здоровых добровольцев и пациентов с подтвержденными тромботическими осложнениями было установлено, что наиболее специфичными и чувствительными маркерами тромботических осложнений являются время формирования сгустка (CFT), максимальная плотность сгустка (MCF) и тромбодинамический потенциал по C. Ruby, представляющий собой частное максимальной эластичности и времени формирования сгустка (TPI = MCE/CFT) [7]. Поскольку максимальная плотность сгустка обусловлена вкладом как фибрина, так и тромбоцитов, для различения тромбоцитарной и плазматической гиперкоагуляции был предложен новый параметр — «дельта». Согласно базовому алгоритму работы ТЭГ/ТЭМ, начальный отрезок времени r (в приборах ТЭГ) либо так называемое время тромбообразования (CT) (в приборах ТЭМ) заканчивается при расхождении «ветвей» ТЭГ/ТЭМ на 2 мм. Однако именно в конце этого временного интервала начинается активная генерация тромбина. При отображении первой производной изменения плотности сгустка (т. е. скорости) появляется возможность увидеть начало этого процесса и, таким образом, рассчитать время «дельта», от начала кривой первой производной до конца интервала r (или CT). Сочетание высокой максимальной плотности сгустка с короткой «дельтой» (менее 0,6 мин) связано с плазматической гиперкоагуляцией, а сочетание с более продолжительной «дельтой» — с тромбоцитарной [9]. Связь нормо-, гипер- и гипокоагуляционных паттернов ТЭГ/ТЭМ и течения сепсиса была прослежена в исследовании S. Ostrowski с соавт. [5]. Базовым критерием была выбрана максимальная амплитуда ТЭГ (соответствует максимальной плотности сгустка в тестах ТЭМ). Было показано, в частности, что в момент диагностики сепсиса 22 % пациентов имели гипокоагуляционный, а 30 % — гиперкоагуляционный паттерн ТЭГ. У большинства пациентов исходные характеристики ТЭГ сохранялись на протяжении четырех суток наблюдения. Развитие гипокоагуляции в любой из дней исследования являлось независимым фактором риска летального исхода. Выявление паттерна гиперкоагуляции на фоне сепсиса не имело прогностического значения, летальность пациентов данной группы достоверно не отличалась от группы нормокоагуляции. Связь гипокоагуляционных нарушений ТЭГ/ТЭМ, развившихся на фоне сепсиса, с неблагоприятным исходом была подтверждена и в ряде других исследований [8], что согласуется с наличием у данной группы больных явного синдрома ДВС. Тест генерации тромбина также относится к интегральным тестам гемостаза. Наибольшее распространение получила методика с флуоресцентной детекцией и автоматизированным расчетом количества тромбина, предложенная C. Hemker. Допустимое содержание тромбоцитов в плазме зависит от задачи исследования. С практической точки зрения предпочтительнее использование бедной тромбоцитами плазмы, так как это позволяет замораживать и хранить образцы, а также упрощает процедуру межлабораторного контроля. Данные исследований по оригинальной методике C. Hemker, выполненных в ранние сроки развития сепсиса, противоречивы. В ряде наблюдений не продемонстрировано повышения генерации тромбина, которое могло бы объяснить гиперкоагуляционный статус пациентов [10]. Напротив, в исследовании отечественных авторов отмечено повышение генерации тромбина у пациентов с абдоминальным сепсисом [11]. В связи с этим представляет интерес модификация теста генерации тромбина с добавлением рекомбинантного человеческого тромбомодулина (активатора протеина С), что позволяет в какой-то степени моделировать условия коагуляции in vivo. Доза тромбомодулина подбирается таким образом, чтобы на 50 % снизить площадь под кривой концентрации тромбина (так называемый эндогенный тромбиновый потенциал, ETP) и на 40 % пиковую концентрацию тромбина (Peak) в плазме здоровых доноров. Недостаточное снижение Peak и ETP свидетельствует об аномалиях в системе протеина C. Вопрос о сочетании гиперкоагуляционного статуса пациентов с сепсисом (на основании ТЭГ/ТЭМ скрининга) и других маркеров гиперкоагуляции, а также прогностическое значение таких сочетаний является объектом нашего исследования.
Цель исследования — оценить частоту выявления отдельных маркеров гиперкоагуляции у септических пациентов с гиперкоагуляционным паттерном ТЭГ/ТЭМ и их связь с исходом заболевания.
Проспективно и ретроспективно были обследованы 85 пациентов (58 мужчин и 27 женщин), находившихся в отделении хирургической интенсивной терапии с диагнозом сепсиса. Медиана возраста 60 (50–66) лет. 70 из 85 пациентов имели абдоминальную локализацию первичного септического очага (перитонит, панкреатит, холангит и т. п.). В ряде случаев достоверная локализация первичного септического очага оставалась неопределенной (например, при обнаружении инфильтратов легочной ткани одновременно с гнойным холангитом). Во всех случаях диагноз сепсиса был установлен на основании текущих рекомендаций Surviving Sepsis Campaign и Согласительной конференции Sepsis-3. В большинстве случаев (более 70 %) системные инфекции были вызваны грамотрицательными палочками, реже — грамположительными кокками. Верификация возбудителя не всегда была возможна (например, при панкреатите). В качестве суррогатных маркеров, подтверждающих бактериальную этиологию системной воспалительной реакции, нами было использовано сочетание уровней прокальцитонина (пороговое значение выше 2 мкг/л) и C-реактивного белка (пороговое значение выше 50 мг/л). Лечение сепсиса проводили в соответствии с рекомендациями Surviving Sepsis Campaign. Рутинное использование антикоагулянтов для профилактики тромбоэмболических событий было затруднено необходимостью повторных хирургических вмешательств, установкой новых дренажей и т. п. Таким образом, в большинстве наблюдений антикоагулянтная терапия в виде инфузии нефракционированного гепарина или подкожного введения низкомолекулярного гепарина носила непостоянный, «мозаичный» характер. При выраженном дефиците антитромбина (менее 40 %) использовали лиофилизированные препараты антитромбина или свежезамороженную плазму. Тесты ROTEM выполняли всем пациентам при установлении диагноза сепсиса, а также пациентам с впервые выявленными уровнями C-реактивного белка и прокальцитонина выше пороговых значений (см. выше). Определение коагуляционного статуса в объеме скрининговой коагулограммы, антитромбина и D-димера проводили на ежедневной основе. Кратность повторения тестов ТЭМ зависела от клинической ситуации (чаще при кровотечении). Кровь забирали в вакуумные пробирки с 3,2 % цитратом натрия (Vacutainer, BD, США), как правило, из артериального либо центрального венозного катетера. Тромбоэластометрию из образцов цельной (цитратной) крови выполняли на приборах ROTEM Delta или ROTEM Gamma (TEM International, Германия). Использовали оригинальные реагенты EXTEM, INTEM, FIBTEM (TEM International, Германия). Критериями гиперкоагуляции считали следующие: CTextem < 45 с, CTintem < 120 с, MCF > 72 мм, TPI > 3,5, α > 78°. Из образцов стабилизированной цитратом натрия крови получали бедную тромбоцитами плазму путем двухступенчатого центрифугирования при 2500G по 15 мин (Eppendorf Centrifuge 5804, Eppendorf, Германия). Далее пробы были аликвотированы и заморожены при –85 °С. Определение протромбинового индекса, активированного парциального тромбопластинового времени, фибриногена, фактора фон Виллебранда выполняли на приборе STA Compact (Diagnostica Stago, Италия) с использованием оригинальных реагентов. Для определения антитромбина, протеина C, протеина S на том же оборудовании использовали реагенты Stachrom ATIII, Stachrom Protein C, Staclot Protein S соответственно. Активность факторов V и VIII измеряли на коагулометре ACL TOP 300 (Instrumentation Laboratory, США) с использованием оригинальных реагентов. Содержание D-димера и прокальцитонина определяли на анализаторе VIDAS (bioMerieux, Франция). Тест генерации тромбина выполняли в лаборатории свертывания крови Федерального государственного бюджетного учреждения «Российский научно-исследовательский институт гематологии и трансфузиологии». Была использована методика Calibrated Automated Thrombogram (Thrombinoscope BV, Нидерланды) c применением планшетного флуориметра Fluoroscan Ascent (ThermoFisher Scientific, Финляндия). Параллельно выполняли стандартный тест генерации тромбина и тест с добавлением рекомбинантного человеческого тромбомодулина, по результатам которых оценивали эндогенный тромбиновый потенциал (ETP), пиковую концентрация тромбина (Peak) и степень снижения показателей ETP и Peak (в %). Результаты тестов ROTEM, скрининговой коагулограммы, уровня антитромбина и D-димера были доступны персоналу отделения реанимации в режиме реального времени и могли влиять на принятие решений о назначении/отмене антикоагулянтной терапии. Остальные коагуляционные тесты (протеин C, протеин S, фактор фон Виллебранда, фактор V, фактор VIII, тест генерации тромбина) выполняли из замороженных образцов, и информация о них была доступна только ретроспективно. Для диагностики явного синдрома ДВС были использованы критерии ISTH overt DIC (Taylor FB, 2001). Тип распределения параметрических переменных оценивали с помощью теста Шапиро—Вилкоксона. Переменные представлены либо в виде M ± SD (нормальный тип распределения), либо Me (Q1–Q3) (распределение, отличающееся от нормального). В зависимости от типа данных, различия между группами оценивали с применением критерия t-test, метода Манна—Уитни, точного критерия Фишера. Зависимость между отдельными переменными оценивали с помощью коэффициента корреляции Пирсона. Критическим уровнем значимости считали p < 0,05. Статистический анализ данных проводили с помощью программы MedСalc версии 19.0.3.
На основании данных 28-суточной выживаемости пациенты были разделены на выживших (n = 62) и умерших (n = 23). Группы не имели достоверных различий по полу и возрасту. Интервал времени от выявления факта гиперкоагуляции до выписки из стационара (для выживших) либо до летального исхода также не отличался. Оценка по шкале SOFA в группе умерших была достоверно выше (6 (4–10) баллов), чем у выживших (4 (3–5) балла), число пациентов в состоянии дистрибутивного шока, потребовавшем инфузии вазопрессоров, также достоверно различалось, 8 и 6 соответственно (p = 0,01) (табл. 1). Наиболее частым признаком гиперкоагуляции по результатам тромбоэластометрии являлась максимальная плотность сгустка в тестах INTEM, различия между группами не достоверны. Индекс тромбодинамического потенциала, отражающего как плотность, так и кинетику образования сгустка, также достоверно не отличался в группах выживших и умерших: TPI 5,9 (5,1–7,4) и 6,7 (4,9–8,3) соответственно (р = 0,5). Тесты генерации тромбина, пригодные для оценки, выполнены у 59 пациентов, из них 43 — выжившие, 16 — умершие. При выполнении данного теста гиперкоагуляция (повышение эндогенного тромбинового потенциала и пиковой концентрации тромбина) в нативном тесте генерации тромбина наблюдалась лишь в семи случаях. В остальных же пробах генерация тромбина была в пределах нормальных значений или снижена. Пиковые значения генерации тромбина достоверно отличались: 210 ± 91 нмоль/л у выживших, 148 ± 86 нмоль/л у умерших, р = 0,02. При выполнении тестов с добавлением рекомбинантного человеческого тромбомодулина в 41 случае (68 %) наблюдалась низкая чувствительность к тромбомодулину, проявлявшаяся недостаточным подавлением ETP и Peak. Группы выживших и умерших достоверно не различались по степени снижения ЕТР: 20 (10–25) % и 14 (10–31) % соответственно, и Peak: 8 (2,9–16) % и 7 (3–18) % соответственно (табл. 2). Результаты модифицированного теста генерации тромбина с тромбомодулином указывают на недостаточность в системе протеина С, что подтверждается более низким уровнем протеина С в группе умерших по сравнению с выжившими (64,9 ± 25 % и 79,5 ± 28 % соответственно, р = 0,04). В качестве стандартных (скрининговых) показателей коагулограммы оценивали концентрацию фибриногена, протромбиновый индекс и активированное парциальное тромбопластиновое время (табл. 1). Значимой корреляции между отдельными параметрами интегральных тестов и показателями скрининговой коагулограммы не наблюдалось.
Таблица 1. Общая характеристика пациентов в зависимости от исхода
Table 1. Demographics and clinical characteristics of patients depending on outcome
| Показатель | Выжившие | Умершие | p |
|---|---|---|---|
| Возраст, лет | 59 (50–66) | 64 (56–69) | 0,2 |
| Прокальцитонин в день исследования, мкг/л | 1,9 (0,3–5) | 3,2 (1,2–6,5) | 0,1 |
| С-реактивный белок, мг/л | 120 (71–223) | 197 (126–289) | 0,03 |
| Билирубин мкмоль/л | 16 (9–30) | 42 (17–129) | 0,001 |
| Креатинин мкмоль/л | 72 (60–108) | 130 (73–214) | 0,006 |
| Лейкоциты, 109/л | 12 (9–16) | 14 (11–17) | 0,09 |
| Тромбоциты, 109/л | 289 (204–406) | 226 (211–334) | 0,09 |
| Фибриноген, г/л | 5,5 ± 1,8 | 6,0 ± 2,4 | 0,3 |
| Протромбиновый индекс по Quick, % | 66 ± 18 | 61 ± 19 | 0,3 |
| Активированное парциальное тромбопластиновое время, с | 41,9 (35–52) | 47,1 (38–56) | 0,2 |
| Фактор V, % | 104 (89–130) | 102 (82–132) | 0,9 |
| Фактор VIII, % | 226,4 ± 66 | 276,6 ± 94 | 0,03 |
| Фактор фон Виллебранда, % | 269 ± 129 | 435 ± 181 | 0,02 |
| D-димер, мкг/л | 2157 (1341–3964) | 3253 (1911–6914) | 0,009 |
| Оценка по шкале ISTH DIC score, баллы | 3,5 ± 1,2 | 4,0 ± 1,1 | 0,09 |
| Оценка по SOFA, баллы | 4 (3–5) | 6 (4–10) | < 0,0001 |
| Койко-дни (до выписки или смерти) | 20 (12–30) | 20 (9–35) | 0,897 |
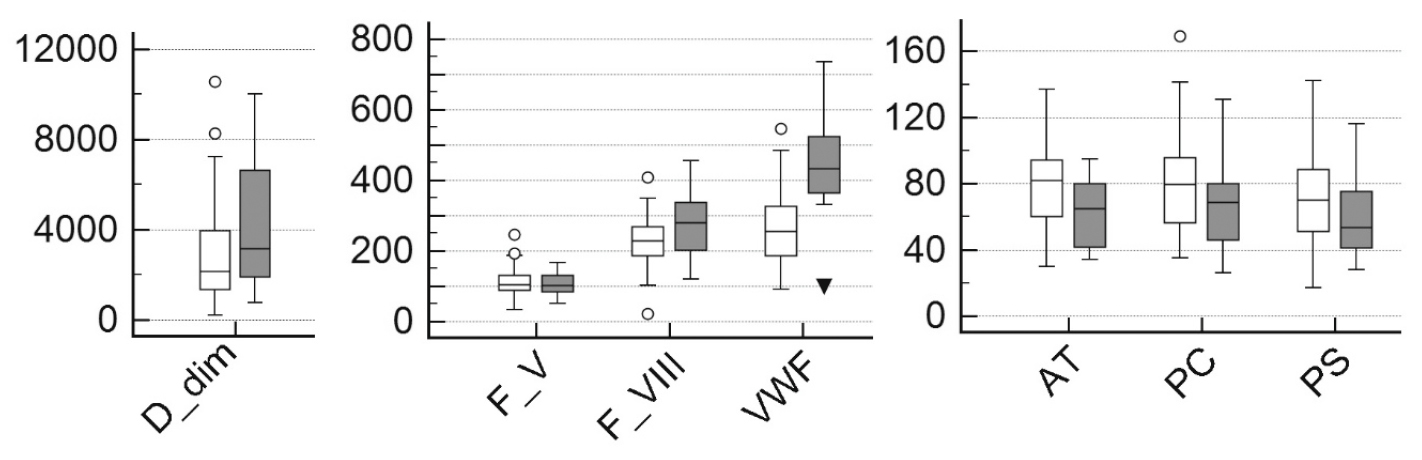
Активность протеина C, фактора VIII, фактора фон Виллебранда, антитромбина и содержание D-димера достоверно отличались в группах выживших и умерших. Для протеина S и фактора V различия были не достоверны (табл. 2, рис. 1). Короткоживущий витамин К-независимый фактор V в данном случае характеризует нормальную синтетическую функцию печени в обеих группах. Интересно, что уровни специфических маркеров гиперкоагуляции очень слабо коррелировали между собой, т. е. каждый пациент имел свой индивидуальный «отпечаток» маркеров. Исключением является корреляция активности антитромбина и протеина C (r = 0,459, p < 0,0001).
Таблица 2. Данные интегральных тестов коагуляции и уровни физиологических антикоагулянтов
Table 2. Viscoelastic tests results and anticoagulants levels
| Показатель | Выжившие | Умершие | p |
|---|---|---|---|
| Время тромбообразования CTextem, с | 76,5 (64–90) | 86,5 (68–129) | 0,1 |
| Время тромбообразования CTintem, с | 191 (167–216) | 184 (155–221) | 0,3 |
| Угол alpha ROTEM, градусы | 80,2 ± 2,1 | 80,1 ± 2,3 | 0,9 |
| Время формирования сгустка CFTextem, с | 47,5 (42–56) | 50,5 (42–59) | 0,5 |
| Время формирования сгустка CFTintem, с | 50 (40–58) | 48 (40–54) | 0,5 |
| Максимальная плотность сгустка MCFintem, мм | 74 (73–78) | 74 (73–78) | 0,6 |
| TPI | 5,9 (5,1–7,4) | 6,7 (4,9–8,3) | 0,5 |
| ETP, нмоль·мин | 1489 ± 592 | 1139 ± 573 | 0,4 |
| Peak, нмоль/л | 210 ± 91 | 148 ± 86 | 0,02 |
| ETP с тромбомодулином, нмоль·мин | 1199 ± 530 | 926 ± 445 | 0,07 |
| Peak с тромбомодулином, нмоль/л | 194 ± 91 | 135 ± 73 | 0,02 |
| Снижение ETP в тесте с тромбомодулином, % | 20 (10–25) | 14 (10–31) | 0,7 |
| Снижение Peak в тесте с тромбомодулином, % | 8 (2,9–16) | 7 (3–18) | 0,8 |
| Антитромбин, % | 82 (60–94) | 65 (41–80) | 0,003 |
| Протеин С, % | 79,5 ± 28 | 64,9 ± 25 | 0,04 |
| Протеин S, % | 69,4 ± 29,4 | 60,1 ± 25,7 | 0,17 |
Рис. 1. Уровни специфических маркеров гиперкоагуляции в группе выживших (белые прямоугольники) и умерших пациентов
Fig. 1. Levels of specific markers of hypercoagulability in survivors (white boxes) and nonsurvivors

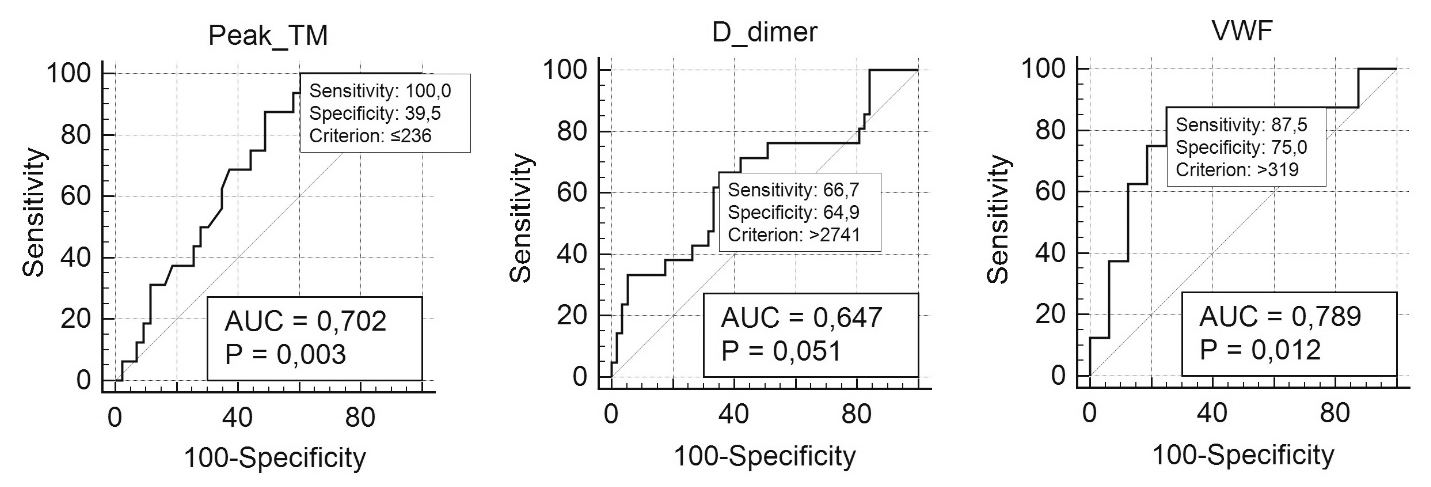
Как следует из анализа ROC (receiver operating characteristic) кривых (рис. 2), все исследованные маркеры в сочетании с гиперкоагуляционным паттерном ТЭМ имеют относительно невысокую прогностическую способность. Наибольший показатель площади под кривой выявлен у фактора фон Виллебранда (0,789; p = 0,012). Для сравнения: оценка по шкале SOFA (площадь под кривой 0,750, p < 0,001). Из-за малого количества наблюдений прогностическая ценность приведенных ROC-кривых достоверно не различалась.
Рис. 2. Примеры ROC-кривых прогностической способности отдельных маркеров гиперкоагуляции
Fig. 2. ROC curves examples of prognostic values of hypercoagulability markers
Мы установили, что пациенты с сепсисом, имеющие одинаковый ТЭМ-паттерн гиперкоагуляции, тем не менее имеют различную комбинацию маркеров тромбофилии, что ставит под сомнение попытки заместительной терапии коагулопатии каким-либо одним монокомпонентным препаратом. При планировании исследований по коррекции септической коагулопатии необходимо учитывать разнородность данной группы пациентов. Как отмечают критики, неудачи клинических исследований различных антикоагулянтов при сепсисе связаны с неспособностью идентифицировать пациентов, вероятность позитивного ответа на тестовый препарат у которых выше. В качестве примеров приводятся исследования активированного протеина C (кроме PROWESS), антитромбина, ингибитора пути тканевого фактора. Интересна история исследования тромбомодулина (SCARLET), негативно завершившегося совсем недавно [12]. Критерием включения в исследование был рост международного нормализованного отношения до 1,4 при уровне тромбоцитов от 30 до 150·109/л. В большинстве случаев сепсиса такое сочетание будет наблюдаться при развитии явного ДВС. Получается, препарат, основным (но не единственным) действием которого является запуск естественных антикоагулянтных механизмов, предлагалось вводить уже в гипокоагуляционную фазу ДВС. Возможно, для введения препарата лучше было бы выбрать более подходящее терапевтическое окно в фазе гиперкоагуляции, а также предварительно проверить весьма вариабельный эффект тромбомодулина in vitro (например, в тесте генерации тромбина с тромбомодулином).
Мы считаем, что при выявлении гиперкоагуляции при сепсисе необходимо измерение уровня физиологических антикоагулянтов (антитромбин, протеин C), поскольку это потенциально открывает новые терапевтические возможности. Определенную прогностическую ценность имеют D-димер, фактор VIII, фактор фон Виллебранда и снижение уровня генерации тромбина. Однако количество исследуемых факторов, их последовательность и кратность тестов остаются неизвестными и требуют дальнейшего анализа, поскольку непосредственный процесс перехода от гиперкоагуляции к явному ДВС в клинических условиях детально не изучен.
Пациенты с сепсисом, имеющие признаки гиперкоагуляции по критериям ТЭГ/ТЭМ, имеют различные сочетания маркеров тромбофилии, что требует индивидуализации антикоагулянтной терапии. Риск развития явного синдрома ДВС и летального исхода возрастает при выявлении низкого уровня антитромбина, протеина C, а также высокого уровня фактора VIII, фактора фон Виллебранда, D-димера. Риск летального исхода также возрастает при снижении пиковых значений тромбина и эндогенного тромбинового потенциала в тесте генерации тромбина. Скрининговые коагуляционные тесты не оказывают влияния на прогноз при сепсисе.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Осовских В.В., Васильева М.С., Баутин А.Е., Киселева Л.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.