Позвоночно-спинномозговая травма шейного отдела в большинстве случаев сопровождается респираторными нарушениями (до 80 % от общего количества осложнений). Прекращение нисходящей эфферентной импульсации ниже уровня повреждения спинного мозга приводит к денервации дыхательной мускулатуры с развитием параличей и парезов дыхательных мышц различной степени выраженности в зависимости от уровня и степени повреждения спинного мозга. Альвеолярная гиповентиляция и нарушение дренажной функции легких способствуют задержке секрета в трахеобронхиальном дереве и развитию инфекционно-воспалительных изменений в легких. Развитие острой дыхательной недостаточности, как правило, требует проведения длительной искусственной вентиляции легких, которая сама по себе оказывает повреждающее воздействие на паренхиму легких и является фактором риска развития пневмонии [1–3]. Известно, что именно пневмония — наиболее распространенное осложнение у пациентов с позвоночно-спинномозговой травмой шейного отдела. В ранее выполненном исследовании нами было определено влияние фактора срочности проведения хирургической декомпрессии спинного мозга на частоту развития пневмонии и показано, что выполнение декомпрессии спинного мозга в первые 8 ч от момента травмы уменьшало частоту развития пневмонии на 26,6 % [4].
Нозокомиальная пневмония может вызываться различными возбудителями и иметь полимикробный характер, но наиболее часто ее вызывают аэробные грамотрицательные микроорганизмы, такие как Pseudomonas аeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae, Escherichia coli, Proteus mirabilis, Stenotrophomonas maltophilia [5, 6]. Госпитальная микрофлора, как правило, отличается высоким уровнем устойчивости к антибактериальным препаратам различных классов. Проведенные в последнее время исследования показывают нарастающий рост устойчивости внутрибольничных штаммов не только к антимикробным препаратам первого ряда, но и к препаратам резерва. Высокая вероятность неэффективности стандартной антибактериальной терапии нозокомиальной пневмонии определяет необходимость микробиологического мониторинга, раннего выявления этиологического патогена, детекции факторов устойчивости для проведения своевременной целенаправленной антимикробной терапии [7, 8]. Рост уровня антибиотикорезистентности и отсутствие в клинической практике антимикробных препаратов, целенаправленно действующих с учетом выявленных карбапенемаз, создают негативный фон относительно возможностей антибактериальной терапии и благоприятных результатов лечения нозокомиальной пневмонии.
С учетом того, что пациенты с осложненной травмой шейного отдела позвоночника требуют длительного периода интенсивного наблюдения и лечения в условиях отделения реанимации и интенсивной терапии, представляет интерес изучение микробной флоры при развитии госпитальной пневмонии у этой категории больных, что и определило цель нашего исследования.
Цель исследования — изучить этиологическую структуру и антибиотикорезистентность возбудителей госпитальной пневмонии у пациентов с осложненной травмой шейного отдела позвоночника.
В ретроспективное исследование включены 418 бактериальных изолятов, выделенных из эндотрахеального аспирата, бронхоальвеолярного лаважа у 29 пациентов с травмой спинного мозга с госпитальной пневмонией, находившихся на лечении в отделении реанимации и интенсивной терапии в периоды 2012–2013 гг. и 2017–2018 гг. Дизайн исследования представлен на рис. 1.
Рис. 1. Блок-схема дизайна исследования
APACHE — Acute Physiology and Chronic Health Evaluation; ASIA — American Spinal Injury Association (шкала тяжести повреждения спинного мозга, где A — отсутствие функций, B — только сенсорная функция, C — сохранение некоторой сенсорной и двигательной функции, D — полезная моторная функция); CPIS — Clinical Pulmonary Infection Score; SOFA — Sepsis-related Orqan Failure Assesment.
Fig. 1. Study design flowchart

Все пациенты были госпитализированы в Федеральное государственное бюджетное учреждение «Новосибирский НИИТО им. Я.Л. Цивьяна» по экстренным показаниям в связи с позвоночно-спинномозговой травмой шейного отдела. Всем больным было выполнено хирургическое лечение, направленное на декомпрессию содержимого позвоночного канала, восстановление биомеханической оси и стабилизацию травмированного отдела позвоночника. После завершения хирургического этапа лечения с целью проведения комплекса мероприятий интенсивной терапии больные переводились в отделение реанимации и интенсивной терапии. Основные характеристики пациентов представлены в табл. 1.
Таблица 1. Основные характеристики пациентов
Table 1. Key characteristics of patients
Характеристики |
Этапы исследования, гг. |
U-критерий Манна—Уитни, p-уровень |
|
|---|---|---|---|
2012–2013 |
2017–2018 |
||
Количество пациентов, n |
14 | 15 | |
Количество выделенных штаммов, n |
215 | 213 | |
Возраст пациентов, лет |
25 (20,5–40,25) | 28,5 (24,25–40) | 0,662 |
Неврологический дефицит, ASIA A, n (%) |
13 (92,9 %) | 10 (66,7 %) | 0,169 |
ASIA B, n (%) |
1 (7,1 %) | 5 (33,3 %) | |
Длительность операции, мин |
142,5 (107,5–168) | 142 (110–165) | > 0,999 |
Кровопотеря, мл |
375 (187,5–662,5) | 275 (162,5–400) | 0,380 |
APACHE II, баллы |
11 (8,25–12,75) | 8,5 (8–9,75) | 0,086 |
SOFA, баллы |
5 (3,25–6) | 4,5 (2,25–5) | 0,239 |
CPIS, баллы |
10 (8,25–11) | 8 (7–9,75) | 0,051 |
Сроки диагностирования пневмонии, сут |
5 (4–8) | 4.5 (3,25–6) | 0,500 |
Длительность искусственной вентиляции легких, сут |
30 (17,75–62,5) | 19,5 (17–25,5) | 0,141 |
Длительность госпитализации в отделении реанимации и интенсивной терапии, сут |
37,5 (24,5–69) | 26,5 (24,25–35) | 0,240 |
Основные направления мероприятий интенсивного лечения также не имели принципиальных отличий и заключались в осуществлении респираторной терапии и поддержании гемодинамики. Целевыми показателями при проведении искусственной вентиляции легких были: SaО2 > 96 %, напряжение углекислого газа в артериальной крови (РаСО2) 35–45 мм рт. ст., напряжение кислорода в артериальной крови (РаО2) > 65 мм рт. ст., рН 7,35–7,45. Комплекс мероприятий, направленных на профилактику вентилятор-ассоциированной пневмонии, включал: использование бактериальных фильтров, одноразовых контуров, закрытых аспирационных систем; аспирацию из области надманжеточного пространства; подогрев и увлажнение дыхательной смеси.
Диагноз нозокомиальной пневмонии устанавливали на основании выявления у больного не менее чем через 48 ч после госпитализации клинической картины инфекции, ухудшения показателей газообмена и наличия инфильтративных изменений при рентгенологическом исследовании. При манифестации госпитальной пневмонии назначалась стартовая эмпирическая антибактериальная терапия, которая основывалась на российских национальных рекомендациях «Нозокомиальная пневмония у взрослых» [5]. При этом учитывалось наличие факторов риска полирезистентной флоры, локальных данных микробиологического пейзажа отделения реанимации и интенсивной терапии с учетом природной и приобретенной резистентности. Далее производились посевы биологических сред, по результатам антибиотикограммы назначалась целенаправленная антибиотикотерапия.
Идентификация микроорганизмов и определение чувствительности проводили в микробиологической лаборатории на автоматическом анализаторе VITEK 2 COMPACT (bioMerieux, Франция). Чувствительность к антимикробным препаратам у выделенных штаммов определялась с помощью диско-диффузного метода компании BD и полосок для определения минимальной подавляющей концентрации градиентным методом компании bioMerieux на агаре Мюллера—Хинтон в соответствии с критериями EUCAST v. 6.0 и российскими клиническими рекомендациями «Определение чувствительности микроорганизмов к антимикробным препаратам», версия 2015-02 [9, 10]. Учитывались штаммы, резистентные к антибактериальным препаратам.
Малый размер сравниваемых групп не позволил провести проверку необходимых условий нормальности и гомоскедастичности для t-критерия Стьюдента с ошибкой второго рода меньше 20 %, поэтому для сравнения непрерывных показателей между группами использовался непараметрический непарный U-критерий Манна—Уитни. Описательные статистики непрерывных показателей представлены в виде медианы (первый квартиль; третий квартиль). Сравнение бинарных показателей проводилось точным двусторонним критерием Фишера с оценкой отношения шансов первой группы ко второй и построением 95%-го доверительного интервала (95% ДИ) для отношения шансов. Бинарные показатели представлены в виде количества и процента в группе с расчетом 95% ДИ для процентов по формуле Вилсона. Проверка статистических гипотез проводилась при критическом уровне значимости p = 0,05, т. е. различие считалось статистически значимыми для p < 0,05.
Статистические расчеты проводились в программе Rstudio (версия 1.2.5001 — © 2009–2019 RStudio, Inc., USA, URL: https://www.rstudio.com/) на языке R (версия 3.6.1, URL: https://www.R-project.org/).
Проведение исследования одобрено локальным этическим комитетом Федерального государственного бюджетного учреждения «ННИИТО им. Я.Л. Цивьяна» Минздрава России (Протокол заседания № 010/20 от 5 марта 2020 г.).
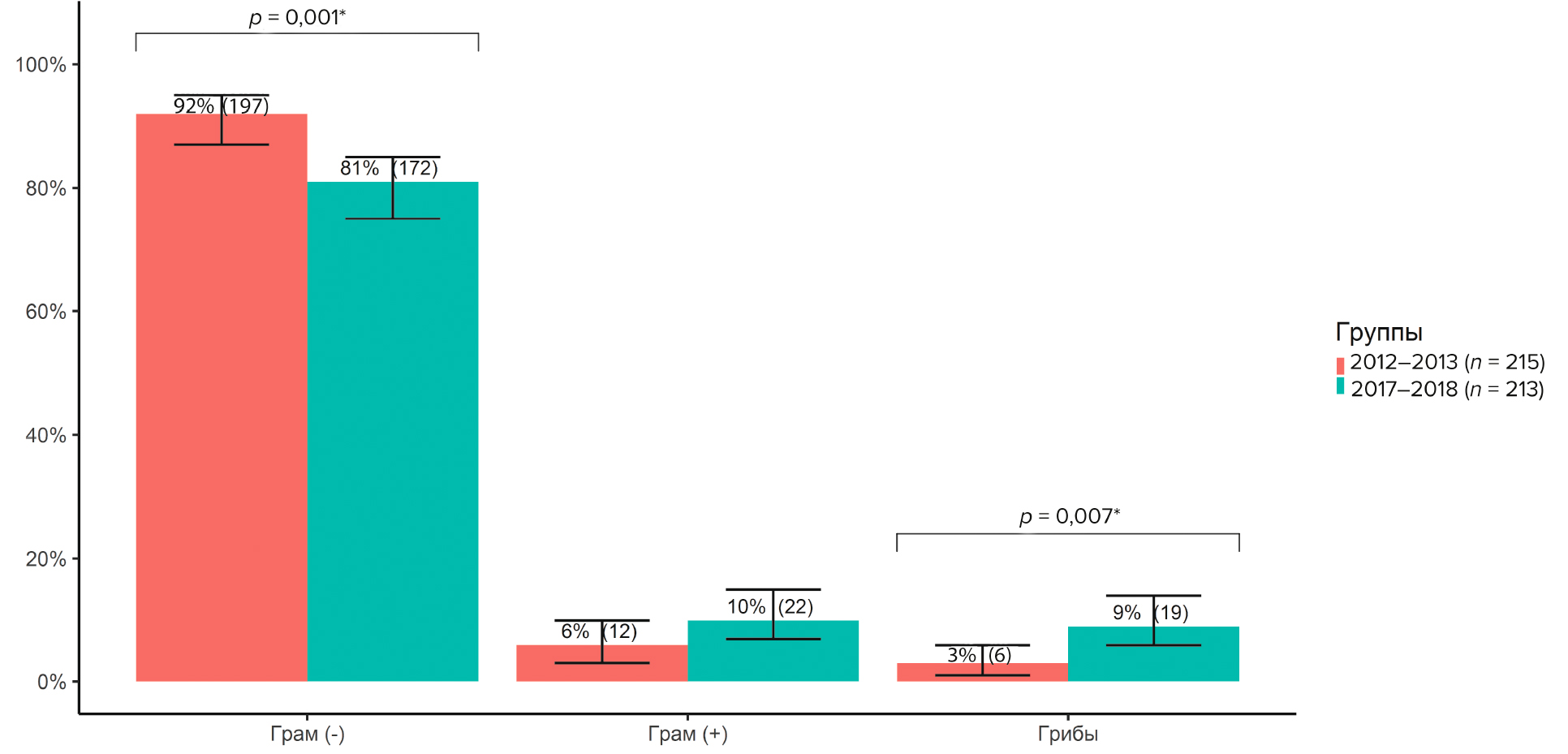
Из 428 бактериальных изолятов грамотрицательная флора выделена в 86,2 % (369 штаммов), грамположительная — в 7,9 % (34 штамма), грибковая флора — в 3,5 % (15 штаммов). Результаты частоты выделения грамотрицательной, грамположительной и грибковой флоры из нижних дыхательных путей в 2012–2013 гг. и 2017–2018 гг. представлены на рис. 2. Доля грамотрицательной флоры в 2012–2013 гг. составила 91,6 % (197 штаммов; 95% ДИ 87,2–94,6), в 2017–2018 гг. — 80,8 % (172 штамма; 95% ДИ 74,9–85,5), разница между группами статистически значимая (ОШ 0,4; 95% ДИ 0,2–0,7; p = 0,001). Разница выделенной грамположительной флоры в группах статистически незначимая (ОШ 1,9; 95% ДИ 0,9–4,4; p = 0,076).
Рис. 2. Частота выделения грамотрицательной, грамположительной и грибковой флоры из нижних дыхательных путей у пациентов с осложненной травмой шейного отдела позвоночника в 2012–2013 гг. и 2017–2018 гг.
Fig. 2. Frequency of isolation of gram-negative, gram-positive and fungal flora from the lower respiratory tract in patients with complicated cervical spine injury in 2012–2013 and in 2017–2018
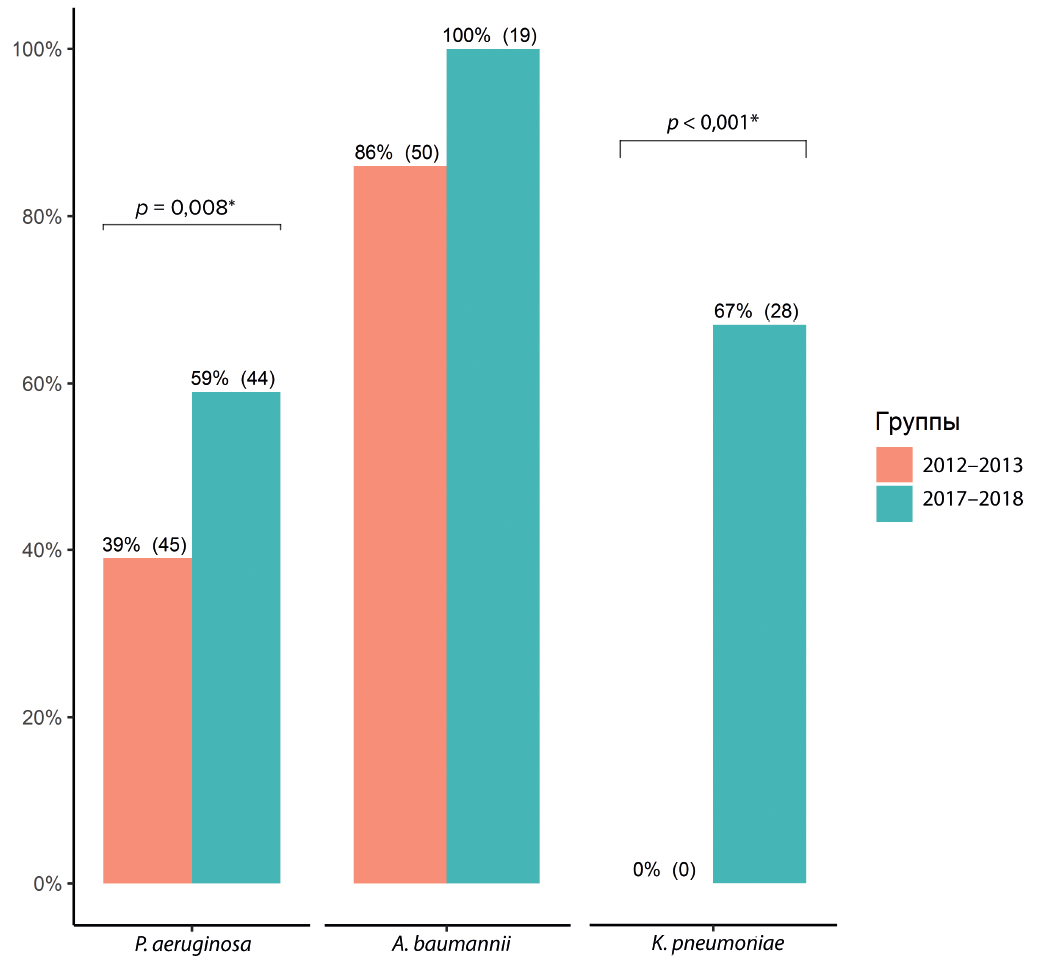
Наиболее частыми возбудителями госпитальной пневмонии как в 2012–2013 гг., так в 2017–2018 гг. были P. аeruginosa, A. baumannii, K. pneumoniae (рис. 3). При этом частота выделения P. аeruginosa в 2017–2018 гг. снизилась на 15,9 % (ОШ 0,5; 95% ДИ 0,3–0,8; p = 0,004), A. baumannii — на 18,4 % (ОШ 0,3; 95% ДИ 0,2–0,5; p < 0,001), тогда как частота встречаемости K. pneumoniae увеличилась на 16,8 % (ОШ 3,9; 95% ДИ 2–7,9; p < 0,001). В меньшей степени встречались P. mirabilis, Serratia spp., E. coli. Дополнительно в 2017–2018 гг. выделены Stenotrophomonas maltophilia — 6,9 % (12 штаммов) и M. morganii — 0,6 % (1 штамм).
Рис. 3. Частота выделения грамотрицательных микроорганизмов в 2012–2013 гг. и 2017–2018 гг., % от общего числа выделенных штаммов
Fig. 3. Frequency of isolation of gram-negative pathogens in 2012–2013 and 2017–2018, % of the total number of isolated strains

Данные по резистентности к антибактериальным препаратам представлены в табл. 2.
Таблица 2. Сравнительные данные по резистентности к антимикробным препаратам грамотрицательных бактерий, выделенных в 2012–2013 гг. и 2017–2018 гг.
Table 2. Comparative data on antimicrobial resistance of gram-negative bacteria isolated in 2012–2013 and 2017–2018
Антимикробные препараты |
Этапы исследования, гг. |
||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
2012–2013 |
2017–2018 |
2012–2013 |
2017–2018 |
2012–2013 |
2017–2018 |
2012–2013 |
2017–2018 |
2012–2013 |
2017–2018 |
2012–2013 |
2017–2018 |
2017–2018 |
|
Патоген, n, % |
|||||||||||||
Pseudomonas аeruginosa |
Acinetobacter baumannii |
Klebsiella pneumoniae |
Proteus mirabilis |
Serratia spp. |
Esherichia coli |
Stenotro |
|||||||
116 |
75 |
58 |
19 |
15 |
42 |
2 |
14 |
5 |
6 |
1 |
3 |
12 |
|
| Ципрофлоксацин | 62,1 | 56 | 100 | 94,7 | 60 | 95,2* | 50 | 0* | 0 | 0 | 0 | 33,3* | 0 |
| Цефтазидим | 62,1 | 56 | 100 | 100 | 60 | 95,2* | 50 | 0* | 0 | 0 | 0 | 33,3* | 0 |
| Цефепим | 76,7 | 64* | 100 | 100 | 80 | 95,2 | 0 | 0 | 100 | 16,7* | 0 | 33,3* | НП |
| Пиперациллин/ тазобактам | 28,4 | 35,3 | 96,6 | 100 | 20 | 95,2* | 0 | 0 | 100 | НП | 0 | НП | НП |
| Цефоперазон/ сульбактам | 55,2 | НП | 98,3 | 100 | 20 | 95,2* | 0 | 0 | 100 | НП | 0 | 33,3* | НП |
| Амоксиклав | НП | НП | НП | НП | 80 | 95,2 | 0 | 0 | 100 | 66,7* | 0 | 100* | НП |
| Амикацин | 32,8 | 54,7* | 98,3 | 94,7 | 66,7 | 71,4 | 0 | 0 | 100 | 0* | 0 | 33,3* | |
| Эртапенем | 0 | 95,2* | 0 | 0 | 0 | 0 | 0 | 0 | |||||
| Меропенем | 81,9 | 66,7* | 88,9 | 100 | 0 | 95,2* | 0 | 0 | 0 | 0 | 0 | 0 | |
| Тигециклин | 26,6 | 0 | 50 | НП | 60 | 0* | 0 | 0 | НП | ||||
| Полимиксин | НП | 0 | НП | 0 | НП | 0 | |||||||
НП — определение чувствительности не проводилось.
* Статистически значимо различающиеся показатели (p < 0,05).
Изоляты P. aeruginosa обладали высоким уровнем устойчивости ко всем классам исследуемых антимикробных препаратов. В динамике устойчивость P. аeruginosa к пиперациллину/тазобактаму увеличилась на 6,9 % (ОШ 1,4; 95% ДИ 0,7–2,8; р = 0,338), к амикацину — на 21,9 % (ОШ 2,5; 95% ДИ 1,3–4,7; р = 0,004), тогда как к ципрофлоксацину, цефтазидиму устойчивость снизилась на 6,1 % (ОШ 0,8; 95% ДИ 0,4–1,5; р = 0,451), к цефепиму — на 12,7 % (ОШ 0,5; 95% ДИ 0,3–1,1; р = 0,070), к меропенему — на 15,2 % (ОШ 0,4; 95% ДИ 0,2–0,9; р = 0,024).
Госпитальные штаммы A. baumannii обладали 100%-й устойчивостью к цефалоспоринам III и IV поколения как в 2012–2013 гг., так и в 2017–2018 гг. (табл. 2). К ингибиторзащищенным антибиотикам устойчивость превышала 95 % и увеличилась в 2017–2018 гг. до 100 %. Также отмечался высокий уровень устойчивости к меропенему, приближающийся к 90 % в 2012–2013 гг., а в 2017–2018 гг. — к 100 %. Статистически значимых различий между группами не выявлено.
Отмечался рост устойчивости штаммов K. pneumoniae к цефалоспорину III поколения и фторхинолону с 60 % в 2012–2013 гг. до 95,2 % в 2017–2018 гг. (ОШ 12,5; 95% ДИ 1,9–146,6; р = 0,003), к цефалоспорину IV поколения и ингибиторзащищенному амоксициллину — с 80 до 95,2 % (ОШ 4,8; 95% ДИ 0,5–64,2, р = 0,108), к ингибиторзащищенному пенициллину и цефалоспорину — с 20 до 95,2 % (ОШ 67,2; 95% ДИ 9,6–884; р < 0,001). Штаммов K. pneumoniae, устойчивых к карбапенемам, в 2012–2013 гг. не было, тогда как в 2017–2018 гг. 95 % штаммов были устойчивы к меропенему и эртапенему (р < 0,001). Вместе с тем у всех исследуемых штаммов K. pneumoniae в 2017–2018 гг. сохранялась чувствительность к тигециклину и полимиксину.
У одного из двух выделенных штаммов P. mirabilis в 2012–2013 гг. отмечалась устойчивость к ципрофлоксацину, цефтазидиму и тигециклину. Тогда как в 2017–2018 гг. все штаммы P. mirabilis были чувствительны ко всем классам исследуемых препаратов.
Все 5 штаммов Serratia spp., выделенные в 2012–2013 гг., были устойчивы к цефепиму, пиперациллину/тазобактаму, цефоперазону/сульбактаму, амоксиклаву и амикацину. В 2017–2018 гг. значимая устойчивость Serratia spp. была лишь к амоксиклаву (66,7 %).
Единственный штамм E. coli, выделенный в 2012–2013 гг., был чувствительный ко всем исследуемым антимикробным препаратам. Выделенные в 2017–2018 гг. 3 штамма E. coli были устойчивы к амоксиклаву, 1 штамм был устойчив к фторхинолонам, цефалоспоринам III и IV поколений, амикацину. Все штаммы E. coli сохраняли чувствительность к карбапенемам и тигециклину.
Stenotrophomonas maltophilia считается редким возбудителем госпитальной пневмонии. Частота выделения Stenotrophomonas maltophilia варьирует в зависимости от стационара, популяции пациентов, типа отделения реанимации и интенсивной терапии [5]. В нашем наблюдении штаммы Stenotrophomonas maltophilia в 2012–2013 гг. отсутствовали, тогда как в 2017–2018 гг. выделено 12 изолятов. Все выделенные штаммы Stenotrophomonas maltophilia были чувствительны к фторхинолонам и цефалоспоринам III и IV поколений.
Частота выделения из нижних дыхательных путей грамположительных микроорганизмов была выше в 2017–2018 гг. — 22 штамма (10,3 %), в 2012–2013 гг. — 12 штаммов (5,6 %) (табл. 3). Из грамположительных штаммов 2012–2013 гг. преобладали бактерии рода Staphyloccocus, в 2017–2018 гг. — бактерии рода Streptococcus. Метициллинрезистентность Staphyloccocus в 2012–2013 гг. составила 45,5 %, в 2017–2018 гг. — 50 % (ОШ 1,4; 95% ДИ 0,1–25,3; р > 0,999). Один штамм Enterococcus faecium, выделенный в 2017–2018 гг., был чувствителен к ванкомицину. Штаммы бактерий рода Streptococcus и грибы, выделенные из нижних дыхательных путей на поздних стадиях пневмонии, рассматривали скорее как результат колонизации, чем этиологически значимые.
Таблица 3. Количество выделенных грамположительных микроорганизмов в 2012–2013 гг. и 2017–2018 гг.
Table 3. The number of isolated gram-positive pathogens in 2012–2013 and 2017–2018
Патоген, n |
2012–2013 гг. |
2017–2018 гг. |
|---|---|---|
| Staphylococcus aureus | 11 | 2 |
| Staphylococcus epidermidis | 1 | 1 |
| Enterococcus faecium | – | 1 |
| Streptococcus oralis | – | 16 |
| Streptococcus pneumoniae | – | 2 |
Результаты оценки данных микробиологических исследований из нижних дыхательных путей показали, что грамотрицательная флора является ведущим этиологическим фактором госпитальной пневмонии у пациентов с осложненной травмой шейного отдела позвоночника.
В 2017–2018 гг. отмечено значительное увеличение доли микроорганизмов семейства Enterobacteriaceae с 11,6 до 38,3 % (p < 0,001). Рост значимости госпитальных штаммов энтеробактерий в России также подтверждается данными карты антибиотикорезистентности (AMRmap: https://amrmap.ru/). По данным российского исследования «МАРАФОН», грамотрицательные бактерии семейства Enterobacteriaceae являются наиболее частой причиной нозокомиальной инфекции. Так, в 2011–2012 гг., 2013–2014 гг. и 2015–2016 гг. доля изолятов семейства Enterobacteriaceae среди всех возбудителей нозокомиальных инфекций составляла соответственно 33,7, 43,1 и 48,2 % [11].
Как известно, P. аeruginosa, A. baumannii и бактерии семейства Enterobacteriaceae являются представителями микрофлоры внутрибольничной среды, объединенные аббревиатурой ESKAPE, ввиду высокой частоты встречаемости и способности к формированию вторичной резистентности к антибиотикам разных классов [12]. Кроме того, Всемирная организация здравоохранения отнесла P. аeruginosa, A. baumannii и энтеробактерии к группе микроорганизмов первоочередной важности, представляющих наибольшую угрозу для общественного здоровья, в отношении которых ведутся наиболее значимые исследования как в Российской Федерации, так и в других странах [13].
По нашим наблюдениям, P. аeruginosa является наиболее распространенным возбудителем госпитальной пневмонии с высоким уровнем устойчивости, превышающим 50 %, к фторхинолонам, цефалоспоринам III и IV поколений и карбапенемам (табл. 2). По данным исследования «МАРАФОН 2015–2016», устойчивость P. aeruginosa к пиперациллину/тазобактаму выявлена у 62 % изолятов, цефтазидиму — у 56,8 %, цефепиму — у 51,5 %, меропенему — у 55,5 % [14]. При этом в нашем исследовании в динамике в 2017–2018 гг. отмечается даже некоторое снижение устойчивости к большинству исследуемых антимикробных препаратов. В то же время в 2017–2018 гг. наблюдается статистически значимый рост количества штаммов с экстремальной резистентностью. В соответствии с международными критериями [15] фенотипом множественной резистентности (устойчивостью к антимикробным препаратам как минимум трех классов) обладали 26 штаммов (22,4 %) в 2012–2013 гг. и 4 штамма (5,3 %) P. aeruginosa в 2017–2018 гг. (ОШ 0,2; 95% ДИ 0–0,6; p = 0,002), а фенотипом экстремальной резистентности (устойчивостью к препаратам всех классов, за исключением одного или двух) — 45 (38,8 %) и 44 (58,7 %) штамма соответственно (ОШ 2,2; 95% ДИ 1,2–4,2; p = 0,008).
Штаммы бактерий рода Acinetobacter в нашем исследовании были вторыми по частоте встречаемости среди возбудителей госпитальной пневмонии у пациентов с осложненной травмой шейного отдела позвоночника. Исследование устойчивости демонстрировало высокий уровень резистентности к фторхинолонам, цефалоспоринам III и IV поколений, ингибиторзащищенным пенициллинам и карбапенемам, превышающий 88 % в 2012–2013 гг. и 94 % в 2017–2018 гг. (табл. 2). Авторы исследований, проведенных в 2010–2016 гг., также показывают высокий уровень резистентности A. baumannii к цефалоспоринам III и IV поколений (> 90 %), ципрофлоксацину (99 %), амикацину (89,2 %) и карбапенемам (> 70 %) [16–18]. Следует отметить, что вид A. baumannii обладает низкой природной чувствительностью к большинству β-лактамных антибиотиков. Практически единственным выбором для лечения госпитальной пневмонии, вызванной A. baumannii, оставался полимиксин В. В 2012–2013 гг. изолятов A. baumannii с фенотипом множественной и экстремальной устойчивости было соответственно 8 (13,8 %) и 50 (86,2 %) штаммов, тогда как в 2017–2018 гг. все исследуемые 19 штаммов были с фенотипом экстремальной устойчивости (увеличение доли экстремально резистентных штаммов A. baumannii статистически незначимо, р = 0,189). Таким образом, госпитальная пневмония, вызванная A. baumannii, представляет реальную угрозу и серьезную проблему в выборе антимикробных препаратов.
Наибольшие изменения в чувствительности наблюдались у штаммов K. pneumoniae. Отмечено статистически значимое увеличение устойчивости в 2017–2018 гг. по сравнению с 2012–2013 гг. к фторхинолонам и цефалоспоринам III поколения на 35 % (р = 0,003), к ингибиторзащищеным пенициллинам и цефалоспоринам — на 75 % (р < 0,001), а к карбапенемам — на 95 % (р < 0,001). Штаммов K. pneumoniae с фенотипом множественной устойчивости в 2012–2013 гг. было 73,3 % (11 штамов). Штаммов с фенотипом экстремальной устойчивости в 2012–2013 гг. не было. В 2017–2018 гг. штаммов с фенотипом множественной устойчивости и фенотипом экстремальной устойчивости было соответственно 11,9 % (5 штаммов) и 66,7 % (28 штаммов) (увеличение доли экстремально резистентных штаммов K. pneumoniae статистически значимо, p < 0,001). Штаммы K. pneumoniae с устойчивостью ко всем исследуемым препаратам отсутствовали.
В совокупности представители семейства Enterobacteriaceae в 2017–2018 гг. были на втором месте по этиологической значимости госпитальной пневмонии. Высокий уровень устойчивости Enterobacteriaceae в нашем наблюдении согласуется с данными других исследований. Так, по данным исследования «МАРАФОН 2015–2016», большинство изолятов семейства Enterobacteriaceae были устойчивы к оксиимино-β-лактамам: к цефотаксиму — 78,4 %, цефтазидиму — 67,2 %, цефепиму — 68,4 % и азтреонаму — 71,5 % [11]. Наиболее высокая устойчивость к карбапенемам наблюдалась среди изолятов K. pneumoniae: эртапенему — 41,6 %, меропенему — 12,2 %, имипенему — 11,9 %. В нашем исследовании мы наблюдали значительный рост устойчивости K. pneumoniae к фторхинолонам, цефалоспоринам III и IV поколений, ингибиторзащищенным пенициллинам. Штаммов K. pneumoniae, устойчивых к карбапенемам в 2012–2013 гг., не было, тогда как в 2017–2018 гг. 95 % штаммов K. pneumoniae были устойчивы к эртапенему и меропенему. В то же время сохранялась 100 % чувствительность к тигециклину и полимиксину, что позволяло сохранять эффективность антимикробной терапии госпитальной пневмонии, вызванной карбапенем-резистентными штаммами энтеробактерий.
В последние годы отмечается негативная тенденция по увеличению устойчивости грамотрицательных возбудителей нозокомиальных инфекций к антимикробным препаратам различных классов, включая карбапенемы. В нашем исследовании также отмечается высокий уровень карбапенем-резистентности, нарастающий в последние годы (рис. 4).
Рис. 4. Динамика устойчивости к меропенему нозокомиальных штаммов P. aeruginosa, A. baumannii, K. pneumoniae
Fig. 4. Dynamics of resistance to meropenem of nosocomial strains P. aeruginosa, A. baumannii, K.pneumoniae

Одной из причин, объясняющих глобальный рост резистентности к антимикробным препаратам, является рост количества штаммов, обладающих множественной резистентностью и продуцирующих различные β-лактамазы (KPC, VIM, IMP, NDM, OXA-48 и др.). Эпидемиологические исследования, проведенные в 2013–2016 гг., показывают, что 51,4 % госпитальных штаммов P. aeruginosa имели фенотип экстремальной резистентности, частота продукции метало-β-лактамаз составила 30,5 %. У штаммов A. baumannii фенотип экстремальной устойчивости выявлен у 64,4 % изолятов, частота продукции β-лактамаз — 76,2 %. Среди всех изолятов энтеробактерий продукция β-лактамаз расширенного спектра была выявлена у 67,8 %, а продукция карбапенемаз — у 14,4 %. [7, 11, 16–18]. Сравнение результатов, полученных нами, с данными предшествующих исследований свидетельствует о продолжающемся росте устойчивости P. aeruginosa, A. baumannii, K. pneumoniae к антимикробным препаратам и увеличении частоты выделения штаммов с фенотипом экстремальной резистентности (рис. 5).
Рис. 5. Динамика выделения штаммов P. aeruginosa, A. baumannii, K. pneumoniae с фенотипом экстремальной резистентности
Fig. 5. The dynamics of isolation of P. aeruginosa, A. baumannii, K. pneumoniae pathogens with an extreme resistance phenotype
Следует отметить, что этиология нозокомиальной пневмонии во многом определяется эпидемиологической обстановкой в клиническом подразделении и стационаре в целом. Несмотря на то что все пострадавшие являлись лицами молодого возраста с неотягощенным преморбидным фоном, наличие грубого неврологического дефицита в связи с осложненной травмой шейного отдела позвоночника, необходимость в длительной искусственной вентиляции легких (более 20 суток) и продолжительной госпитализации в отделении реанимации и интенсивной терапии (от 30 до 40 суток) после экстренного хирургического лечения создают предрасполагающие условия для присоединения госпитальной флоры и инфицирования нижних дыхательных путей.
В условиях присутствия в стационаре грамотрицательных штаммов с множественной устойчивостью к антимикробным препаратам в нашем отделении придается большое значение мониторингу микробной флоры и профилю резистентности к антибактериальным препаратам. Понимание текущей ситуации по антибиотикорезистентности в отделении реанимации и интенсивной терапии позволяет отказаться от ряда антибактериальных препаратов, например фторхинолонов и цефалоспоринов III и IV поколений, при проведении эмпирической антибактериальной терапии. В случае диагностирования госпитальной пневмонии используется режим деэскалации, назначение максимальных доз антибиотика, соблюдение режима дозирования и способа введения с учетом фармакодинамики и фармакокинетики препарата. Предпочтение отдается комбинированной антибактериальной терапии. Нет сомнений, что в условиях высокой антибиотикорезистентности диагностика этиологического патогена должна быть максимально быстрой, включая выявление механизмов устойчивости к антимикробным препаратам. Для быстрого выявления генов лекарственной устойчивости грамотрицательной флоры мы используем метод полимеразной цепной реакции с помощью анализатора GeneXpert (Cepheid, США). Этот метод позволяет существенно ускорить получение результата по выявлению карбапенемаз: диагностика занимает не более 1,5 ч. Детекция карбапенемаз обеспечивает возможность ранней целенаправленной антибактериальной терапии по «точечным» показаниям таких дорогостоящих препаратов, как недавно появившийся в клинической практике цефтазидим/авибактам. В целом это отвечает современным подходам в «индивидуализации» медицинской помощи, должно уменьшить вероятность селекции новых механизмов устойчивости и повысить эффективность антибактериальной терапии.
Как показывает наше исследование, грамотрицательные микроорганизмы являются ведущими возбудителями госпитальной пневмонии у пациентов с осложненной травмой шейного отдела позвоночника. Наиболее частыми патогенами, выделяемыми из нижних дыхательных путей, как в 2012–2013 гг., так и в 2017–2018 гг. были P. аeruginosa, A. baumannii, K. pneumoniae. При этом доля K. pneumoniae в 2017–2018 гг. увеличилась на 16,8 % (в 3,2 раза чаще), а доля микроорганизмов семейства Enterobacteriaceae — на 26,7 % (р < 0,001).
Анализ в динамике показывает рост устойчивости госпитальных грамотрицательных штаммов возбудителей нозокомиальной пневмонии к основным группам антимикробных препаратов и увеличение частоты выделения экстремально резистентных патогенов P. аeruginosa на 19,9 % (р = 0,008), A. baumannii — на 13,8 % (р = 0,189), K. pneumoniae — на 66,7 % (p < 0,001).
Рост уровня антибиотикорезистентности создает неблагоприятный фон относительно эффективности антимикробной терапии госпитальной пневмонии и определяет необходимость раннего выявления механизмов устойчивости как для назначения целенаправленной антибактериальной терапии, так и с целью эпидемиологического контроля.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Первухин С.А., Филичкина Е.А., Стаценко И.А., Пальмаш А.В., Витковская И.В., Лебедева М.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.