Внутренняя поверхность сосудистой стенки представлена однослойным образованием специализированных клеток — эндотелиоцитов. Согласно последним данным, эти клетки выполняют более ста физиологических функций (барьерную, сохранение онкотического и осмотического давления и др.) и участвуют в трофике сосудистой стенки, свертывании крови, иммунном ответе, ангиогенезе и т. д. В случае возникновения и прогрессирования ряда патологических реакций и процессов дисфункция эндотелиоцитов является одним из важных компонентов и часто определяет или задает единолично ключевой вектор развития атеросклероза, сепсиса, шока, реперфузионных и ишемических повреждений, генерализованных осложнений интоксикации, а также синдрома системной воспалительной реакции (СВР) вне зависимости от его этиологии (вследствие чрезмерной альтерации тканей и/или действия инфекционного агента) [1, 2]. Экстравазация жидкости в периферическом русле сердечно-сосудистой системы, генерализованная вазодилатация, а также тотальная потеря белков и осмотически активных веществ, возникающие вследствие дисфункции эндотелиоцитов или их гибели, последовательно и необратимо приводят к скоплению жидкости в интерстициальном пространстве, что на уровне целостного организма соответствует началу полиорганной недостаточности [3].
Таким образом, с одной стороны, эндотелиальная дисфункция способствует возникновению и прогрессированию критических состояний, с другой стороны, дисфункция эндотелиоцитов дополнительно утяжеляет течение СВР, способствуя распространению провоспалительных цитокинов за пределами гистогематических барьеров (что является дополнительным самостоятельным фактором их разрушения) и выходу активированных лейкоцитов за пределы сосудистой стенки с последующей инфильтрацией тканей [4]. Более того, нарушение барьерной функции эндотелия, которое отмечается при сепсисе, ухудшает прогноз основного заболевания [5]. Профилактика, коррекция и минимизация возможных последствий возникновения и прогрессирования СВР являются в настоящий момент одной из ключевых задач анестезиологии-реаниматологии.
Логично предположить, что наличие и выраженность противовоспалительных эффектов, т. е. способности предотвращать прогрессирование СВР и эндотелиальной дисфункции, безусловно, являются желаемым эффектом большого числа известных и исследуемых препаратов [6].
На сегодняшний день механизмы действия хлорида лития на эндотелиальные клетки при синдроме СВР остаются неизученными как в клинике, так и в эксперименте. До настоящего времени действие хлорида лития изучалось в основном лишь на таких органах, как головной мозг, миокард, почечный эпителий [7, 8]. В недавнем исследовании было показано, что хроническое введение хлорида лития в постреанимационном периоде после 10-минутной остановки сердца у крыс приводит к выраженной защите в нейрональных популяциях гиппокампа [9]. Другое исследование показало защитное действие хлорида лития при моделировании инфаркта миокарда у крыс, которое заключалось в уменьшении зоны инфаркта при его введении во время реперфузии в сравнении с контрольными животными и было опосредовано практически двукратным ростом содержания фосфорилированной формы киназы гликогенсинтазы 3β (GSK-3β) в миокарде [10].
С учетом важной роли эндотелиальной дисфункции при критических состояниях представляется актуальным изучение влияния хлорида лития на эндотелиоциты в эксперименте.
Цель исследования — изучить влияние хлорида лития на интенсивность апоптоза эндотелиоцитов в монослое in vitro под действием сывороток крови пациентов с СВР на фоне тяжелой сочетанной травмы.
Кровь больных с СВР на фоне тяжелой сочетанной травмы (n = 5; средний возраст 38,4 (29,8–42,4) года; средний балл тяжести повреждений по шкале ISS (Injury severity score) 34 (30–36)) для исследований забирали на вторые или третьи сутки после поступления при развитии СВР, которое определялось наличием 2 критериев и более, предложенных American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference [10]: температура > 38 или < 36 °C; частота сердечных сокращений > 90 уд./мин; частота дыхательных движений > 20/мин или парциальное давление углекислого газа (PCO2) < 32 мм рт. cт.; лейкоцитоз > 12×109/л или лейкопения < 4×109/л. В качестве контроля использовали биоматериал, полученный от 5 практически здоровых доноров, средний возраст 35,6 (28,7– 45,0) года. В каждой из групп было 3 мужчины и 2 женщины.
Эндотелиальные клетки линии EA.hy926 до эксперимента выращивали с использованием среды Dulbecco’s Modified Eagle Medium (Gibco, USA), содержащей 10 % эмбриональной телячьей сыворотки — Fetal Bovine Serum, FBS (HyClone, USA). В эксперименте в качестве контроля клетки инкубировали на протяжении 3 ч при 37 °С с 5% сывороткой того же качественного содержания. В качестве группы сравнения проводили эксперименты, где эндотелиоциты инкубировали с сывороткой крови здорового человека. Основная серия экспериментов была представлена опытами с инкубацией эндотелиальных клеток с сывороткой крови пациента с СВР без добавления хлорида лития и в его присутствии в конечных концентрациях 0,01; 0,1; 1 и 10 ммоль/л. Хлорид лития добавляли за 1 ч до смены сывороток. После окончания инкубации эндотелиоциты при 37 °С промывали исходной средой Dulbecco’s Modified Eagle Medium, фиксировали с помощью 2% раствора параформа и пермеабилизовывали 1% раствором Triton X-100. Окраску клеток проводили с помощью последовательного добавления первичных антител к VE-кадгерину (BD Biosciences, США), вторичных антител с флуоресцентным красителем Oregon Green 488 (Life Technologies, USA), с фаллоидином красным (Invitrogen, США) и красителем Hoechst 33342 (Life Technologies, США). Анализ полученных изображений осуществляли с помощью программ ImageJ 1.44p и MetaVue 4.6.
Для проведения вестерн-блоттинга эндотелиальные клетки линии EA.hy926 получали тем же способом, что описано выше. Затем клетки лизировали горячим буфером (62,5 мМ Трис-HCl, pH 6,8; 2% SDS; 10% глицерин; 50 мМ ДТТ (дитиотреитол), 0,01% бромфенолового синего) на протяжении 4 мин при +94 °С. Белки разделяли в 12% полиакриламидном геле и переносили на мембраны из поливинилиденфторида. Были использованы антитела к VE-кадгерину и клаудину (BD Biosciences, США), а также вторичные антитела, конъюгированные с пероксидазой хрена (BD Biosciences, США). Визуализацию проводили набором SuperSignal West Pico (Thermo Scientific, США). Для денситометрического анализа использовали программу Image Lab (BioRad, США).
Для определения выраженности апоптоза после инкубации все эндотелиальные клетки смывали раствором трипсина-версена, затем фиксировали 70% этанолом, после чего окрашивали йодистым пропидием. Клетки с фрагментированной дезоксирибонуклеиновой кислотой исследовали на проточном цитофлуориметре [12].
В процессе статистического анализа полученные данные представляли в виде среднего со стандартными отклонениями. Статистическая значимость различий количественных показателей рассчитывалась с помощью теста Манна—Уитни, а качественных — с помощью критерия χ2.
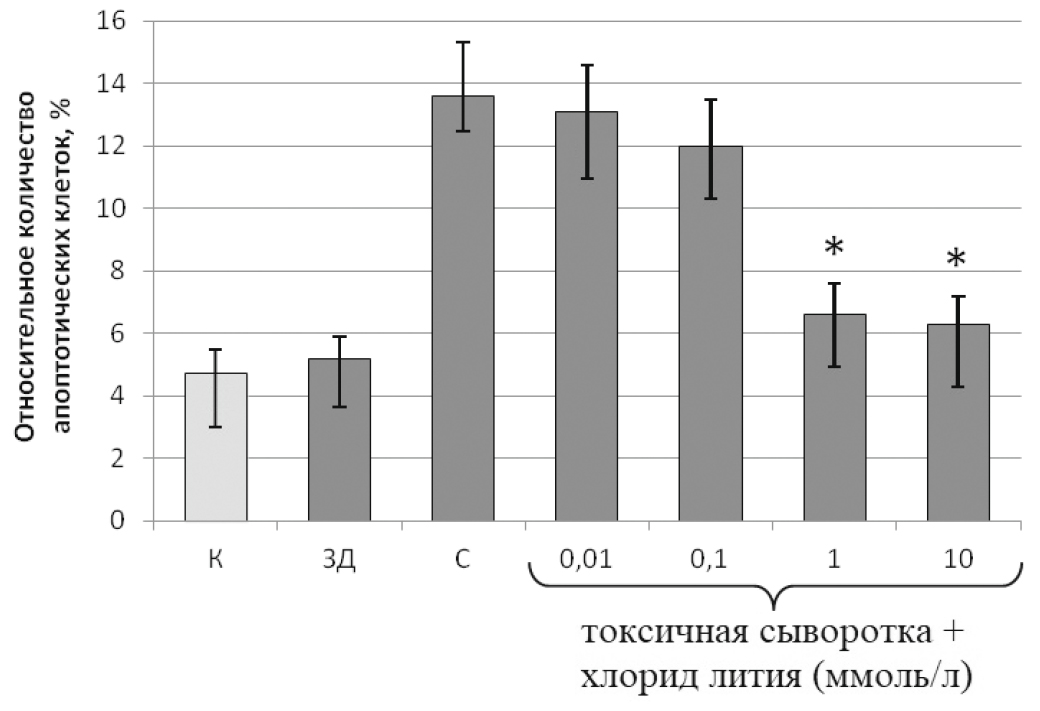
В норме in vivo эндотелий практически не подвергается апоптозу, но есть данные о том, что при СВР увеличивается количество апоптотических эндотелиальных клеток [13]. В моделях in vitro многие провоспалительные агенты, такие как липополисахарид, фактор некроза опухоли-α, интерлейкин-1, увеличивают апоптоз различных линий эндотелиальных клеток [14, 15]. В нашем исследовании инкубация с 5% сыворотками крови пациентов с СВР приводила к значительному увеличению количества апоптотических клеток (рис. 1).
Рис. 1. Влияние различных концентраций хлорида лития на уровень апоптоза эндотелиальных клеток, обработанных 5% сывороткой крови пациентов с СВР на фоне тяжелой сочетанной травмы
ЗД — сыворотка крови здоровых доноров; К — контрольная сыворотка крови FBS; С — токсичная сыворотка крови; С + литий — сочетание хлорида лития в указанных концентрациях с токсичной сывороткой.
Результаты представлены в виде среднего значения со стандартным отклонением.
* p < 0,05 по отношению к С.
Fig. 1. The effect of different concentrations of lithium chloride on the level of apoptosis of endothelial cells treated with 5 % serum of patients with systemic inflammatory response syndrome against the background of severe concomitant injury

Хлорид лития в концентрации 0,01 ммоль/л не обладал протективным действием на эндотелий. Прединкубация с хлоридом лития в концентрации 0,1 ммоль/л не оказывала статистически достоверного эффекта. В то же время хлорид лития в концентрациях 1 или 10 ммоль/л обладал выраженным протективным действием на эндотелий, снижая интенсивность апоптоза практически в 2 раза.
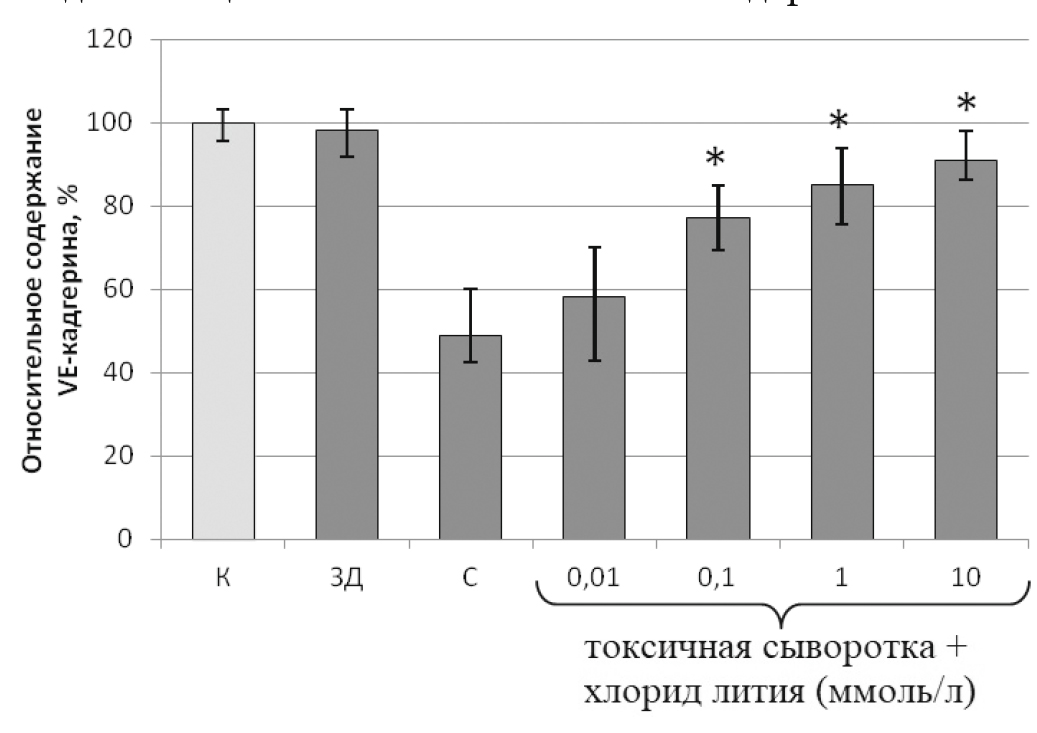
Согласно результатам иммунофлюоресцентной микроскопии, предварительная инкубация монослоя эндотелиоцитов с хлоридом лития в концентрациях 0,01 и 0,1 ммоль/л не оказывала достоверного влияния на разборку клаудина, актина и VE-кадгерина (рис. 2). В концентрациях 1 и 10 ммоль/л хлорид лития практически на 80 % (р < 0,01) снижал разрушение межклеточных контактов эндотелиального монослоя под действием токсичной сыворотки крови пациентов с СВР на фоне тяжелой сочетанной травмы.
Рис. 2. Влияние различных концентраций хлорида лития на относительное количество белка адгезивных межклеточных контактов VE-кадгерина в монослое эндотелиальных клеток, обработанных 5% сывороткой крови пациентов с СВР на фоне тяжелой сочетанной травмы
Fig. 2. Influence of various concentrations of lithium chloride on the relative amount of VE-cadherin adhesive intercellular contact protein in a monolayer of endothelial cells treated with 5 % serum of patients with systemic inflammatory response syndrome against the background of severe concomitant trauma
Результатом повышенного разбора белков адгезивных межклеточных контактов эндотелиоцитов под воздействием токсичной сыворотки крови от пациентов с СВР на фоне тяжелой сочетанной травмы явилось увеличение образования межклеточных промежутков монослоя эндотелиальных клеток (рис. 3), чему однозначно способствовали и эндотелиоциты, ушедшие в апоптоз.
Рис. 3. Влияние различных концентраций хлорида лития на образование межклеточных промежутков монослоя эндотелиальных клеток под действием 5% сывороток крови пациентов с СВР на фоне тяжелой сочетанной травмы
ЗД — сыворотка крови здоровых доноров; К — контрольная сыворотка крови FBS; С — токсичная сыворотка крови; С + литий — сочетание хлорида лития в указанных концентрациях с токсичной сывороткой.
Результаты представлены в виде среднего значения со стандартным отклонением.
* p < 0,05 по отношению к С.
Fig. 3. Influence of different concentrations of lithium chloride on the formation of intercellular spaces of a monolayer of endothelial cells under the influence of 5 % blood serum of patients with systemic inflammatory response syndrome against the background of severe concomitant trauma
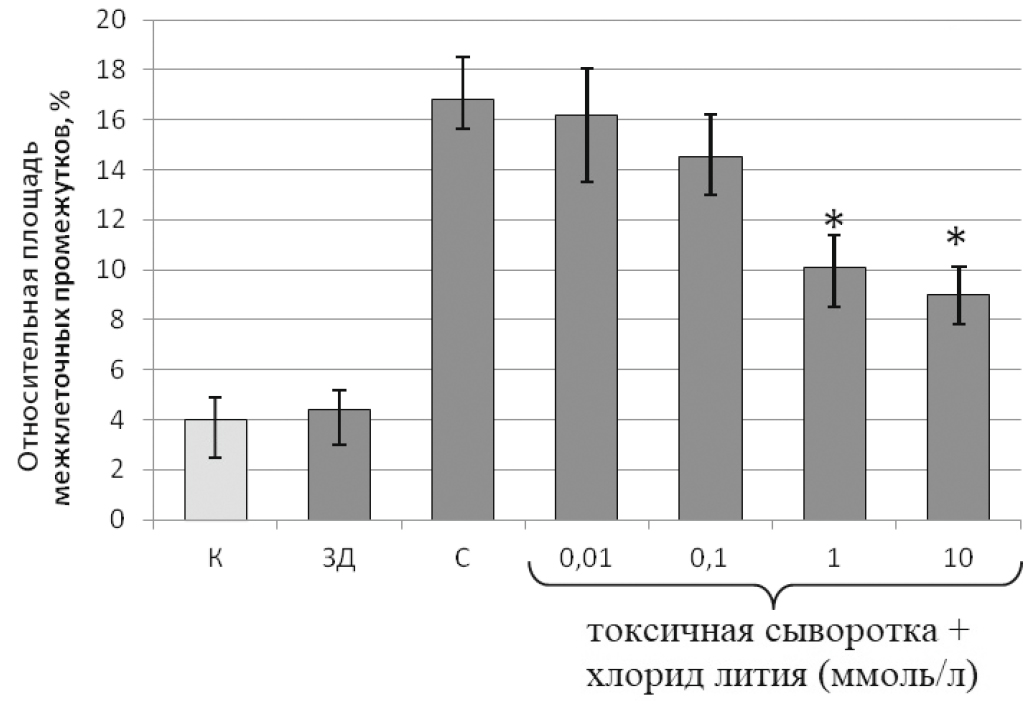
Предшествующая инкубация клеток с хлоридом лития в конечной концентрации более 1 ммоль/л, защищая от расщепления адгезивные белки под действием токсичной сыворотки крови в дозозависимой манере, достоверно профилактировала образование межклеточных промежутков монослоя эндотелиоцитов.
Добавление токсичной сыворотки крови к монослою эндотелиоцитов вызывало снижение содержания в них фосфорилированной формы GSK-3β до 15 % от общего количества данного фермента (рис. 4). Защита эндотелиальных клеток хлоридом лития от токсичной сыворотки крови с помощью прединкубации длительностью 1 ч в концентрации 1 ммоль/л и выше предотвращало инактивацию GSK-3β. Более того, подобно эффекту в группе сравнения, хлорид лития на фоне воздействия токсичной сыворотки крови вызывал существенный рост концентрации фосфо-GSK-3β.
Рис. 4. Совместное действие токсичной сыворотки и разных концентраций хлорида лития на фосфорилирование киназы GSK-3β в клетках эндотелия. Приведены данные иммуноблот-анализа после двухчасовой инкубации с токсичной сывороткой
К — контрольная сыворотка крови FBS; С — токсичная сыворотка крови.
* p < 0,05 по отношению к К в случае использования донорской сыворотки крови и к С в случае использования токсичной сыворотки.
Fig. 4. The combined effect of toxic serum and different concentrations of lithium chloride on the phosphorylation of GSK-3β in endothelial cells. The data of immunoblot analysis after two-hour incubation with toxic serum are presented

В настоящем исследовании установлено, что хлорид лития способен предотвращать апоптоз и разборку клаудина, актина и VE-кадгерина в межклеточных контактах эндотелиальных клеток линии EA.hy926, вызванные действием токсичных сывороток больных с СВР на фоне тяжелой сочетанной травмы.
Механизмы воздействия хлорида лития на эндотелиоциты комплексны, но среди ведущих выделяется ингибирование (фосфорилирование) фермента GSK-3β. В ряде работ [16, 17] было показано, что фосфорилирование фермента GSK-3β приводит к увеличению времени жизни белков плотных межклеточных контактов (в результате увеличения времени полураспада на 38 и 43 % соответственно), обеспечивающих целостность эндотелиального барьера [18]. Доказано, что GSK-3β регулирует активность транскрипционного фактора NF-kB (nuclear factor kappa-light-chain-enhancer of activated B cells) [19], который, в свою очередь, является мастер-регулятором транскрипции генов, контролирующих синтез иммунных и воспалительных белков [20]. Ингибирование GSK-3β хлоридом лития снижает продукцию фактора некроза опухоли альфа и интерлейкина-6 и увеличивает синтез интерлейкина-10 в моноцитах [21], а также подавляет активность циклооксигеназы-2 и индуцибельной синтазы оксида азота [22]. Кроме того, известно, что хлорид лития, ингибируя фермент GSK-3β, снижает активацию транскрипционного фактора STAT (сигнальный трансдьюсер и активатор транскрипции; signal transducer and activator of transcription) [23, 24].
Таким образом, согласно нашим результатам, появляются серьезные основания считать, что фосфорилирование GSK-3β — один из путей, регулирующих сосудистую проницаемость. Полученные ранее данные о фосфорилировании GSK-3β в ткани почек хлоридом лития в дозе 30 мг/кг [8] позволяют предположить наличие дозозависимого эффекта у данного препарата, оказывающего прежде всего воздействие не только и не столько на сохранение активной формы GSK-3β, сколько на синтез фосфо-GSK-3β.
Возможно, хлорид лития также индуцирует в эндотелии защитные антиоксидантные механизмы, противостоящие неблагоприятным прооксидантным воздействиям, которые практически всегда сопутствуют различной патологии. Известно, что антиоксиданты способны предотвращать апоптоз эндотелиальных клеток [19, 24] и препятствовать развитию эндотелиальной дисфункции.
В результате выполнения настоящей работы гипотеза о реализации защитных эффектов хлорида лития на эндотелий через GSK-3β получила свое предварительное подтверждение: было обнаружено, что токсичная сыворотка крови подавляет фосфорилирование GSK-3β и переводит фермент в активную форму, а хлорид лития, наоборот, увеличивает фосфорилирование (инактивацию) GSK-3β и, что более важно, предотвращает вызванное токсичной сывороткой крови уменьшение фосфорилирования GSK-3β. Важно отметить, что даже в минимальных концентрациях (0,01 ммоль/л) хлорид лития предотвращал ингибирование фосфорилирование GSK-3β во всех исследованных концентрациях, а в концентрациях от 0,1 до 10 ммоль/л данный эффект имел выраженный дозозависимый характер. Тем не менее остается неясным, реализуется ли такой механизм in vivo.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Кузовлев А.Н., Гребенчиков О.А., Мешков М.А., Долгих В.Т., Прокофьев М.Д., Шпичко Н.П., Ершов А.В. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.