В 2008 г. создатель большинства современных ингаляционных галогенсодержащих анестетиков Ross C. Terrell (Росс С. Террелл), описывая историю создания десфлурана (ДЕС), вспоминал: «…Примерно в 1960 г. компания Ohio Medical Products (небольшое подразделение Airco, Inc.) инициировала исследовательский проект, цель которого заключалась в синтезе нового летучего анестетика, по крайней мере, равного, и даже лучшего, чем галотан, который был лидером рынка в то время. Я помню, что тогда некоторые из наших коллег говорили, что у нас не было шансов конкурировать с крупными компаниями типа Abbott Laboratories, Imperial Chemical Industries или Ayerst, которые наверняка уже сделали или выполняют значительные исследования по новым анестетикам… Мы не унывали, и в течение следующих 10–15 лет синтезировали несколько сотен новых фторированных соединений, четыре из которых — энфлуран, изофлуран, севофлуран и десфлуран — в настоящее время используются в клинической практике» [1].
ДЕС стал одним из последних синтезированных галогенсодержащих ингаляционных анестетиков и вошел в историю под наименованием «соединение I-653». В то время его производство требовало применения потенциально взрывоопасных методов синтеза и стало возможным, только когда в 1975 г. был получен Патент США (US3897502A) «Процесс производства фторированных эфиров» [2]. Соединение I-653 обладало высоким давлением пара при пятикратно меньшем по сравнению с изофлураном (ИЗО) анестетическом потенциале, как было установлено E.I. Eger 2nd et al. (1987) в экспериментальных работах, проведенных далеко не сразу [3–5]. Однако фармакокинетические свойства ДЕС, по мнению исследователей, все же обеспечивали ему ряд преимуществ [4, 5], открывая дорогу в практическое применение, и в 1989 г. в клинике Guy’s Hospital Лондонского университета препарат был впервые применен у 10 добровольцев, а результаты испытаний опубликованы (R.M. Jones et al., 1990) [6]. Далее последовали многочисленные публикации, посвященные изучению физико-химических и клинических свойств ДЕС, его фармакокинетики и фармакодинамики, обобщенные в ряде статей и обзоров [7–15], из которых наиболее всеобъемлющей была работа S.S. Patel, K.L. Goa (1995) [15]. С тех пор минуло 30 лет, и за это время ДЕС прочно занял свое место как на страницах учебников и научных журналов, так и в арсенале современной анестезиологии, став одним из наиболее востребованных галогенсодержащих ингаляционных анестетиков (ГИА) в мире, уступая в этом, пожалуй, лишь севофлурану (СЕВ). Интерес к ГИА третьего поколения в мире сохраняется и растет, что отражается в количестве проводимых исследований и последующих публикаций — только за 2020 г. PubMed в результатах поиска приводит 282 публикации, так или иначе посвященных ДЕС, и 1172 — СЕВ.
В августе 2013 г. ДЕС был разрешен к применению в России. Его появление сопровождалось целым рядом прекрасных публикаций в русскоязычной специальной литературе 2013–2014 гг., познакомивших отечественных анестезиологов с различными аспектами применения препарата, в том числе и первым собственным опытом [16–23]. Были опубликованы детальный обзор литературы, представленный Д.А. Мощевым и А.Ю. Лубниным [22], и учебное пособие, подготовленное В.В. Лихванцевым и соавт. [23], крайне полезные как для практических врачей, так и для обучающихся специальности. И с 2014 г. эти работы, по сути, остались единственными такого рода в русскоязычной литературе. За 2013–2020 гг., по данным eLIBRARY, в отечественных журналах было опубликовано всего 42 статьи (включая упомянутые), посвященные в основном клиническим, экспериментальным и фармакоэкономическим исследованиям по ДЕС, а также описаниям случаев из практики применения препарата. Единичные обзоры литературы затронули только вопросы применения ГИА как компонента программы ускоренного восстановления после хирургических операций [24] и во время искусственного кровообращения [25]. Но анестезиология — динамично развивающаяся наука, и назревшая потребность освещения ряда методологических особенностей использования ДЕС весьма наглядно проявилась в количестве вопросов от практикующих врачей, во время «Школ ФАР» в апреле — июне 2020 г. Собственно говоря, именно большое количество и направленность этих вопросов и инициировали данный обзор литературы последних лет, целью которого стало: освещение методологических аспектов применения ДЕС в современной анестезиологии.
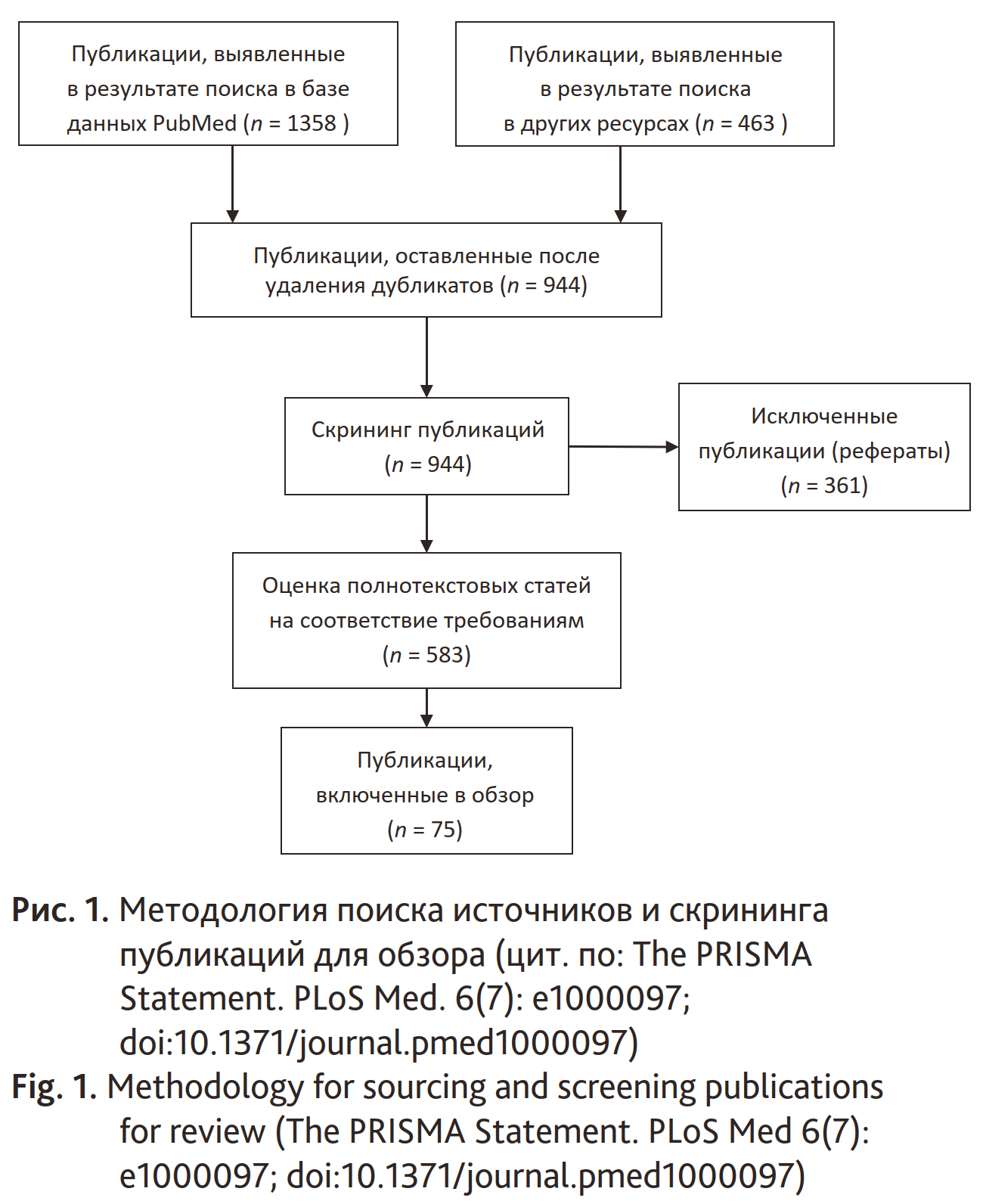
Поиск источников для данного обзора литературы проводился с использованием ресурсов российской научной электронной библиотеки eLIBRARY.ru (https://www.elibrary.ru/), библиографической базы статей Национальной медицинской библиотеки США (National Center for Biotechnology Information (NCBI), https://www.ncbi.nlm.nih.gov/), электронной библиотеки ClinicalKey (https://www.clinicalkey.com/) и базы данных рефератов и цитирования Scopus (https://www.scopus.com/search/). Были использованы следующие ключевые слова: Desflurane, Pharmacology, Anesthetics, Inhalation/administration & dosage, Standards, Anesthesia Recovery Period, Adverse Effects. Глубина поиска составила 7 лет: с 2014 по 2020 г. Критерием отбора публикаций из полученных в результате предварительного поиска по ключевым словам послужило наличие в их библиографическом описании (название, реферат, ключевые слова) следующих терминов: administration, dosage, methodology, methodological techniques, anesthesia technique, inhalation induction, maintenance of anesthesia, low-flow anesthesia, minimal flow anesthesia. При скрининге источников были приоритетны данные рандомизированных контролируемых исследований, систематизированных обзоров и метаанализов. Проанализировано 583 и включено в статью 75 источников литературы за 2014–2020 гг. (рис. 1).
Рис. 1. Методология поиска источников и скрининга публикаций для обзора (цит. по: The PRISMA Statement. PLoS Med. 6(7): e1000097; doi:10.1371/journal.pmed1000097)
Fig. 1. Methodology for sourcing and screening publications for review (The PRISMA Statement. PLoS Med 6(7): e1000097; doi:10.1371/journal.pmed1000097)

В рамках настоящего обзора, наверное, нецелесообразно говорить о физико-химических свойствах и клинических характеристиках 2-(дифторметокси)-1,1,1,2-тетрафторэтана (ДЕС), хорошо изученных и подробно описанных в классической и учебной литературе [3–12, 23, 26, 27]. Просто вспомним, что ДЕС выгодно отличается от всех ГИА наименьшей растворимостью в крови (коэффициент распределения кровь/газ = 0,42–0,45) и тканях (коэффициент распределения масло/газ = 18,7–29), что определяет его главные преимущества: быстрое начало действия, лучший контроль за поддержанием анестезии, минимальный метаболизм (0,02 %) и более быстрое выведение из организма, а значит — меньшее время на восстановление после анестезии. Из-за низкой температуры кипения (22,8 °С при Ратм = 760 мм рт. ст.) и высокого давления насыщенного пара (669 мм рт. ст. при 20 °С) ДЕС, его контролируемое дозирование требует специального термокомпенсируемого испарителя с постоянным подогревом (до 39 °С) типа Tec 6, Tec 6 Plus, либо кассетного испарителя Aladin. Этот тип испарителей радикально отличается от испарителей переменного обходного потока, находящихся вне круга циркуляции газонаркотической смеси и специфичных для конкретных препаратов: галотана, энфлурана, ИЗО и СЕВ. Испаритель Tec 6 — это, скорее, смеситель газовых потоков, имеющий два независимых газовых контура, работающих параллельно. Остерегайтесь случайного заполнения традиционного испарителя ДЕС, так как это может привести к непредсказуемым последствиям, вплоть до поступления в дыхательный контур гипоксической смеси газов и массивной передозировки анестетика [12, 23, 26, 27].
Немного о минимальной альвеолярной концентрации (МАК) ДЕС и о его анестетической активности. Согласно определению, МАК — это альвеолярная (или в конце выдоха) концентрация вдыхаемого анестетика, при которой у 50 % пациентов не будет двигательной реакции на стандартизированный болевой стимул — разрез кожи (Eger E.I., 1965). Следует помнить, что МАК — не константа, а величина достаточно условная, рассчитанная лабораторно для пациента 40 лет, находящегося на уровне моря в нормальных условиях (1 атм или 760 мм рт. ст., +20 °С), и ее стандартные значения предполагают отсутствие всех других факторов, которые могут потенциально повлиять на МАК. Известно, что множество физических (например, температура), фармакологических (наиболее выражено — внутривенные анестетики и наркотические анальгетики), физиологических (возраст — прежде всего в обратно пропорциональной зависимости, со снижением на 6 % за каждое десятилетие жизни) и патологических (например, нейродегенеративные заболевания, электролитные нарушения) факторов влияют на величину МАК. ДЕС — яркий пример такой зависимости. Даже стандартная величина МАКДЕС варьирует в разных источниках от 6 до 7 %, а влияние на нее возраста (от 0 до 1 года = 10,65 — 8,95 %; от 1 до 12 лет = 9,4 — 7,2 %; от 18 до 30 лет = 7,25 — 6,35 %; от 30 до 65 лет = 6,25 — 5,75 %; старше 65 лет = 5,17 %), использования закиси азота (60–70 % содержания в газонаркотической смеси N2O снижают в среднем в 2 раза) либо фентанила в разной дозировке (3 мкг/кг снижают на 46 % [18–30 лет] — 51 % [31–65 лет], а 6 мкг/кг — на 53 и 64 % соответственно) имеет важное клиническое значение [26–30].
В современной наркозно-дыхательной аппаратуре (НДА) предусмотрена функция автоматического преобразования концентрации ГИА в скорректированный по возрасту эквивалент МАК, для чего необходимо ввести возраст пациента — обязательность этого действия при наличии подобной опции предупредит проведение чрезмерно глубокой или избыточно поверхностной анестезии. Однако следует учесть, что разные производители НДА и газоанализаторов используют разные формулы расчета МАК и разную величину стандартной МАКДЕС (для 40 лет). Например, Dräger использует формулу W.W. Mapleson, 1996 {MAК(возраст) = MAК(40 лет)×10(−0,00269 × [возраст − 40])} и значения МАКДЕС (40 лет) в 6 % для Dräger Primus и Dräger Perseus либо 6,65 % — для Dräger Apollo; а GE и Nihonkoden вычисляют MAК с помощью формулы E.I. Eger 2nd, 2001, {MAК(возраст) = MAК(40лет) × 1,32 × 10(−0,00303 × возраст)}, используя значения МАКДЕС (для 40 лет) в 6 %, например, для GE Aisys или 6,45 % для Nihonkoden BSM9101 [31]. Это определяет возможность занижения МАКДЕС (и более поверхностной анестезии) при работе с молодыми пациентами (Dräger Perseus или GE Aisys) либо, напротив, повышения его значений (Nihonkoden BSM9101 или Dräger Apollo) с риском передозировки ДЕС у пожилых [26, 29, 31]. Даже если эта возможность только теоретическая, всегда полезно выяснить эти детали в руководстве пользователя НДА или монитора, а еще более надежно — для профилактики недо- или передозирования ГИА использовать МАК-ориентированную анестезию в условиях мониторинга степени угнетения сознания, например, биспектрального индекса (BIS).
Этот тезис подтверждается еще рядом соображений. Ориентируясь на абсолютную величину МАК (в %) как на стандартную меру эффективности ингаляционных анестетиков, правомочен вывод, что анестетическая активность ДЕС в среднем в 5 раз меньше, чем у ИЗО, и в 3 раза меньше, чем у СЕВ. Но насколько распространяется это правило на анальгетический или гипнотический потенциал ГИА при эквипотенциальных значениях в 1 МАК? J.K. Kim et al. (2014) выполнили проспективное рандомизированное клиническое исследование (РКИ), сравнив интраоперационные профили BIS при однотипном вмешательстве (тиреоидэктомия) у 90 пациенток (ASA I–II, 18–65 лет), выполненном в условиях комбинированной общей анестезии (КОА) на основе ИЗО, СЕВ или ДЕС в равной дозировке — 1 МАК и инфузии ремифентанила 0,05–1 мкг/кг в минуту. Период исследования был определен как первые 60 мин после хирургического разреза (через 15 мин после начала ингаляции ГИА) у всех пациенток, анализировали усредненные по времени данные (среднее из четырех показаний с интервалом 15 с в течение 1 мин), извлеченные из памяти монитора BIS VISTA™. Не было статистически значимых различий между группами по демографическим данным, виду индукции (пропофол), суммарной дозе ремифентанила и длительности оперативного вмешательства или анестезии. Значения BIS в течение исследуемого периода были достоверно ниже в группе ДЕС по сравнению с группой СЕВ (р = 0,008), что указывало на то, что ДЕС производит больший гипнотический эффект, чем СЕВ при эквивалентной концентрации в 1 МАК. Более того, ДЕС в условиях эквипотентной анестезии показал почти вдвое большую продолжительность глубокого гипнотического эффекта с BIS < 40, чем СЕВ (р = 0,026) [32].
Серия более поздних публикаций K.H. Ryu et al. (2017, 2018) показала, что различные ГИА, действуя на всю центральную нервную систему, включая подкорковые (анальгезия) и корковые (гипнотический эффект) области головного мозга, а также спинной мозг (неподвижность как критерий МАК), имеют различные спектры анальгетического, гипнотического и иммобилизирующего потенциалов [33–35]. В рамках РКИ (NCT02609802, 72 пациента 19–65 лет, ASA I–II, артроскопия, индукция анестезии — пропофол, поддержание — СЕВ или ДЕС) ими было установлено, что при концентрации в 1 МАК (с поправкой на возраст, через 30 мин после достижения эквилибриума) средние значения хирургического плетизмографического индекса (SPI) (38,1 ± 12,8 vs 30,7 ± 8,8 соответственно, p = 0,005) и средние значения BIS (40,7 ± 5,8 vs 36,8 ± 6,2 соответственно, p = 0,008) были значительно выше в группе СЕВ, чем в группе ДЕС [33]. В следующем исследовании (NCT02698514, 89 пациентов 19–65 лет, ASA I–II, артроскопия, индукция анестезии — пропофол, поддержание — СЕВ или ДЕС в концентрации 1 МАК) было изучено влияние стандартной тетанической стимуляции (M-NMT MechanoSensor) на анальгетический (SPI) и гипнотический (BIS) эффект сравниваемых анестетиков в эквипотентной концентрации (1 МАК) [34]. В группе ДЕС значения SPI были ниже по сравнению с таковыми в группе СЕВ как до (23 [19–30] vs 29 [21–33]; разница — 4 [95%-й доверительный интервал (ДИ), 1–8], p = 0,024), так и после стимуляции (23 ± 10 vs 34 ± 13; разница — 11 [95% ДИ, от 6 до 15], p < 0,001). Результаты BIS-мониторинга также различались между группами по достижению эквилибриума (36 [31–41] vs 41 [38–47]; разница — 6 [95% ДИ, от 2 до 9], p = 0,001), за 1 мин до стимуляции (33 [29–38] vs 37 [31–42]; разница — 3 [95% ДИ, 0–6], p = 0,038) с сохранением различий в значениях через 1 мин после нее (3 [от 1 до 6] vs 5 [от 2 до 9]; разница — 2 [95% ДИ, от 0 до 4], p = 0,021) [34]. Еще одно РКИ (NCT02830243, 82 пациента 19–65 лет, ASA I–II, лапароскопическая холецистэктомия, индукция анестезии — пропофол, поддержание — СЕВ или ДЕС в концентрации 1 МАК в сочетании с инфузией ремифентанила под контролем SPI, BIS и энтропии — SE и RE) показало, что для достижения целевого уровня SPI (20–50) в группе СЕВ потребовалась бóльшая доза ремифентанила, чем в группе ДЕС: 263 (219–370) vs 148 (105–189) мкг; разница — 182 (95% ДИ 120–244); p < 0,001; аналогичные результаты наблюдали и для средней скорости инфузии ремифентанила (0,192 ± 0,064 vs 0,099 ± 0,033 мкг кг–1 мин–1, p < 0,001) [35]. Значения BIS, SE и RE были достоверно выше при использовании СЕВ [35]. Эти данные предполагают, что ДЕС и СЕВ в эквипотентной дозировке в 1 МАК не могут гарантировать эквивалентную обезболивающую или гипнотическую активность, которые, как оказалось, выше у ДЕС [33–35]. На наш взгляд, необходимы дальнейшие серьезные исследования, чтобы определить, окажутся ли приведенные результаты клинически полезными для оптимизации применения современных ГИА.
Ингаляционная индукция анестезии — методологический прием, проверенный временем, с которого, собственно, начиналась анестезиология, но которому не так часто уделяют внимание в специальной литературе сегодня. Можно сколь угодно дискутировать о ее преимуществах (несомненных, хотя бы исходя из фармакокинетики ГИА третьего поколения) и недостатках (очевидных, например, при нерешенной проблеме «полного желудка»), о целесообразности использования у пациентов разного возраста и с различной коморбидностью [17, 23, 36–41], однако вряд ли кто будет отрицать то, что каждый практикующий анестезиолог обязан владеть этим способом, так же как и внутривенной индукцией.
ДЕС противопоказан для индукции у детей из-за высокой частоты респираторных побочных эффектов, что отмечено как в инструкции к препарату, так и на сайте FDA [17, 23, 42–43] и обсуждению не подлежит. Но он может быть использован для индукции общей анестезии у взрослых, правда, с некоторыми ограничениями. К сожалению (ведь из-за низкого коэффициента распределения кровь/газ время достижения потери пациентом сознания, возможно, было бы ниже, чем у СЕВ), для ДЕС крайне нежелательно проведение вводной анестезии методом «максимальной концентрации с первым вдохом» (stepdown, или с предварительным заполнением контура газонаркотической смесью, как при индукции СЕВ), из-за все того же раздражающего действия на верхние дыхательные пути. Разумная альтернатива — метод stepuр, заключающийся в постепенном повышении инспираторной концентрации ДЕС, с целью постепенной адаптации пациента к неприятному запаху. Именно такой вариант по сей день предлагают и производитель, и FDA: начинать ингаляцию ДЕС после денитрогенизации и премедикации наркотическим анальгетиком с 3 % (при потоке «свежего» газа [FGF, fresh gas flow] = 4–8 л/мин закисно-кислородной смеси [1 : 1] или кислорода 100 %), повышая ее на 0,5–1 % с каждыми 2–3 вдохами до достижения потери сознания (от 4 до 11 % в выдыхаемой смеси) [23, 42, 43]. Однако моноиндукция ДЕС все же не позволяет полностью избежать нежелательных респираторных явлений, в 7 % случаев сопровождающихся десатурацией до 90 % [42, 43]. В то же время известно, что опиоиды могут повышать порог раздражения дыхательных путей, что подтверждено рядом исследований по применению ремифентанила при индукции ДЕС. Например, J.Y. Yoo и соавт. (2016) провели РКИ (NCT 02379715; пациенты 19–60 лет; ASA I–II), в котором показали, что предварительное введение ремифентанила (значения эффективной целевой концентрации) EC50 = 3,40 нг/мл (95% ДИ 2,42, 4,38 нг/мл) и EC95 = 4,31 нг/мл (95% ДИ 2,15, 5,98 нг/мл) может обеспечить плавную ингаляционную индукцию ДЕС с постепенным увеличением дозы анестетика (с 4 до 8 и 12 % с интервалом в 30 с) при отсутствии респираторных осложнений, но при успешности индукции лишь в 54 %: в случаях задержки дыхания подачу ДЕС отключали и завершали индукцию тиопенталом [44]. Наш опыт (РКИ, 125 пациентов от 19 до 60 лет, ASA I–III, амбулаторная хирургия, индукция ДЕС с последующей установкой ларингеальной маски без введения миорелаксантов) показал, что предварительное (до начала ингаляции) введение фентанила 2 мкг/кг и использование сниженной до 1 МАК (6 %) концентрации ДЕС на выдохе не позволили избежать задержки дыхания практически у всех пациентов (94,5 %) при успешности индукции в 84,5 % случаев и снижении частоты ожидаемых нежелательных респираторных явлений — ларингоспазма (7,9 %) и кашля (6,4 %) [39].
Следует также отметить, что быстрое повышение концентрации ДЕС с 0,55 до 1,66 МАК при индукции или ингаляционном «болюсе» (кратковременном повышении FGF до 4–8 л/мин и увеличении подачи анестетика на испарителе до 12 об%) вызывает активацию симпатической и ренин-ангиотензиновой систем с повышением плазменных уровней адреналина, норадреналина, вазопрессина и высокой активностью ренина. Обусловленное этим повышение ЧСС и АД серьезно ограничивает применение этих методологических приемов (моноиндукция, «болюс») современной ингаляционной анестезии, особенно у пациентов с сопутствующей коронарной недостаточностью. Кроме того, постепенное повышение концентрации ДЕС с 2 до 18 % (или от 6 до 12,5 %) вызывает значительное удлинение интервала QT, что может стать причиной электрической нестабильности миокарда и вызывать полиморфную желудочковую тахикардию по типу «пируэт» (TdP — torsade de pointes), а также фибрилляцию желудочков [23, 42, 43, 45, 46].
В 2017 г. M.C. Kao и соавт. предложили с целью профилактики тахикардии при повышении концентрации ДЕС вводить после индукции анестезии эсмолол в дозе 0,5 мг/кг с хорошим клиническим эффектом. Выполненный ими частотно-временной анализ вариабельности сердечного ритма (HRV) показал, что ДЕС-опосредованное повышение ЧСС может быть в значительной степени связано с парасимпатическим торможением анестетика. По мнению исследователей, предварительное введение эсмолола не только ослабляет вызванное ДЕС повышение ЧСС, но и усиливает восстановление парасимпатического торможения [47]. S. Tominaga et al. (2018) в рандомизированном исследовании (50 пациентов от 20 до 69 лет, ASA I–II, плановые спинальные операции) изучили влияние внутривенных анестетиков на интервал QT при индукции анестезии ДЕС. Для стандартизации и точности измерения использовали относительную корригированную (относительно ЧСС) величину интервала QT–QTc (QT corrected), определяемую по формуле Базетта, и дисперсию QTc (QTcD). Результаты исследования показали, что пропофол (1,5 мг/кг) достоверно противодействовал удлинению интервала QTc во время индукции анестезии ДЕС, не влияя на QTcD. Барбитурат тиамилал в дозе 5 мг/кг не оказывал влияния на изученные параметры. Следовательно, пропофол более пригоден для комбинированной индукции анестезии ДЕС у пациентов с факторами риска развития желудочковой аритмии [48].
K. Kumari et al. (2019) при сравнении гемодинамического ответа на ингаляционный болюс ДЕС (при значениях BIS > 55 в течение 30 с, выставляли на испарителе 16 % при повышении FGF до 4 л × мин–1 [закись азота 2 л/мин и кислород 2 л/мин] на 30 с) у нормотензивных (исходное АД менее 140/80 мм рт. ст.) и гипертонических пациентов (АД до 180/100 мм рт. ст.) при обеспечении ЛХЭ и не наблюдали статистически значимой разницы в проценте случаев снижения, увеличения или отсутствия изменений ЧСС или АДср между группами. Это позволило им заключить, что BIS-ориентированные ингаляционные болюсы ДЕС безопасны, осуществимы и не вызывают симпатической стимуляции даже при наличии исходной артериальной гипертензии, при которой чувствительность к болюсу была выше, чем при нормотонии. Авторы связали такую возможность с ограничением FGF (до 4 л × мин–1) и продолжительности болюса, а также с использованием BIS-контроля и пропофола, так как ранее было показано, что индукция пропофолом уменьшает ДЕС-опосредованную симпатическую активацию [49]. Подобные же рекомендации есть и по использованию мидазолама, ремифентанила или фентанила [44–46], что, на наш взгляд, наряду с ограничением FGF (до 4 л × мин–1) и времени болюса до 30 с выглядит предпочтительным по сравнению с применением бета-блокаторов [47] на фоне повышения концентрации ДЕС с позиции понимания того, что анксиолитики, внутривенные анестетики и опиоиды значительно снижают МАКДЕС, т. е. те же 6 % уже составят около 1,5–2 МАК, требуемых для ингаляционного болюса [26–30, 42–43]. Однако в случаях необходимости сохранения доказанного эффекта фармакологического прекондиционирования, обусловливающего органопротективность ГИА, но нивелируемого внутривенными анестетиками и антиаритмиками [40, 50–52], предпочтительнее применять опиоиды.
Таким образом, ингаляционная индукция ДЕС у взрослых возможна при наличии к ней показаний либо в силу обстоятельств, но с целью снижения частоты возможных нежелательных явлений со стороны респираторной и сердечно-сосудистой систем, необходимо предварять индукцию введением наркотического анальгетика, начинать методом stepuр (при FGF = 4 л/мин 100 % О2) с 3 об% (на испарителе), постепенно повышая инспираторную концентрацию до потери вербального контакта с пациентом. По достижении 1 МАКДЕСможно снизить FGF до 2 л/мин с целевым значением концентрации О2 на вдохе не ниже 30 % (N2O : О2 или воздух : О2), на испарителе выставить 6–8 об%. В случаях необходимости быстрого повышения концентрации ДЕС в контуре длительность ингаляционного болюса не должна превышать 30 с при увеличении FGF не выше 4 л/мин с выставлением на испарителе 16 об%.
Фармакокинетические свойства ГИА третьего поколения (СЕВ и ДЕС) делают их идеальными для низкопоточной анестезии, причем использование данной методологии более выгодно при анестезии ДЕС, не имеющего ограничений по величине минимального потока свежего газа (вплоть до метаболического), рекомендуемых FDA при анестезии СЕВ (FGF = 1–2 л/мин, не более 2 МАК/ч) [11, 12, 14–16, 53, 54]. Преимущества низкопоточной анестезии хорошо известны, напомним только об основных [16, 23, 26, 27, 36, 54–58]:
Все они имеют принципиально важное значение и определяют необходимость широкого внедрения низкопоточной анестезии в клиниках, обладающих соответствующим наркозно-дыхательным и мониторным оборудованием, и оснований для такого утверждения более чем достаточно.
Еще в 2011 г. M. Bilgi et al. определили, что при клиническом применении анестезии с низким потоком газа через 45 мин от ее начала достигается необходимая абсолютная влажность, а через час — требуемый нагрев дыхательной смеси [55]. Позднее метаанализ, выполненный J.R.C. Braz et al. (2017), подтвердил, что при использовании минимального FGF (0,25–0,5 л/мин) для достаточного кондиционирования газонаркотической смеси в контуре (до влажности вдыхаемого газа 20 мг H2O на 1 л) не требуется дополнительного тепло- и влагообменника [56]. А Y. Cui et al. (2020) показали, что одно только использование FGF < 1 л/мин позволяет уменьшить частоту (с 87,6 до 69,6 %, p < 0,01) и длительность (со 104 до 30 мин, p < 0,01) непреднамеренной гипотермии у новорожденных (крайне подверженных ей), оперированных на органах пищеварительного тракта [57]. R. Leelanukrom et al. (2014) в перекрестном исследовании измерили концентрацию и расход ДЕС во время низкоточной анестезии у 30 взрослых пациентов (ASA I–II). Было установлено, что при FGF = 0,5 л × мин–1 (EtDES = 6,13 ± 0,12 %) средний расход препарата составил всего 8,77 ± 0,17 мл/ч, тогда как при FGF = 1 л × мин–1 (EtDES = 5,68 ± 0,08 %) расход составил 16,28 ± 0,24 мл/ч, а при FGF = 2 л × мин–1 (EtDES = 5,54 ± 0,07 %) расход — 31,73 ± 0,41 мл/ч [58]. Данные Л.С. Золотаревой и соавт. (2019), изучивших расход СЕВ и ДЕС у детей, показали, что для ДЕС он составляет 1,94 л/ч при FGF = 0,5 л/мин, что эквивалентно 6,81 мл жидкого анестетика [59]. Приведенные результаты наглядно демонстрируют фармакоэкономический эффект низкопоточной анестезии. Не менее важным сегодня представляется эффективность снижения FGFв экологических целях. В последнее время появилось много публикаций, посвященных влиянию на экологию ингаляционных анестетиков, обладающих парниковым эффектом, с доказательствами необходимости снижения их потребления именно за счет перехода на низкий и минимальный поток свежего газа [60–62]. И эти публикации резонны. Более того, современная методология низкопоточной анестезии позволяет уменьшить потребность в ГИА еще на этапе насыщения анестетиком до достижения относительного равенства между концентрацией того же ДЕС в альвеолах и головном мозге (эквилибриума).
В частности, при классической схеме насыщения ДЕС после внутривенной индукции и интубации трахеи начинали искусственную вентиляцию легких (ИВЛ) с FGF не ниже 4–6 л/мин, выставляя на испарителе не менее 6–8 об% до достижения эквилибриума, и только потом (в среднем через 8–10 мин) снижали поток до 1 л/мин и менее, выставляя настройку испарителя до необходимого значения (обычно 5–6 об%). Позднее была доказана эффективность и безопасность схемы 1 : 1 : 12, позволяющая выполнять насыщение ДЕС при меньшей потребности в препарате, с фиксацией настройки испарителя на 12 об% при FGF = 2 л/мин (1 л кислорода + 1 л закиси азота либо 1 л кислорода + 1 л воздуха) и достижением эквилибриума в 1 МАКДЕС в течение 4–5 мин при стабильности мониторируемых параметров кровообращения и газообмена, с последующим снижением настройки испарителя до 6 об%, либо по результатам BIS-мониторинга [23, 63–65]. В 2016 г. M. Horwitz и J.G. Jakobsson установили, что при использовании фиксированной настройки испарителя в 18 об% время достижения концентрации в 1 МАК (с поправкой на возраст) составило для ДЕС — 8,5 ± 1,7 мин при FGF = 0,5 л/мин и 3,7 ± 0,7 мин при FGF = 1,0 л/мин [66]. При фиксированном значении на испарителе в 6 об% эти значения для СЕВ составили 15,2 ± 2,4 мин (при FGF = 0,5 л/мин) и 6,2 ± 1,3 мин (при FGF = 1,0 л/мин) соответственно, p < 0,001. Снижение FGF до 0,5 л/мин сокращало потребление ДЕС на 30 %, а СЕВ — на 19 %. В последующем время до экстубации трахеи составило 6,7 ± 2,3 мин для ДЕС и 10 ± 2,3 мин для СЕВ (p < 0,001) [66]. S. Bahar et al. (2019) показали, что при использовании фиксированной настройки испарителя (18 об%) время достижения концентрации ДЕС в 0,7 МАК (с поправкой на возраст) у 104 пациентов (47 ± 15 лет, ASA I–III, ИМТ = 27 кг/м2 [15–48], общая и пластическая хирургия) составило 2,9 ± 0,5 мин (от 2 до 4,3 мин) при FGF = 1,0 л/мин кислородно-воздушной смеси [67]. На фоне инфузии ремифентанила, по достижении 0,7 МАКДЕС начинали операцию, а на испарителе выставляли концентрацию, на 2 об% превышающую 0,7 МАКДЕС (в 64 % случаев дальнейшей коррекции не требовалось). При этом значения BIS были равны 39 ± 8,5 и не повышались свыше 60 в течение всей операции. Расход ДЕС составил в среднем 0,33 ± 0,05 мл/мин при длительности вмешательств до 300 мин [67]. P. Toal et al. (2019) установили, что среднее время достижения равновесного состояния при использовании СЕВ выше (4,59 ± 0,77 мин), чем при применении ДЕС (3,78 ± 0,56 мин, p < 0,001). По их данным, при FGF = 1 л/мин (50 % О2 + 50 % N2O) несоответствие между установленной (на испарителе) и доставленной (альвеолярной) концентрациями у СЕВ больше (20 %), чем у ДЕС (12 %) [68]. Анализируя все приведенные данные, представляется разумным выполнять насыщение ДЕС (после внутривенной индукции анестезии и интубации трахеи) при FGF = 1 л/мин (кислородно-воздушной смеси с минимальной концентрацией О2 не ниже 30–35 %) и настройке испарителя на 18 об% в течение 3–4 мин, так как этот временной промежуток достаточен как для достижения 0,8–1 МАКДЕС, так и для достижения эквилибриума, после чего уже можно понижать FGF до 0,5 л/мин, а настройку испарителя — до 6–8 об%, ориентируясь на клинические данные и результаты мониторинга, в том числе — и степени глубины анестезии. Последний (например, BIS) весьма желателен в случаях необходимости однолегочной вентиляции, при переходе на которую в результате шунтирования к 10-й минуте концентрация в крови ДЕС снижается, по данным E. Biricik et al. (2019) [69], с 224,6 мкг/мл до 159,8 мкг/мл (р = 0,018), сохраняясь в среднем ниже исходной на 29 % (у СЕВ — на 26 %), что представляет собой потенциальный риск слишком поверхностной анестезии [69, 70]. Таким образом, согласно приведенным данным [63–68], низкопоточная анестезия ДЕС без использования начального высокого потока FGF в период насыщения анестетиком является эффективным, безопасным, легко выполнимым и экономичным методом, который, на наш взгляд, можно и нужно взять на вооружение.
Разумеется, используя низкопоточную методологию поддержания анестезии, следует помнить не только о ее преимуществах, но и о недостатках [16, 23, 26, 27, 36, 71].
В последнем случае ограничение носит чисто экономический характер, никак не запрещая ингаляцию ДЕС через ларингеальную маску у взрослых при использовании редуцированного потока свежего газа [72, 73]. А вот применение ДЕС у неинтубированных детей ограничено рекомендациями производителя и FDA [17, 23, 42–43], хотя в литературе и встречаются единичные исследования, результаты которых идут вразрез с этими «запретами». Так, например, M. Alonso et al. (2017), представив свой опыт применения ДЕС для обеспечения диагностических и терапевтических процедур у 876 детей (средний возраст 8,8 лет), сделали вывод о безопасности применения препарата даже вне операционной. Индукцию анестезии осуществляли пропофолом (26 % случаев) или ингаляцией СЕВ (74 % случаев), с последующим поддержанием инфузией ремифентанила и ингаляцией ДЕС (6,2 ± 2,1 %) через носовую канюлю или лицевую маску при сохранении спонтанной вентиляции легких. Эффективность такой «сэндвич»-анестезии составила 98 %, а частота побочных эффектов — 15 %, среди которых отмечали ажитацию (6 %), головную боль (4 %), ПОТР (3 %) и ларингоспазм (2 %). Авторы подчеркивают, что поддержание анестезии ДЕС (в концентрациях, близких к гипнотическому МАК) при спонтанной вентиляции легких было эффективным, с быстрым восстановлением и низкой частотой побочных эффектов [74].
Тем не менее популярность ингаляционной анестезии с использованием низкого или минимального потока свежего газа из года в год растет. В частности, в 2015 г. D. Benhamou et al. [75] в публикации, посвященной результатам анкетирования 981 врача-анестезиолога Франции, отмечали, что:
F. McGain et al. (2019), проанализировав результаты анкетирования 359 анестезиологов Австралии и Новой Зеландии, показали, что низкие значения FGF при работе СЕВ применяют 93 % (310 из 333; 95% ДИ 90–95%) практикующих, а при использовании ДЕС — 98 % (262 из 268; 95% ДИ 95–99 %) врачей. Наиболее частой причиной использования ДЕС анестезиологи назвали более быстрое время пробуждения по сравнению с другими анестетиками [76]. Причем длительность поддержания анестезии ДЕС практически не влияет на скорость пробуждения пациентов любого возраста в силу его фармакокинетики, и этот факт заслуживает отдельного упоминания, так как определяет одну из важных «ниш» преимущественного применения препарата — использование при обеспечении длительных оперативных вмешательств, что подчеркнуто многими исследованиями [21, 77–79]. Другое применение ДЕС в качестве препарата выбора — использование у пациентов с повышенным и высоким индексом массы тела (с учетом его низкой жирорастворимости, отсутствием кумуляции и минимальным метаболизмом), у которых он обеспечивает практически такой же по скорости профиль пробуждения, как и при отсутствии ожирения [21, 23, 54, 71, 81, 82]. Еще один контингент преимущественного использования ДЕС, как это отмечено в метаанализах последних лет, — пациенты пожилого и старческого возраста, у которых он обеспечивает более короткий период ранней посленаркозной реабилитации и относительную сохранность исходного когнитивного статуса по сравнению с СЕВ, ИЗО или пропофолом [83–86]. Впрочем, сравнительная характеристика преимуществ, равно как и особенности применения этого галогенсодержащего анестетика третьего поколения при обеспечении операций в различных областях хирургии, заслуживает отдельного разговора о клинических аспектах анестезии ДЕС, в рамках соответствующего обзора.
Заключительный этап анестезии не менее важен и ответствен, чем ее индукция. Методологически завершение любой ингаляционной анестезии несложно: в нужный момент времени (о нем чуть позже) прекращается подача анестетика в дыхательный контур и устанавливается FGF, равный или превышающий жизненную емкость легких пациента. Однако скорость пробуждения пациентов — процесс многофакторный, зависящий от многих обстоятельств: исходного физического и неврологического статуса, травматичности и длительности операции, объема кровопотери, состояния к моменту окончания вмешательства и, конечно же, от скорости элиминации (метаболизма) анестетика, наркотических анальгетиков, миорелаксантов и других препаратов, использованных анестезиологом [12, 23, 26, 27]. ДЕС в силу своей низкой растворимости в крови и жировой ткани обладает быстрым профилем пробуждения у пациентов любого возраста, который практически не зависит от дозировки препарата, длительности анестезии, исходного физического статуса, а также функции печени и почек, и поэтому предсказуем по своему действию. Быстрое восстановление сознания, защитных рефлексов и спонтанной вентиляции является отличительной характеристикой ДЕС, определяющей его преимущества перед севофлураном и пропофолом, что было отмечено многочисленными РКИ, подтверждено их метаанализами и в дополнительных доказательствах не нуждается [21–23, 72–74, 77–90]. Более того, иногда, для обеспечения максимально быстрого и полноценного восстановления пациентов после анестезии, ДЕС используется в качестве анестетика поддержания анестезии после ее индукции СЕВ. Пример такого сочетания положительных качеств обоих ГИА третьего поколения ввиде ингаляционной «сэндвич»-анестезии у взрослых интубированных пациентов описан I. Mikuni et al. (2016), отметивших достоверное сокращение всех временных характеристик периода ранней посленаркозной реабилитации в среднем на 3–4 мин (95% ДИ 1,9–5,2; р < 0,001) [91]. Причем быстрый (по сравнению с СЕВ) и такой же безопасный (по сопоставимому с СЕВ сравнению частоты возможных нежелательных респираторных явлений) профиль восстановления при анестезии ДЕС отмечается и при использовании надгортанного воздуховода у пациентов разного возраста [72, 73, 92–94].
Следует отметить, что на скорость пробуждения после анестезии ГИА, помимо уже перечисленных причин, общего количества израсходованного фентанила (к сожалению, в Российской Федерации ремифентанил не зарегистрирован) и времени от последнего введения миорелаксанта, существенное влияние оказывает величина FGF после прекращения подачи анестетика. Ведь при низкопоточной анестезии альвеолярная концентрация ингаляционных анестетиков изменяется очень медленно, поэтому после установки испарителя на 0 об% их концентрация уменьшается тоже постепенно. Прекращение подачи свежей порции анестетика в определенный (тот самый — нужный) момент времени при определенной FGF позволяет сохранять пациента в состоянии наркоза до окончания операции, сокращая до минимума период пробуждения. Для ДЕС такие «нужные» точки были рассчитаны J.S. Jeong et al. (2014) (РКИ, 105 пациентов 18–64 лет, ASA I–II) [91]: при выставлении испарителя на «0» и FGF = 2 л/мин (100 % О2) концентрация ДЕС в конце выдоха (EtDES) снижается с 5,4 ± 0,4 % (уровень BIS = 41,8 ± 8,2) до момента открытия глаз пациента (EtDES = 1,4 ± 0,4 %; BIS = 80,2 ± 7,9) за 16,4 ± 5,4 мин; при выставлении испарителя на «0» и FGF = 4 л/мин (100 % О2) EtDES снижается с 5,5 ± 0,3 % (уровень BIS = 42,3 ± 9,1) до момента открытия глаз пациента (EtDES = 1,1 ± 0,3 %; BIS = 79,0 ± 9,8) за 9,1 ± 2,7 мин; при выставлении испарителя на «0» и FGF = 6 л/мин (100 % О2) EtDES снижается с 5,3 ± 0,4 % (уровень BIS = 42,6 ± 8,5) до момента открытия глаз пациента (EtDES = 0,9 ± 0,3 %; BIS = 81,5 ± 8,9) за 8,0 ± 3,1 мин. Время до экстубации трахеи составило соответственно: при FGF = 2 л/мин — 17,6 ± 5,6 мин; при FGF = 4 л/мин — 9,9 ± 2,8 мин; при FGF = 6 л/мин — 9,1 ± 3,2 мин [91]. Таким образом, имеется определенный потенциал для прогнозирования времени появления сознания, основанного на изменении скорости потока свежего газа после анестезии ДЕС, практическое применение которого может как сократить расход анестетика, если его подача прекращена в предсказанное время, так и ускорить экстубацию трахеи.
В исследованиях, посвященных применению ДЕС, в основном отмечалось его превосходство в сравнении с другими ингаляционными и внутривенными анестетиками по таким показателям, как скорость и предсказуемость восстановления сознания, внешнего дыхания, мышечной силы и рефлекторной активности, что особенно ценно для хирургии «одного дня» и актуально для реализации программ по ускоренному послеоперационному восстановлению пациентов. Последующая сравнительная оценка качества течения раннего послеоперационного периода у пациентов, оперированных в условиях общей анестезии ДЕС или СЕВ, не выявила существенных различий в частоте возможных нежелательных явлений и критических инцидентов, а также длительности нахождения в палате пробуждения [23, 72, 96–98].
Резюмируя обзор современной литературы, посвященной методологическим аспектам применения десфлурана, отметим, что этот парообразующий галогенсодержащий анестетик третьего поколения, не будучи препаратом выбора для ингаляционной индукции анестезии, обладает рядом уникальных достоинств, обусловливающих его преимущество для использования низкого или минимального потока свежего газа: превосходство в скорости и предсказуемости периода ранней посленаркозной реабилитации; безопасность применения как у пожилых пациентов, так и у детей; актуальность для амбулаторной анестезиологии, бариатрической хирургии и программ по ускоренному послеоперационному восстановлению пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Овезов А.М., Пивоварова А.А., Халимов М.Р. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.