В 1909 г. Джеймс Николь, работавший хирургом в детской больнице города Глазго, Шотландия, сообщил в «Британском медицинском журнале» об успешном выполнении операций у 8988 детей и выписки их домой в течение одного дня. Данное направление получило название хирургии одного дня [1]. Несмотря на свою оригинальность и новизну, предложенная новая концепция ведения хирургических больных была забыта почти на 50 лет, и только в 1955 г. доктор Фаргухарсон из Эдинбурга вновь сообщил об успешной хирургии одного дня у пациентов с паховой грыжей [2]. Данная концепция получила свое дальнейшее развитие в 1960-х гг. в США, и первое отделение дневной хирургии было открыто в 1962 г. в Лос-Анджелесе [3]. В Канаде, Австралии и странах Западной Европы первые отделения хирургии одного дня появились в 1970–80-х гг. [4]. Примерно 40–65 % всех плановых хирургических вмешательств в США и странах Западной Европы на сегодняшний день выполняются в хирургии одного дня. Однако в краткосрочной перспективе их количество планируется довести до 75–80 % [4–6].
В последние годы получили широкое распространение различные методики ускоренной мобилизации больного после хирургических вмешательств [7]. Ранняя мобилизация больного может предупреждать развитие многих послеоперационных осложнений, таких как ателектаз легких, пневмония, тромбоэмболия и другие [8]. По своей сути, хирургия одного дня является одним из вариантов ранней мобилизации больного после хирургических вмешательств. Выписка пациента из медицинского учреждения в день выполнения хирургического пособия предъявляет высокие требования к профессионализму врачей — хирургов и анестезиологов. Существует также необходимость доступа врачей к постоянно обновляющейся информации о последних научных и практических достижениях в области дневной хирургии. Поэтому основная цель данного обзора литературы — предоставить вниманию коллег последние международные научные и практические достижения в области анестезии в отделении хирургии одного дня.
Правильная и логичная организация работы хирургии одного дня является залогом успешного проведения как хирургических операций, так и анестезий. На сегодняшний день существует множество вариантов хирургии одного дня: от размещения их на мобильных платформах до организации отдельных клиник со своими гостиницами [9–11]. Современные клиники дневной хирургии по своему оснащению и квалификации персонала практически не отличаются от обычных больниц. Хотелось бы особо отметить, что выписка пациента домой в день операции не является самоцелью для клиник дневной хирургии [12]. Несмотря на высокую квалификацию персонала и современное оснащение отделений/клиник хирургии одного дня, часть пациентов все же требует последующей госпитализации. Поэтому создание отделений/клиник хирургии одного дня на базе многопрофильных больниц является наилучшим вариантом для осуществления безопасного лечения больных. Данная концепция входит в рекомендации многих профессиональных сообществ США и Западной Европы [6].
В каждой клинике существует собственный список хирургических вмешательств для дневной хирургии. Он зависит от таких факторов, как профиль, традиции, оснащение клиники, квалификация персонала, потребность в хирургии данного направления и т. д. По мере становления и развития отделения дневной хирургии список хирургических вмешательств обычно поступательно расширяется. Начиная с простых и небольших хирургических операций, отделение постепенно приходит к проведению более сложных хирургических вмешательств, например лапароскопических операций, протезированию коленных/бедренных суставов и т. д. [13–19]. На сегодняшний день в отделениях хирургии одного дня США и Западной Европы проводится широкий спектр отоларингологических, гинекологических, ортопедических, урологических, абдоминальных, пластических, челюстно-лицевых, офтальмологических и стоматологических вмешательств [13–19].
Хирург определяет показания для оперативного лечения в отделении хирургии одного дня на основе собеседования и осмотра пациента в поликлинике (рис. 1). Основным критерием отбора больных является физическое состояние, соответствующее группам 1 и 2 по шкале Американского общества анестезиологов (АSА). Однако пациенты групп 3 и 4 по шкале АSА также могут оперироваться в отделении дневной хирургии, в случае если сопутствующие заболевания находились в стабильной фазе последние 3 мес. Интересно, что в прошлогодних рекомендациях Британской ассоциации анестезиологов хирургии одного дня авторы предлагают использовать функциональный, а не физический статус пациента, оцениваемый по шкале АSА [6]. Авторы также отмечают, что больные с хроническими заболеваниями, например с сахарным диабетом, могут очень быстро вернуться к обычному образу жизни после лечения в отделении дневной хирургии [6]. Самым важным изменением в данных рекомендациях стало отсутствие каких-либо ограничений для хирургического лечения в дневном стационаре по возрасту и весу, а также наличию ночного апноэ у пациента [6]. Противопоказаниями для хирургии одного дня являются предполагаемая операционная кровопотеря более 300–400 мл и/или потребность в инвазивном мониторинге гемодинамики и/или использовании центрального венозного катетера, а также ожидаемое время операции более 3 ч, хотя продолжительность операции не является абсолютным противопоказанием и некоторые отоларингологические операции длительностью до 4–6 ч выполняются в дневном стационаре.
Существуют также социальные критерии отбора больных для оперативного лечения в отделении хирургии одного дня. Важно, чтобы больной понимал и четко выполнял все инструкции персонала [20]. Необходимым требованием также является наличие одного сопровождающего совершеннолетнего возраста, который будет наблюдать за пациентом после выписки в течение первых 24 ч после операции. Кандидат для отделения дневной хирургии должен жить на доступном расстоянии до больницы в случае необходимости его срочной госпитализации в послеоперационном периоде. Последнее условие может быть выполнено путем размещения больного после операции в гостиницу при больнице [12]. В связи с наличием мобильных телефонов отпала потребность в обязательном наличии домашнего телефона как одного из важных социальных критериев отбора для хирургического лечения в дневном стационаре.
Предоперационный осмотр пациента врачом-анестезиологом остается важным фактором, способствующим снижению осложнений в периоперационный период. Биохимический анализ крови, рентген легких и ЭКГ не являются обязательными для всех пациентов, планируемых для оперативного лечения в отделениях хирургии одного дня [21–29]. В 2009 г. группа канадских ученых провела клиническое рандомизированное исследование у 1026 пациентов отделения хирургии одного дня [28]. Больные были распределены в две группы: первая группа прошла предоперационное обследование, включающее биохимический анализ крови, рентген грудной клетки и ЭКГ, в то время как вторая группа не получила таких обследований [28]. Возраст свыше 40 лет был у 85 % включенных больных [28]. Исследователи не нашли какой-либо разницы между этими группами в частоте осложнений на 7-й и 30-й дни после операций [28]. Таким образом, на сегодняшний день в отделениях дневной хирургии, биохимический анализ крови, рентген легких и ЭКГ проводятся только выборочным больным и только после осмотра врача — хирурга или анестезиолога [29].
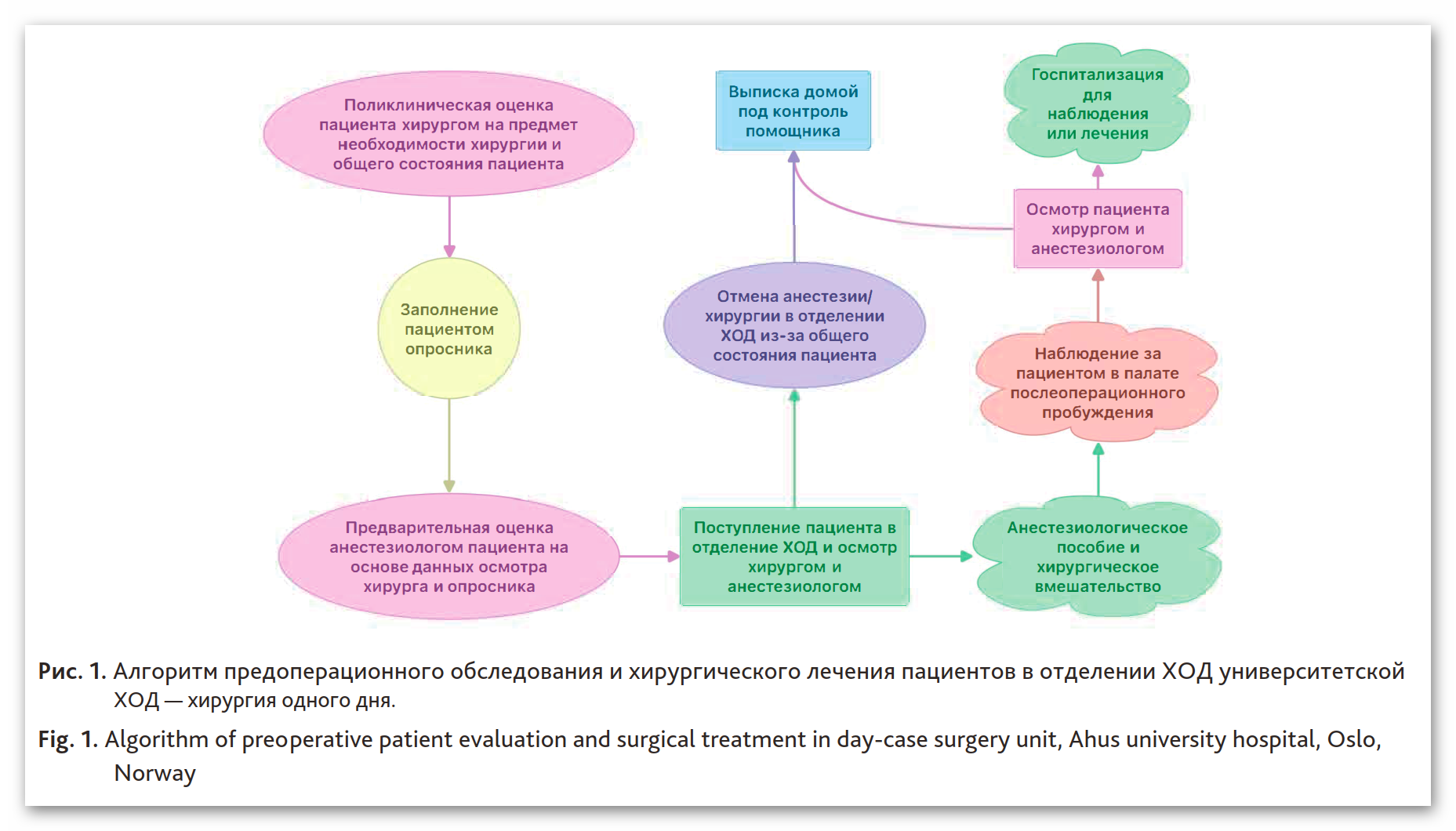
На рис. 1 представлена схема предоперационного обследования и лечения пациента в отделении хирургии одного дня, используемая в университетской клинике Ахюс, г. Осло, Норвегия. Одним из важных скрининговых инструментов в данном отделении остается использование опросников, заполняемых самим больным. Опросник включает примерно 15–20 вопросов: анамнез жизни, наличие сопутствующих заболеваний, список постоянно принимаемых препаратов, аллергий, может ли пациент подниматься на второй этаж без одышки, возникает ли затрудненное дыхание в ночное время или в положении на спине и т. д. Этот опросник помогает врачу-анестезиологу выявить клинические проблемы, которые могут влиять на течение анестезии и послеоперационного периода. Альтернативой опроснику может быть интервью по телефону или собеседование с пациентом в медицинском учреждении. Однако эти методики не показали каких-либо преимуществ [30–33]. Опыт нашего отделения показывает, что основное количество факторов риска выявляется при помощи опросников (86 % пациентов), и лишь у небольшого количества больных — в результате клинического осмотра (8 %) и на основании дополнительных обследований (6 %).
Пациент оценивается врачом-анестезиологом дважды: по документации и при личном контакте с больным. Вначале анестезиолог читает записи первичного осмотра хирурга и опросник, заполненный самим больным (см. рис. 1). При этом анестезиолог может назначить дополнительное обследование при необходимости. После поступления больного в отделение проводится клиническая оценка пациента. При выявлении противопоказаний операция может быть отменена. Отмена операции происходит редко и в основном из-за нарушения пациентом режима приема жидкости и пищи («правило 2–4–6»: последний прием светлой жидкости за 2 ч до анестезии, последний прием молочных продуктов за 4 ч до анестезии и последний прием твердой пищи за 6 ч до анестезии). Отмена операции у детей зачастую связана с наличием симптомов острой респираторной инфекции. Хроническая инфекция верхних дыхательных путей без наличия признаков обострения не является абсолютным противопоказанием для проведения анестезии. При оценке пациентов с сердечно-сосудистой патологией можно использовать калькуляторы риска осложнений: http://www.surgicalriskcalculator.com.
Рис. 1. Алгоритм предоперационного обследования и хирургического лечения пациентов в отделении ХОД университетской клиники Ахюс, г. Осло, Норвегия
Fig. 1. Algorithm of preoperative patient evaluation and surgical treatment in day-case surgery unit, Ahus university hospital, Oslo, Norway
ХОД — хирургия одного дня.

Премедикация в дневном стационаре, как и анестезия, является многокомпонентной. В последнее время наблюдается крайне редкое использование седативных препаратов в качестве компонента премедикации. Это обусловлено тем, что препараты этой группы значительно замедляют время пробуждения пациента после анестезии. Хорошая информированность пациента с помощью тематических буклетов, личных бесед с врачом и т. д. позволяет в большинстве случаев избежать применения седативных препаратов [34–36]. Одним из важных компонентов премедикации в качестве базисной послеоперационной анальгезии является использование парацетамола per os. При операциях с выраженными травматизирующими моментами (например, фиксация перелома лучевой кости металлическими пластинами) необходимо добавление опиоидных анальгетиков, например, оксиконтин per os за 20–30 мин до операции [37]. Следующим важным компонентом премедикации является использование противовоспалительных препаратов, например, диклофенак per os. Нестероидные противовоспалительные препараты уменьшают воспаление и отек в зоне операции и, таким образом, снижают давление на периферические нервные окончания, что приводит к снижению интенсивности болевого импульса из зоны повреждения тканей [37]. При наличии симптомов повышенной кислотности желудка необходимо добавить к премедикации антациды. В последнее время в качестве дополнительного противовоспалительного и противорвотного средства в комплексной премедикации часто используется синтетический глюкокортикоид — дексаметазон 4–12 мг per os.
Таким образом, стандартная премедикация в отделениях хирургии одного дня обычно состоит из комбинации парацетамола, диклофенака, дексаметазона с добавлением по показаниям оксиконтина и/или антацида. Хотелось бы подчеркнуть, что все препараты даются пациенту перорально с использованием 25–50 мл воды для облегчения процесса проглатывания. Прием данных препаратов вместе с водой за 15–30 мин до анестезии не увеличивает частоту аспирации и не является противопоказанием для использования ларингеальной маски или анестезии с сохраненным спонтанным дыханием.
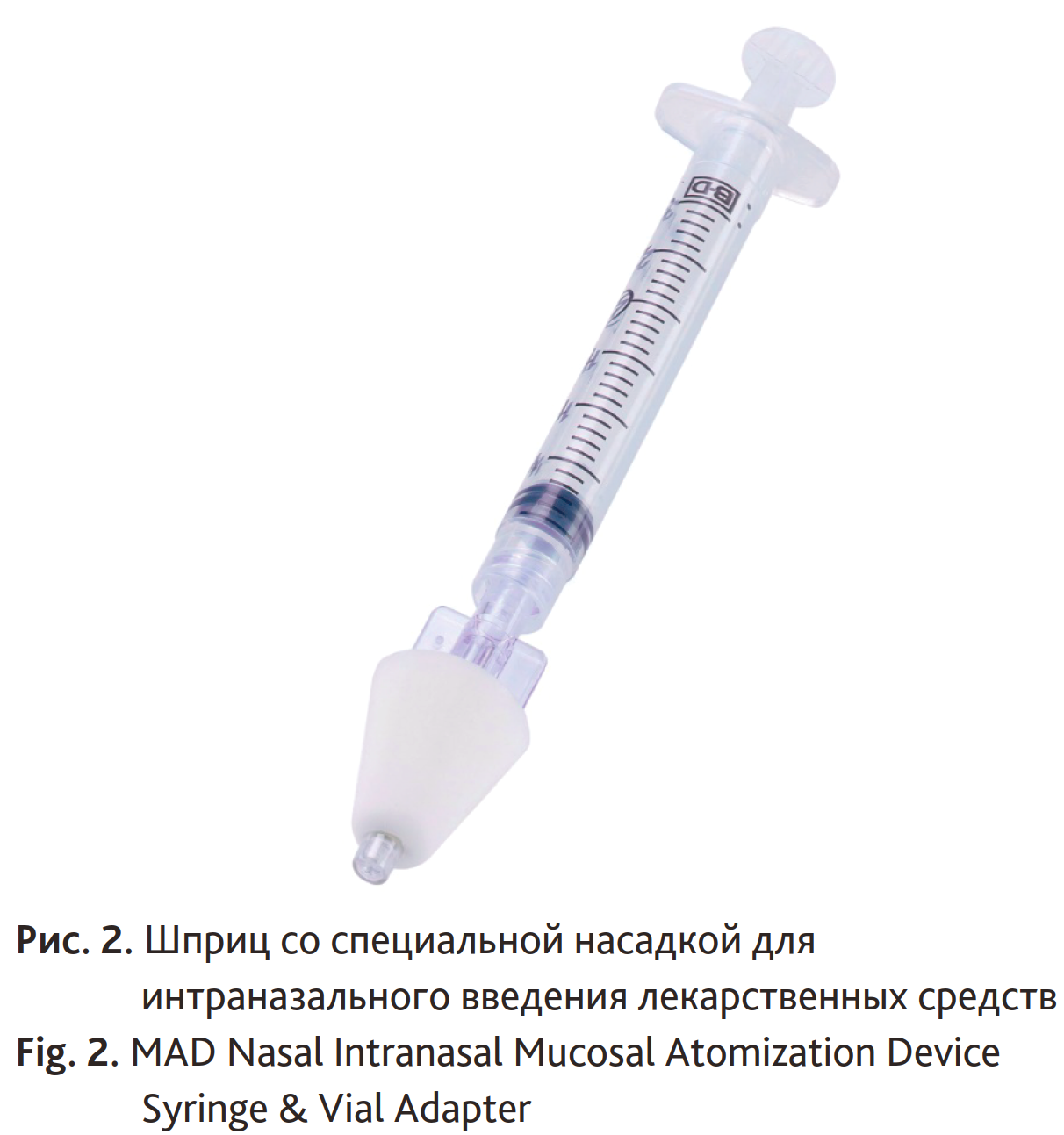
Отдельно необходимо осветить особенности премедикации у детей. В отличие от взрослых, у детей 1–7 лет необходимо использование седативных препаратов в премедикации, поскольку маленький ребенок еще не в состоянии самостоятельно контролировать свои стрессовые реакции перед операцией [38–42]. Использование у детей peros или интраназально мидазолама, кетамина, клофелина или дексмедетомидина имеет свои недостатки: продолжительное время развития полного эффекта (20–60 мин) и непредсказуемость эффекта [38–42]. Альтернативным вариантом является использование суфентанила в дозе 1–1,5 мкг/кг интраназально [42]. Преимущество суфентанила заключается в быстром (5–10 мин) и предсказуемом развитии эффекта, отсутствии раздражения слизистых оболочек носа при интраназальном введении специальным шприцом [42] (рис. 2). Обычно дети не в состоянии проглотить таблетки парацетамола, диклофенака и дексаметазона, поэтому данные препараты вводятся внутривенно или ректально в течение наркоза. Родители должны быть заранее проинформированы о ректальном введении премедикации.
Рис. 2. Шприц со специальной насадкой для интраназального введения лекарственных средств
Fig. 2. MAD Nasal Intranasal Mucosal Atomization Device Syringe & Vial Adapter
Выбор типа анестезии в отделении хирургии одного дня должен базироваться на принципах безопасности, эффективности и минимальной стоимости [43, 44]. В 1993 г. американские исследователи из клиники Майо проанализировали 30-дневную смертность и заболеваемость у 38 598 пациентов после оперативного лечения в дневном стационаре [43]. За изучаемый период было 4 летальных исхода, два из них от острого инфаркта миокарда и два — в результате транспортного проишествия [43]. Таким образом, авторы исследования продемонстрировали, что оперироваться в дневном стационаре довольно безопасно, поскольку 30-дневная смертность и заболеваемость после хирургии не превышают таких же показателей в общей популяции населения [43]. В 2012 г. датские исследователи ретроспективно проанализировали 57 709 анестезий, выполненных в отделениях хирургии одного дня в течение 3 лет. Они обнаружили, что частота повторной госпитализации после проведенной хирургии составила 1,21 %, при этом из них 0,5 % были госпитализированы из-за повторного кровотечения, 0,44 % в результате инфекции, 0,03 % вследствие тромбоэмболий [44]. Однако если хирургическое лечение проводится в отделениях или кабинетах, которые недостаточно оборудованы и/или при отсутствии врача-анестезиолога, то риск неблагоприятного исхода и осложнений значительно возрастает [45]. Группа исследователей из Нидерландов, проанализировав почти 800 000 анестезиологических пособий у госпитализированных пациентов, пришла к выводу, что значительное снижение осложнений анестезий напрямую связано с регулярным использованием проверочных листов для тестирования оборудования, присутствием одного и того же врача-анестезиолога в течение всего наркоза, применением антидота мышечных релаксантов в конце анестезии и использованием местных анестетиков для послеоперационного обезболивания [46].
Подводя итог, хотелось бы отметить, что выбор вида типа анестезии в дневном стационаре практически не оказывает значительного влияния на раннюю смертность и/или заболеваемость после дневной хирургии [47]. Соблюдение протоколов анестезии и послеоперационного лечения, использование проверочных листов, высокая компетенция персонала и наличие необходимого оборудования обеспечивают безопасное проведение анестезии в отделении хирургии одного дня [47, 48]. Очевидный факт, что правильная организация работы дневного стационара намного важнее для безопасного лечения пациента, чем тип анестезии, используемый в данном стационаре [48]. Однако выбор типа анестезии может существенно влиять на частоту побочных эффектов анестетиков, срок восстановления нормального функционального состояния пациента в раннем послеоперационном периоде и в итоге на время пребывания пациента в дневном стационаре.
Спинальная анестезия зарекомендовала себя как простая и безопасная методика. Однако использование лидокаина в качестве анестетика приводит к развитию транзиторных неврологических симптомов (ТНС) [49]. У пациентов с ТНС отмечается более выраженный болевой синдром в первые 72 ч после операции и снижение функционального состояния в первые 24 ч после операции [50]. Развитие ТНС четко связано с дозировкой лидокаина. При использовании лидокаина в дозе ниже 40 мг данная симптоматика не появляется [50, 51]. Однако при дозе лидокаина ниже 40 мг возникает потребность в добавлении опиоидов. С одной стороны, это приводит к увеличению времени наблюдения, а с другой стороны, может вызвать развитие кожного зуда и других побочных эффектов, характерных для опиоидов [52, 53]. Использование ропивакаина или бупивакаина не приводит к развитию ТНС [54, 55]. Необходимо использовать данные препараты в малых дозах для снижения времени моторной блокады и нахождения пациента в блоке пробуждения [54, 55]. Другим ограничивающим фактором использования спинальной анестезии в дневном стационаре может быть возникновение постпункционной головной боли, что может задержать выписку больного из отделения хирургии одного дня. Нарушение опорожнения мочевого пузыря, особенно у пожилых пациентов, может приводить к необходимости катетеризации мочевого пузыря и также последующей задержке выписки пациента домой [56].
Таким образом, несмотря на то что спинальная анестезия сама по себе является безопасной и простой в исполнении, использование ее в отделении хирургии одного дня может приводить к значительным задержкам с выпиской пациента домой, а порой и к необходимости госпитализации больного в стационар [57]. Все вышеперечисленное снизило частоту использования спинальной анестезии в дневных стационарах, а многие клиники одного дня вообще отказались от ее применения.
В последние годы ингаляционная анестезия с использованием севофлурана по закрытому контуру с малым потоком приобрела широкое распространение в анестезиологической практике [58, 59]. Экономичность, простота дозирования и отсутствие раздражения верхних дыхательных путей создает возможность использования севофлурана как в качестве средства для вводной анестезии, так и для поддержания в ходе операции [58, 59]. Сравнительный анализ анестезий с использованием севофлурана/фентанила и пропофола/фентанила показал, что время пробуждения после наркоза было всего лишь на 1 мин быстрее в пользу севофлурана: 6,9 +/– 0,4 мин, чем в группе пропофола 8,2 +/– 0,4 мин [60]. Использование севофлурана, как и других ингаляционных анестетиков, в качестве поддержания анестезии во время операции приводит к значительному увеличению количества пациентов (до 30 %) с жалобами на послеоперационную тошноту, рвоту и озноб [60–62]. Кроме того, последние исследования [63–65] показывают, что ингаляционная анестезия ухудшает когнитивную функцию в раннем послеоперационном периоде у лиц старше 65 лет по сравнению с использованием пропофола. В целом, являясь довольно безопасным анестетиком [66], севофлуран на сегодняшний день ограничивается только вводным наркозом у детей или клиническими ситуациями, где использование пропофола противопоказано [67, 68]. В последние годы в анестезиологической практике набирает популярность использование десфлурана в комбинации с ремифентанилом [69, 70]. Данная комбинация особо показана при длительных (более 3 ч) хирургических операциях, когда использование пропофола может приводить к его постепенному накоплению в организме и последующему замедлению пробуждения пациента. Однако при использовании десфлурана, как и при применении других ингаляционных анестетиков, необходимо профилактическое использование антиэметиков (ондансентрон), а также проведение профилактики фазы возбуждения в ходе пробуждения пациента, особенно выраженной у детей. Для этого нужен переход на внутривенную инфузию пропофола за 20–30 мин до окончания наркоза или болюсное введение небольших доз пропофола или тиопентала за 3–5 мин до предполагаемого пробуждения.
В скандинавских странах тотальная внутривенная анестезия (ТВВА) с использованием пропофола и ремифентанила — наиболее используемый тип анестезии в отделениях хирургии одного дня [67, 68]. Применение специальных пластиковых одноходовых клапанов (рис. 3) препятствует забрасыванию крови пациента в систему подачи пропофола и ремифентанила и, таким образом, позволяет использовать один и тот же шприц с препаратом для нескольких больных, тем самым снижать расходы. ТВВА может применяться двумя способами: первый — это постоянная внутривенная инфузия пропофола, второй — это поддержание заданной целевой концентрации. В табл. 1 представлены обе методики и дозы пропофола, необходимые для определенных стадий наркоза. Современные насосы поддержания заданной целевой концентрации пропофола имеют хорошую корреляцию с клинической картиной и измеренной плазмоконцентрацией [71]. В начале использования данной методики отмечались довольно большие отклонения между предсказанной и измеренной концентрацией пропофола в плазме [72]. В современных насосах применяются две математические модели (Марш и Шнидер) для расчета и поддержания заданной целевой концентрации. Модель Марша дает более точные предсказанные уровни, если плазмоконцентрации пропофола < 3 мкг/мл, а модель Шнидера — если плазмоконцентрации > 4 мкг/мл [73]. Обычно для поддержания анестезии в ходе операции используется заданная плазмаконцентрация пропофола от 3 до 6 мкг/мл, а снижение плазмоконцентрации до 1,5 мкг/мл приводит к пробуждению пациента. Методика поддержания заданной целевой концентрации имеет преимущество перед постоянной внутривенной инфузией в том, что в результате ее применения используется меньше пропофола, поскольку насос периодически делает паузы. При проведении ТВВА важно, чтобы внутривенный доступ всегда находился в зоне визуального наблюдения и не был закрыт стерильными простынями (рис. 4). Если у больного используются мышечные релаксанты, плазмоконцентрация пропофола должна быть выше 2,5 мкг/мл для профилактики пробуждения больного в ходе хирургической операции.
Таблица 1. Эффекты пропофола в зависимости от скорости ведения в/в или от достигнутой целевой плазмоконцентрации (разработка д-ра Кая Кнюдсена, Швеция, https://narkosguiden.se/book/pocketguide/)
Table 1. Clinical effects of propofol by intravenous continues infusion or target controlled infusion (Dr. Kai Knudsen, Sweden)
| По скорости введения в/в, мг/кг/ч | Клинический эффект | По целевой плазмоконцентрации, мкг/мл |
|---|---|---|
| 4 | Седация | 1,5 |
| 6 | Умеренная боль | 2,0 |
| 8 | Установка ларингеальной маски | 3,0 |
| 10 | Сильная боль | 3,5 |
| 12 | Интубация трахеи | 4,0 |
| 14–16 | Глубокий наркоз | 5,0–6,0 |
Рис. 3. Одноходовой клапан, предотвращающий обратный заброс крови, — Codan R-Lock
Fig. 3. Codan R-Lock One-way Needleless Valve
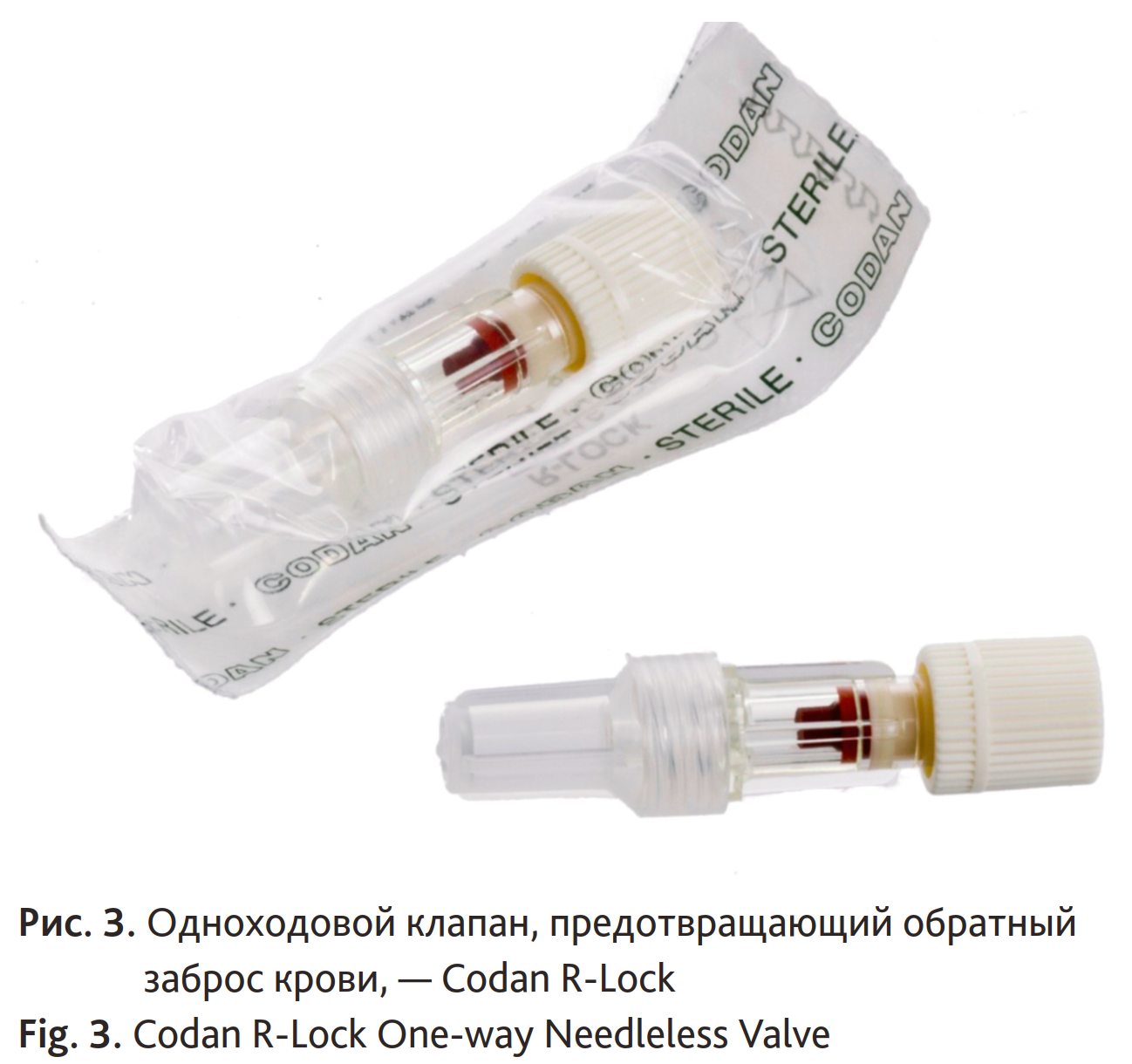
Рис. 4. Визуальный мониторинг венозного доступа при проведении тотальной внутивенной анестезии
Fig. 4. Visual monitoring of intravenous access during total intravenous anaesthesia
В табл. 2 представлены две методики дозирования ремифентанила. Для уменьшения послеоперационной мышечной слабости, ускорения мобилизации пациента и снижения риска дыхательной недостаточности в скандинавских странах используется интубация трахеи без применения мышечных релаксантов. Для проведения такого рода интубации необходимо использовать ремифентанил не менее 3–4 мкг/кг, однако данную дозу нельзя вводить болюсом, можно только в виде медленной внутривенной инфузии в течение 3–4 мин. Фентанил в обычных дозах для индукции в наркоз плохо подходит для интубации без применения мышечных релаксантов. Для угнетения трахеального рефлекса и интубации трахеи без релаксантов необходима доза фентанила не менее 6–8 мкг/кг [74, 75]. В табл. 3 представлены характеристики всех опиоидов, используемых в отделениях хирургии одного дня. Необходимо отметить, что все четыре опиоида, используемые в анестезии, являются чистыми мю-агонистами и механизм их действия в организме человека одинаков. Однако они имеют существенные различия по времени наступления максимального эффекта, продолжительности действия и используемым дозам. Алфентанил быстрее всех проникает через гематоэнцефалический барьер и является самым короткодействующим препаратом. Алфентанил идеально подходит для использования в процедурах, где боль обусловлена расширением анатомической структуры при введении хирургического или диагностического инструмента, например при расширении шейки матки, введении колоноскопа или гастроскопа. Алфентанил в 10 раз слабее фентанила, поэтому доза, эквивалентная 100 мкг фентанила, будет 1000 мкг алфентанила. В свою очередь, суфентанил в 10 раз сильнее фентанила, и поэтому его 10 мкг соответствуют 100 мкг фентанила. Суфентанил не является оптимальным препаратом для интубации трахеи, поскольку пик его действия наступает только через 5,6 мин. В то же время суфентанил идеально подходит для длительных операций, где в силу его времени действия 50–60 мин не требуется частое введение болюсов. В итоге общая доза введенного опиоида не будет высокой и больной проснется, соответственно, гораздо быстрее. Самым привлекательным препаратом для длительной хирургии является ремифентанил, который не накапливается в организме человека и метаболизируется с помощью плазмаэстераз. Даже в случае длительного применения ремифентанила (в течение нескольких дней) больной просыпается через 10 мин после остановки инфузии данного препарата. Недостаток ремифентанила заключается в том, что он не обеспечивает анальгезию после остановки инфузии, и поэтому необходимо за 10 мин до окончания инфузии ремифентанила ввести больному опиоид (в/в морфин 5–10 мг или фентанил 50–100 мкг).
В последнее время в отделениях хирургии одного дня благодаря ультразвуку (УЗ) набирает популярность использование регионарной анестезии [76, 77]. С помощью УЗ можно легко идентифицировать практически любое нервное сплетение, а введение иглы контролируется визуально, уменьшая опасность повреждения сосудов или других анатомических структур [76, 77]. Использование 15–40 мл ропивакаина, который является менее кардиотоксичным, чем бупивакаин, обычно обеспечивает достаточную анальгезию в течение 8–24 ч. У пожилых пациентов и тех, кто не хочет оперироваться под общей анестезией, можно применить блокаду нервного сплетения местным анестетиком в сочетании с легкой седацией.
Таблица 2. Эффекты ремифентанила в зависимости от скорости ведения в/в или от достигнутой целевой плазмоконцентрации (разработка д-ра Кая Кнюдсена, Швеция, https://narkosguiden.se/book/pocketguide/)
Table 2. Clinical effects of remifentanil by intravenous continues infusion or target controlled infusion (Dr. Kai Knudsen, Sweden)
| По скорости введения в/в, мг/кг/мин | Клинический эффект | По целевой плазмоконцентрации, нг/мл |
|---|---|---|
| 0,05 | Седация | 1,3 |
| 0,1 | Умеренная боль | 2,5 |
| 0,2 | Установка ларингеальной маски | 5,0 |
| 0,25 | Сильная боль | 6,0 |
| 0,3 | Интубация трахеи | 7,5 |
| 1,0 | Глубокий наркоз | 12,5–20,0 |
Таблица 3. Время пикового эффекта, продолжительности действия опиоидов и примерная эквипотенция опиоидов по отношению к фентанилу (адаптировано из [96, 97])
Table 3. Time to peak effect, duration of opioid’s effect and approximate equipotential effect related to fentanyl (adapted from [96, 97])
| Опиоид | Время максимального эффекта препарата, мин | Продолжительность действия, мин | Примерная эквипотенция опиоидов к фентанилу |
|---|---|---|---|
| Алфентанил | 1,4 | 10 | 10 : 1 |
| Фентанил | 3,6 | 20–30 | 1 |
| Суфентанил | 5,6 | 50–60 | 1 : 10 |
| Ремифентанил | 1,6 | 10 | Интубация 1 : 2–3 Поддержание 10–15 : 1 |
Умеренную или интенсивную боль после операции в дневном стационаре отмечают 10–30 % пациентов [78]. Интенсивность послеоперационной боли зависит от типа операции и эмоционального статуса пациента [79]. Хирургические операции в дневном стационаре, вызывающие наибольшую боль, включают в себя микродискэктомию, эндовидеохирургическую холецистэктомию, операции на плечевом, локтевом, голеностопном и коленном суставе, а также выполнение пластики паховой грыжи и чрезвлагалищного удаления матки [79]. Одним из факторов возникновения интенсивной боли в домашних условиях может быть недостаточный контроль боли в течение первых нескольких часов после операции. И это может быть важным аргументом в проведении «агрессивного» лечения ранней послеоперационной боли [79]. Регионарная анестезия под контролем УЗ, особенно в ортопедической хирургии, может обеспечивать адекватную анальгезию как в первые часы после операции, так и длительное время после выписки. В дневных стационарах следует отдавать предпочтение данному виду послеоперационного обезболивания как самому простому и безопасному.
Премедикация с применением парацетамола, нестероидных противовоспалительных препаратов (НПВП), а также, при необходимости, опиоидов (оксиконтин 5–10 мг) может служить хорошим базисом для послеоперационного обезболивания [79]. Тем не менее для купирования острой послеоперационной боли необходимо использовать опиоиды, такие как фентанил (от 10 до 100 мкг), если боль по визуально-аналоговой шкале (ВАШ) 8–10, или морфин (от 1 до 10 мг), если ВАШ 5–8. Важно вводить данные препараты внутривенно по принципу start low go slow, т. е. начинать с малых доз и постепенно их наращивать. Необходим контроль за частотой дыхания (ЧД) в первые 30 мин после внутривенного введения данных препаратов. При снижении ЧД ниже 6/мин и периферического насыщения кислородом ниже 90 % может быть показано введение налоксона. В последнее время набирает популярность использование клонидина (клофелина) в качестве адъюванта в послеоперационном обезболивании [80]. Внутривенное введение 2 мкг на кг клонидина, а иногда и до 4 мкг на кг, приводит к временной седации пациента, (около 30 мин), и когда пациент просыпается, у него нет боли. Противопоказанием к применению клонидина может быть расширение комплекса QRS, А–В-блокады, выраженная брадикардия и низкое артериальное давление. В домашних условиях пациент продолжает прием парацетамола, НПВП, а при необходимости — трамадола или оксиконтина.
Невозможность купировать острую боль стандартными методами в послеоперационном периоде является показанием для госпитализации пациента и лечения его в блоке посленаркозного наблюдения с применением более высоких доз опиоидов и/или внутривенной инфузией малых доз кетамина или лидокаина.
Основными критериями выписки пациента домой из отделения хирургии одного дня являются полное восстановление сознания, адекватность, ориентированность во времени и пространстве, способность принимать воду и пищу, отсутствие тошноты/рвоты, боль не выше 3–4 по визуально-аналоговой шкале, отсутствие катетеров или зондов (в мочевом пузыре, желудке и т. д.), наличие сопровождающего человека, который будет находиться с пациентом первые 24 ч после выписки, а также нормальные показатели артериального давления, частоты сердечных сокращений, частоты дыхания и периферического насыщения кислородом. Пациент должен проживать недалеко, чтобы он мог добраться до больницы в течение 20–30 мин. Если больной проживает далеко от больницы, его выписывают в больничную гостиницу.
Залогом безопасного и эффективного проведения анестезии и хирургического вмешательства в дневном стационаре являются следующие факторы: тщательный отбор пациентов, хороший уровень подготовки персонала, наличие современного оборудования операционных и блоков посленаркозного пробуждения, доступность широкого спектра лекарственных средств, хорошая логистика организации работы отделения с разработкой собственных протоколов и алгоритмов, а также размещение дневного стационара на базе многопрофильной больницы. Наличие больничной гостиницы создает дополнительные возможности для лечения пациентов из удаленных от медицинского учреждения зон проживания.
Конфликт интересов. Автор заявляет об отсутствии конфликта интересов.
Вклад автора. Куклин В.Н. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи, обоснование научной значимости.