Поиск источников для данного обзора литературы проводился с использованием электронных ресурсов российской научной электронной библиотеки eLIBRARY.ru, библиографической базы статей по медицинским наукам (MEDlars onLINE) Национальной медицинской библиотеки США (U.S. National Library of Medicine, NLM), а также электронной библиотеки журнала Obstetrics and Gynecology. Были использованы следующие ключевые слова: patient blood management in obstetrics, iron deficiency, iron deficiency anemia, pregnancy, intravenous iron. Глубина поиска составляла 10 лет. При отборе источников сделан акцент на данные рандомизированных контролируемых исследований, метаанализов по теме обзора.
Более 30 % населения мира, более 2 млрд человек, страдают анемией, наиболее частой причиной которой является дефицит железа. Дефицит железа поражает большее количество людей, чем любое другое заболевание, представляя собой глобальную проблему общественного здравоохранения, соизмеримую с эпидемией. Более тонкий по своим проявлениям, чем, например, белково-энергетическое голодание, дефицит железа наносит тяжелейший урон качеству жизни населения Земли, проявляясь в виде плохого здоровья и преждевременной смерти [1].
Периоперационная анемия является доказанным фактором риска заболеваемости и смертности при всех видах хирургических вмешательств, а также сопровождает около двух третей пациентов в отделениях реанимации и интенсивной терапии, увеличивая тяжесть состояния и длительность пребывания [2–5].
Ведущие эксперты однозначно рекомендуют выявлять и устранять анемию еще до операции, использовать технологии кровесбережения и контроля анемии во время операции и в послеоперационном периоде в рамках концепции «менеджмент крови пациента» (МКП), одной из целей которого является рестриктивная стратегия трансфузии аллогенных компонентов крови [6, 7]. Эта концепция тесно переплетена с принципом «раннего восстановления после хирургии» (Enhanced Recovery After Surgery — ERAS), которая также подразумевает коррекцию анемии в периоперационном периоде, в том числе и в акушерстве [8, 9].
Использование концепции МКП в акушерстве имеет свои особенности. В первую очередь, необходимо учитывать, что во время беременности у женщин в норме уровень гемоглобина, как и градация тяжести анемии, иной, чем в общей популяции (табл. 1) [10].
Таблица 1. Нормальный уровень гемоглобина (г/л) и степени тяжести анемии у взрослых, по данным ВОЗ
Table 1. Normal hemoglobin level (g/L) and severity of anemia in adults according to WHO
| Возраст | Нормальный уровень гемоглобина, г/л | Анемия (по уровню гемоглобина, г/л) | ||
|---|---|---|---|---|
| Легкая | Средняя | Тяжелая | ||
| Женщины (от 15 лет) | 120 и выше | 110–119 | 80–109 | менее 80 |
| Мужчины (от 15 лет) | 130 и выше | 110–129 | 80–109 | менее 80 |
| Беременные женщины | 110 и выше | 100–109 | 70–99 | менее 70 |
Итак, норма гемоглобина во время беременности — 110 г/л, во втором/третьем триместре — до 105 г/л и после родов — 100 г/л [11].
Такое снижение уровня гемоглобина во время физиологической беременности связано в первую очередь с непропорциональным увеличением объема плазмы крови (на 40–50 % больше по отношению к состоянию вне беременности) по отношению к эритроцитам с 6 нед. и достигающей максимального значения к 24 нед. беременности [12]. Основная цель: улучшение кровообращения в фетоплацентарном комплексе, реологических свойств крови, транспорта кислорода и обеспечение потребностей плода. При этом также увеличиваются масса эритроцитов на 15–25 %, концентрация эритропоэтина, но эти эффекты маскируются гемодилюцией и возвращаются к норме в течение 4–6 нед. после родов. Увеличение массы эритроцитов во время беременности прямо связано с адекватным потреблением железа как с пищей, так и из депо [13].
Анемия различного генеза во время беременности является общемировой проблемой (более 40 % беременных женщин страдают анемией), и хорошо известно, что с ранних сроков беременности анемия приводит к неблагоприятным исходам для матери, высокому риску преждевременных родов, низкой массы новорожденных, инфекционных осложнений, кровопотери, трансфузии аллогенных эритроцитов, материнской и перинатальной заболеваемости и смертности [14]. У женщин с анемией отмечаются повышенная утомляемость, ограничение физической активности, головокружения, головные боли и снижение когнитивных функций, что в послеродовом периоде значительно ухудшает способность матери заботиться о новорожденном. Баланс железа в организме коррелирует с материнскими показателями качества жизни, такими как общее состояние здоровья, физическая активность и психическое здоровье, а также когнитивным развитием ребенка [15–18].
В Международной классификации болезней 10-го пересмотра анемия во время беременности представлена в разделе «О99.0 Анемия, осложняющая беременность, деторождение и послеродовой период плюс состояния, классифицированные в рубриках D50–D64». Несмотря на абсолютное преобладание во время беременности железодефицитной анемии (ЖДА) — более 50 % в структуре всех анемий, необходимо учитывать возможность развития анемии другого генеза и своевременно проводить дифференциальную диагностику.
Даже при физиологической беременности происходят значительные изменения метаболизма железа в организме женщины. Рекомендуемая диета беременной женщине не способна компенсировать потребности организма в витамине D, фолиевой кислоте и железе (обеспечивает всего на 35 %) [19]. Потребление железа во время беременности у женщин в 11 странах Европы (1991–2014 гг.) ниже рекомендуемых значений в 60–100 % случаев (рекомендуется 14,8–30,0 мг/день). Испания, Босния и Польша сообщили о потреблении 8,3–10,1 мг/день, Хорватия, Великобритания, Норвегия и Финляндия — 10,2–11,4 мг/день, Германия, Португалия, Чешская Республика и Греция — 12,2–15,4 мг/день [20]. Только у 16–20 % беременных женщин, не получающих препараты железа, определяются адекватные запасы железа в костном мозге. Потери железа во время беременности достигают 1000 мг — 6,3 мг/сутки (увеличение массы эритроцитов 450 мг, рост плода 225 мг, развитие плаценты 80 мг, потеря крови во время нормальных родов 250 мг), при родоразрешении с 1,0 мл крови теряется 0,5 мг железа, во время лактации теряется 0,5 мг/день [21, 22]; каждый дополнительный грамм гемоглобина, который синтезирует мать, требует дополнения 3,46 мг элементного железа [23].
Следует помнить о U-образной кривой концентрации гемоглобина у матери и риска неблагоприятных исходов беременности: как и анемия, так и высокие уровни гемоглобина (более 130 г/л) и высокое содержание сывороточного железа в третьем триместре беременности ассоциируются с преждевременными родами, низкой массой тела новорожденного, риском мертворождения [24].
Если диагностика анемии во время беременности по уровню гемоглобина не проблематична, то для верификации дефицита железа (в МКБ-10: Е61.1 Недостаточность железа) или железодефицитного состояния (ЖДС), а также ЖДА необходимо исследовать уровень ферритина (табл. 2) [25] как наиболее чувствительного индикатора дефицита железа. Ферритин — белковый комплекс, выполняющий роль основного внутриклеточного депо железа у человека и животных. Уровень ферритина сыворотки — самый полезный и легко доступный лабораторный параметр для оценки дефицита железа во время беременности. Уровни ферритина сыворотки менее 15 мкг/л указывают на подтвержденный дефицит железа и требуют коррекции. Уровень ферритина сыворотки менее 30 мкг/л с/или без анемии указывает на недостаточные запасы железа и также необходимость коррекции [22]. Однако поскольку ферритин — белок острой фазы, уровень ферритина сыворотки в нормальном диапазоне не исключает дефицита железа при воспалении (рекомендуется контроль С-реактивного белка), то необходимо определять сатурацию трансферрина — гликозилированного белка, который связывает и транспортирует ионы железа. В этих условиях сатурация трансферрина менее 20 % (в норме от 20 до 50 %) при различных патологических состояниях свидетельствует о железодефицитном состоянии [23, 26, 27].
В меньшей степени для оценки дефицита железа используются такие показатели, как средний объем эритроцита (MCV) — микроцитоз, среднее содержание гемоглобина в эритроцитах (MCHC) — гипохромия, снижение концентрации сывороточного железа, трансферрина и гепсидина в сыворотке крови, увеличение общей железосвязывающей способности сыворотки (TIBC) и концентрации растворимых рецепторов трансферрина (sTfR) [13, 23].
Итак, на всех этапах периоперационного периода обязательным компонентом принципа «менеджмента крови пациента» является выявление и коррекция анемии, что особенно актуально при оперативном родоразрешении, когда объем кровопотери значительно выше, чем при вагинальных родах.
В периоперационном периоде принцип «менеджмента крови пациента» или технологии минимизации кровопотери и применения аллогенных компонентов крови в акушерстве включает следующие этапы [22, 28, 29].
Во время беременности:
В родах (во время операции):
После родов (после операции):
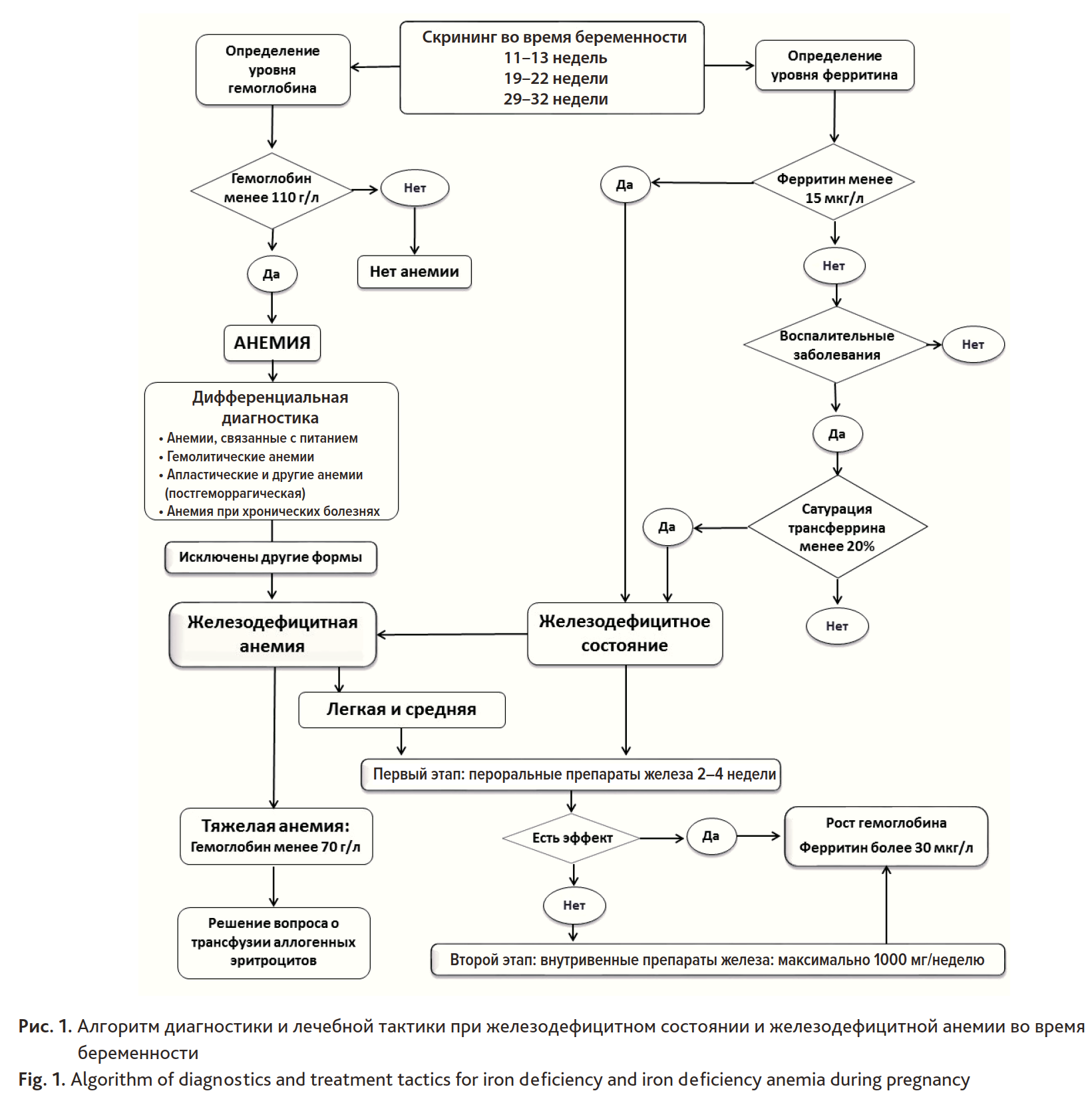
Первым этапом коррекции ЖДС и ЖДА во время беременности является пероральный прием препаратов железа (в «Перечне жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 г.» — железа (III) гидроксид полимальтозат) (рис. 1). Прием препаратов железа и фолиевой кислоты для коррекции ЖДА во время беременности рекомендован ВОЗ и другими акушерскими организациями как стандартная профилактическая и лечебная процедура (постоянный прием: железо 30–60 мг и фолиевая кислота 0,4 мг в сутки и интермиттирующий прием: железо 120 мг и фолиевая кислота 2,8 мг в неделю) [30, 31].
Кроме этого, ВОЗ рекомендует прием препаратов железа женщинам и девочкам-подросткам во время менструации для коррекции дефицита железа (прием элементного железа 30–60 мг/день) [32].
Кстати, одной из задач «Глобальной стратегии здоровья женщин, детей и подростков (2016–2030)» ВОЗ является устранение всех форм недоедания и обеспечение всех пищевых потребностей детей, юных девочек, беременных и кормящих женщин [33].
Однако для достижения адекватного эффекта при приеме пероральных препаратов железа требуется длительное время, которого очень часто нет у акушерских пациенток группы высокого риска по развитию массивной кровопотери и с анемией в периоперационном периоде.
Рис. 1. Алгоритм диагностики и лечебной тактики при железодефицитном состоянии и железодефицитной анемии во время беременности
Fig. 1. Algorithm of diagnostics and treatment tactics for iron deficiency and iron deficiency anemia during pregnancy

Вторым этапом коррекции ЖДА во время беременности является использование внутривенных препаратов железа (см. рис. 1), которые показаны при следующих обстоятельствах [22, 28, 34]:
Поскольку внутривенные препараты трехвалентного железа позволяют достичь более выраженного положительного эффекта (увеличение гемоглобина, снижение потребности в трансфузии аллогенных эритроцитов) и в более короткие сроки, чем пероральные препараты [35–37], то именно эта группа препаратов предпочтительна в периоперационном периоде, особенно при известных факторах риска развития массивной кровопотери и ограниченном времени для коррекции ЖДС и ЖДА. При этом ни один препарат внутривенного трехвалентного железа не был лучше, чем другие, так как выбор в значительной степени определялся стоимостью и удобством применения [31, 38].
В Российской Федерации «Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2020 г.» включает три препарата железа для внутривенного введения: железа (III) гидроксид олигоизомальтозат (Монофер, «Солюфарм Фармацойтише Эрцойгниссе ГмбХ», Германия), железа (III) гидроксид сахарозный комплекс (Венофер, «БИПСО ГмбХ», Германия) и железа карбоксимальтозат (Феринжект, «Вифор (Интернэшнл) Инк», Швейцария) [39].
Согласно инструкциям по применению, все три препарата железа для внутривенного введения можно использовать во II и III триместрах беременности и во время лактации.
Наибольшее количество исследований (систематический обзор и метаанализ по эффективности и безопасности применения во время беременности и в послеродовом периоде) проведено в отношении железа карбоксимальтозата (Феринжект) [40–45]. Так, S. Wani et al. сообщают результаты применения одного введения железа карбоксимальтозата (500, 1000 или 1500 мг) во втором или третьем триместре беременности у 1001 женщины. Результаты показали, что у 41,4 % женщин смогли получить увеличение гемоглобина в крови более чем на 20 г/л в целом. Изменение более чем на 20 г/л было достигнуто у 27,5 % женщин, которым вводили дозу 500 мг, 39,2 % женщин — дозу 1000 мг и 63,9 % женщин — дозу 1500 мг внутривенно железа карбоксимальтозата. Это указывает на прямо пропорциональную зависимость между увеличением внутривенной дозы железа карбоксимальтозата и увеличением концентрации гемоглобина крови более чем на 20 г/л. Всего 7 (0,7 %) женщин сообщили о легких побочных эффектах во время исследования [42]. В сообщении B. Froessler et al. 863 беременные женщины получали внутривенно 1000 мг железа карбоксимальтозата, и автор заключает, что железа карбоксимальтозат эффективно и безопасно корректирует дефицит железа или железодефицитную анемию у беременных женщин, не вызывая гемоконцентрации [43].
На основании анализа 14 рандомизированных контролируемых исследований, сравнивающих внутривенное и пероральное лечение ЖДА у 2913 женщин с послеродовым кровотечением, A. Daniilidis et al. делают заключение, что внутривенное введение железа важно для лечения женщин и улучшения их физической работоспособности и качества жизни. Сравнение препаратов железа для внутривенного введения показывает преимущества железа карбоксимальтозата по сравнению с другими во время достижения желаемых значений гемоглобина и ферритина, а также в отношении побочных реакций [44].
Анализ C. Breymann et. al. показывает, что железосодержащие препараты, которые были изучены в хорошо контролируемых клинических исследованиях во время беременности и в послеродовом периоде, такие как железа карбоксимальтозат, должны быть предпочтительны по соображениям безопасности (анафилактические реакции) [45].
Применение внутривенных препаратов железа во время беременности и в послеродовом периоде также описано и для железа (III) гидроксид олигоизомальтозата (Монофер) [46, 48], и для железа (III) гидроксида сахарозного комплекса (Венофер) [49–51].
После родоразрешения ВОЗ рекомендует прием препаратов железа и фолиевой кислоты в послеродовом периоде в течение 8–12 нед. [52].
Консенсус Network for the Advancement of Patient Blood Management, Haemostasis and Thrombosis (NATA) рекомендует пероральные препараты железа (элементное железо 80–100 мг ежедневно в течение 3 мес.) в сочетании с фолиевой кислотой в течение 6–12 нед. после родоразрешения для снижения риска развития анемии, а также для женщин с умеренной послеродовой анемией и стабильным состоянием (уровень гемоглобина 90–110 г/л). Женщинам, которые не отвечают на применение пероральных препаратов железа (увеличение уровня гемоглобина менее чем на 10 или 20 г/л через 2 или 4 нед. соответственно), при непереносимости пероральных препаратов железа, при доказанном железодефицитном состоянии и у женщин с умеренной и/или тяжелой анемией (уровень гемоглобина менее 90 г/л) рекомендуется перейти на внутривенные препараты железа. Также рекомендуется применение внутривенного железа для устранения дефицита железа у женщин с умеренным или массивным послеродовым кровотечением (уровень гемолобина менее 90 г/л) [22, 53].
Требуется осторожность в оценке ЖДС и назначении препаратов железа у женщин с преэклампсией, у которых повышены уровень сывороточного железа, ферритина, гепсидина и сатурация трансферрина [54]. Рутинное назначение препаратов железа пациенткам с преэклампсией может стимулировать перегрузку железом, вызвать окислительный стресс, эндотелиальную дисфункцию и ухудшить состояние матери и плода [55, 56].
Безусловно, когда позволяет время, беременные женщины принимают пероральные препараты железа при ЖДА легкой степени с регулярным контролем гемоглобина и ферритина. Пациентки в сроке беременности более 34 нед. с признаками ЖДА умеренной или тяжелой степени должны быть госпитализированы для решения вопроса о способе коррекции анемии. При ЖДА умеренной степени (гемоглобин 70–99 г/л) показаны препараты внутривенного железа, а при анемии тяжелой степени (гемоглобин менее 70 г/л) без кровотечения при решении вопроса о трансфузии аллогенных эритроцитов необходимо ориентироваться на Приказ Министерства здравоохранения РФ от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов» и оформлять показания коллегиально. Без кровотечения рекомендуется клиническая переоценка и/или измерение уровня гемоглобина после каждой дозы аллогенных эритроцитов и определение потребности в дальнейшей трансфузии [22].
Во время операции объем кровопотери и потребность в аллогенных эритроцитах в первую очередь будет определяться эффективностью хирургического и консервативного гемостаза, а трансфузионная тактика регламентируется Приказом Министерства здравоохранения РФ от 2 апреля 2013 г. № 183н «Об утверждении правил клинического использования донорской крови и (или) ее компонентов» и должна ориентироваться на целевое значение уровня гемоглобина более 70 г/л.
Для уменьшения интраоперационного объема трансфузии аллогенных эритроцитов активно используется важнейший компонент «менеджмента крови пациента» в акушерстве — аппаратная реинфузия крови, которая позволяет контролировать объем кровопотери, адекватно восполнять уровень эритроцитов и гемоглобина и, что особенно важно при массивной кровопотере, значительно сократить вероятность трансфузионных осложнений [57, 58].
Предоперационная острая нормоволемическая гемодилюция рекомендуется для применения у беременных женщин высокого риска по развитию массивной кровопотери (аномалии плацентации) только на уровне мнения экспертов [59], поскольку адекватных исследований по эффективности этой методики в акушерстве нами не обнаружено.
В послеродовом (послеоперационном) периоде, особенно у пациенток с массивной кровопотерей, помимо контроля уровня гемоглобина показано определение уровня ферритина и сатурации трансферрина для верификации ЖДС. При анемии легкой и умеренной степени в первые сутки после родоразрешения показано применение препаратов внутривенного железа. Трансфузия аллогенных эритроцитов после родоразрешения у пациенток с анемией тяжелой степени (гемоглобин менее 70 г/л) — наиболее частое показание для трансфузии аллогенных компонентов крови, поскольку при остановленном кровотечении показания для трансфузии свежезамороженной плазмы, тромбоцитов и криопреципитата крайне ограниченны [53, 60, 61].
Трансфузия аллогенных эритроцитов у пациенток без кровотечения с уровнем гемоглобина менее 70 г/л в послеродовом периоде проводится с учетом клинических признаков анемии и факторов риска (риск кровотечения, сердечной недостаточности и т. д.), а решение следует принимать коллегиально. У пациенток без кровотечения в послеродовом периоде необходима клиническая переоценка и/или измерение уровня гемоглобина после каждой дозы эритроцитов для определения потребности в дальнейшей трансфузии [22, 53, 60].
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Куликов А.В., Шифман Е.М., Матковский А.А., Каюмова А.В., Роненсон А.М. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи.