На протяжении нескольких десятилетий инотропные и вазоактивные средства продолжают оставаться наиболее часто используемыми в кардиоанестезиологии группами фармакологических препаратов. Причина этого кроется в сохраняющейся актуальности интраоперационного повреждения миокарда и индукции системного воспалительного ответа при кардиохирургических вмешательствах. В большинстве исследований по профилю кардиоанестезиологии дозы использованных инотропов вазопрессоров учитываются как показатели выраженности развившейся систолической дисфункции миокарда или снижения тонуса сосудов. Однако подобный подход закономерно затрудняется комплексным характером инотропной вазоактивной терапии и изменением доз на этапах лечения пациентов. Усилия по повышению диагностической информативности дозировок инотропных вазоактивных препаратов вылились в создание фармакологических индексов.
Впервые попытку количественно оценить степень фармакологической сердечно-сосудистой поддержки предприняли Wernovsky G. et al., полученные данные были опубликованы в 1995 г. [1]. При оценке гемодинамического профиля у детей авторы предложили использовать инотропный индекс (ИИ). Общая доза инотропной поддержки вычислялась путем суммирования доз (мкг/кг/ мин) допамина и добутамина, а доза 0,1 мкг/кг/мин эпинефрина принималась за значение «10». В дальнейших исследованиях ИИ пытались соотнести со степенью тяжести основного заболевания, хотя изначально он не был создан для этого [2–5]. С течением времени этот показатель был модифицирован в так называемый вазоактивный инотропный индекс (ВИИ). В отличие от инотропного индекса ВИИ учитывает не только дозы препаратов, повышающих сократительную способность миокарда (допамина, добутамина и эпинефрина), но и дозы вазопрессоров, при этом за 1 у. е. принимается 0,01 мкг/кг/мин эпинефрина и 0,1 мкг/кг/мин фенилэфрина. Достаточно быстро именно ВИИ стали использовать в качестве про- гностического критерия клинических исходов в детской кардиохирургии [6, 7]. Впервые это было продемонстрировано в исследовании Gaies M.G. et al. в 2010 г. [6]. В него было включено 174 пациента в возрасте от 0 до 6 мес. после кардиохирургических вмешательств с использованием искусственного кровообращения (ИК). В этом исследовании было выявлено, что наибольший ВИИ в течение 48 ч после операции являлся предиктором неблагоприятных клинических исходов, таких как смерть, остановка кровообращения, неврологические нарушения, необходимость в применении механической поддержки кровообращения или заместительной почечной терапии. Высокий ВИИ был также сопряжен с длительным нахождением пациентов в отделениях интенсивной терапии (ОИТ) и продленной искусственной вентиляцией легких (ИВЛ). В другом исследовании, включавшем 70 младенцев (возраст ≤ 90 дней), перенесших кардиоторакальные вмешательства, Davidson J. et al. продемонстрировали, что высокий ВИИ через 48 ч после операции коррелировал не только с более продолжительной ИВЛ и временем пребывания в ОИТ, но и с общим временем пребывания в стационаре [7]. Butts R.J. et al. изучали синдром малого сердечного выброса и максимальный ВИИ у 76 новорожденных, перенесших операцию на сердце с использованием ИК [8]. Авторы сообщили о невысокой корреляции показателя ВИИ с продолжительностью ИВЛ, а также временем пребывания в ОИТ. К тому же этот показатель не коррелировал с общей продолжительностью пребывания пациентов в стационаре. Все указанные выше исследования были проведены у новорожденных и детей, чей возраст не превышал 6 месяцев. В 2013 г. было выполнено ретроспективное одноцентровое когортное исследование, которое включало всех пациентов младше 18 лет (средний возраст 1,4 года), подвергшихся ортотопической трансплантации сердца с 2004 по 2010 г. [9]. Это было первое исследование, призванное оценить важность ВИИ в качестве прогностического критерия у пациентов после трансплантации сердца. Авторы показали, что высокий уровень ВИИ был довольно распространен в первые 24 ч после ортотопической трансплантации, особенно у пациентов с длительным периодом ИК, но этот индекс не был связан с неблагоприятными исходами в раннем послеоперационном периоде. По мнению исследователей, высокие дозы вазоактивных препаратов в первые 24 ч после операции обусловлены транзиторными изменениями гемодинамики, связанными с длительностью и особенностями ИК. Напротив, высокий ВИИ, сохраняющийся в течение 48 ч, свидетельствует о серьезных неблагоприятных патофизиологических изменениях.
Необходимо отметить, что у взрослых пациентов кардиохирургического профиля ИИ и ВИИ стали использоваться для оценки течения послеоперационного периода относительно недавно, и число подобных исследований невелико [10, 11]. Неоднозначные результаты применения фармакологических индексов в детской кардиохирургии и крайне малое число подобных работ, выполненных у взрослых пациентов, стимулировали проведение представленного ниже исследования. Мы попытались оценить ВИИ и ИИ в качестве предикторов неблагоприятного течения раннего послеоперационного периода и показателей гемодинамического профиля у взрослых кардиохирургических пациентов.
Цель исследования: изучить возможность использования ИИ и ВИИ в качестве предикторов неблагоприятного течения послеоперационного периода кардиохирургических вмешательств и показателей гемодинамического профиля пациентов.
Выдвинутая нами гипотеза предполагает низкую диагностическую ценность ВИИ ≥ 10 как предиктора неблагоприятного течения раннего послеоперационного периода и критерия острой сердечной недостаточности (ОСН) ввиду выраженного влияния вазоплегии на этот показатель.
Проведено проспективное одноцентровое обсервационное исследование течения раннего послеоперационного периода кардиохирургических вмешательств, выполненных на базе ФГБУ «НМИЦ им. В.А. Алма- зова» в период с декабря 2017 г. по февраль 2018 г. Поскольку исследование имело исключительно описательный характер, для его проведения не требовалось разрешения локального этического комитета. Критерии включения: операции на сердце в условиях ИК, возраст старше 18 лет. Критерий невключения: трансплантация сердца. В исследование включили 144 пациента, из них 99 мужчин и 45 женщин, средний возраст составил 63,6 ± 10,4 года. Пациенты перенесли 75 изолированных аортокоронарных шунтирований (АКШ), 25 АКШ в сочетании с протезированием/пластикой клапанов, 9 операций на восходящей аорте, 32 вмешательства на клапанном аппарате, 1 миоэктомию выходного отдела левого желудочка, 1 тромбэктомию легочной артерии, 1 перевязку коронарно-предсердной фистулы.
Анестезиологическое обеспечение оперативных вмешательств, ИК и интраоперационная защита миокарда проводились в соответствии с внутренними протоколами НМИЦ им. В.А. Алмазова. Использовали общую комбинированную анестезию на основе севофлурана или десфлурана. ИК проводили в режиме умеренной гипотермии с применением нормотермической кровяной кардиоплегии.
Инвазивный мониторинг показателей центральной гемодинамики у всех пациентов осуществляли с помощью катетера Свана—Ганца методом препульмональной термодилюции. Всем пациентам после индукции анестезии и в конце операции, а также в течение первых послеоперационных суток каждые 6 ч производили измерение сердечного выброса с последующим расчетом параметров центральной гемодинамики. Показатели ВИИ и ИИ фиксировали каждые 6 ч после окончания операции. ВИИ и ИИ рассчитывали в условных единицах (у. е.). Одна у. е. была равна 1 мкг/кг/мин для допамина или добутамина и 0,01 мкг/кг/мин — для эпинефрина или норэпинефрина, показатели всех использованных препаратов суммировались.
В качестве осложнений раннего послеоперационного периода учитывали нарушения ритма сердца, остановку кровообращения, синдром малого сердечного выброса, рестернотомию, неврологические нарушения (острые нарушения мозгового кровообращения, судороги, делирий), дыхательную недостаточность, острую почечную недостаточность, инфекционные осложнения и летальный исход. Также оценивали продолжительность респираторной поддержки, продолжительность пребывания в отделении реанимации и интенсивной терапии (ОРИТ) и общее время лечения в стационаре. За критерий продленной респираторной поддержки была принята ее продолжительность более 24 ч, а прод- ленного пребывания в ОРИТ — более 48 ч.
Статистический анализ проведен с помощью пакета Statistica 7.0 (Statsoft Inc., США). Нормальный характер распределения полученных данных проверяли с помощью теста Шапиро—Уилка. Для сравнения показателей с нормальным характером распределения использовали t-тест, а при распределении, отличном от нормального, — метод Манна—Уитни. Сравнение качественных показателей проводили с помощью точного критерия Фишера. Критическим уровнем значимости считали р = 0,05. При нормальном распределении данные представлены в виде: среднее ± стандартное отклонение (М ± SD), в случае ненормального распределения данные представлены как медиана (25-й, 75-й процентили).
Данные о показателях ВИИ и ИИ на этапах исследования представлены в табл. 1.
| Таблица 1. Показатели инотропной и вазоактивной терапии у включенных в исследование пациентов (n = 144) | ||||||
| Показатель | До ИК | Конец операции | 6 ч в ОРИТ | 12 ч в ОРИТ | 18 ч в ОРИТ | 24 ч в ОРИТ |
|---|---|---|---|---|---|---|
| Число пациентов c ВИИ > 0 | 48 (33,3 %) | 106 (73,6 %) | 89 (61,8 %) | 75 (52,1 %) | 58 (40,3 %) | 33 (22,9 %) |
| Медиана значения ВИИ | 7 (5–11) | 12,5 (7–20) | 10 (5– 20) | 15 (4–36) | 30 (9–60) | 55 (19–235) |
| Число пациентов с ВИИ ≥ 10 | 23 (16 %) | 73 (50,7 %) | 53 (36,8 %) | 46 (31,9 %) | 41 (28,5 %) | 46 (31,9 %) |
| Число пациентов c ИИ > 0 | 24 (16,7 %) | 53 (36,8 %) | 52 (36,1 %) | 47 (32,6 %) | 29 (20,1 %) | 25 (17,4 %) |
| Медиана значения ИИ | 5 (3–5) | 5 (3–5) | 3 (2–5) | 3 (2–5) | 4 (2–5) | 4 (2–8) |
| Число пациентов с ИИ ≥ 10 | 1 (0,7 %) | 7 (4,9 %) | 7 (4,9 %) | 3 (2,1 %) | 3 (2,1 %) | 6 (4,2 %) |
ВИИ — вазоактивный инотропный индекс; ИИ — инотропный индекс.
Данные табл. 1 указывают на то, что наибольшая частота применения инотропных и вазоактивных препаратов была отмечена в конце оперативных вмешательств и через 6 ч после поступления в ОРИТ, фармакологический профиль в этих двух временных точках отличался незначительно. Однако с практической точки зрения представляется, что тактика инотропной и/или вазопрессорной терапии была более обоснованной через 6 ч после поступления в ОРИТ, поскольку у врачей имелось достаточно времени для формирования суждения о гемодинамическом профиле пациентов. Как следует из представленных выше данных источников литературы, большинство авторов рассматривали в качестве предикторов неблагоприятного клинического течения значения ВИИ и ИИ ≥ 10. Поэтому при дальнейшем анализе мы исследовали показатели ВИИ и ИИ ≥ 10, отмеченные через 6 ч после поступления в ОРИТ.
Клиническое течение раннего послеоперационного периода у пациентов со значениями вазоактивного инотропного индекса ≥ 10
Основные показатели клинического течения раннего послеоперационного периода во всей исследованной выборке представлены в табл. 2.
| Таблица 2. Показатели клинического течения послеоперационного периода в исследованной выборке пациентов (n = 144) | |
| Показатель | Значение |
|---|---|
| Продолжительность респираторной поддержки, ч | 10 (5,5–17) |
| Число пациентов, требовавших респираторной поддержки более 24 ч, n (%) | 11 (7,6 %) |
| Продолжительность пребывания в ОРИТ, ч | 22 (19–44) |
| Число пациентов, находившихся в ОРИТ более 48 ч, n (%) | 28 (19,4 %) |
| Число пациентов без осложнений, n (%) | 85 (59 %) |
| Среднее число осложнений у пациентов с их наличием | 1,7 ± 0,8 |
| Продолжительность пребывания в стационаре, сут | 20 (16–25) |
| Летальность, n (%) | 2 (1,4 %) |
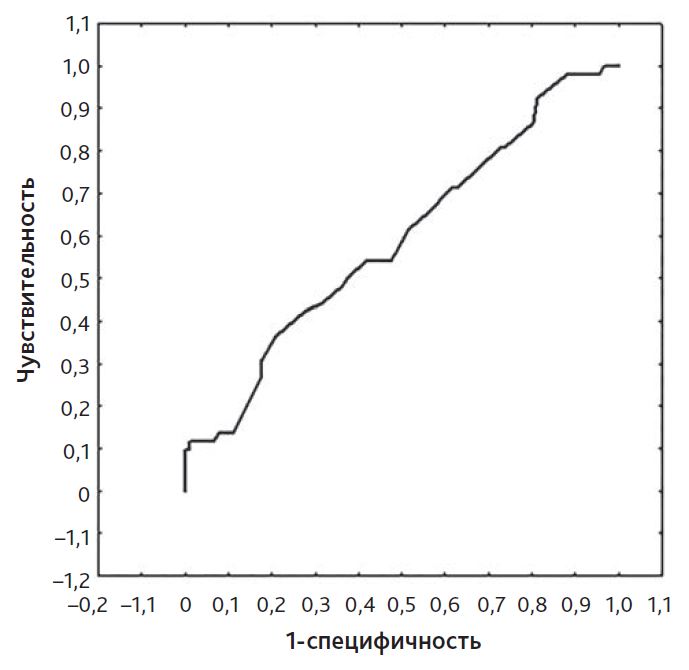
Исследование показателя ВИИ ≥ 10 (сумма доз инотропных и вазоактивных препаратов) показало недостаточно высокую прогностическую значимость в отношении неблагоприятного клинического течения послеоперационного периода. Так, при ROC-анализе площадь под кривой предсказания длительности респираторной поддержки оказалась равной только 0,59, такое же значение было вычислено и для предсказания длительности пребывания в ОРИТ (рис. 1 и 2).

Рис. 1. ROC-анализ модели прогноза продолжительности респираторной поддержки при вазоактивном инотропном индексе ≥ 10. Площадь под кривой равна 0,59
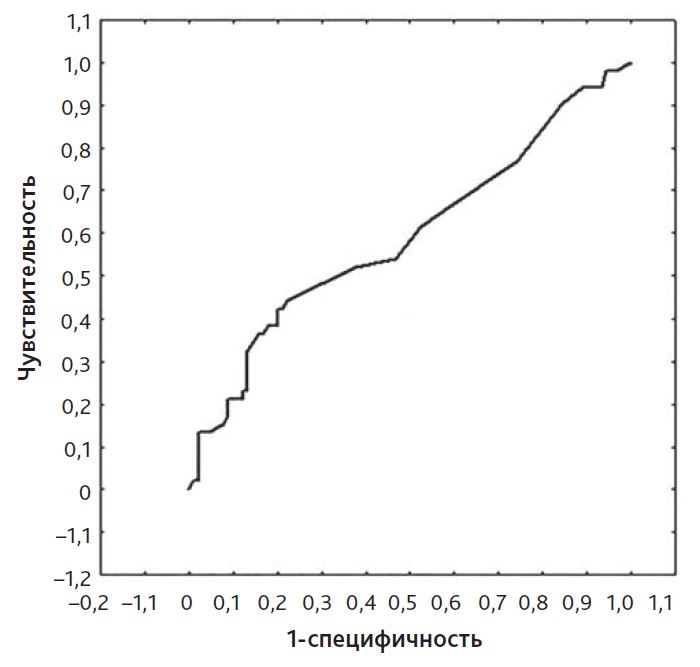
Рис. 2. ROC-анализ модели прогноза продолжительности лечения в отделении реанимации и интенсивной терапии при вазоактивном инотропном индексе ≥ 10. Площадь под кривой равна 0,59
Сравнение показателей клинического течения в группах ВИИ < 10 и ВИИ ≥ 10 выявило тенденцию к большим срокам проведения респираторной поддержки и пребывания в ОРИТ у пациентов с более высоким ВИИ, однако статистически значимое различие было подтверждено только для бóльшей частоты длительного пребывания в ОРИТ (табл. 3).
| Таблица 3. Сравнение показателей клинического течения послеоперационного периода в группах пациентов с вазоактивным инотропным индексом < 10 и ≥ 10 (n = 144) | |||
| Показатель | ВИИ < 10 (n = 91) | ВИИ ≥ 10 (n = 53) | p |
|---|---|---|---|
| Продолжительность респираторной поддержки, ч | 9 (5–16) | 12 (6–18) | 0,07 |
| Число пациентов, требовавших респираторной поддержки более 24 ч, n (%) | 5 (5,5 %) | 6 (11,3 %) | 0,17 |
| Продолжительность пребывания в ОРИТ, ч | 22 (19–24) | 24 (20–58) | 0,06 |
| Число пациентов, находившихся в ОРИТ более 48 ч, n (%) | 12 (13,2 %) | 16 (30,2 %) | 0,01 |
| Число пациентов без осложнений, n (%) | 56 (61,5 %) | 28 (52,8 %) | 0,19 |
| Продолжительность пребывания в стационаре, сут | 20 (17–28) | 20 (16–25) | 0,75 |
| Летальность, n (%) | 0 | 2 (3,8 %) | 0,13 |
ВИИ — вазоактивный инотропный индекс.
Клиническое течение раннего послеоперационного периода у пациентов со значениями инотропного индекса ≥ 10
ИИ (сумма доз допамина, добутамина и эпинефрина) показал высокие прогностические качества в отношении неблагоприятного клинического течения послеоперационного периода. ROC-анализ (рис. 3 и 4) свидетельствовал о хороших прогностических моделях как для длительности респираторной поддержки (площадь под кривой — 0,86), так и для продолжительности лечения в ОРИТ (площадь под кривой — 0,91).
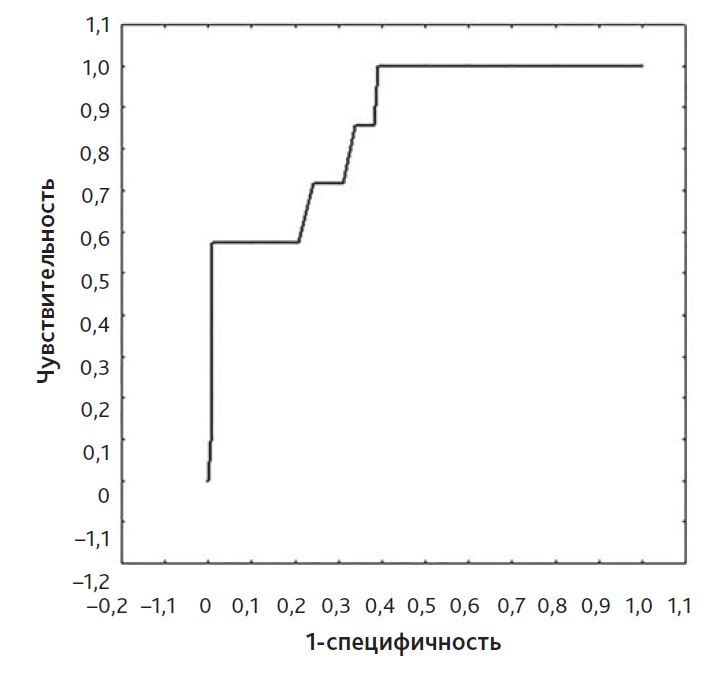
Рис. 3. ROC-анализ модели прогноза продолжительности респираторной поддержки при инотропном индексе ≥ 10. Площадь под кривой равна 0,86

Рис. 4. ROC-анализ модели прогноза продолжительности лечения в отделении реанимации и интенсивной терапии при инотропном индексе ≥ 10. Площадь под кривой равна 0,91
Анализ данных о клиническом течении послеоперационного периода выявил худшие показатели при ИИ ≥ 10, причем различия почти по всем критериям были статистически значимыми (табл. 4). Необходимо отметить обнаруженную тенденцию к большей продолжительности лечения в стационаре, однако это различие не получило статистического подтверждения.
| Таблица 4. Сравнение показателей клинического течения послеоперационного периода в группах пациентов с инотропным индексом < 10 и ≥ 10 (n = 144) | |||
Показатель |
ИИ < 10 (n = 137) |
ИИ ≥ 10 (n = 7) |
p |
|---|---|---|---|
Продолжительность респираторной поддержки, ч |
9 (5–16) |
83 (15–120) |
0,002 |
Число пациентов, требовавших респираторной поддержки более 24 ч, n (%) |
7 (5,1 %) |
4 (57,1 %) |
< 0,001 |
Продолжительность пребывания в ОРИТ, ч |
22 (19–26) |
85 (60–143) |
< 0,001 |
Число пациентов, находившихся в ОРИТ более 48 ч, n (%) |
22 (16,1 %) |
6 (85,7 %) |
< 0,001 |
Число пациентов без осложнений, n (%) |
83 (60,6 %) |
1 (14,3 %) |
0,02 |
Продолжительность пребывания в стационаре, сут |
20 (16–25) |
27 (20–29) |
0,37 |
Летальность, n (%) |
0 |
2 (28,6 %) |
0,02 |
ИИ — инотропный индекс.
Гемодинамический профиль пациентов со значениями вазоактивного инотропного индекса ≥ 10
При анализе гемодинамических параметров в группах ВИИ ≥ 10 и ВИИ < 10 (табл. 5) не было обнаружено значимых различий в производительности сердца. Это позволило предположить, что основной причиной на- значения адреномиметиков была вазоплегия. Косвенно об этом свидетельствовал тот факт, что у 23 из 53 пациентов с ВИИ ≥ 10 инотропные препараты не использовались. Таким образом, в 43,4 % случаев ВИИ ≥ 10 был представлен только вазоактивными препаратами. На фоне проводимой терапии в группе ВИИ ≥ 10 удавалось поддерживать адекватную перфузию тканей, о чем говорили нормальные показатели насыщения кислородом гемоглобина смешанной венозной крови и отсутствие нарастания концентрации лактата.
| Таблица 5. Гемодинамические показатели у пациентов с вазоактивным инотропным индексом < 10 и ≥ 10 (n = 144) | |||
| Показатель | ВИИ < 10 (n = 91) | ВИИ ≥ 10 (n = 53) | p |
|---|---|---|---|
| ИУО, мл/м2 | 35 (30–40) | 34,5 (29,6–43) | 0,64 |
| ОПСС, дин × c × см−5 | 1118 (971–1348) | 1085 (952–1304) | 0,66 |
| SvO2, % | 71,4 (65–76,4) | 73,2 (69–78,8) | 0,04 |
| Лактат, ммоль/л | 2,5 (1,8–3,3) | 2,2 (1,7–3,9) | 0,88 |
SvO2 — насыщение кислородом гемоглобина смешанной венозной крови; ВИИ — вазоактивный инотропный индекс; ИУО — индекс ударного объема; ОПСС — общее периферическое сопротивление сосудов
Гемодинамический профиль пациентов со значениями инотропного индекса ≥ 10
У пациентов с ИИ ≥ 10 отмечена тенденция к сниженной производительности сердца, однако, в силу небольшого объема группы, различие не получило статистического подтверждения (табл. 6). Мы полагаем, что назначение высоких доз инотропных препаратов в группе ИИ ≥ 10 было связано с формированием синдрома малого сердечного выброса. Выраженные нарушения гемодинамики в этих случаях сопровождались значимым снижением перфузии тканей. Об этом свидетельствовала сохранявшаяся к 6-му часу пребывания в ОРИТ гиперлактатемия.
| Таблица 6. Гемодинамические показатели у пациентов с инотропным индексом < 10 и ≥ 10 (n = 144) | |||
| Показатель | ИИ < 10 (n = 137) | ИИ ≥ 10 (n = 7) | p |
|---|---|---|---|
| ИУО, мл/м2 | 35 (30–41) | 31 (17–47) | 0,36 |
| ОПСС, дин × с × см−5 | 1119 (971–1348) | 1068 (965–1177) | 0,28 |
| SvO2, % | 72 (66–77) | 75 (68–83) | 0,25 |
| Лактат, ммоль/л | 2,2 (1,7–3,3) | 7,6 (6–10) | < 0,001 |
SvO2 — насыщение кислородом гемоглобина смешанной венозной крови; ИИ — инотропный индекс; ИУО — индекс ударного объема; ОПСС — общее периферическое сопротивление сосудов
Выполненное исследование подтвердило гипотезу о низкой диагностической ценности ВИИ ≥ 10 как предиктора неблагоприятного течения раннего послеоперационного периода, кроме того, эта величина ВИИ не оправдала себя в качестве критерия развития ОСН после вмешательств на сердце. Действительно, показатели производительности сердца в таких наблюдениях были близки к нормальным значениям (см. табл. 5). Более того, в 43,4 % случаев ВИИ ≥ 10 был обусловлен назначением исключительно вазоактивных препаратов (норэпинефрина или фенилэфрина) без использования инотропов. Это позволяет нам полагать, что высокие значения ВИИ после операций на сердце с бóльшей вероятностью отражают вазоплегию, связанную с системным воспалительным ответом, нежели послеоперационное снижение производительности сердца.
В 2017 г. исследовательской группой CHEETAH были опубликованы результаты крупного (включено 506 пациентов) многоцентрового двойного слепого рандомизированного исследования по оценке эффективности препарата левосимендан в качестве гемодинамической поддержки после кардиохирургических операций [11]. Критерием включения в исследование было наличие одного из признаков: исходной низкой фракции выброса левого желудочка (< 25 %), потребность во внутриаортальной баллонной контрпульсации до операции или после нее, а также назначение в первые 24 ч после операции высоких доз инотропной/вазопрессорной поддержки, соответствующей ВИИ ≥ 10. Показатели центральной гемодинамики не были доступны для всех пациентов, включенных в это исследование. Решение о назначении инотропов или вазопрессоров принималось врачами на основе анализа клинических показателей. Первичным конечным параметром определили 30-дневную летальность. Исследование не выявило какого-либо влияния левосимендана как на послеоперационную летальность, так и на другие клинические показатели. Одной из причин отрицательных результатов исследования CHEETAH могла быть ошибка в выборе в качестве критерия включения ВИИ ≥ 10. Необходимо отметить, что в соответствии с этим критерием в исследование была включена большая часть пациентов — 390 из 506 (77,1 %). Поскольку ВИИ ≥ 10 недостаточно специфичен в отношении ОСН и может быть обусловлен вазоплегией, это, вероятно, привело к занижению степени выраженности сердечной недостаточности и значительной распространенности вазоплегии у включенных в исследование пациентов. Эксперты в области кардиоанестезиологии полагают, что в выборке с подобным гемодинамическим профилем доказать эффективность левосимендана как средства лечения послеоперационной ОСН было невозможно [12]. Если применить критерии включения в исследование CHEETAH к нашей выборке пациентов, окажется, что показания для назначения левосимендана имелись у 36,8 % больных (ВИИ ≥ 10 на 6 ч нахождения в ОРИТ). Данные, представленные в табл. 3 и табл. 5, позволяют предполагать, что при использовании левосимендана в подгруппе пациентов с ВИИ ≥ 10 этот препарат не смог бы показать свою эффективность, поскольку клинические показатели течения послеоперационного периода значимо не отличались от общей выборки, и в 40,3 % случаев гемодинамические нарушения были связаны с вазоплегией, но не с сердечной недостаточностью (пациенты получали исключительно вазопрессоры).
Выполненное нами исследование продемонстрировало недостаточную диагностическую ценность ВИИ ≥ 10 в отношении неблагоприятного течения послеоперационного периода и подтверждения наличия ОСН. Вероятно, этот показатель не должен использоваться в исследованиях, посвященных послеоперационной сердечной недостаточности. Напротив, ИИ ≥ 10 показал свою высокую чувствительность и специфичность в отношении неблагоприятного течения послеоперационного периода и возможность характеризовать гемодинамический профиль пациентов с ОСН.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Баутин А.Е. — определение цели исследования, разработка дизайна, обработка полученных данных, подготовка статьи к печати; Ксендикова А.В. — сбор первичного материала, обработка результатов, подготовка раздела «Введение»; Белолипецкий С.С., Карпова Л.И. — сбор первичного материала, обработка результатов, подготовка раздела «Материалы и методы»; Абуталимова Н.Р., Маричев А.О., Этин В.Л., Гребенник В.К. — сбор первичного материала, обработка результатов, клиническое сопровождение пациентов, вошедших в исследование; Наймушин А.В. — сбор первичного материала, обработка результатов, клиническое сопровождение пациентов, вошедших в исследование, редактирование статьи; Радовский А.М. — сбор первичного материала; Гордеев М.Л. — определение цели исследования, научное редактирование статьи.