Рефидинг-синдром (РФС) — это комплекс жизнеугрожающих метаболических нарушений, возникающих при возобновлении питания у пациентов с исходной нутритивной недостаточностью [1]. Клиническим проявлением синдрома является органная дисфункция:
Провоцирующим фактором может быть любое питание: пероральное, энтеральное и парентеральное.
Впервые проявления РФС были описаны у освобожденных узников концентрационных лагерей времен Второй мировой войны, а также у голодающих жертв вооруженных конфликтов, когда возобновление питания приводило к полиорганной недостаточности [2]. В 1980-х гг. на РФС вновь было обращено внимание в связи с развитием полиорганной недостаточности у недокормленных пациентов, которым проводили полное парентеральное питание [3].
Гипофосфатемия сопровождает РФС в 96 % случаев, однако существует множество других причин гипофосфатемии, что затрудняет дифференциальную диагностику [4].
РФС исторически считали проблемой пациентов с нервной анорексией и длительным голоданием, пока не обратили внимание на то, что у некоторых групп пациентов частота гипофосфатемии после возобновления питания составляет 20 %, а у пациентов отделения реанимации и интенсивной терапии (ОРИТ) может достигать 59 % [5]. В последние годы началось изучение эпидемиологии РФС у пациентов ОРИТ, а также наметилась стратегия для оптимизации диагностики и лечения синдрома возобновления питания у пациентов в критических состояниях [6, 7].
Исследование эпидемиологии РФС у пациентов в критических состояниях осложняет отсутствие единых общепризнанных критериев и высокоспецифичных маркеров этого состояния [8].
Общепринятым маркером РФС является гипофосфатемия, встречающаяся у 1–3 % госпитализированных пациентов, а у некоторых категорий пациентов превышающая 20 % [9]. У пациентов ОРИТ частота гипофосфатемии, по разным данным, составляет 34–59 % [5,7]. Такая разница в показателях связана с тем, что практически в каждой работе принимали разный диагностический порог гипофосфатемии от < 0,32 до < 1 ммоль/л [5, 6, 10].
Во многих работах единственным критерием диагноза РФС является возникновение или усугубление гипофосфатемии у пациентов после возобновления питания [6, 7, 11–13]. Rio А. et al. были предложены трехкомпонентные критерии РФС, которые состоят из электролитных нарушений (гипофосфатемия, гипокалиемия, гипомагниемия), острой задержки жидкости и отеков, а также органной дисфункции [10]. Хотя эти проявления являются патогномоничными для РФС, это состояние часто протекает субклинически или маскируется под уже имеющейся органной дисфункцией, что приводит к гиподиагностике РФС [8].
В появившихся недавно крупных исследованиях были использованы одинаковые критерии, предложенные Doig G. et al.: снижение фосфатов плазмы до уровня менее 0,65 ммоль/л в течение 72 ч после возобновления питания, при этом снижение должно быть более чем на 0,16 ммоль/л [6, 7]. Учитывая то, что именно в этих работах доказана эффективность лечебных мероприятий при РФС, вероятно, целесообразно использовать данные критерии при диагностике РФС у пациентов ОРИТ.
Для определения группы пациентов с риском по развитию РФС используют критерии дефицита питания по NICE (National Institute for Health and Clinical Excel- lence) [14]. Согласно этой шкале, высокий риск развития РФС существует при наличии одного из следующих факторов («большие» критерии):
Также по шкале NICE высокий риск развития РФС существует при наличии двух из следующих факторов («малые» критерии):
Помимо этого, рутинно применяют шкалы MUST и NRS 2002, которые очень похожи на шкалу NICE [15, 16]. Данные критерии используют для определения риска РФС у пациентов с нервной анорексией, однако в исследованиях, проведенных у пациентов в критических состояниях, они не показали своей эффективности [17]. Это может быть объяснено тем, что у пациентов в критических состояниях риск РФС обусловлен не длительным голоданием, а стресс-индуцированным катаболизмом. Так, в единственном рандомизированном клиническом исследовании, проведенном Doig G. et al., средний индекс массы тела (ИМТ) составлял 28 кг/м2 [6], тогда как при нервной анорексии низкий ИМТ практически во всех работах свидетельствует о риске гипофосфатемии [12, 18–20].
Хотя проведенные среди пациентов ОРИТ исследования не выявили предикторов развития РФС, а так- же не показали эффективности шкал, применяющихся у пациентов с нервной анорексией, пациента с клиническими признаками нутритивной недостаточности и истощения, низким индексом массы тела, вероятно, следует отнести к категории высокого риска [14].
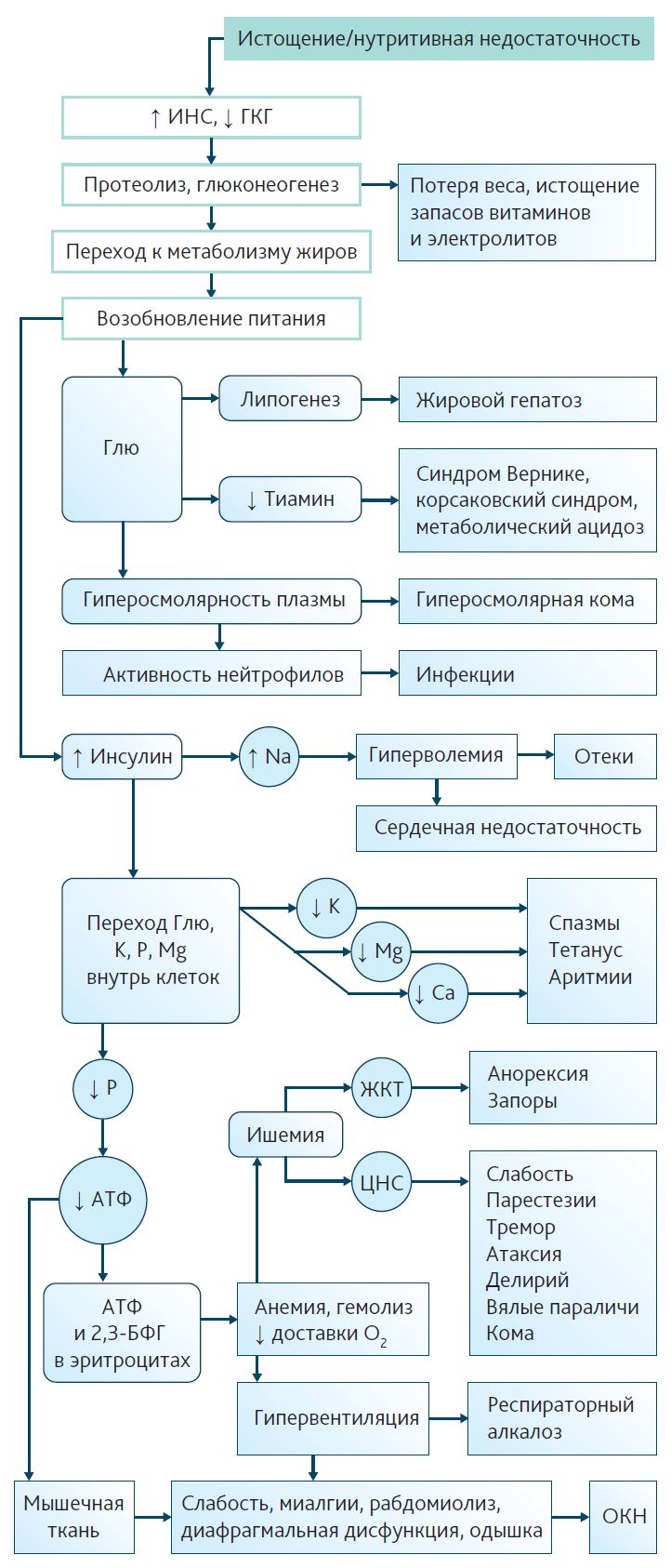
Патогенез РФС может быть представлен следующим образом (рис. 1).

Рис. 1. Патогенез рефидинг-синдрома 2,3-БФГ — 2,3-бифосфоглицерат; Ca — кальций; K — калий; Mg — магний; P — фосфор; АТФ — аденозинтрифосфат; ГКГ — глюкагон; Глю — глюкоза; Инс — инсулин; ОКН — острый канальцевый некроз
При длительном голодании повышается секреция контринсулярных гормонов, снижается секреция инсулина, происходит переход анаболического состояния к катаболическому [21]. Основным источником энергии становятся кетоновые тела и аминокислоты, получаемые в процессе катаболизма мышечной и жировой ткани [22]. Питание глюкозозависимых тканей поддерживается за счет глюконеогенеза в печени, в дальнейшем уровень базального метаболизма значительно снижается, замедляется глюконеогенез [23]. Это необходимо для экономии белка и поддержания тощей массы тела, т. к. аминокислоты используются для «наполнения» цикла трикарбоновых кислот [24]. В процессе голодания снижается внутриклеточный объем, происходит потеря основных внутриклеточных ионов (фосфора, калия, магния), истощаются запасы витаминов, в том числе тиамина [25]. При возобновлении питания происходит повышение плазменной концентрации глюкозы, стимулируется секреция инсулина, происходит переключение на гликолиз [26]. При повышении концентрации инсулина происходит транспорт ионов внутрь клеток, вследствие чего возникают гипофосфатемия, гипомагниемия, гипокалиемия, а также снижается экскреция натрия, увеличивается задержка жидкости, возникают отеки [27].
При возникновении РФС характерно появление инсулинорезистентности: гипергликемия, метаболизм кетоновых тел, снижение дыхательного коэффициента (RQ) [26, 28]. Персистирующая гипергликемия значимо увеличивает летальность, что обусловливает важность ее контроля и коррекции [29, 30].
Неорганические фосфаты PO4 3- являются одними из основных внутриклеточных электролитов; они необходимы для синтеза высокоэнергетических фосфатов (АТФ), 2,3-бифосфоглицерата, регулирующего сродство гемоглобина к кислороду, нуклеотидов, входящих в состав ДНК и РНК. Кроме того, неорганический фосфат — субстрат ферментов фосфокиназ и фосфатаз, играющих ключевую роль в клеточных сигнальных системах, а также компонент буферной системы регуляции кислотно-щелочного равновесия [31]. Гипофосфатемия может вызывать острую дыхательную, сердечную, почечную недостаточность, задержку отлучения от респиратора, мышечную слабость, рабдомиолиз, гемолиз, нарушение хемотаксиса лейкоцитов, отек головного мозга [1].
Гипокалиемия приводит к нарушению возбудимости кардиомиоцитов, ухудшению проведения нервных импульсов, возникновению жизнеугрожающих аритмий и является независимым предиктором внутрибольничной летальности [32].
Магний является кофактором более 300 ферментов, в том числе обеспечивает биологическую активность АТФ. У пациентов ОРИТ дефицит магния встречается в 18–65 % случаев при поступлении и связан с ростом летальности, увеличением длительности ИВЛ, увеличением времени нахождения в ОРИТ [33].
Тиамин является кофактором в реакциях пентозофосфатного пути, а также превращения пирувата в ацетил-КоА [34]. При этом тиамин не синтезируется в организме человека, а его запасы ограничены коротким периодом полураспада, что делает его зависимым от поступления с пищей. У пациентов с исходной нутритивной недостаточностью внутриклеточные запасы тиамина зачастую истощены. Проведенное обсервационное исследование выявило дефицит тиамина у 39,7 % пациентов ОРИТ [35]. Несмотря на то что тиамин является кофактором, в ходе превращения пирувата в лактат происходит его гидролиз, что приводит к дальнейшему уменьшению запасов тиамина при возобновлении питания, нарушению аэробного метаболизма углеводов и недостаточному синтезу АТФ, повышению концентрации лактата за счет перехода на анаэробный гликолиз.
Плазменная концентрация фосфатов в норме составляет 0,85–1,45 ммоль/л, при этом легкая (0,6–0,85 ммоль/л) и среднетяжелая (0,3–0,6 ммоль/л) гипофосфатемия обычно протекают бессимптомно, а тяжелая гипофосфатемия < 0,3 ммоль/л может сопровождаться жизнеугрожающей органной дисфункцией — острой сердечной недостаточностью, аритмиями, увеличением продолжительности ИВЛ [36].
Необходимо учитывать, что гипофосфатемия часто ассоциирована с повышенной летальностью, но не является независимым предиктором неблагоприятного исхода, т. е., вероятно, является маркером тяжести состояния [11].
У пациентов ОРИТ в трети случаев гипофосфатемия не связана с РФС, при этом рефидинг-гипофосфатемия чаще развивается у пациентов с предшествующими электролитными расстройствами (гипокалиемией, гипомагниемией, гипофосфатемией) [7].
Электролитные нарушения приводят к нарушениям со стороны мышечной ткани (спазм, тетанус, миалгии, слабость диафрагмы с развитием дыхательной недостаточности, рабдомиолиз, нарушения работы сердца, аритмии), уменьшению синтеза АТФ и 2,3-дифосфоглицерата в эритроцитах, гемолизу, а также развитию неврологических нарушений — делирию, парестезиям, тремору, атаксии, отеку головного мозга (табл. 1).
| Таблица 1. Клинические проявления рефидинг – синдрома [1, 9] | |
| Система | Симптом |
|---|---|
| Сердечно-сосудистые | Аритмии; сердечная недостаточность; внезапная смерть |
| Респираторные | Слабость дыхательных мышц; острая дыхательная недостаточность; невозможность отлучения от вентилятора |
| Метаболические | Гипергликемия; метаболический ацидоз; метаболический алкалоз; респираторный алкалоз |
| Неврологические | Энцефалопатия Вернике; слабость; парестезии; тремор; атаксия; делирий; острая энцефалопатия; кома; синдром Гийена—Барре; центральный понтинный миелинолиз |
| Скелетно-мышечные | Слабость; миалгии; рабдомиолиз; остеомаляция |
| Желудочно-кишечные | Анорексия; боли в животе; запоры; рвота |
| Другие | Острый тубулярный некроз; острая печеночная недостаточность |
Согласно рекомендациям NICE, у пациентов с риском развития РФС возобновление питания следует начинать осторожно, покрывая малую часть энергетической потребности, с адекватным возмещением дефицита витаминов и микроэлементов. До возобновления питания не следует назначать инфузию глюкозы — это может спровоцировать развитие РФС [14].
Наибольшие споры в ведении пациентов с риском развития РФС возникают вокруг нутритивной поддержки, т. к. основной стратегией является гипокалорийное питание, которое, с одной стороны, позволяет улучшить исход при РФС, с другой — может привести к нутритивной недостаточности [37, 38].
Пионеры парентерального питания Dudrick S. et al. проводили нутритивную поддержку пациентам с тяжелой мальабсорбцией, онкологическим больным, которые из-за выраженного истощения не могли получать химиотерапию [39]. Для лечения таких больных требовалось восстановить критический дефицит массы тела, что было решено реализовать за счет достижения положительного азотистого баланса при помощи парентерального питания [40]. Это потребовало введения огромного (по современным меркам) количества белка (> 2,5 г/кг/сут) и калорий (> 60 ккал/кг/сут). На тот момент стабильные жировые эмульсии не были доступны, поэтому небелковые калории доставлялись за счет растворов углеводов [39].
С точки зрения современного представления о РФС это были пациенты очень высокого риска — истощенные больные, питание за счет парентеральных растворов глюкозы, высокий калораж питания.
В своих работах исследователи отмечали частое развитие гипофосфатемии, поэтому парентеральное питание всегда сопровождалось замещением дефицита фосфора [41]. Нередко встречались острая задержка жидкости и прогрессирующая сердечная недостаточность, хотя эти явления неудивительны, учитывая большую инфузионную нагрузку (до 5 л в сутки, которые затем компенсировали стимуляцией диуреза). Концепция парентеральной гипералиментации была широко популяризирована Dudrick S. и его учениками, но она не подтвердила своей эффективности в большинстве современных исследований [42–46].
Хотя гипофосфатемия играет важную роль в патогенезе РФС, доказательств о необходимости коррекции бессимптомной гипофосфатемии нет, т. к. в небольших исследованиях это не улучшило клинический исход у пациентов с риском РФС [47]. Тем не менее из-за потенциального риска жизнеугрожающих осложнений многочисленные рекомендации по ведению пациентов с РФС, основанные в целом на экспертном мнении, говорят об обязательной коррекции гипофосфатемии [14, 27, 37]. Фосфаты входят в состав современных смесей для парентерального и энтерального питания, но их количества недостаточно для восполнения дефицита фосфатов при РФС. Препараты фосфора в РФ, к сожалению, не зарегистрированы. В других странах они доступны в виде таблеток и растворов для инфузий, в виде фосфатов натрия или калия. Отсутствие на российском рынке добавок фосфатов для энтерального и парентерального питания значительно осложняет лечение таких больных.
Рекомендации по лечению гипофосфатемии [27, 48]
- Легкая: 0,6–0,85 ммоль/л — 0,32 ммоль/кг/сут.
- Среднетяжелая: 0,3–0,6 ммоль/л — 0,64 ммоль/кг/сут.
- Тяжелая: < 0,3 ммоль/л — 1 ммоль/кг/сут.
Коррекция электролитов
До возобновления питания должны быть оценены концентрации фосфора, калия, магния в плазме крови, за- тем необходим ежедневный мониторинг в первую неделю [14]. Все пациенты с риском развития РФС должны получать магний и фосфор для поддержания их повышенной потребности при возобновлении питания. В зависимости от степени дефицита дозировку необходимо корректировать. Также необходимо избегать гипокалиемии. При этом не следует откладывать возобновление питания на время коррекции электролитных нарушений. На данный момент не существует доказательной базы по режимам замещения дефицита электролитов при РФС у пациентов в критическом состоянии, поэтому все рекомендации основаны на мнениях экспертов.
Рекомендации по замещению дефицита электролитов при рефидинг-синдроме [27, 48]
Гипокалиемия:
- 3,0–3,4 ммоль/л — 40 ммоль калия в час (общая доза 80 ммоль), повторная оценка через 2 ч (т. е. со скоростью 80 мл 4 % раствора калия хлорида в час);
- < 3,0 ммоль/л — 40 ммоль калия в час (общая доза 120 ммоль), повторная оценка через 2 ч (т. е. со скоростью 80 мл 4% раствора калия хлорида в час).
Гипомагниемия:
- нормомагниемия — 0,2 ммоль/кг/сут;
- 0,5–0,7 ммоль/л — 0,5 ммоль/кг/сут в первые 24 ч, затем 0,25 ммоль/кг/сут в течение 5 сут;
- < 0,5 ммоль/л — 24 ммоль в течение 6 ч, затем 0,25 ммоль/кг/сут в течение 5 сут.
Тиамин
Для профилактики развития энцефалопатии Вернике и Корсаковского синдрома перед началом питания следует назначить 200–300 мг тиамина, затем ежедневно вводить комплекс витаминов группы B в течение первых 10 сут возобновления питания [27, 48].
Наиболее исследованной группой пациентов с риском РФС являются больные нервной анорексией. Нервная анорексия — одно из самых опасных заболеваний в области психиатрии, а восстановление массы тела — обязательный этап в лечении таких пациентов, но слишком агрессивное введение питания может спровоцировать развитие РФС, особенно при парентеральном питании [49]. Это нашло отражение в рекомендациях по лечению нервной анорексии, согласно которым питание у пациентов с риском развития РФС необходимо начинать с минимальных объемов (500 ккал/сут) и постепенно расширять калораж [37].
Пример восстановления питания у пациентов с нервной анорексией
Ниже представлены примеры расчета при сипинге и зондовом питании пациента с нервной анорексией массой 35 кг (табл. 2, 3). Следует отметить, что стандартные энтеральные смеси не содержат достаточного количества фосфатов, чтобы покрыть потребности пациентов после длительного голодания.
| Таблица 2. Пример питания пациента 35 кг при помощи сипинга [48, 50] | |||||
| Пищевая смесь 1,5 ккал/мл | 1–3-й дни, мл | 4–5-й дни, мл | 6–8-й дни, мл | 9–10-й дни, мл | 11-й день |
|---|---|---|---|---|---|
| Завтрак | 100 | 150 | 200 | 200 | Увеличивать по 300 ккал/день до увеличения массы тела 0,5–1 кг в неделю |
| Второй завтрак | 50 | 50 | 50 | 100 | |
| Обед | 100 | 150 | 200 | 200 | |
| Полдник | 50 | 50 | 50 | 100 | |
| Ужин | 100 | 150 | 200 | 200 | |
| Второй ужин | 100 | 100 | 100 | 200 | |
| Калораж, ккал | 750 | 975 | 1200 | 1500 | |
| Таблица 3. Пример питания пациента массой 35 кг через зонд [48, 50, 51] | ||
| Дни | Энтеральная смесь с пищевыми волокнами, 1 ккал/мл | Калораж, ккал |
|---|---|---|
| 1–3-й | 750 мл 31 мл/ч за 24 ч | 750 |
| 4–5-й | 1000 мл 42 мл/ч за 24 ч | 1000 |
| 6–8-й | 1250 мл 52 мл/ч за 24 ч | 1250 |
| 9–10-й | 1500 мл 63 мл/ч за 24 ч | 1500 |
| 11-й | Увеличивать по 300 ккал/день до увеличения массы тела 0,5–1 кг в неделю | |
Следуя таким рекомендациям, врач оберегает пациента, снижая риск развития РФС, но при этом существенно снижается набор веса и увеличивается длительность госпитализации. Также появляется риск недокормить пациента с исходно тяжелой нутритивной недостаточностью — это состояние получило название underfeeding syndrome [37].
За последние годы был проведен ряд работ, оценивающих влияние более агрессивных подходов к лечению РФС. Первое исследование, в котором применялся агрессивный подход к возобновлению питания у пациентов с нервной анорексией, опубликовали в 2010 г. Whitelaw M. et al. Возобновление питания начинали с 1900 ккал/сут (около 45 ккал/кг/сут), при этом не было выявлено клинических случаев РФС [18]. Вслед за этой работой последовали более крупные. Redgrave G. et al. проанализировали рефидинг у 331 пациента с нервной анорексией, у которых применяли высококалорийную стратегию: питание начинали с 1200–1500 ккал/сут и постепенно расширяли до 3500 4000 ккал/сут [19]. Только в двух работах сравнивались две группы пациентов: с консервативным и агрессивным подходом к питанию [12, 52]. Ни в одном из приведенных выше исследований не было выявлено клинических случаев РФС, а увеличенный калораж питания позволил быстрее набрать целевую массу тела и сократить сроки госпитализации, хотя и не влиял на итоговую массу тела.
Хотя ни в одном исследовании не было выявлено случаев РФС, единственным показателем, предсказывавшим развитие гипофосфатемии, являлся ИМТ [12, 52, 53]. При этом необходимо учитывать, что средний ИМТ в этих работах был достаточно высоким (> 16 кг/м2), а проведенный Redgrave et al. анализ подгруппы с крайне низкой массой тела (ИМТ < 15 кг/м2) показал, что именно у этих пациентов чаще всего развивается гипофосфатемия и, соответственно, повышается риск развития РФС [19].
На основании этих работ были пересмотрены рекомендации MARSIPAN по лечению нервной анорексии, при этом для большинства пациентов с низким риском развития РФС рекомендована либеральная стратегия питания (около 20 ккал/кг/сут или 1000 ккал/сут с последующим наращиванием по 200 ккал/сут) с обязательным мониторингом электролитов: при падении уровня фосфора необходимо прекратить увеличение калоража питания и начать возмещение дефицита электролитов [37]. Для пациентов очень высокого риска РФС (крайне низкий ИМТ, проявления на ЭКГ, признаки сердечной недостаточности или отеков) необходимо крайне осторожно начинать питание с 5–10 ккал/кг/сут и постепенно увеличивать калораж, проводя мониторинг электролитов 2 раза в сутки в течение первых 5–7 дней [54, 55].
Как и у пациента с нервной анорексией, у пациента ОРИТ адекватная нутритивная поддержка критически важна, поэтому любая задержка или уменьшение калоража питания должны быть оправданны. Учитывая достаточно мягкие критерии NICE и высокую распространенность субклинической гипофосфатемии у пациентов в критических состояниях, неясно, оправданно ли переносить в ОРИТ рекомендации по ограничению калорий из практики пациентов с нервной анорексией [56].
На данный момент для лечения пациентов с РФС без нервной анорексии приняты рекомендации NICE, которые практически идентичны рекомендациям MARSIPAN по ведению пациентов с нервной анорексией: у пациентов с риском развития РФС питание следует начинать с 500 ккал/сут с постепенным достижением целевого калоража к 5–7-м суткам; при развитии гипофосфатемии необходимо вернуться к 500 ккал/сут [14, 37]. Несмотря на то что эти рекомендации общеприняты и широко применяются, до недавних пор они были основаны только на экспертном мнении.
За последние годы было проведено несколько первых крупных исследований, оценивавших терапевтические стратегии при РФС у пациентов ОРИТ.
Единственное на сегодняшний день рандомизированное контролируемое исследование было проведено Doig et al. в 2015 г.: в него были включены пациенты с рефидинг-гипофосфатемией (падение фосфатов плазмы > 0,16 ммоль/л, до уровня < 0,64 ммоль/л) [6]. В группе низкокалорийного питания калораж ограничивали 20 ккал/ч (~500 ккал/сут) и затем постепенно расширяли, достигая уровня 100 % расчeтной энергопотребности к 4-м суткам, тогда как в контрольной группе питание сразу проводили в объеме, покрывающем расчeтную энергопотребность. Если в процессе исследования выявлялось снижение фосфатов < 0,71 ммоль/л, в группе гипокалорийного питания калораж снижали до 500 ккал/сут. Было выявлено снижение 60-дневной летальности в группе низкокалорийного питания, а также уменьшение количества инфекционных осложнений, в том числе респираторных инфекций.
В 2017 г. Olthof et al. опубликовали результаты ретроспективного исследования у пациентов ОРИТ, которым длительное время проводили ИВЛ [7]. После возобновления питания у 38 % пациентов развился РФС (применялись критерии из исследования Doig et al.). У пациентов без РФС гипокалорийное питание не показало никакого отрицательного влияния в целом, но в группе РФС было выявлено статистически значимое снижение 6-месячной летальности, что повторяет результаты Doig et al. Интересно, что ограничение калоража питания не оказывало влияния на пациентов с риском развития РФС [6, 7].
Учитывая то, что РФС возникает в первые несколько суток с момента восстановления питания, неясно, необходимо ли восполнять 100 % расчетной энергопотребности у пациентов ОРИТ в остром периоде.
Согласно рекомендациям ESPEN, необходимо максимально быстро расширить калораж питания для достижения 80–100 % расчетной энергопотребности [57], но существуют опасения, что это ведет к риску «перекорма» пациентов и увеличению летальности [58]. В крупном обсервационном исследовании Weijs et al. было показано [59], что пациенты ОРИТ, которые получали избыточное количество калорий в первую неделю после поступления в отделение, имели наибольшую летальность, а небольшой «недокорм» (80 % от расчетной энергопотребности) приводил к снижению летальности. Кроме того, последние крупные рандомизированные исследования, которые оценивали влияние низкокалорийного питания по сравнению с нормокалорийным, не показали вреда от низкокалорийного питания [42, 43, 60].
Так, в исследовании EDEN, опубликованном группой ARDSnet в 2012 г., не было выявлено различий между получением 25 и 80 % энергопотребности у пациентов с ОРДС в первые 6 сут возобновления питания после интубации трахеи [42]. Так как пациенты не получали дополнительного белка, в группе гипокалорийного питания поступление белка было значимо ниже, что могло повлиять на результаты.
В 2015 г. опубликовано многоцентровое рандомизированное клиническое исследование PermiT [60], в котором, в отличие от EDEN, обе группы получали рекомендованное количество белка (1,2–1,5 г/кг/сут), но никаких различий между группами также не было получено.
Недавно опубликованное многоцентровое двойное слепое рандомизированное клиническое исследование TARGET [43], в котором проводили энтеральное зондовое питание смесями с различным содержанием калорий (1 и 1,5 ккал/мл), количество белка в обеих группах составляло 1,2–1,5 г/кг/сут, также не показало негативного влияния гипокалорийного питания у пациентов ОРИТ.
Последние работы Doig G. и Olthof L.E. показали, что даже бессимптомная рефидинг-гипофосфатемия имеет клиническое значение, и рестриктивный метод возобновления питания позволяет улучшить исходы [6, 7]. Это соответствует данным последних работ по раннему энтеральному питанию TARGET и EDEN, в которых снижение калоража питания не ухудшает результатов лечения [42, 43, 60].
Необходимо обратить внимание, что в исследованиях по РФС отдельно рассматривают две категории пациентов: тяжело истощенные пациенты с нервной анорексией и пациенты ОРИТ без исходной нутритивной недостаточности. Следовательно, необходимы работы среди пациентов ОРИТ с выраженным «недокормом», т. к. они являются категорией наибольшего риска развития РФС.
Основываясь на данных единственного рандомизированного клинического исследования [6], мнении экспертов, а также рекомендациях [14, 37], разработанных для пациентов с нервной анорексией, можно рекомендовать ограничение калорийности питания до 15 ккал в первые 2 сут с последующим постепенным его повышением. У пациентов со значительным дефицитом питания, низким ИМТ, исходной гипофосфатемией следует начинать с меньшего калоража. Если по мере наращивания объема питания возникает падение уровня фосфора или появляются клинические признаки РФС, необходимо вернуться к минимальной энергопотребности.
Синдром возобновления питания имеет разную выраженность — от бессимптомной до жизнеугрожающей органной дисфункции. Требуются дальнейшие исследования для определения оптимальных диагностических критериев, профилактических мер и терапевтических стратегий этого состояния.
Конфликт интересов. Авторы заявляют об отсутствии конфликтов интересов
Вклад авторов. Ярошецкий А.И. — концепция статьи, редактирование и написание текста; Конаныхин В.Д., Степанова С.О. — написание статьи; Резепов Н.А. — редактирование статьи.