
Хроническая боль после лапароскопической холецистэктомии представляет собой значительную проблему, частота развития которой колеблется от 3 до 55 %. К этиологическим факторам можно отнести проблемы со сфинктером Одди, или наличие остаточных камней, однако большей частью причина болевого синдрома остается неясной, и складывается впечатление, что это связано с висцеральной гиперальгезией и центральной сенситизацией. Кроме этого, существуют определенные факторы риска, такие как женский пол, молодой возраст, длительность и выраженность предоперационного болевого синдрома, наличие психологических проблем [1, 2].
Одним из направлений предотвращения и лечения хронического болевого синдрома являются попытки использования различных адъювантов, из которых наиболее многообещающие результаты показали антидепрессанты, антиконвульсанты, антагонисты NMDA-рецепторов, α2-агонисты и местные анестетики [3].
Цель исследования: оценка влияния системного интраоперационного введения лидокаина на развитие хронического послеоперационного болевого синдрома в долговременной перспективе.
После одобрения локальным этическим комитетом ФГБОУ ВО СЗГУ им. И.И. Мечникова для участия в исследовании было рандомизировано 96 пациентов, которых распределили в две группы. Информированное согласие на исследование было подписано каждым пациентом согласно протоколу университета.
В исследование включались пациенты, которым проводились плановые лапароскопические холецистэктомии, старше 21 года, с оценкой по шкале ASA II–III.
Критериями исключения были беременность, наличие хронического болевого синдрома, ожирение с ИМТ > 40, аллергия на амидную группу местных анестетиков, АВ-блокада, нарушение функции почек и печени, текущая терапия антиаритмическими препаратами.
96 пациентов, соответствующих требованиям критериев включения и исключения, были рандомизированы в две группы: с интраоперационной инфузией лидокаина (лидокаиновая группа) и с инфузией 0,9% раствора NaCl (контрольная группа).
Пациентам в лидокаиновой группе (n = 42) внутривенно вводилась нагрузочная доза лидокаина 1,5 мг/кг, с последующей постоянной инфузией препарата со скоростью 2,0 мг/кг/ч. Введение препарата начиналось перед индукцией анестезии, заканчивалось с завершением операции. Пациентам контрольной группы (n = 54) аналогичным образом вводился 0,9% раствор натрия хлорида.
Для введения в общую анестезию использовался тиопентал натрия 3–5 мг/кг, фентанил 1–2 мкг/кг. Анестезия поддерживалась изофлураном в концентрации 1 МАК, анальгезия — фентанилом 3–4 мкг/кг/ч. Для миорелаксации использовался пипекуроний 0,04–0,05 мг/кг.
В послеоперационном периоде с целью обезболивания использовались кеторолак — 30 мг и тримеперидин — 20 мг (при достижении уровня боли по визуальной аналоговой шкале [ВАШ] > 4) согласно внутреннему протоколу университета.
С учетом того что в хроническом болевом синдроме присутствует значительный нейропатический компонент [1], для оценки болевого синдрома в отдаленном периоде нами был выбран опросник МакГилла. Оценка уровня боли проводилась через 3, 6 и 12 мес. после операции по полной русскоязычной версии опросника МакГилла (Melzack, 1975) [2].
Опросник состоит из 78 дескрипторов боли, разделенных на три категории.
В 1–13-х подклассах пациенты описывают боль в терминах механического, термического воздействия, изменения временных и пространственных характеристик, интенсивности. Например, пациент должен выбрать один из дескрипторов подкласса — боль: распирающая, тянущая, пилящая, разрывающая.
В 14–19-х подклассах отражаются эмоциональная связанные с болевым синдромом.
Для статистической обработки данных применяли программы Cytel Studio 8.0 и LePAC 2.0.41.
В исследование было включено 96 пациентов, из них полностью закончили исследование 82 человека (рис. 1). Обе группы были одинаковыми по демографическим данным, операционному времени и, соответственно, продолжительности инфузии.

Рис. 1. Схема рандомизации пациентов
Частота развития хронической послеоперационной боли через 3 мес. после операции была значительно ниже в группе с использованием лидокаина: 10 vs 37,3 % (точный тест Фишера p = 0,0069) с общей частотой болевого синдрома 29,2 %, а через 6 мес. — 18,3 % (16 vs 19,3 % со- ответственно, точный тест Фишера p = 1,0).
Индекс числа выбранных дескрипторов через 3 мес. после операции был значительно ниже в группе с использованием лидокаина согласно U-критерию Манна— Уитни p = 0,0085 p < α (α=0,05).
С целью дальнейшей статистической обработки данных все пациенты были распределены в три группы: «нет боли», «минимальная боль» и «выраженная боль» — в соответствии с числом выбранных дескрипторов. Полученные данные оценивались с помощью точного теста Фишера. Результаты представлены в табл. 1.
Таблица 1. Данные MPQ по трем подкатегориям через 3 месяца после операции |
|||
|
Нет боли |
Минимальная боль |
Выраженная боль |
Контроль (сенсорная категория) |
18 |
7 |
41 |
Лидокаин (сенсорная категория), p = 0,0167 (p < 0,05) |
2 |
1 |
27 |
Контроль (аффективная категория) |
23 |
1 |
41 |
Лидокаин (аффективная категория), p = 0,0157 (p < 0,05) |
3 |
0 |
27 |
Контроль (когнитивная категория) |
25 |
0 |
41 |
Лидокаин (когнитивная категория), p = 0,006 (p < 0,05) |
3 |
0 |
27 |
Данные по индексу числа выбранных дескрипторов через 3 мес. после операции приведены на рис. 2 и 3.
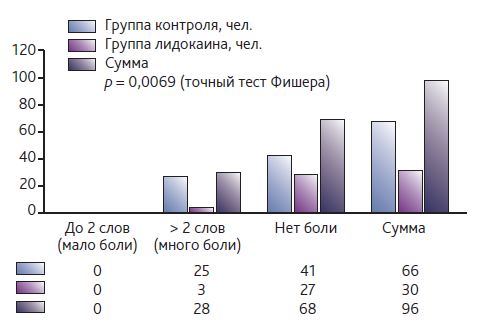
Рис. 2. Индекс числа выбранных дескрипторов через 3 месяца после операции
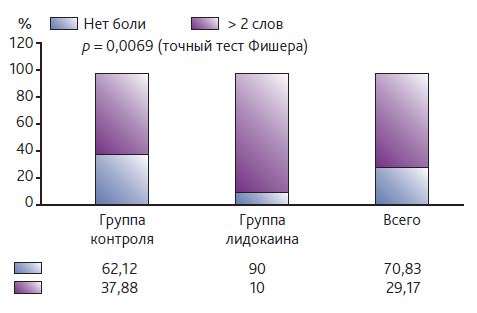
Рис. 3. Индекс числа выбранных дескрипторов через 3 месяца после операции
Оценка данных через 6 и 12 мес. после операции показала отсутствие отличий по всем категориям при сравнении с применением точного теста Фишера и U-критерия Манна—Уитни между лидокаиновой и контрольной группой (рис. 4–5).

Рис. 4. Индекс числа выбранных дескрипторов через 6 месяцев после операции
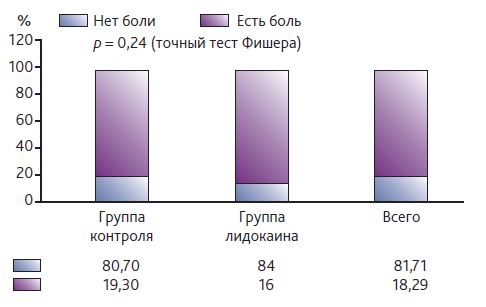
Рис. 5. Индекс числа выбранных дескрипторов через 6 месяцев после операции
Хотя это и не являлось целью работы, во время проведения исследования не отмечалось побочных эффектов, связанных с системной токсичностью лидокаина. Необходимо отметить, что в группе с использованием лидокаина была отмечена тенденция к артериальной гипотонии во время анестезии у 14 % пациентов, однако данные статистически не достоверны.
Хроническая боль определяется как неприятное сенсорное или эмоциональное переживание, которое отмечается через 3 мес. после операции, при том что все остальные источники болевого синдрома исключены. Частота развития хронической послеоперационной боли зависит в том числе и от оперативного вмешательства и может достигать 56 %, как, например, в случае лапароскопической холецистэктомии [1, 5, 6]. На настоящий момент не установлено определeнного патогенетического механизма, приводящего к формированию хронического болевого синдрома, однако провоцирующими факторами могут выступать пол, возраст, психологические проблемы, тип оперативного вмешательства и пр. [7].
Как один из потенциальных фармакологических методов борьбы с хроническим болевым синдромом рассматривается использование средств, действующих на N-метил-D-аспартат (NMDA) рецепторы, т. к. установлена их роль в механизмах центральной сенситизации ноцицептивных нейронов в заднем роге спинного мозга [8–11]. Поскольку для развития феномена центральной сенситизации требуется активация NMDA-рецепторов, то, возможно, фармакологическая блокада данных рецепторов может привести к снижению частоты возникновения хронического болевого синдрома. Группу препаратов, воздействующих на этот тип рецепторов, составляют кетамин, закись азота, амантадин, мемантин и лидокаин, который был использован в нашем исследовании. Обезболивающий эффект лидокаина может быть связан с различными механизмами: влияние на рецепторы G-протеинового комплекса, NMDA-рецепторы, кальций-активируемые натриевые каналы, понижение уровня субстанции Р.
Воспаление является одним из признанных ключевых факторов в болевом синдроме, определяющих возникновение феномена периферической и центральной сенситизации [12]. В 2009 г. Yardeni et al. опубликовали результаты работы, в которой было показано, что лидокаин способен понижать уровень провоспалительных цитокинов в послеоперационном периоде [13]. К сожалению, другие авторы не смогли подтвердить эти оптимистичные результаты. Например, de Oliveira et al. показал, что лидокаин в дозе 2 мг/кг/ч не уменьшает уровень боли и не влияет на плазменный уровень ИЛ-6 у пациентов после абдоминальной гистерэктомии [14].
Лидокаин достаточно активно используется для терапии ранней послеоперационной боли. Исследования показали, что периоперационная инфузия лидокаина значительно снижает потребление опиоидов и уровень боли в послеоперационном периоде [15, 16]. К сожалению, лидокаин показал свою эффективность только в отношении висцеральной боли. Ness et al. выявили, что внутривенное введение лидокаина дозозависимо ингибирует висцеромоторные и кардиоваскулярные рефлексы [17].
Groudine et al. использовали болюсное введение лидокаина 1,5 мг/кг с дальнейшим поддержанием 2–3 мг/мин при радикальной простатэктомии. Послеоперационная боль была значительно ниже, потребление морфина было меньше на 50 %, а эффект длился 2–3 сут [18]. Yardeni et al. вводил лидокаин — 1,5 мг/кг лидокаина на индукцию и 21,5 мг/кг для поддержания у пациентов с гистерэктомиями; были выявлены снижение уровня послеоперационной боли в первые 8 ч и отсутствие разницы с контрольной группой через 12–72 ч после вмешательства [13].
Последний метаанализ показал статистически значимое снижение уровня послеоперационной боли в первые 4 ч после операции при измерении по ВАШ (0–10 см); средняя разница — 0,84 см, 95% доверительный интервал −1,10 … −0,59 [19].
Grigoras использовал лидокаин у пациентов после операций на молочной железе по схеме: болюс 1,5 мг/кг в течение 10 мин с последующей инфузией 1,5 мг/кг/ч, окончание инфузии через 60 мин после окончания операции. Количество пациентов с хроническим болевым синдромом в группе с лидокаином было меньше, чем в контрольной, — 11,8 % (2/17) vs 47,4 % (9/19), p = 0,031 [20].
Оптимальный режим инфузии и продолжительность инфузии остаются под вопросом; очевидно, оптимальной дозой является не менее 1,5–2 мг/кг, т. к. меньшие дозы практически не оказывают эффекта [19].
Основным результатом нашего исследования является демонстрация эффекта периоперационного введения лидокаина на частоту возникновения хронического болевого синдрома через 3, 6 и 12 мес. после операции. В исследовании впервые показано положительное влияние интраоперационного введения лидокаина на снижение формирования хронического болевого синдрома в отдаленном послеоперационном периоде, в частности через 3 мес. Однако через 6 и 12 мес. различий в проявлениях хронического болевого синдрома в обеих группах не отмечалось.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Все авторы внесли равноценный вклад.