
В современной медицине отмечается тенденция к уменьшению инвазивности кардиохирургических операций. Это связано с увеличением доли пожилых и соматически тяжелых больных, а также с появлением новых медицинских технологий. Чаще всего пожилые пациенты имеют заболевания нескольких органов и систем одновременно. При выполнении операции в условиях искусственного кровообращения у коморбидных пациентов риск периоперационных осложнений остается высоким. Кроме того, увеличиваются сроки реабилитации и активизации пациента. Операция без искусственного кровообращения может существенно снизить риск осложнений и органной недостаточности (дыхательной, сердечно-сосудистой, когнитивной, почечной), обеспечить более стабильную гемодинамику во время операции и анестезии, более раннюю реабилитацию пациента, что является особенно актуальным для данной категории пациентов.
За последние 10 лет в Российской Федерации широкое распространение получила так называемая гибридная кардиохирургия. Метод объединяет стандартные хирургические методики с интервенционными способами лечения. Самыми распространенными операциями данного метода являются: транскатетерное протезирование и баллонная вальвулотомия аортального клапана, эндоваскулярное протезирование аорты [1, 2].
Наряду со снижением уровня хирургической агрессии возрастает интерес к выполнению малоинвазивных операций и гибридных операций в условиях седации, в том числе с использованием дексмедетомидина [3–7]. Общая анестезия у больных высокого хирургического риска может приводить к увеличению числа осложнений, а также может быть связана с более длительной реабилитацией пациента [8]. Несмотря на меньшую инвазивность по сравнению с общей анестезией, глубокая седация технически более сложна и требует повышенного внимания от анестезиолога. Необходимо соблюдать стандарты безопасности пациента во время анестезии, проводить полноценный мониторинг, а также создавать оптимальные условия для выполнения операции с учетом потенциально возможных осложнений. Профилактика периоперационных осложнений особенно актуальна для больных пожилого и старческого возраста, которым, как правило, и выполняются гибридные хирургические вмешательства.
Цель исследования: изучение безопасности и эффективности седации дексмедетомидином при гибридных кардиохирургических операциях.
В отделении анестезиологии и реанимации ФГБУ «НМИЦ кардиологии» МЗ РФ проведено ретроспективное исследование «случай-контроль». В исследование включено 132 пациента, которым выполнялись гибридные кардиохирургические вмешательства в условиях различных методов анестезии. В основной группе (1) проводили седацию дексмедетомидином (56 пациентов). В контрольной группе (2) выполняли операцию в условиях общей анестезии (76 пациентов). У больных с хронической обструктивной болезнью легких (ХОБЛ) чаще предпочитали использовать седацию дексмедетомидином, что было обусловлено желанием врачей. В структуре операций преобладали транскатетерная имплантация аортального клапана, баллонная вальвулотомия аортального клапана. В исследуемых группах интраоперационно оценивались: показатели гемодинамики — артериальное давление (АД), частота сердечных сокращений (ЧСС), центральное венозное давление (ЦВД), объем инфузионной терапии, диурез, частота применения катехоламинов, глубина седации и частота конверсии в общую анестезию (в группе 1), параметры легочного газообмена (напряжение кислорода и углекислого газа в артериальной крови — paO2, paCO2), длительность анестезии и операции. В послеоперационном периоде оценивалась частота осложнений: делирий, острое нарушение мозгового кровообращения, острая почечная недостаточность и динамика скорости клубочковой фильтрации (СКФ), респираторные осложнения; параметры послеоперационной гемодинамики: АД, ЧСС, ЦВД; количество диуреза и объем инфузионной терапии; длительность пребывания в отделении реанимации.
В группе 1 использовалась внутривенная седация дексмедетомидином (Dexdor®, Финляндия) по схеме: после катетеризации периферической вены и обеспечения мониторинга вводилась нагрузочная доза в течение 30 мин из расчета 1,5–2,5 мкг/кг/ч (инфузионные шприцы B. Braun Space, Германия). При достижении уровня седации −3 балла по шкале Ричмонда (RASS) доза препарата снижалась до 0,5–1,5 мкг/кг/ч. Целевым уровнем седации считали −3, −4 балла по одноименной шкале. Дополнительные препараты с целью анальгоседации (фентанил) не вводились. В месте кожного разреза выполняли инфильтрационную анестезию лидокаином 2% + ропивакаин 0,75%.
В группе 2 выполняли комбинированную общую анестезию с искусственной вентиляцией легких. Внутривенная индукция анестезии осуществлялась по схеме: фентанил 1,5–4,0 мкг/кг, мидазолам 0,1– 0,3 мг/кг или диазепам 0,1–0,15 мг/кг, цисатракурия безилат 0,2–0,4 мг/кг. Поддержание анестезии осуществлялось севофлураном в диапазоне 0,5–2,5 % (наркозно-дыхательный аппарат Maquet Flow-i, Германия), болюсное введение фентанила — 1,0–2,0 мкг/кг (на этапе кожного разреза), непрерывная инфузия цисатракурия безилата — 1,0–2,0 мг/кг.
Мониторинг пациента в операционной (монитор Phillips IntelliVue, Нидерланды) соответствовал стандартам мониторинга кардиохирургического пациента (ЧСС, инвазивное АД и ЦВД, ЭКГ, пульсоксиметрия, чреспищеводная эхокардиография, скорость диуреза, кислотно-щелочное состояние и газовый состав артериальной крови, определение количества гемоглобина и гематокрита).
Полученные данные обработаны в программе Statistica 7.0 (STATsoft inc., США). Для описания групп использовали непараметрические методы статистики. Для оценки межгрупповых различий применяли U-критерий Манна—Уитни, достоверность при p< 0,05. Для выявления достоверности качественных различий — χ2 с поправкой Йетса и критерий Фишера. Результаты представлены в виде медианы, нижнего и верхнего квартилей, абсолютных и относительных частот.
Исходная клинико-демографическая характеристика пациентов была сопоставимой практически по всем параметрам в группе седации и общей анестезии (табл. 1).
| Таблица 1. Клинико-демографическая характеристика пациентов в исследуемых группах | |||
| Показатель | Седация дексмедетомидином (n = 56) | Общая анестезия (n = 76) | p |
|---|---|---|---|
| ТИАК/БВ, n (%) | 51/5 (91/9 %) | 76/0 (100/0 %) | 0,012 |
| Возраст, лет | 79,0 (75,0–84,0)* | 77,0 (73,0–82,0)* | 0,24 |
| Пол, м/ж | 26/30 | 30/46 | 0,53 |
| EuroScore II, % | 10,0 (6,0–16,0)* | 7,0 (4,0–11,0)* | 0,009 |
| АГ, n (%) | 49 (87,5 %) | 63 (82 %) | 0,62 |
| СД, n (%) | 18 (32 %) | 18 (23,6 %) | 0,37 |
| ЦВБ, n (%) | 24 (42,8 %) | 41 (53,9 %) | 0,27 |
| ХБП, n (%) | 17 (30 %) | 37 (48,6 %) | 0,052 |
| ХОБЛ, n (%) | 24 (42,8 %) | 18 (23,6 %) | 0,031 |
| ХСН III–IV NYHA, n (%) | 31 (55,3 %) | 45 (59,2 %) | 0,79 |
| Предшествующая кардиохирургия, n (%) | 11 (19,6 %) | 15 (19,7 %) | 0,83 |
| Предоперационный гемоглобин, г/л | 123,0 (114,0–133,0)* | 123,0 (114,0–132,0)* | 0,82 |
| ФВ ЛЖ, % | 60,0 (53,0–60,0)* | 60,0 (46,0–60,0)* | 0,23 |
АГ — артериальная гипертензия; СД — сахарный диабет; ТИАК/БК — транскатетерная имплантация аортального клапана; ФВ ЛЖ — фракция выбороса левого желудочка; ХБП — хроническая болезнь почек; ХОБЛ — хроническая обструктивная болезнь легких; ХСН — хроническая сердечная недостаточность; ЦВБ — цереброваскулярные болезни.
* Результаты в виде медианы, нижнего и верхнего перцентилей.
Исключение составили ХОБЛ и шкала оценки риска неблагоприятных исходов EuroScore II, где в группе седации данные показатели достоверно преобладали над группой общей анестезии. Летальных исходов в ходе госпитализации отмечено не было.
В ходе исследования выявлено, что диапазон значений систолического и среднего АД в интраоперационном периоде оказался достоверно более высоким в группе 1 по сравнению с группой 2, при этом значения диастолического АД статистически не различались. В условиях равных объемов инфузионной терапии, скорости диуреза и величины кровопотери в исследуемых группах потребовалась достоверно большая частота назначения препаратов симпатомиметического ряда в группе 2 (рис. 1).

Рис. 1. Значения среднего артериального давления, объем инфузии и частота применения катехоламинов
Различий в значениях ЧСС в изучаемых группах выявлено не было (p = 0,14). В группе 1 медиана составила 55,0 (50,0–60,0) в мин, в группе 2 — 55,0 (55,0–64,0) в мин. При этом в обеих группах у троих пациентов отмечалось критическое снижение ЧСС (< 40 уд. мин), что потребовало применения временной эндокардиальной стимуляции (p = 0,5). Не найдено статистических отличий в величине ЦВД: 10,0 (8,0–12,0) мм рт. ст. и 11,0 (9,0–14,0) мм рт. ст. в группе 1 и группе 2 соответственно (p = 0,08).
Длительность операции и анестезии достоверно различались при сравнении исследуемых групп (p < 0,001). В группе 1 операция выполнялась 125,0 (120,0–150,0) мин, в то время как в группе 2 — 160,0 (140,0–195,0) мин. Время анестезии в группе 1 составило 175,0 (155,0–200,0) мин, а в группе 2 — 210,0 (190,0–245,0) мин.
В группе 1 глубина седации по шкале RASS составила −4,0 (−3,0… −4,0) балла. По шкале Рамсея седация была оценена в 5,0 (5,0–5,0) балла. Данные оценки соответствовали глубокому уровню седации, что позволило выполнить операцию в комфортных условиях в подавляющем большинстве случаев. Тем не менее у 3 пациентов (5,3 %) была отмечена недостаточная степень седации, по поводу чего была проведена конверсия в общую анестезию.
Газообменную функцию легких оценивали по величине paO2 и paCO2, которые в группе 1 составили 245,0 (210,0–295,0) мм рт. ст. и 47,0 (45,0–49,0) мм рт. ст. соответственно при скорости потока кислорода 8 л/мин (paO2/FiO2 — 408 мм рт. ст.). В группе 2 показатели газообмена составили: paO2 246,5 (206,0–286,5) мм рт. ст., paCO2 37,0 (33,0–39,0) мм рт. ст. при фракции кислорода 60 % (paO2/FiO2 — 410 мм рт. ст.). Очевидно, что в группе 1 отмечалась легкая степень гиперкапнии при наличии статистически значимой достоверности (p < 0,001), однако такие значения считались допустимыми у данной категории пациентов. Объем введенного интраоперационно контрастного вещества в группе 1 составил 140,0 (110,0–150,0) мл и 135,0 (120,0–150,0) мл в группе 2 (p = 0,69).
В раннем послеоперационном периоде параметры гемодинамики и показатели легочного газообмена практически не различались в исследуемых группах. Исключение составило напряжение кислорода в артериальной крови: значения в группе 2 преобладали над значениями группы 1 при наличии статистической достоверности. Различия не влияли на клиническую картину и непосредственные результаты операции (табл. 2).
| Таблица 2. Послеоперационные показатели гемодинамики и газообмена | |||
| Показатель | Группы | Значения | p |
|---|---|---|---|
| АД систолическое, мм рт. ст. | СД | 130,0 (110,0–140,0) | 0,88 |
| ОА | 130,0 (115,0–140,0) | ||
| АД диастолическое, мм рт. ст. | СД | 55,0 (50,0–65,0) | 0,06 |
| ОА | 60,0 (50,0–75,0) | ||
| АД среднее, мм рт. ст. | СД | 79,0 (72,0–90,0) | 0,17 |
| ОА | 85,0 (76,0–89,0) | ||
| paO2, мм рт. ст. | СД | 201,0 (150,0–248,0) | < 0,001 |
| ОА | 241,0 (201,0–285,5) | ||
| paCO2, мм рт. ст. | СД | 39,0 (34,0–42,0) | 0,96 |
| ОА | 38,0 (35,0–42,0) | ||
АД — артериальное давление; ОА — общая анестезия; СД — седация дексмедетомидином.
Объем гидратации и величина диуреза оказались сопоставимыми: 1925,0 (1450,0–2450,0) мл и 1200,0 (900,0–1800,0) мл соответственно в группе 1 vs 1600,0 (1250,0–2400,0) мл и 1200,0 (1000,0–1700,0) мл в группе 2 соответственно (при p = 0,27; p = 0,62).
В раннем послеоперационном периоде отмечено близкое количество осложнений в отслеживаемых группах, за исключением случаев послеоперационного делирия: в группе 2 он встречается достоверно чаще (рис. 2).
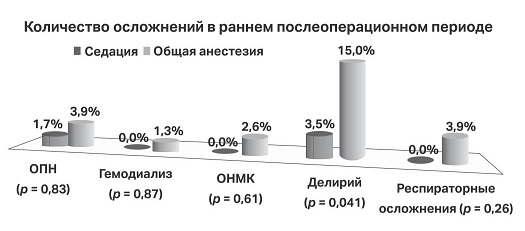
Рис. 2. Осложнения в послеоперационном периоде в группах седации и общей анестезии ОНМК — острое нарушение мозгового кровообращения; ОПН — острая почечная недостаточность.
В ходе исследования отмечено достоверное увеличение СКФ по MDRD 2007 в группе 1 по сравнению с группой 2: 70,0 (55,0–93,0) мл/мин/1,73 м2 vs 62,5 (46,0–72,5) мл/мин/1,73 м2, при p = 0,02.
Время искусственной вентиляции легких с учетом операции в группе 2 составило 405,0 (330,0–615,0) мин. Сроки пребывания в отделении реанимации не отличались в исследуемых группах и составили 1,0 (1,0–1,0) суток в обеих группах.
Интраоперационные параметры гемодинамики оказались более предпочтительными при использовании седации дексмедетомидином, хотя препарат обладает выраженными симпатолитическими свойствами. В литературе имеются противоречивые данные о параметрах гемодинамики при выполнении седации дексмедетомидином. В одном исследовании (Mayr N. et al., 2015) показано более частое использование вазопрессоров в группе опиоидно-пропофоловой анестезии по сравнению с дексмедетомидином, что вполне сопоставимо с полученными нами данными [9]. В другом исследовании (Khalil M. et al., 2016) выявлены достоверно более низкие значения среднего АД и более частое применение вазопрессоров в группе дексмедетомидина по сравнению с седацией пропофолом [10]. В нашем исследовании в группе дексмедетомидина отмечены более высокие значения систолического и среднего АД при одинаковых значениях диастолического АД. Также в группе дексмедетомидина достоверно реже применялись катехоламины и вазопрессоры, притом что объем инфузионной терапии, величина ЦВД и темп диуреза существенно не различались в изучаемых группах. Вероятно, дексмедетомидин обладает менее выраженным кардиодепрессивным эффектом по сравнению с фентанилом и севофлураном у больных с критическим аортальным стенозом. В многочисленных исследованиях подчеркивается свойство дексмедетомидина влиять на сердечную проводимость и вызывать брадикардию, но у кардиологического пациента этот эффект может оказаться даже полезным [11–13]. Тем не менее, по результатам нашего исследования, частота возникновения клинически значимой брадикардии (< 40 уд./ мин) оказалась одинаковой в группах 1 и 2 (5,2 и 5,3 %). Медиана времени операции и анестезиологического обеспечения оказалась существенно короче (на 35 мин) в группе седации по сравнению с группой общей анестезии. Менее длительная операция и анестезия в группе дексмедетомидина в нашей работе не повлияла на сроки пребывания в отделении реанимации, что составило 1,0 (1,0–1,0) суток в обеих группах и частично согласуется с данными иностранных коллег. В зарубежных публикациях показано снижение времени оперативного вмешательства при использовании седации при транскатетерном протезировании аортального клапана, а также уменьшение времени пребывания в отделении интенсивной терапии [14–16].
При выполнении седации дексмедетомидином в группе 1 были достигнуты удовлетворительные показатели глубины седации при оценке по шкалам ажитации–седации Ричмонда и Рамсея при сохранении адекватных показателей газообмена. Тем не менее у 3 пациентов (5,3 %) в связи с неэффективностью седации потребовалось провести конверсию в общую анестезию. В одном отечественном исследовании отмечена достоверно лучшая переносимость операции в условиях седации дексмедетомидином по сравнению с пропофолом, что подтверждает полученные нами данные об эффективности проводимой нами седации [17].
Напряжение кислорода артериальной крови существенно не различалось в исследуемых группах, однако в группе седации отмечался достоверно более высокий уровень углекислоты, что вероятно связано с преобладанием в данной группе больных, страдающих ХОБЛ. По данным литературы, дексмедетомидин не влияет на минутную альвеолярную вентиляцию, а частота возникновения гиперкапнии при применении дексмедетомидина существенно ниже при сравнении с другими седативными средствами [9, 18]. Тем не менее в нашем исследовании при умеренной и глубокой интраоперационной седации у больных с ХОБЛ наблюдалась гиперкапния легкой степени, хотя данные показатели напряжения углекислоты не повлияли на клинический результат. В 1-е сутки после операции напряжение углекислоты существенно не различалось в группах седации и общей анестезии.
В многочисленных публикациях демонстрируются нейропротекторные свойства дексмедетомидина, особенно у больных кардиохирургического профиля [19–21]. Результаты нашего исследования оказались сопоставимы с данными коллег, изучающими нейропротекторные свойства дексмедетомидина в периоперационном периоде, где отмечена меньшая частота возникновения делирия при использовании дексмедетомидина в кардиальной и некардиальной хирургии [13, 22–25]. В нашей работе демонстрируется достоверное снижение случаев делирия в раннем послеоперационном периоде при выполнении седации дексмедетомидином (3,5 %) при сравнении с общей анестезией (15 %) в гибридной хирургии аортального клапана (p = 0,041). Частота случаев острой почечной недостаточности, потребность в гемодиализе, а также частота острого нарушения мозгового кровообращения и частота респираторных осложнений оказались схожими в исследуемых группах, что подтверждает гипотезу о безопасности дексмедетомидина.
Вместе с тем при сходной частоте острой почечной недостаточности, одинаковом объеме введенного контрастного препарата, равном объеме инфузионной терапии отмечен прирост СКФ по MDRD в группе седации в 1-е послеоперационные сутки. Данную находку можно объяснить нефропротекторными свойствами дексмедетомидина. Многие коллеги отмечали снижение числа острого почечного повреждения у пациентов в кардиохирургии, где применялся дексмедетомидин [26, 27].
В проведенном нами исследовании выполнено сравнение методик анестезии в гибридной кардиохирургии. На основании анализа полученных результатов демонстрируется потенциально безопасное и эффективное использование дексмедетомидина для седации в гибридной кардиохирургии.
Седация дексмедетомидином является эффективной и безопасной стратегией в аспекте анестезиологического обеспечения гибридных кардиохирургических вмешательств. Выполнение седации особенно актуально у больных пожилой и старческой возрастных групп, имеющих сопутствующую ХОБЛ. Гемодинамический профиль при выполнении седации дексмедетомидином остается стабильным. Применение седации дексмедетомидином достоверно снижает количество послеоперационного делирия при сравнении с общей анестезией. Интраоперационная седация дексмедетомидином может благоприятно влиять на функцию почек у кардиохирургического пациента.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов. Груздев К.А., Марголина А.А. — разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, проверка и утверждение текста статьи; Табакьян Е.А. — разработка концепции статьи, получение и анализ фактических данных, аналитическая обработка информации, написание и редактирование текста статьи, проверка и утверждение текста статьи; Лепилин М.Г. — научное руководство, разработка концепции статьи, получение и анализ фактических данных, написание и редактирование текста статьи, рецензирование текста статьи, проверка и утверждение текста статьи.